
如果说mRNA是细胞里的“快递小哥”,那circRNA(环状RNA)就像“永生胶囊”——没有首尾,结构稳定,功能神秘。它们从哪里来?什么时候会被“剪”成环?又受哪些因子调控?2017年12月,Molecular Cell上线了一篇来自宾夕法尼亚大学Wilusz团队的研究,用minigene技术,首次系统揭示了“当pre-mRNA剪接机器掉链子时,细胞会把更多基因输出转向circRNA”。今天,我们就借这篇文章,带大家看看minigene技术如何成为circRNA剪接研究的“神器”。
01 研究背景
circRNA由前体mRNA“反剪接”(backsplicing)产生,即下游5′剪接位点回头与上游3′位点相连,形成共价闭环。虽然高通量测序告诉我们人类75%以上基因都能产生circRNA,但它们的丰度通常不足对应线性mRNA的10%。于是问题来了:circRNA水平到底受什么控制?是“生成慢”还是“降解慢”?Wilusz组猜测,答案藏在“剪接机器”本身——当核心组分稀缺或被抑制时,细胞会不会把“备胎”circRNA当成主要输出?
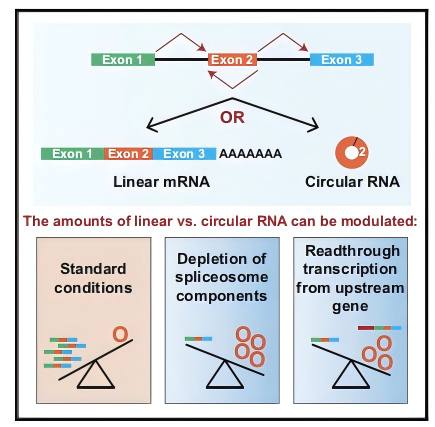
图1 经典mRNA剪接与反向剪接(backsplicing)存在竞争(Liang et al., 2017)。
02 实验设计思路
把E1-Intron1-E2-Intron2-E3克隆到铜诱导pMT启动子下,E2内插入XmaI位点作身份标记,两侧反向DNAREP1_DM重复碱基配对拉近空间距离,迫使剪接机器在“正剪接”生成线性E1-E2-E3 mRNA与“反剪接”生成514nt circRNA之间二选一。通过铜离子精确开关转录,Northern一次跑胶即可同时定量两种产物。
03 结果解读
图1A:正剪接vs反剪接同台竞技。绿色“发夹”代表一对反向DNAREP1_DM转座子重复序列,可像拉链一样把两个内含子拉近距离,促进反剪接。
图1B:14 h铜诱导后,circRNA条带亮度竟高于线性mRNA。
图1C:诱导0–8 h取样发现,2 h时线性mRNA已清晰可见,而circRNA几乎检测不到;8 h时两者相当。说明backsplicing初始效率远低于canonical splicing。
图1D:3h诱导后洗掉铜离子(BCS终止转录),线性mRNA约2 h减半;circRNA 24 h仍保持一定量。
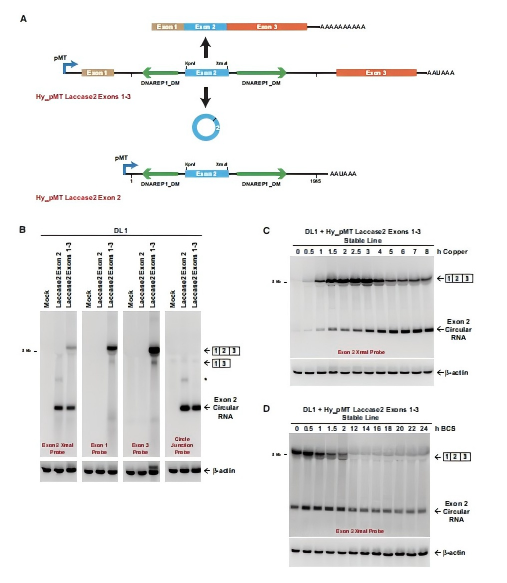
图2 minigene技术验证Laccase2基因的反向剪接(Liang et al., 2017)。
参考文献
Liang D,Tatomer DC, Luo Z, et al. The output of protein- coding genes shifts to circular RNAs when the pre-mRNA processing machinery is limiting[J]. Molecular cell, 2017,68(5):940-954.e3.




















 1025
1025

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








