神经退行性疾病的发病率呈现上升趋势。这些疾病通常会导致进行性功能障碍。识别强有力的神经退行性疾病生物标志物是促进早期识别病理特征和更好理解个体疾病发病机制的关键。弥散张量成像(DTI)是目前评估神经退行性疾病最广泛使用的弥散MRI技术。DTI参数是评估微观结构变化的有希望的生物标志物,但DTI的一些限制限制了其更广泛的临床应用。新的弥散MRI技术,如弥散峰度成像(DKI)、双张量DTI和神经纤维取向密度与分散成像(NODDI),已被证明在评估神经退行性疾病方面为DTI提供了增值。在本文中,我们总结了这些技术的关键技术方面,并概述了DKI、双张量DTI和NODDI作为阿尔茨海默病、帕金森病、肌萎缩性侧索硬化症和亨廷顿病等代表性神经退行性疾病的微结构变化生物标志物的现状。本文发表在Journal of Magnetic Resonance Imaging杂志。
正文:
神经退行性疾病的流行率正在增加,部分原因是由于寿命的延长。根据联合国关于世界人口老龄化的报告(2017年),2017年全球60岁及以上人口估计为9.62亿,到2050年这一数字预计将翻倍。衰老是神经退行性疾病发展的主要风险因素,其相关的疾病负担具有高成本。因此,开发有效的疾病修饰或神经保护疗法是关键研究课题;然而,这需要对各类疾病的病因病机进行深入理解。此外,需要开发敏感的生物标志物以在早期阶段识别神经退行性疾病的病理特征,从而在显著细胞丧失之前开始治疗。
弥散磁共振成像(MRI)通过测量组织中水分子的随机运动,是非侵入性表征组织微结构的有希望的方法。目前,弥散张量成像(DTI)是研究神经退行性疾病最广泛使用的弥散MRI技术。从DTI获得的指标,如分数各向异性(FA)和平均弥散率(MD),是神经退行性疾病患者脑异常的潜在生物标志物。然而,DTI的局限性已被广泛描述,并在下文中详细阐述。
弥散MRI的最新发展已经解决了DTI的一些局限性。弥散峰度成像(DKI)、双张量DTI和神经纤维取向分散与密度成像(NODDI)越来越多地用于评估可以在临床可行时间内完成的神经退行性疾病。这些方法可以使用标准MRI扫描仪在临床可行时间内进行。简而言之,DKI是DTI的扩展,允许量化大脑中非高斯水弥散特性;双张量DTI旨在估计和去除脑脊液(CSF)和表观自由水成分对组织弥散张量的信号贡献;NODDI的生物物理组织模型可能提供大脑微结构变化的特定生物标志物,如神经纤维的密度和取向分散。表1总结了这些方法的特性。虽然这些方法也有其自身的局限性,但已被证明在评估神经退行性疾病方面为DTI提供了附加值。
表1. 各种弥散MRI模式的特性总结

在这篇综述中,我们讨论了这些更先进的弥散MRI方法的关键技术方面,并概述了当前关于这些方法在神经退行性疾病中的角色的知识现状。我们讨论了它们在提供阿尔茨海默病(AlzD)、帕金森病(PD)、肌萎缩性侧索硬化症(ALS)和亨廷顿病(HD)等神经退行性疾病微结构变化生物标志物方面的潜力。由于DTI在评估神经退行性疾病方面的应用已被广泛综述,我们将只简要提及DTI的相关话题。
弥散MRI技术
弥散张量成像
DTI的原理及其基本概念在文献中已有广泛综述(详见参考文献10, 11)。DTI指数如FA、MD、径向弥散率(RD)和轴向弥散率(AD)分别表征水分子随机运动的方向分布、弥散大小、沿轴突的弥散方向性以及垂直于轴突的弥散方向性(见表1)【12】。
如上所述,DTI参数由于一些局限性,其临床实用性有限。首先,DTI忽略了生物组织的非高斯特性【4】,而组织异质性和组织微结构(如细胞膜和髓鞘)中的生物限制已知会导致水弥散的非高斯分布【6, 7】。其次,假设每个体素为单一组织区间,从而由于细胞外自由水在体素中的部分体积效应平均化,可能会在DTI指数的解释中引入偏差,如FA降低和MD增加【13】。第三,DTI测量的生物特异性缺乏【10】。例如,FA的降低伴随MD的增加可能归因于神经损伤的缓解或脱髓鞘【14, 15】。AD和RD分别被认为对轴突损伤/退化和髓鞘化程度敏感【16】。然而,这些解释在文献中也受到质疑【17】。此外,如果体素包括健康的纤维束,这些参数可能提供可接受的近似值,这决定了体素的弥散特性。然而,在信噪比低、存在交叉纤维或由潜在病理引起的各向异性降低的情况下,这种方法可能导致结果的误判【18】。
弥散峰度成像
DKI被提出作为DTI的数学扩展。峰度是一个无量纲的测量,量化了体素中水弥散的非高斯分布【6, 7】。为了描述这种非高斯弥散行为,峰度作为分布的第四阶张量被引入【19】,公式如下【20】:

在这个公式中,Dapp和Kapp分别是沿特定弥散方向的表观弥散系数和峰度,S(b)是沿该方向在某个b值下的弥散加权信号,S0是非弥散加权信号。峰度参数如平均峰度(MK)、沿所有弥散方向的弥散峰度的平均值;轴向峰度(AK),沿轴向方向的峰度;和径向峰度(RK),沿径向方向的峰度,适用于评估具有复杂排列的白质(WM)区域中的神经元完整性,包括在有交叉纤维的区域(见表1)【21】。此外,DKI通过检测不仅在白质(各向异性组织)中,而且在灰质(GM;各向同性组织)中的微观结构变化来扩展传统的DTI测量,因为它独立于结构的空间方向【7, 22】。弥散峰度越高,水分子弥散偏离高斯分布的程度越大,这表明弥散环境更受限【23】。因此,与传统DTI相比,DKI在检测神经组织病理变化方面的敏感性可能更强。然而,由于DKI参数的特异性较差,解释这些参数的变化比较困难【24】。DKI的另一个限制是模型比DTI更复杂(需要至少两个非零b值和至少15个弥散方向【见表1】);因此,与DTI相比,采集时间更长。然而,使用较短的成像协议(即7分钟协议),DKI参数在不同脑区可能会有所不同【25】。尽管如此,DKI指标的测试-重测重现性被证明与DTI相当(变异系数≤4.5%)【26】。但是,如果只对MK感兴趣而不是对完整张量感兴趣,那么可以在1-2分钟内进行快速DKI采集【20】。
双张量DTI
自由水定义为不流动且不受限的水分子。在人脑中,自由水以脑脊液(CSF)的形式存在于脑室和脑实质周围。由于脑部病理如肿瘤、创伤和神经炎症,自由水也可能在脑实质的细胞外空间积聚【8, 27】。
双张量DTI使得可以区分组织本身的变化(通过自由水校正的DTI指数测量,称为FAT、MDT、RDT和ADT)和细胞外自由水的变化(通过自由水体积分数测量,称为FW)(见表1)【8】。这是通过采用一个两区间模型并将两个张量拟合到弥散数据中来实现的:一个各向异性的(组织区间,Ctissue),另一个是具有自由水弥散特性的各向同性区间(Cwater)【8】。双张量DTI的图像通过在每个体素中拟合以下模型来计算【8】:

其中,Abi–tensor 是体素逐向建模的衰减向量,其每个弥散方向都有一个条目,而 Atissue 和 Awater 是表示的衰减向量模型。标量 f 是组织区间的体积分数(0 < f < 1),同样地,(1-f) 是自由水的体积分数。FW 区间具有固定的弥散率,为 3 × 10^-3 mm²/s(体温下自由水的弥散系数)【28】。
该模型的优点在于该方法仅需单壳 DTI 采集,并且可以轻松与现有的 DTI 管道合并【8】。与单张量 DTI 模型相比,双张量 DTI 显示出在表征人类白质(无论是健康状态还是病变状态)方面的更好组织特异性【13】,并且在检测微结构变化方面具有更高的敏感性【29】。双张量 DTI 还被证明可以减少 DTI 指标的测试-重测重现性误差【29】,并改善基于 DTI 的纤维束重建【8】。另一个潜在优势是可以提取出一个 FW 图,可以用作神经炎症的生物标志物【30, 31】。但是,由于神经炎症是一个在固定样本中无法观察到的活跃生理过程,因此不可能通过组织学确认 FW 作为神经炎症的标志物【32】。然而,最近的一项研究表明,通过双张量 DTI 获得的 FW 与使用18-kDa 转运蛋白结合配体的正电子发射断层扫描(PET)成像之间存在相关性,这是一种神经炎症的测量方法【33】。
然而,双张量 DTI 模型确实存在一些限制。首先,假设区间之间不存在水分子的交换。在这种情况下,必须对水肿采取预防措施,因为它可能与组织通透性变化有关。交换率的增加预计会导致 FA 估计中的偏差,因此会导致组织区间 FA 值的偏差【8】。同样的限制也适用于灰质,其中细胞体比纤维束的髓鞘更具通透性【8】。双张量 DTI 的另一个限制是该模型源自一个包含 FW 区间和单一纤维群体的双张量模型。然而,据估计,66-90% 的脑白质体素至少包含两个纤维束。因此,在这些体素中,双张量 DTI 的指标容易出现错误估计,因为未拟合到单纤维张量的纤维束信号将被视为自由水信号【34】。最后,双张量模型不考虑弥散衰减的非高斯部分【8】。
神经纤维取向分散和密度成像(NODDI)
NODDI 是一种多壳弥散技术,能够使用临床可行的协议更具体地表征整个脑中的组织微结构【9】。NODDI 模型【9】假设神经组织中的水分子可以分为三个独立的区间:1)神经纤维内部空间,建模为受限弥散(形成沃森分布的棒状集合);2)神经纤维外部空间,建模为受阻弥散(各向异性高斯分布);3)脑脊液区间,建模为各向同性高斯弥散。完整的归一化信号 A 可以表示为:

其中,Ain 和 Vin 分别是神经纤维内部区间的归一化信号和体积分数;Aen 是神经纤维外部区间的归一化信号;Aiso 和 Viso 分别是脑脊液区间的归一化信号和体积分数。
NODDI 通过估计神经纤维密度和神经纤维的空间组织或几何复杂性,能够更具体地表征组织微结构;这些分别称为神经纤维密度指数(NDI)(或其他研究中的细胞内体积分数[ICVF15 或 Vic35])和取向分散指数(ODI)——这是 FA 的两个关键方面。与另一个共享共同框架的白质模型(如白质束完整性 [WMTI])相比,NODDI 提供了各向同性成分的自由水体积分数,称为 ISO【36】。NODDI 的测量能够更好地区分白质和灰质(正常白质显示更高的 NDI 和更低的 ODI,而灰质则相反)【37】,并能区分不同的灰质结构【38】。此外,ODI 被证明与小胶质细胞密度密切相关;因此,ODI 和 ISO 具有作为神经炎症生物标志物的潜力【39】。
NODDI 的主要限制是缺乏任何直接的弥散率估计。NODDI 预先确定并假设平行的细胞内和细胞外弥散率相等(Da,|| = De,|| = 1.7 μm²/ms [在成人中])【36】。此外,脑脊液的弥散率固定为 3 × 10^-3 mm²/s。因此,NODDI 的假设可能代表一种过度简化,这可能导致微结构信息的减少,并且任何偏离这些固定值的情况都可能偏向其余参数,从而降低其特异性。交叉纤维未在 NODDI 模型中明确建模;因此,ODI 对交叉纤维的存在敏感。如果两束纤维交叉且只有一束纤维退化,则会表现为 ODI 的减少【40】。最后,NODDI 测量的重现性比 DTI 测量更具变异性;此外,磁场强度对 NODDI 有显著影响,这要求对在 1.5T 和 3T 获得的数据进行谨慎解释【14】。
弥散MRI在神经退行性疾病中的应用
阿尔茨海默病
阿尔茨海默病(AlzD)是最常见的进行性神经退行性疾病,以逐渐的记忆缺失为特征。其潜在的病理变化包括淀粉样β(Aβ)积聚和tau蛋白的过度磷酸化,分别导致Aβ斑块和细胞内神经纤维缠结的形成,最终导致神经元死亡【41】。无临床症状但有AD家族史或携带AD风险基因(载脂蛋白E [APOE ε4] 的ε4等位基因)或CSF tau/Aβ42阳性生物标志物的个体,也被认为是临床前AD【42】。轻度认知障碍(MCI)患者发展为AlzD的风险更高;此外,MCI常被认为是AlzD的早期阶段【43】。
MRI测量脑萎缩的程度和模式,特别是在包括海马、杏仁核和内嗅区在内的内侧颞叶,现在是诊断AlzD的金标准【44】。然而,脑萎缩对AlzD的诊断准确性仅中等偏高【45】。相比之下,弥散MRI是评估MCI和AD患者的潜在有希望的技术【46】。
DTI在AlzD中的应用
在一项多中心研究中,AlzD病理核心区域(包括胼胝体、内侧和外侧颞叶、穹窿、扣带回、楔前叶和额叶白质)中显示出FA显著减少和MD显著增加【47】。此外,在一项关于MCI和AlzD的荟萃分析研究中,FA在除顶叶白质和内囊外的所有区域中均降低,而MCI患者在除顶叶和枕叶外的所有白质区域中FA值均较低。AlzD患者在所有白质区域中表现出MD增加,而MCI患者在除枕叶和额叶外的所有区域中表现出MD增加【48】。根据文献【49】,DTI是检测MCI和AlzD患者白质变化的敏感方法,这些患者已经在脑区域弥散性方面广泛受损。此外,疾病严重程度的增加与白质破坏的加重相关。然而,DTI在检测早期AD方面并未显示出优于结构性内侧颞叶体积测量【49】。
DKI在AlzD中的应用
Falangola等人[50]首次使用弥散峰度成像(DKI)技术,通过手动绘制和自动生成的感兴趣区域(ROI)分析,比较了健康对照组、轻度认知障碍(MCI)患者和阿尔茨海默病(AlzD)患者。与健康对照组相比,MCI和AlzD患者前冠状辐射的所有峰度指标均下降。与对照组相比,AlzD患者的颞叶椭圆体、颞叶段和胼胝体膝部的平均峰度(MK)和径向峰度(RK)降低,而分段前额叶白质的RK降低。与健康对照组相比,MCI患者的前额叶椭圆体中MK和RK降低。在关注海马体的研究[51, 52]中,与健康对照组相比,MCI和AlzD患者的MK显著降低,AlzD患者表现出最低值。相比之下,三组之间的分数各向异性(FA)相似[51];此外,在遗忘型MCI组和健康对照组之间没有观察到海马体积的显著差异[52]
Gong等人【53】对皮层灰质进行顶点分析并对深部灰质进行ROI分析,观察到与健康对照组相比,MCI和AlzD患者在所有深部灰质区域(除了杏仁核外)中的MK降低;此外,与体积和FA的变化相比,微结构异常分布更广泛(见图1)。这些变化被认为是由于AlzD中皮层和皮层下区域的神经元细胞体、轴突、突触和树突等微结构区间的丧失所致。然而,MD是捕捉MCI和AlzD患者皮层微结构异常最敏感的指标,尤其是在后扣带皮层。作者推测,这种差异是由深部灰质和皮层灰质之间的微结构差异引起的。深部灰质由更多密集排列的细胞和横向轴突纤维组成,而皮层灰质主要由星形胶质细胞等细胞体组成【54】。
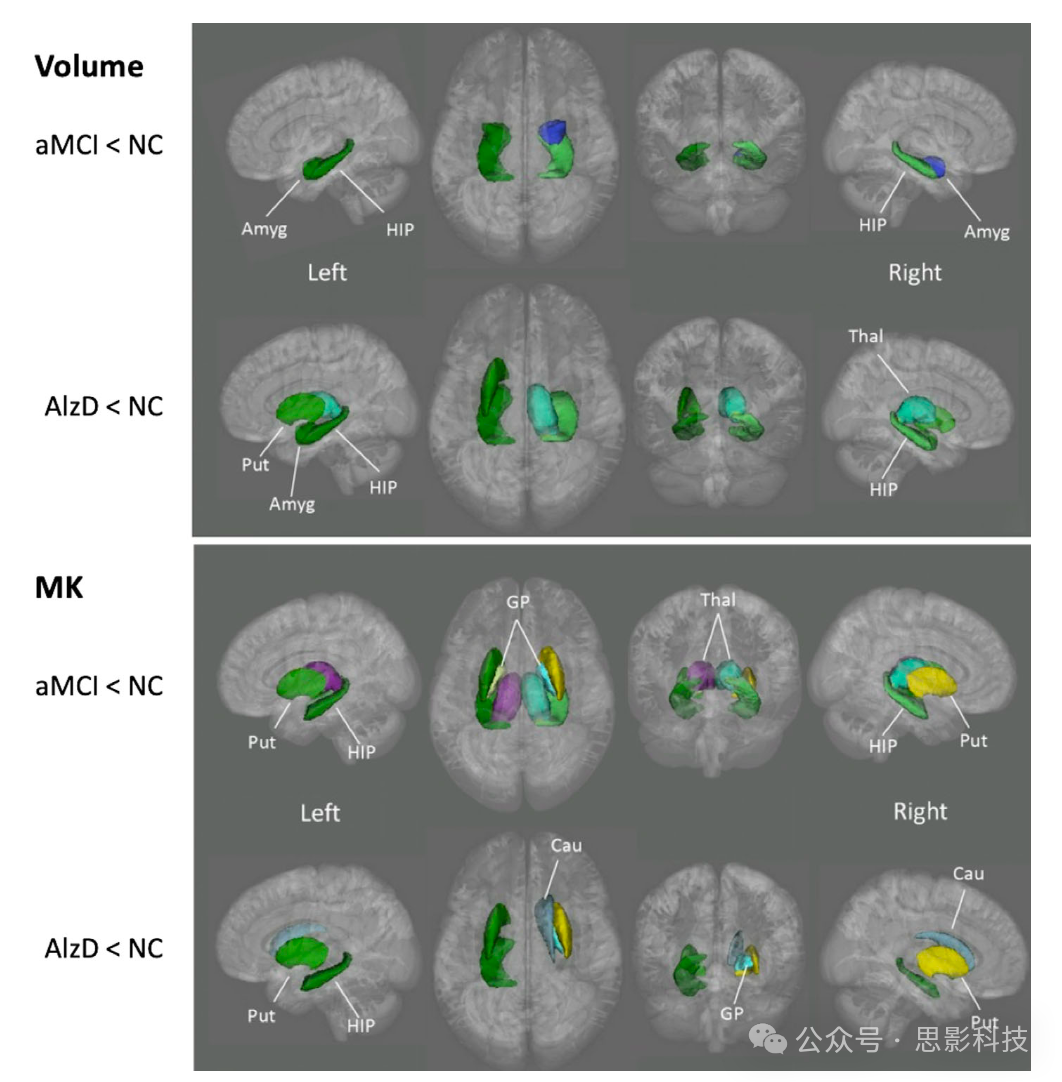
图1 深部灰质区域在健康对照组和患有健忘型轻度认知障碍(aMCI)/阿尔茨海默病(AlzD)患者之间在体积和平均峰度(MK)方面显示出显著差异。
GP:苍白球;Put:壳核;Thal:丘脑;HIP:海马;Cau:尾状核;Amyg:杏仁核。
Chen等人【55】使用机器学习检测AlzD中的白质变化;他们证明了DKI检测到的海马和后扣带束的异常,这些异常未被DTI指标捕捉到。然而,DTI和DKI的结合在检测异常方面显示出比单独的峰度或弥散率更好的性能。此外,在一项AlzD动物研究中,Vanhoutte等人【56】在16个月大的APP/PS1转基因小鼠(脑淀粉样变模型)的皮层和丘脑等一些ROI中显示出MK、AK和RK的增加,但未观察到DTI参数的变化。确实,已显示细胞外Aβ斑块的存在增加了大脑的微结构复杂性【56】。总的来说,这些研究证明了DKI在描绘MCI早期和AlzD晚期微结构变化方面的有用性,并展示了从对照到MCI再到AlzD的轨迹。
双张量DTI在AlzD中的应用
在一项使用基于体素分析的研究中,双张量DTI衍生的自由水(FW)显示在双侧颞叶和额叶与AlzD的CSF生物标志物(如pTau181、Aβ42、YKL-40、sAPPβ和tTau)相关(见图2)【42】。在这些生物标志物中,YKL-40是已知的小胶质细胞活化和神经炎症标志物【42】。与对照组相比,MCI患者的海马中也发现了FW的升高,而体积上没有差异。此外,海马中的FW还与低CSF Aβ(1-42)水平和高全脑淀粉样蛋白PET值相关【57】。MCI和AD患者白质中的广泛FW增加与较差的注意力、执行功能、视觉建构和运动表现相关。较低的FAT还显示在穹窿体内与较低的记忆评分相关【58】。

图2 较高的pTau181/Aβ42水平与较高的白质FW值相关。上方的红黄颜色标度显示了全族错误校正的P值。下层图像是具有1毫米各向同性分辨率的T1加权MNI模板。
在Dumont等人的一项研究中【34】,与健康对照组相比,MCI和AlzD患者在皮质脊髓束和边缘系统束(如扣带束和穹窿束)中表现出FW升高;此外,与MCI患者相比,AlzD患者显示出更广泛的病理。即使在使用白质掩膜去除灰质和CSF部分体积污染后,较高的FW仍然保持不变。即使在从掩膜中去除白质高信号后,显著结果仍然保持,这表明组间FW指标差异不是由于白质病变引起的【34】。
NODDI在AlzD中的应用
在AlzD早期发病的患者中,在一些预定义的皮层灰质区域(这些区域在AlzD中早期萎缩)中,NDI和ODI显著低于健康对照组(内嗅区[仅NDI]、下颞叶、中颞叶、梭状回和楔前皮层)(见图3)【59】。在相对早期发病的AlzD中,NDI也在通常相对免于萎缩的中央前回显示降低;然而,病理学研究表明初级运动皮层容易受到显著的AlzD相关病理的影响【60】。NDI显示与简短精神状态检查的结果呈正相关;在楔前叶、下颞叶和中颞叶区域观察到最强的关联【59】。使用NODDI和基于束的空间统计(TBSS),在APOE ε4阳性和阴性早发AlzD患者中,发现前部白质轴突丧失更为广泛【61】。与健康对照组相比,APOE ε4阳性和阴性早发AlzD患者在从顶枕叶投射的白质束(下纵束和上纵束、下额枕束、胼胝体膝部和后丘脑辐射)中表现出NDI降低;然而,在ε4阳性患者中观察到更广泛的变化,额外涉及胼胝体体和额叶及颞叶的一些部分【61】。此外,所有患者双侧顶枕叶投射的白质束中的NDI与视空间和视知觉认知表现相关【61】。

图3 健康对照组和早发AlzD患者在预定义的皮层ROI中皮层厚度、神经纤维密度指数(NDI)和取向分散指数(ODI)的箱形图:*P < 0.05 **P < 0.008。Bonferroni校正阈值:P = 0.05除以6(ROI总数)。
帕金森病(PD)
PD 是第二常见的进行性神经退行性疾病,涉及多个与各种临床特征相关的神经递质通路。PD 的诊断基于运动缺陷的存在,包括运动迟缓、僵硬和震颤。这些运动特征是由于黑质致密部(SN)中多巴胺能神经元的选择性丧失,以及Lewy病理(包括Lewy神经元和Lewy小体)中α-突触核蛋白免疫反应性包涵体的广泛聚集所致【62, 63】。组织病理学研究表明,PD 初次诊断时,多达 70% 的多巴胺神经元可能已经丧失【64】。因此,识别 PD 的敏感生物标志物是关键任务。
DTI 在 PD 中的应用
DTI 参数,尤其是 FA 和 MD,能够区分 PD 患者和健康对照。据最近的荟萃分析研究【65, 66】,PD 患者在 SN、胼胝体、额叶以及扣带和颞叶皮质中一致表现出 FA 降低和/或 MD 增加。然而,Guimarães 等人【67】质疑 DTI 检测早期 PD 中白质变化的能力。他们使用 DTI 评估了早期、中期和重度 PD,发现只有在重度 PD 组中存在显著异常。
DKI 在 PD 中的应用
仅有两项研究使用 DKI 评估 PD 中的 SN,并且这两项研究均发现 MK 显著增加【68, 69】。Kamagata 等人【70, 71】进行了多项研究,使用 DKI 评估 PD 患者的白质。在第一项使用束特异性分析的研究中,发现 PD 患者的前扣带中 MK 和 FA 降低,而 MK 显示出更好的诊断性能。前扣带是 PD 中早期病理变化的脑部区域;因此,这些发现支持使用 DKI 作为 PD 的早期诊断生物标志物【70】。此外,使用 TBSS 分析,Kamagata 等人【71】证明 DKI 是比 DTI 更敏感的 PD 白质变化检测方式;相比之下,PD 患者的大脑中 MK 值的减少(如在额叶、顶叶和枕叶白质以及胼胝体中)比 FA 的减少更广泛(见图 4)。在交叉纤维区域(如冠状辐射和 SLF)中也观察到 MK 减少,而这些区域的 FA 没有显示出任何变化【71】。Kamagata 等人【15】还使用 DKI 和 NODDI 评估了灰质,这将在后面的子部分中进一步讨论(PD 中的 NODDI)。

图4 比较帕金森病(PD)患者和健康对照的 DTI 和 DKI 指标。
基于束的空间统计(TBSS)图显示 PD 患者与年龄匹配的健康受试者相比,分数各向异性(FA)降低(a)和平均峰度(MK)降低(b)。在 TBSS 图中,FA 骨架(FA >0.2)显示为绿色;单侧置换校正 P <0.05 的体素标记为蓝色(FA)或红色(MK)。
双张量 DTI 在 PD 中的应用
SN (黑质致密部)内的 FW 被认为是区分 PD 患者和健康对照以及 PD 疾病进展的生物标志物。在包括大量队列的单站点和多站点研究中,PD 患者在后 SN 中表现出更高的 FW 和未变化的 FAT 值【72-74】。此外,后 SN 中的 FW 值与运动症状的严重程度相关【72】。在一项研究中,长期 PD 患者在前后 SN 中表现出 FW 增加,这被认为是由于后到前 SN 的退化【75】。FW 还可用于区分 PD 和非典型帕金森病,如多系统萎缩(MSA)和进行性核上性麻痹(PSP)。Planetta 等人【74】显示所有形式的帕金森病中 SN 中的 FW 增加。然而,MSA 和 PSP 均表现出广泛的 FW 增加和 FAT 改变,不仅在 SN 中,还包括基底节、丘脑和小脑【74】。
在纵向研究中,后 SN (黑质致密部)中的 FW 随 PD 进展在 1 年【72】和 4 年【76】内增加,而健康对照中的自由水值未变化。可以使用 Hoehn 和 Yahr 分期系统评估 FW 在 1 年和 2 年的纵向变化【76】。此外,后 SN 中的 FW 增加与较高的 Hoehn 和 Yahr 评分、MDS-UPDRS-III 总运动评分、姿势和步态及震颤评分相关【77】。此外,尾状核和后 SN 中的 FW 增加与更高的痴呆评分相关【77】。还发现后 SN 中的 FW 与壳核和尾状核中的囊泡单胺转运体 2 型(VMAT2)结合(反映黑质-纹状体多巴胺能神经完整性)之间存在负相关【77】。
自由水消除(FW)技术也被用于评估帕金森病(PD)患者的白质(WM)和灰质(GM),方法是使用基于体素的统计分析(TBSS)、基于灰质的空间统计分析(GBSS)和感兴趣区域(ROI)分析。与弥散张量成像(DTI)指标的变化相比,双张量DTI指标的变化体现在更具体的WM区域,而与对照组相比,在WM前部区域观察到较低的轴突张量(FAT)和较高的髓鞘张量(MDT)、轴突弥散度(ADT)和径向弥散度(RDT)(神经元变性的指标),以及在WM后部区域观察到较高的FW(神经炎症的指标)(图5)。作者认为,这些发现与帕金森病中神经炎症先于轴突变性这一事实相符[30]。帕金森病患者在与Braak分期IV相对应的灰质区域中表现出更高的MDT、ADT和FW,而传统的DTI指标没有显著差异(图5)。这表明FW成像指标对检测帕金森病患者的灰质异常更为敏感[30]。

图5上面部分(a)是前部(ACR、ATR和小束)和后部(PCR、PTR和大束)白质区域的ROI分析。
(b)健康对照组(HC;白条)和帕金森病患者(PD;灰条)前部和后部白质区域的DTI(FA、MD、AD和RD)和FW成像(FAT、MDT、ADT、RDT和FW)指标的平均值。
下面部分(a)是属于Braak IV、V和VI期灰质区域的ROI分析。(b)健康对照组(HC;白条)和PD患者(灰条)各区域的FW成像指标(MDT、ADT和FW)的平均值。
ACR:前冠状辐射;ATR:前丘脑辐射;PCR:后冠状辐射;PTR:后丘脑辐射。
NODDI在PD中的应用
与健康对照组相比,PD患者在对侧SN(黑质致密部)和壳核中显示NDI降低。在受试者工作特征曲线分析中,与DTI指标相比,NDI也显示出最佳的诊断性能【78】。另一项研究揭示PD患者对侧纹状体通路远端部分的NDI降低,这可能反映了逆行退化;然而,未观察到DTI参数的变化【35】。
在一项使用GBSS和ROI分析评估DKI和NODDI在灰质中的研究中,与健康对照组相比,DKI(MK、AK和RK降低)和NODDI(NDI降低和ISO增加)参数变化在额叶、颞叶、边缘区和副边缘区的皮层中表现出来,这些区域对应于Braak IV和V期(见图6)。作者建议这些变化可能反映了由于神经纤维生长和分支抑制导致的稀疏神经纤维结构和神经元丧失。虽然PD患者显示出DTI参数变化,如FA降低和MD、AD、RD增加,但相比于使用DKI和NODDI参数识别的更广泛异常,异常区域较为局限(见图6)。因此,DKI和NODDI在检测PD灰质异常方面似乎比DTI参数更敏感。线性判别分析的结果进一步支持了这一点,显示MK和NDI最大化了诊断的预测准确性。此外,额叶、颞叶、基底节、边缘区和副边缘区的DKI和NODDI参数变化与UPDRS-III评分相关,反映了运动障碍的严重程度。

图6 左图:比较帕金森病(PD)患者和对照组的DTI、DKI和NODDI指标。基于灰质的空间统计(GBSS)结果显示,PD患者与年龄匹配的健康受试者相比,FA、ICVF、MK、AK和RK(蓝色-浅蓝色体素)降低,MD、AD、RD和ISOVF(红色-黄色体素)增加。所有图像均显示在蒙特利尔神经研究所(MNI)空间中,使用神经学常规。在PD患者中,与对照组相比,额叶、颞叶、边缘区和副边缘区的皮层灰质显示出显著降低的MK、AK、RK和ICVF(GBSS分析)。常规DTI参数(FA、AD和RD)显著变化的区域明显小于显著变化的MK、AK、RK和ICVF的区域。为了便于可视化,使用FSL中实现的填充脚本加厚结果(校正P <0.05)。
右图:使用ROI分析,在PD组中与统一帕金森病评分量表(UPDRS)-III运动亚量表评分显著相关的dMRI参数区域;这些区域的散点图。左下额回三角区(IFGTr)的MK、AK、ICVF和OD;右IFGTr的MK和RK,左中央盖区(COC)的OD;右额盖区(FOC)的RK;右颞中回后区的RK;和左尾状核的RK与UPDRS-III评分显著负相关。右海马的ISOVF和AD以及左杏仁核(AMY)的AD与UPDRS-III评分呈正相关。
肌萎缩性侧索硬化症(ALS)
ALS 是一种神经退行性疾病,主要表现为四肢以及延髓和呼吸肌的进行性萎缩和无力,这是由于下运动神经元和上运动神经元的损伤所致【79】。ALS 的发病机制仍然主要未知;然而,染色体9号开放阅读框72基因(C9orf72)中的重复扩展是已知的最常见的ALS遗传原因。ALS的诊断基于无痛的进行性无力史,伴有上运动神经元和下运动神经元功能障碍的体征【79】。至今,还没有确定的ALS诊断测试;因此,需要识别非侵入性神经影像学生物标志物。
DTI 在 ALS 中的应用
根据一些系统综述和荟萃分析研究【5, 80-82】,ALS患者的皮质脊髓束和内囊后肢中的FA持续降低;此外,常伴有MD、RD或AD的增加。胼胝体后中部也发现FA降低,已知该部位包含连接两个运动皮质的纤维【83, 84】。额叶、颞叶和顶叶内的其他区域也显示FA降低。这些发现证实了ALS是一种涉及运动和非运动区域的多系统疾病。一些纵向研究发现CST中的FA降低,而其他研究则没有【80】。总体而言,DTI似乎是ALS的有希望的诊断生物标志物;然而,其敏感性和特异性相对较低(分别为0.65和0.67)【85】。
DKI 在 ALS 中的应用
在ALS患者中,与对照组相比,对侧运动皮层(对侧有症状肢体)的ROI分析中,MK、AK和RK均降低;然而,在DTI参数方面未观察到显著的组间差异【86】。RK还与ALS功能评级量表修订版(ALSFRS-R)相关,这是ALS的疾病严重程度评分【86】。
在基于体素的分析研究中,与对照组相比,ALS患者在以下白质区域显示MK和RK降低:双侧中央前回、双侧冠状辐射、双侧胼胝体中部、左枕叶和右顶上小叶。在灰质中,ALS患者在双侧中央前回、双侧旁中央小叶和左前扣带回中显示MK和RK降低(见图7)【87】。在ALS患者的白质中还发现FA降低和MD及RD增加;然而,空间范围较小(见图7)【87】。在同一研究中,在白质区域中,右白质中央前回的MK值与ALSFRS-R评分呈正相关,而左中央前回的MK和RK值与疾病持续时间呈负相关。在灰质区域中,左尾状核体的RK值与ALSFRS-R评分呈正相关【87】。有趣的是,在这两项研究中【86, 87】,ALS患者中RK一致减少,而AK仅在一项研究中发现减少。RK被认为反映髓鞘的完整性;因此,RK减少可能表明ALS中的髓鞘损伤。确实,尸检研究表明ALS患者中存在脱髓鞘现象【88】。

图7 左图和中图:ALS患者与健康对照相比,灰质和白质区域中显著降低的MK。
中图:ALS患者与健康对照相比,灰质和白质区域中显著降低的RK。
右图:ALS患者与健康对照相比,白质区域中显著降低的FA(a)、显著增加的MD(b)和显著增加的RD(c)。显示的图像覆盖在所有受试者的平均白质和灰质图上。
双张量DTI在ALS中的应用
据我们所知,尚无研究调查双张量DTI在ALS中的应用。
NODDI在ALS中的应用
使用NODDI对表现出ALS症状的患者进行全脑体素分析显示,相对于健康对照组,整个颅内皮质脊髓束直至中央前回的皮质下白质和胼胝体中NDI显著减少,右内囊前肢ODI增加,右侧脑室旁ISO增加(见图8)【89】。此外,与仅涉及肢体的患者相比,同时涉及肢体和延髓的患者在右侧冠状辐射和中央前回皮质下白质中观察到更显著的NDI减少【89】。在这项研究中,较长的病程与中央前回、背外侧前额皮质和楔前叶ODI的减少相关【89】。正如预期的那样,FA在皮质脊髓束中减少,但其程度不及NDI,这些发现表明NODDI可能比DTI更敏感(见图8)【89】。

图8 全脑分析中ALS和对照组在NODDI参数(a)NDI、(b)ODI和(c)ISO及DTI参数(d)FA和(e)MD上的显著差异区域。这些结果显示统计显著性P < 0.05,经过簇级家族错误校正后;簇形成使用P < 0.001。图Ai-Aviii显示了在轴向切片上内囊后肢(vi)延伸至中央前回皮质下白质(viii)中NDI显著差异的区域。
ROI分析显示,在携带C9orf72突变的无症状携带者的白质和灰质体积测量中,NODDI的敏感性也高于DTI【90】。与非携带者相比,C9orf72突变携带者在10条束(涉及额颞相关和皮质脊髓束)中表现出NDI改变,而DTI(MD、AD和RD增加)指标仅在5条束中表现出改变。效应量结果证实,NDI比DTI指标更敏感,而在两个束中NDI的效应量显著高于DTI指标【90】。此外,13个区域显示出ISO增加,而11个区域显示出体积萎缩【90】。总的来说,这两项研究表明,ALS中的白质完整性异常主要是由神经元丧失引起的【89, 90】。
亨廷顿病(HD)
HD是一种常染色体显性遗传的进行性神经退行性疾病,通常在中青年时期发病。该疾病以运动、认知和精神障碍为特征【91】。HD基因中胞嘧啶-腺嘌呤-鸟嘌呤重复扩展被认为导致中型有棘神经元的选择性丧失,特别是在纹状体中;然而,这随后导致基底节周围的白质减少,延伸至整个皮层的皮层白质【91, 92】。由于对该基因突变的了解,HD是少数可以为有已知家族史的个体提供预测性基因检测的神经退行性疾病之一。这使得识别HD基因突变携带者或无症状HD(pre-HD)成为可能。然而,结构性MRI也被证明在评估pre-HD方面有用。在运动特征出现前1-2十年即可检测到纹状体的体积减少【93】。萎缩随时间进展【94】并与疾病负荷相关【95】。这支持使用结构性MRI作为HD的状态生物标志物;然而,它有其局限性,因为它不提供疾病的直接病理测量。
DTI在HD中的应用
最近的一项荟萃分析【96】包括140例pre-HD、235例症状性HD(sym-HD)和302例对照,显示HD患者在基底节和胼胝体中的DTI参数异常。具体而言,与对照组相比,pre-HD和sym-HD患者在尾状核、壳核和苍白球中的FA显著增加,而在胼胝体中的FA显著降低。此外,与对照组相比,pre-HD和sym-HD患者在壳核和丘脑中表现出显著增加的MD,sym-HD患者在尾状核中也表现出显著增加的MD。在胼胝体中,sym-HD患者的RD和AD显著增加。在一项纵向研究中,比较HD患者(包括pre-HD和早期sym-HD)和健康对照在1年期间的变化,显示基线和1年随访期间在皮质下、胼胝体和额纹状体束中FA显著减少,与AD下降重叠,包括内囊上升支和上冠状辐射【97】。
DKI 在 HD 中的应用
迄今为止,DKI 尚未应用于 HD 患者。然而,在一些使用 ROI 分析的研究中,峰度指标已显示出随着老年转基因 HD 大鼠病理变化而变化。Blockx 等人【98】在纹状体和外囊中发现 RK 增加,并建议纹状体中的变化似乎是由于高度的弥散复杂性和限制,而外囊中的变化反映了纤维成分或细胞通透性(见图 9)。组织学上,RK 与星形胶质细胞表达的胶质纤维酸性蛋白呈正相关【98】。另一项研究评估了 DKI 在发育中的转基因 HD 大鼠幼仔在出生后第 15 天和第 30 天评估白质和灰质的应用。出生后第 30 天,尾状核和壳核的 AK 值高于对照组【99】。这两项研究均表明,DKI 是检测与 HD 相关的白质和灰质异常的敏感方法。

图9 在 tgHD 大鼠和 Wt 同窝动物中,不同 ROI(灰质:(前)额叶皮质、皮质和纹状体 - 白质:胼胝体和外囊)中测量的弥散参数的平均值和标准差。tgHD 大鼠在纹状体和外囊中的 RK 增加。*P < 0.05。
双张量 DTI 在 HD 中的应用
Steventon 等人【100】进行了双张量 DTI,并使用 ROI 和束成像方法测量了 HD 患者胼胝体的组织体积分数(TVF),反映了消除 FW 后的估计组织体积分数。他们证明,与健康对照组相比,HD 患者的 TVF 减少;此外,发现 TVF 是比 DTI 指标更敏感的疾病负担参数。沿着白质通路的 TVF 减少表明组织中的包装密度减少,这可能是由于轴突丧失或脱髓鞘引起的【100】。
NODDI 在 HD 中的应用
在使用 NODDI 的 pre-HD(显性 HD 基因携带者)研究中,观察到白质束中轴突密度的广泛减少(由 NDI 指数),这与 MD 增加重叠,包括胼胝体和基底节周围的白质束;胼胝体中 NDI 减少与严重性标志物呈正相关(见图 10)。TBSS 和 ROI 分析结果表明,轴突病理是 pre-HD 中白质退化的主要因素【92】。此外,与对照组相比,在基底节周围和内外囊中的束中观察到 ODI 增加,这是轴突组织增加的指标;这反映了潜在的轴突修剪【92】。

图10上图:与对照组(NC)相比,显性亨廷顿病(pre-HD)基因携带者的 NODDI 参数区域差异分布。
在整个大脑中,神经纤维密度(NDI)减少,表明轴突密度减少(a),以及胼胝体和内外囊中纤维分散(ODI)减少,表明选择性修剪白质纤维(b)。无阈值簇增强 P < 0.05。NODDI 指标组间差异叠加在白质骨架上。
下图:NDI 与疾病进展临床标志物的相关性。(a)胼胝体体中 NDI 与发病累计概率呈负相关。(b)胼胝体压部中 NDI 与总运动评分呈负相关。
结论与未来方向
神经退行性疾病的早期诊断对于未来开发神经保护疗法非常重要。这篇综述表明,DKI、双张量 DTI 和 NODDI 可能作为评估神经退行性疾病微结构变化的潜在敏感生物标志物以及疾病进展的生物标志物。此外,DKI、双张量 DTI 和 NODDI 在检测神经退行性疾病的灰质变化方面显示出比 DTI 更显著的优势。
重要的是,通过双张量 DTI 和 NODDI 获得的 FW 图可以用作神经炎症的生物标志物【30, 31, 39】。神经炎症在神经退行性疾病中的作用也必须得到充分阐明,因为在神经退行性疾病患者中广泛检测到促炎剂【101】。此外,NODDI 可以提供神经纤维密度和取向分散的生物标志物【9】。确实,神经退行性病变与神经元结构的慢性进行性丧失有关【101】。然而,考虑到每种技术的局限性,对弥散指数变化的解释是复杂的,应该谨慎进行。
越来越多的证据表明髓鞘作为神经退行性疾病的重要病理特征的参与【102】。由于弥散 MRI 对髓鞘不敏感,需要同时使用弥散 MRI 和髓鞘成像技术进行评估,以展示神经退行性疾病的更完整的病理图景。
尽管多发性硬化症最近被认为是一种神经退行性疾病,但它未在当前文章中涉及【103】。此外,我们没有讨论其他更复杂的弥散 MRI 微结构模型(如复合受阻和受限弥散模型或 AxCaliber)在神经退行性疾病中的应用,主要是因为它们在运动障碍患者中的临床应用受限于扫描协议的长时间。然而,这些主题值得进一步讨论。
























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








