来自多个实验室和不同神经影像学模态的研究结果一致表明,外源性给予细胞因子或诱导细胞因子的炎症刺激会破坏与动机和运动活动、威胁检测、焦虑以及内感受和情绪处理相关的回路和网络。虽然炎症对神经回路和相关行为的影响可能代表了在免疫激活期间促进节能和提高警惕性的适应性反应,但慢性升高的炎症可能导致精神疾病的症状。事实上,细胞因子和急性期反应物等炎症生物标志物在单极或双极抑郁症、焦虑相关障碍和精神分裂症的一部分患者中可靠地升高,并与不同的治疗反应和较差的临床结果相关。越来越多的文献还描述了在精神病患者和高危人群中,内源性炎症标志物水平较高,以及这些回路内功能或结构连接的改变(通常是降低)与跨诊断症状(如快感缺乏和焦虑)相关。本文介绍了最近的证据,表明炎症及其对大脑的影响可能是与跨诊断症状相关的解剖和/或功能连接的皮质和皮质下区域之间连接异常的一种分子和细胞机制。我们还讨论了建立可重复方法来评估与行为相关的炎症相关连接异常的必要性,以用于转化研究或生物标志物驱动的临床试验,以研究针对炎症或其对大脑影响的新型药理或行为干预。本文发表在Biological Psychiatry杂志。
关键词:
快感缺乏、焦虑、抑郁、功能性磁共振成像、功能连接、炎症、内感受
精神疾病中的炎症:来源和症状
精神病患者炎症增加的机制和流行率
在其他医学上健康的精神病患者中,遗传倾向可能与导致低度炎症的环境/生活方式因素相互作用,包括病原体(如潜伏感染、肠道菌群失调)和在没有病原体存在的情况下触发先天免疫反应的"无菌"炎症信号(图1A)。这些因素中的许多因素增加了精神和医学疾病的风险,表明存在共同的病理生理机制,解释了高共病率。激活的先天免疫细胞释放炎症细胞因子,如白细胞介素(IL)、肿瘤坏死因子α(TNF)和干扰素(IFN),然后诱导肝脏产生C反应蛋白(CRP)等急性期反应物。
大量研究和荟萃分析报告,在抑郁症以及其他共享减少动机、精神运动迟缓和焦虑等常见症状域的精神疾病(包括双相障碍、精神分裂症、焦虑障碍和创伤后应激障碍(PTSD))中,CRP(C反应蛋白)和循环炎症细胞因子(如IL-1、IL-6、TNF、IFN)的蛋白质或基因表达标志物水平较高。例如,在大约25%到40%的抑郁症患者中观察到高外周炎症,定义为CRP>3 mg/L(即心血管代谢疾病的高风险),这可能反映了一些(但不是所有)炎症细胞因子活性的增加。纵向研究发现CRP可以预测抑郁症状,甚至超过先前抑郁症的严重程度。重要的是,较高的CRP(C反应蛋白)和炎症细胞因子也与抑郁症对常规抗抑郁药物的耐药性以及精神分裂症更差的临床结果相关。

图1. 炎症的来源和机制及其对导致精神病症状的神经递质和回路的影响。
(A) 先天免疫激活和慢性低度炎症的机制。遗传倾向可能与多种环境和生活方式因素相互作用,导致慢性低度炎症,其中许多因素是精神疾病和主要医学疾病的风险因素,包括心理压力、睡眠紊乱、不良饮食、代谢变化和肠道菌群失调以及慢性感染和环境毒素。先天免疫细胞被病原体或无菌炎症(如DAMPs、代谢、神经内分泌或氧化应激)途径激活,合成和释放炎症介质如细胞因子(如IL、TNF、IFN),这反过来诱导肝脏产生CRP(C反应蛋白)等急性期反应物。急性炎症活动通常通过体内平衡过程得到解决,但这些机制的破坏或长期免疫激活可导致影响多个系统(包括大脑)的慢性低度炎症。
(B) 血脑界面的双向炎症过程。激活的先天免疫细胞与适应性免疫细胞(如淋巴细胞)相互作用,迁移到循环系统,并转移到器官和组织,包括大脑。循环的炎症细胞因子和激活的免疫细胞与大脑内皮细胞通信,诱导其他炎症介质(如PGE2)。炎症细胞因子可以通过主动运输或在脑室周围器官或血脑屏障紧密连接的开口处被动进入中枢神经系统,同时还通过迷走神经传入纤维向大脑发出信号。小胶质细胞可以被源自中枢神经系统的炎症刺激或这些来自外周的炎症信号激活,并在中枢神经系统中详细释放炎症介质,如细胞因子、ROS和氮中间体以及进一步招募外周炎症细胞到血管周围区域或大脑实质的趋化因子。炎症还增加了来自KYN分解的神经活性代谢物,KYN由IDO在局部激活的小胶质细胞中或由巨噬细胞合成,然后主动运输到大脑。
(C) 炎症细胞因子和相关的氧化分子影响单胺和谷氨酸神经传递。炎症细胞因子和相关的ROS和氮物种的释放可以通过多种方式影响神经元功能,包括对神经递质如单胺和谷氨酸的影响。例如,合成单胺前体所需的辅因子BH4的氧化导致单胺的可用性和释放减少,特别是DA,它需要BH4将苯丙氨酸转化为酪氨酸和酪氨酸转化为左旋多巴。还有证据表明,炎症细胞因子可以降低VMAT2的表达或功能;增加MAT的表达和活性,尤其是5-HTT;并减少MAR如D2受体的表达。这些效应共同导致突触单胺可用性和信号传导的净减少。炎症和氧化因素还影响谷氨酸传递的多个方面,特别是通过降低EAAT2对谷氨酸的星形胶质细胞缓冲,包括逆转其外流,同时促进xCT的活性以增加细胞外谷氨酸。大脑中KYN的增加运输或局部产生以及随后产生的神经毒性代谢物如QUIN(NMDAR激动剂)进一步增加谷氨酸信号传导,包括在突触外受体处,导致兴奋性毒性和下游ROS的产生。
(D) 外周给予急性和慢性炎症刺激,诱导抑郁和焦虑症状,在人类神经影像学研究中可靠地影响相关大脑区域和回路。对慢性接受炎症细胞因子(如IFN-α)治疗的患者或给予诱导细胞因子的刺激(如内毒素、疫苗)的健康参与者进行神经影像学研究表明,细胞因子影响与奖励和运动相关的区域和回路以及参与威胁、焦虑和情感处理的区域和回路。例如,在接受IFN-α治疗的患者中进行的正电子发射断层扫描和磁共振波谱研究反映了细胞因子对神经递质的影响,包括纹状体DA可用性和释放减少以及细胞外谷氨酸增加,这两者都与动机减少和低能量相关。相应的纹状体微观结构和功能变化包括急性或慢性给予IFN-α或其他炎症刺激后,VS(腹侧纹状体)对奖励预期/接收的反应减弱,以及vmPFC(腹内侧前额叶皮质)和VS关键区域之间的功能连接降低。炎症刺激还增加了杏仁核、岛叶和dACC(背侧前扣带回皮质)在设计用于触发情绪反应的任务中的神经激活,无论是独立还是共同作用。重要的是,内毒素还诱导了休息状态下杏仁核更大的时间变异性,这与SN内功能连接降低以及炎症诱导的焦虑增加相关。这些关于外源性炎症刺激对大脑影响的发现为评估精神病患者内源性炎症标志物与这些区域/回路的结构和功能关系的日益增长的工作建立了框架。
缩写词:5-HTT,血清素转运体;ACC,前扣带回皮质;BH4,四氢生物蝶呤;CNS,中枢神经系统;CRP,C反应蛋白;DA,多巴胺;dACC,背侧ACC;DAMPs,危险相关分子模式;DS,背侧纹状体;EAAT2,兴奋性氨基酸转运体2;FC,功能连接;[18]FDG,氟脱氧葡萄糖;[18]FDOPA,氟多巴;IDO,吲哚胺2,3-双加氧酶;IFN,干扰素;IL,白细胞介素;KYN,犬尿氨酸;MAPK,有丝分裂原活化蛋白激酶;MAR,单胺受体;MAT,单胺转运体;NE,去甲肾上腺素;NFκB,核因子kappa B;NLRP3,NOD-,LRR-和pyrin结构域含蛋白3;NMDAR,NMDA受体;PGE2,前列腺素E2;QUIN,喹啉酸;R,受体;ROS,活性氧;SN,突显网络;STAT,信号转导和转录激活因子;TLR,Toll样受体;TNF,肿瘤坏死因子;Trp,色氨酸;VMAT2,囊泡单胺转运体2;vmPFC,腹内侧前额叶皮质;VS,腹侧纹状体;xCT,胱氨酸-谷氨酸交换体。
外周-中枢免疫在血脑界面的交叉对话
在脑脊液(CSF)中发现了升高的CRP、先天性/炎症性细胞因子和外周白细胞,尸检研究显示在抑郁症、双相障碍和精神分裂症中存在炎症细胞因子和信号通路增加、小胶质细胞激活和/或外周免疫细胞向大脑实质迁移的证据。然而,在抑郁症患者与对照组(n=106/组)或与CRP相关(n=73)的研究中,没有观察到广泛的血脑屏障(BBB)破坏的证据(例如,CSF/循环白蛋白、IgG比率),这与动物模型的证据一致。例如,虽然单核细胞迁移和外周IL-6对慢性应激诱导的抑郁模型中快感缺乏和抑郁行为的表达是必需的,但BBB保持相对完整,仅在伏隔核(NAc)区域特异性地完整性降低,表现为对IL-6的通透性增加。易感小鼠的NAc和抑郁症患者(n=39)的尸检NAc(伏隔核)中也观察到BBB蛋白(如claudin-5)减少,但前额叶皮层(PFC)或海马体中未见此现象。
虽然外周免疫激活足以引起抑郁症状(见下文),但重要的是要注意到这涉及双向过程,即外周细胞因子和免疫细胞与内皮细胞、星形胶质细胞和小胶质细胞相互作用,以详细产生细胞因子和炎症介质;小胶质细胞反过来释放趋化因子,招募外周细胞(图1B)。这些双向机制可能在涉及遗传、发育或自身免疫倾向以及可能在大脑中启动以参与外周免疫系统的炎症过程的精神分裂症等疾病中特别相关。例如,与抑郁症不同,除了CSF/血清白蛋白比率和其他BBB破坏标志物(n=104/组),在精神病性障碍中还可见CSF补体激活的证据,在某些情况下还有抗神经元抗体。相反,被认为反映小胶质细胞/巨噬细胞激活的TSPO(转位蛋白)正电子发射断层扫描(PET)成像经常被报道在抑郁症中增加(尽管与外周炎症标志物不相关),但在精神分裂症中较低,这可能反映了方法限制,例如,非特异性结合或来自激活的外周免疫细胞的竞争,而不是炎症状态降低。尽管如此,患者血液和CSF中先天性/炎症性细胞因子和急性期反应物在与各种疾病的症状域相关的类似模式反映了先天免疫激活对大脑影响的潜在共同机制(见下文),无论其来源如何。
炎症增加和跨诊断症状:因果关系
炎症细胞因子诱导动机减退、运动迟缓和焦虑症状
与上述炎症在精神疾病中的作用一致,大量临床和转化数据表明,给予细胞因子或诱导细胞因子的炎症刺激会影响神经递质和与多种疾病病理生理相关的回路,并伴有抑郁和焦虑症状(图1C,D)。一些最强有力的临床证据表明炎症可能在精神症状中起因果作用,这来自于长期接受抗病毒/抗增殖细胞因子(如用于传染病/癌症治疗的IFN-α)的患者。高达50%接受IFN-α治疗的患者可靠地出现符合重度抑郁标准的症状,约80%经历疲劳、能量减退和/或精神运动迟缓。IFN-α治疗后也经常报告焦虑和动机减退或快感缺乏。事实上,专门探测快感缺乏或动机减退的工具产生的效应大小(r=0.47-0.49)与IFN-α诱导的总抑郁或疲劳评分增加相当。急性给予炎症刺激,如低剂量内毒素/疫苗,能有效诱导细胞因子,在人类和实验动物中短暂增加抑郁/焦虑症状,用于研究外周炎症对大脑的影响。
内源性炎症、跨诊断症状和抗细胞因子治疗的逆转
虽然上述炎症对相关回路和行为的影响可能代表了促进能量保存(如动机减退/快感缺乏、精神运动迟缓)、提高警惕性(如威胁检测、焦虑)或免疫激活期间的社会/情感适应的适应性反应,但慢性升高的炎症可能导致精神症状。因此,经常报告低度炎症的生物标志物与那些由外源性炎症刺激诱导的症状以及抑郁和其他精神疾病常见症状之间的关系。例如,在医学上稳定、未用药的抑郁症患者中,我们发现快感缺乏与血浆CRP和炎症细胞因子簇(IL-1、IL-6、TNF)及其在脑脊液中的可溶性受体之间存在关联(n = 76)。研究结果被进一步扩展,报告了T细胞和非T细胞细胞因子与快感缺乏之间的相关性,以及基线TNF与4个月后抑郁症快感缺乏之间的纵向相关性。我们还发现了抑郁症中精神运动迟缓与炎症标志物之间的关系,并且许多研究报告了精神分裂症中高炎症与阴性症状(包括动机缺陷、情感平淡和社交退缩)相关。越来越多的文献进一步描述了CRP/细胞因子与焦虑之间的相关性,包括纵向研究,以及与抑郁的相关性。
TNF拮抗剂英夫利西单抗仅在具有较高血浆CRP的难治性抑郁症患者中降低了整体抑郁严重程度,快感缺乏(工作和活动)是改善最明显的症状,其次是运动迟缓(迟滞)和焦虑(精神性焦虑)。最近的研究同样发现,英夫利西单抗或sirukumab(抗IL-6)在有炎症增加证据的单极或双极抑郁症患者中优先减少快感缺乏。这些因果关系表明,快感缺乏、运动迟缓和焦虑等跨诊断症状既可以被炎症刺激诱导,也可以被细胞因子拮抗逆转,支持炎症对相关大脑区域/回路的特异性影响,这可能作为开发高炎症患者治疗的转化靶点。
炎症刺激对大脑区域和回路的影响:从临床到实验室
如上所述,慢性给予的炎症细胞因子治疗(如IFN-α)以高比率引起临床显著的抑郁症状,这个模型被用于早期研究外周炎症对大脑的影响。对接受IFN-α治疗的患者进行全脑氟脱氧葡萄糖PET分析显示,基底神经节静息葡萄糖代谢增加(与神经系统疾病中多巴胺信号低下一致)和前额叶皮层代谢减少。这些发现随后被PET研究中尾状核、壳核和腹侧纹状体(VS)(包括伏隔核)的低多巴胺可用性/释放以及磁共振波谱(MRS)研究中基底神经节和背侧前扣带回皮质(dACC)的谷氨酸增加(图1D)联系起来,所有这些都与IFN-α诱导的症状相关,包括动机减退和无力。这些在慢性IFN-α治疗期间患者的临床发现表明,外周炎症通过影响多巴胺和谷氨酸等神经递质影响皮质和皮质下区域,这已被许多使用各种炎症刺激的人类和动物实验室研究所证实和补充,其神经生物学机制在其他地方有所综述(图1C)。与更大范围的工作(解决外源性炎症刺激对大脑区域/回路的功能后果)相关,开创性的功能磁共振成像(fMRI)研究在此简要总结(图1D),因为它们为一种主要使用基于回路和网络的方法来理解内源性低度炎症与精神病患者改变的功能连接(FC)和结构连接之间关系的新研究奠定了基础(见高炎症患者的结构和功能连接异常)。
炎症对奖励和运动区域和回路的影响
与上述炎症对多巴胺可用性的影响相辅相成,fMRI在给予炎症细胞因子(如IFN-α治疗)或炎症刺激(如在实验室给予的内毒素或疫苗)的受试者中一致显示,外周炎症对与动机减退和精神运动迟缓相关的大脑区域的功能影响。例如,慢性IFN-α治疗降低了VS对奖励接收的神经激活,与动机减退相关。在健康志愿者中观察到急性内毒素/疫苗后对奖励处理的类似影响,并由疫苗对黑质任务相关活动的影响得到补充,后者与精神运动迟缓和IL-6相关。除了区域聚焦的任务fMRI发现外,全脑分析揭示了快速(4小时)IFN-α诱导的自由水信号微结构变化(与水肿一致),局限于左侧纹状体,预测随后的疲劳。重要的是,来自急性IFN-α或疫苗的证据表明,这些在已知调节动机和运动活动的离散区域中的神经递质、结构和功能变化更广泛地促进了炎症对关键回路中FC(功能连接)的影响,包括VS(腹侧纹状体)-腹内侧前额叶皮层(vmPFC),或作为全局网络中预测抑郁症状的主要节点。
炎症对威胁检测、焦虑以及情感和内感受处理相关区域和回路的影响
除了对奖励和运动区域的影响外(见"炎症对奖励和运动区域和回路的影响";图1D),外周炎症刺激还被证明可以增加杏仁核、dACC(背侧前扣带回皮质)和岛叶的神经激活,类似于在抑郁症、焦虑症和PTSD中报告的发现。虽然针对杏仁核的分析显示,与IFN-α或内毒素诱导的抑郁或社交断开症状相关,右侧杏仁核对情感或社会威胁刺激的反应增强,但全脑分析揭示了炎症通过与任务相关的dACC、mPFC和岛叶激活的增加,无论是独立还是与彼此或杏仁核协同。例如,伤寒疫苗增加了包括中/后岛叶以及杏仁核和dACC在内的内感受网络的任务激活。鉴于岛叶在内感受中的作用,该区域在内毒素后显示PET静息葡萄糖代谢增加和与多个皮质区域的种子点到体素静息态FC(rsFC)降低并不令人惊讶。虽然基于任务和种子的分析可能会偏向或限制观察到的炎症对特定区域的影响,但一种更加不可知的网络方法揭示了突显网络(包括杏仁核、岛叶和dACC)内rsFC的降低,与仅在杏仁核中rsFC信号时间变异增加相关,后者又与内毒素诱导的焦虑相关。这些发现与动物研究一致,后者显示外周炎症刺激可以部分通过直接的细胞因子效应快速激活杏仁核并与行为相关,并强调了参与内感受/情感处理和警惕/威胁检测的功能连接区域对炎症诱导的相关症状(包括焦虑)的贡献的重要性。
高炎症患者的结构和功能连接异常
如"精神疾病中的炎症:来源和症状"和"炎症刺激对大脑区域和回路的影响:从临床到实验室"中所讨论的,炎症可以影响被认为是精神病诊断中观察到的网络功能障碍基础的神经递质和关键区域和回路(图1D),并可能在一部分患者中促进疾病病理生理和离散症状。虽然与炎症相关的结构和自由水变化在精神分裂症中有报道,但有助于我们不断发展的对内源性炎症与精神疾病中与跨诊断症状相关的大脑活动或FC关系理解的研究主要集中在抑郁症或双相障碍上,并采取假设驱动的、以症状为中心的方法来检查炎症与额纹状体、杏仁核-前额叶和内感受回路/网络之间的关系(表1)。因此,结果以回路/症状为重点呈现。由于精神病患者炎症标志物与低rsFC之间的关系已成为炎症相关连接异常最一致的发现,具有作为可靠的炎症大脑生物标志物进行转化使用的潜力,这些研究在图2中得到了突出强调。
表1. 评估内源性炎症与显著精神病症状或诊断背景下功能或结构神经影像学结果关系的研究
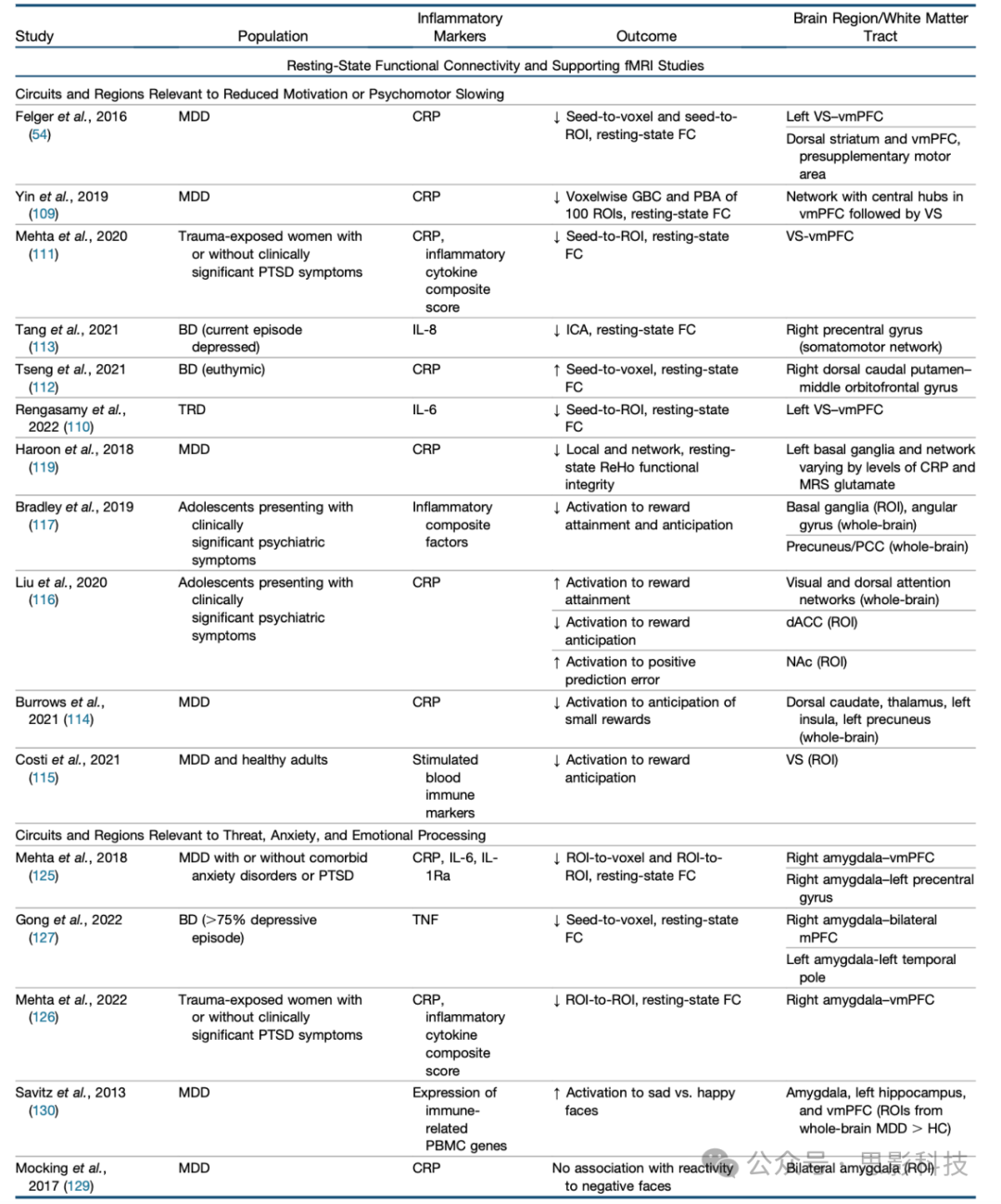

ACC, 前扣带回皮层; AN, 情感网络; BD, 双相障碍; CRP, C反应蛋白; dACC, 背侧ACC; DMN, 默认模式网络; FA, 分数各向异性; FC, 功能连接; fMRI, 功能磁共振成像; GBC, 全脑连接; HC, 健康对照; ICA, 独立成分分析; IFN, 干扰素; IL, 白细胞介素; MDD, 重性抑郁障碍; mPFC, 内侧前额叶皮层; MRS, 磁共振波谱; NAc, 伏隔核; NBS, 基于网络的统计; PBA, 基于分区的分析; PBMC, 外周血单个核细胞; PCC, 后扣带回皮层; PD, 质子密度; PTSD, 创伤后应激障碍; QA, 定量各向异性; Ra, 受体拮抗剂; RD, 径向扩散率; ReHo, 局部一致性; ROI, 感兴趣区; SA, 自杀企图; SZ, 精神分裂症; TNF, 肿瘤坏死因子α; TRD, 难治性抑郁症; VAN, 腹侧注意网络; vmPFC, 腹内侧前额叶皮层; VS, 腹侧纹状体。

图2. 与精神疾病相关的关键回路和网络中与炎症相关的静息态功能连接异常。总结了新兴文献中的关键研究,描述了抑郁症或其他精神疾病患者中循环炎症生物标志物(如炎症细胞因子和急性期反应物CRP)与前纹状体回路(调节动机或运动活动)、杏仁核-前额叶回路(涉及恐惧、威胁和焦虑)以及涉及内感受和情感处理的回路/网络中静息态功能连接降低之间的关联,这些都可能导致精神疾病患者的跨诊断症状。大量医疗、环境和生活方式因素导致抑郁症和其他精神疾病患者的先天免疫激活。外周免疫细胞如单核细胞和T细胞激活炎症信号通路并进行代谢重编程,促进细胞因子的释放和细胞向大脑的迁移。外周和中枢神经系统产生的炎症细胞因子可以通过影响神经递质(如多巴胺和谷氨酸)或结构改变(如白质完整性降低)来影响与精神疾病相关的关键脑区、回路和网络内的神经激活和功能连接。
缩写词:BD, 双相障碍; CRP, C反应蛋白; dACC, 背侧前扣带回皮层; DMN, 默认模式网络; DS, 背侧纹状体; IFN, 干扰素; IL, 白细胞介素; Jak-Stat, Janus激酶/信号转导和转录激活因子; MDD, 重性抑郁障碍; NFκB, 核因子kappa B; NLRP3, NOD-, LRR-和pyrin结构域含蛋白3; PD, 质子密度; pre-SMA, 前补充运动区; PTSD, 创伤后应激障碍; SZ, 精神分裂症; TNF, 肿瘤坏死因子; TRD, 难治性抑郁症; VAN, 腹侧注意网络; vmPFC, 腹内侧前额叶皮层; VS, 腹侧纹状体。
非精神病人群中的炎症和低rsFC(静息态功能连接):全生命周期的风险因素
由于我们的讨论重点是精神疾病背景下的内源性炎症和rsFC,值得提及非精神病人群中类似工作的代表性研究。与上述外周炎症对涉及情绪调节的区域和回路的影响一致(见"炎症对威胁检测、焦虑以及情感和内感受处理相关区域和回路的影响"),CRP/炎症细胞因子的综合指数或经典单核细胞数量与高风险非裔美国青年群体中情绪调节网络的低rsFC相关。青少年中细胞因子(TNF)与改变的rsFC的关联也延伸到其他对炎症敏感的区域,包括右侧杏仁核和左侧VS。在成年人中,IL-6部分介导了儿童期虐待与杏仁核-vmPFC(腹内侧前额叶皮质)rsFC降低之间的关系,而炎症细胞因子综合指数与暴露于压力的消防员中亚临床PTSD症状相关的低突显、默认模式网络(DMN)和中央执行网络间rsFC相关。最后,老年人的炎症细胞指数(中性粒细胞/淋巴细胞比率)与vmPFC区域内的rsFC呈负相关,与老年抑郁症状相关。这些发现,连同炎症刺激对大脑的影响(见"炎症刺激对大脑区域和回路的影响:从临床到实验室"),表明炎症对敏感区域/回路内FC的影响可能是暴露于压力、早期生活逆境和衰老等风险因素的个体中常报告的炎症标志物与精神病症状之间关联的潜在大脑机制,并支持这些途径作为精神病患者中与炎症相关的连接异常的机制。
前纹状体回路和跨诊断症状的动机减退和精神运动迟缓
炎症与奖赏和运动回路中的低rsFC
与外源性炎症刺激对奖赏相关区域的影响类似(参见"炎症对奖赏和运动区域和回路的影响";图1D),我们和其他研究者发现精神病患者的内源性炎症与前纹状体回路中的低rsFC存在关系,包括VS-vmPFC,这是一个在抑郁症和其他精神疾病中被发现受到破坏的经典奖赏回路。例如,在医学上稳定、未用药的抑郁症患者(n=48)中,使用种子点到体素和目标种子到感兴趣区方法观察到血浆CRP与左侧VS-vmPFC rsFC之间的负相关,其中较低的VS-vmPFC(腹侧纹状体-腹内侧前额叶皮质)rsFC反过来与CRP和快感缺乏之间的关系相关并介导了这种关系。前纹状体rsFC也与炎症细胞因子及其可溶性受体呈负相关。这些在抑郁症中的关系得到了基于分区的网络分析的证实,其中主要(vmPFC)和次要(VS,作为前尾状核)枢纽,以及特征CRP(C反应蛋白)相关连接异常网络的多个其他边缘,在支持向量回归中高度预测了快感缺乏症状。Rengasamy等人在难治性抑郁症中复制了炎症标志物与左侧VS-vmPFC rsFC之间的负相关(对于IL-6),我们的研究组在创伤暴露的内城非裔美国女性中发现CRP与快感缺乏相关的负相关,而炎症细胞因子及其受体的复合物仅在具有显著PTSD症状的女性中与rsFC相关。与高炎症和低rsFC之间关联的风险因素相关,早期生活逆境改变了这些关系,其中童年虐待的严重程度在两项研究中都预测了更强的细胞因子-rsFC负相关。
与炎症刺激对运动活动的影响一致,内源性炎症也与涉及背侧纹状体的认知和运动区域的皮质纹状体回路内的连接异常相关。例如,我们发现CRP与背侧尾状核和背侧尾部壳核与vmPFC和/或前补充运动区的rsFC之间存在负相关,与抑郁症中的精神运动迟缓相关。这些关系以及在网络分析中识别的额外rsFC特征高度预测了精神运动迟缓。在抑郁的双相障碍患者中也观察到类似的关系,但在情感平稳期患者中未见,包括IL-8与体感运动网络内右侧中央前回rsFC之间的负相关,如Tang等人通过独立成分分析所证明的。
互补的任务fMRI、神经递质和结构研究
患者前纹状体奖赏和运动回路中内源性炎症与低rsFC之间的关系得到了Burrows等人研究的补充,该研究显示在CRP较高(>3 mg/L)的抑郁症中,背侧尾状核、丘脑、左侧岛叶和左侧楔前叶在预期小额奖赏时的激活降低。Costi等人还发现内毒素刺激的炎症因子与抑郁症中VS对奖赏预期的反应呈负相关,与快感缺乏相关。CRP或炎症细胞因子因子与纹状体和前额叶区域的奖赏预期/获得之间的关系在具有临床显著精神病症状的青少年中也得到了类似的观察。炎症与前纹状体回路内低活动或rsFC之间的这些关联可能涉及其对多巴胺和谷氨酸等神经递质的影响(图1C,D)。在医学上稳定、未用药的抑郁症患者中,血浆和CSF CRP与左侧基底神经节谷氨酸(使用单体素MRS)相关,这共同识别了一个更大的低局部一致性网络(包括奖赏相关子网络在内的邻近MRS体素中振荡活动的一致性),并与快感缺乏和精神运动迟缓相关。关于与多巴胺的联系,我们最近报告,其前体左旋多巴(可快速增加多巴胺可用性)的急性挑战仅在CRP较高(>2 mg/L)的抑郁症患者中改善了左侧VS-vmPFC rsFC,与奖赏预期期间更高的任务FC和左旋多巴诱导的快感缺乏减少相关。除了神经递质对功能回路/网络的影响外,炎症可能通过影响结构连接来影响rsFC,因为在抑郁和双相障碍患者中观察到CRP/细胞因子与低白质完整性(定量和分数各向异性)之间的关系,涉及许多重要的纤维束,包括连接皮质和皮质下结构的皮质纹状体和丘脑辐射。
涉及威胁检测、焦虑和情感处理的杏仁核-前额叶回路
炎症与低杏仁核-PFC rsFC
除了对动机和运动活动的影响外,炎症刺激还在杏仁核和前额叶区域反应性增高和rsFC降低的背景下诱导焦虑症状(见"炎症刺激对大脑区域和回路的影响:从临床到实验室";图1D),这与精神病患者中炎症与该回路中低rsFC之间关联的报告一致。因此,我们在医学上稳定、未用药的原发性抑郁症患者中发现内源性炎症标志物、血浆CRP和炎症细胞因子及其可溶性受体与右侧杏仁核-vmPFC rsFC降低之间存在关联。右侧杏仁核-vmPFC rsFC反过来与CRP和焦虑症状之间的关系呈负相关并介导了这种关系,这些发现在伴有焦虑障碍或PTSD的患者中最为显著。CRP或细胞因子与右侧杏仁核和mPFC/vmPFC之间rsFC的关系也可推广到有或没有PTSD的创伤暴露非裔美国女性(与焦虑相关)和未用药的双相障碍患者。
互补的任务态fMRI研究
内源性炎症标志物与杏仁核低rsFC之间的关系得到了最近一项报告的支持,该报告显示内毒素刺激的炎症因子与对恐惧>快乐面孔的杏仁核激活增强相关,而后者又与抑郁症中焦虑唤醒症状相关。重要的是,虽然并非所有研究都报告了炎症与杏仁核反应性之间的类似关联,但在炎症性疾病患者中使用英夫利西单抗进行TNF拮抗治疗减少了抑郁症状,与情感面孔处理时杏仁核反应性降低相关。Savitz等人还将炎症与杏仁核反应性之间关系的发现扩展到更广泛的区域网络,这些区域与杏仁核一起被炎症刺激激活(见"炎症对威胁检测、焦虑以及情感和内感受处理相关区域和回路的影响";图1D),他们显示外周血免疫细胞中的炎症基因与对悲伤>快乐面孔的杏仁核、vmPFC和海马激活呈正相关。情感任务fMRI还揭示了炎症细胞因子(IL-1β,IL-2)与有自杀或抑郁史的女性的PFC(前额叶皮层)、岛叶和/或ACC(扣带回皮质)激活之间的关系,而通常具有抗炎作用的T调节细胞与双相抑郁症患者背外侧PFC激活呈负相关。因此,内源性炎症相关的杏仁核、PFC和功能相关区域(如岛叶)反应性增加与炎症刺激对这些区域的影响一致,可能导致精神病患者中观察到的杏仁核-vmPFC rsFC降低。
内感受、默认模式和其他大尺度网络
类似于炎症对大脑的影响超出单个区域/回路的发现(见"炎症对威胁检测、焦虑以及情感和内感受处理相关区域和回路的影响"),网络分析揭示了精神病患者大尺度网络中内源性炎症/rsFC关联,这些网络与元分析构建的对炎症敏感的区域/回路重叠,例如DMN、腹侧注意网络和涉及岛叶的内感受通路。在CRP较高(>3 mg/L)的抑郁症患者(n = 33/83)与健康对照组(n = 46)相比,Aruldass等人报告了腹侧注意网络(岛叶/额叶岛盖皮层)和DMN的后扣带回皮层(PCC)内rsFC降低,这个预定义网络的许多特征与所有患者的CRP、IL-6和中性粒细胞呈负相关。虽然Kitzbichler等人在同一队列中报告抑郁症患者(尤其是CRP较高的患者)DMN内负加权rsFC特征的比例更大,同时CRP(C反应蛋白)与DMN内质子密度(组织-自由水/水肿)呈正相关,但对所有患者中所有70,500个可能的边对与CRP之间的成对相关分析也揭示了主要与海马的正相关。然而,CRP(C反应蛋白)与PCC(后扣带回皮层)亚区质子密度之间的正相关介导了CRP与PCC-mPFC rsFC之间的负相关,但不介导CRP与PCC-海马rsFC之间的正相关。因此,CRP较高患者关键区域的炎症相关结构变化可能导致网络内rsFC降低,随后影响与可能不受炎症直接影响的外部网络/区域的rsFC。在另一个抑郁症队列(n = 44)(109)中使用类似策略但分区更少(100 vs. 376)发现的仅有负相关的CRP-rsFC关联表明,可能需要细粒度的方法来揭示正相关。虽然在一个小型抑郁症队列(n = 27)中也观察到与CRP相关的更强的DMN-腹侧注意网络间rsFC,但在未用药的双相抑郁症患者和精神分裂症患者中报告了IL-6与岛叶和DMN的负的种子点到体素rsFC相关。因此,精神病患者的外周炎症主要与大尺度网络内连接性降低相关,有一些证据表明网络间或与其他脑区的连接性增加。
结论和转化意义
在此,我们讨论了新兴文献中描述炎症标志物与抑郁症和其他疾病中与跨诊断症状相关的离散回路和广泛网络中功能连接异常之间关联的关键发现(图2)。这些结果与大量数据一致,并在其背景下进行了描述,这些数据证明了临床或实验给予的细胞因子或炎症刺激对相同区域和回路中的神经递质、功能活动和连接性的因果影响与相关症状相关(见"炎症刺激对大脑区域和回路的影响:从临床到实验室";图1)。患者中与炎症相关的神经递质、任务激活、结构连接和水肿改变(见"高炎症患者的结构和功能连接异常";表1)进一步作为功能连接异常的潜在机制。
大多数研究报告了低结构连接性或FC与先天性/炎症性细胞因子(IL、TNF、IFN,单独或作为复合物评估)或CRP(被认为反映多种细胞因子的活性)之间的关系。虽然少数研究测量了多个细胞因子(但不包括CRP)并仅报告了一个标志物(IL-1β、IL-6、IL-8、TNF),但尚不清楚这是否代表患者慢性低度炎症背景下生物学显著的细胞因子-回路关联,还是反映了研究/标志物之间方法/检测的变异性。随着这一研究领域的扩展,可以在大型数据集中研究连接性与个别免疫标志物之间的关系,纵向和实验研究可以确认稳定性、神经生物学机制和因果关联/通路特异性。
例如,在区域/回路分析中,炎症与前纹状体奖赏/运动相关回路中低rsFC之间的关系已成为各实验室和样本中一致的发现(图2),同时还有炎症刺激对这些区域多模态神经影像学结果影响的平行发现(见"炎症刺激对大脑区域和回路的影响:从临床到实验室")。我们最近报告左旋多巴仅在CRP(C反应蛋白)较高的抑郁症患者中增加VS(腹侧纹状体)-vmPFC(腹内侧前额叶皮质)的静息态功能连接,与快感缺乏改善相关,这不仅将炎症相关的奖赏回路缺陷与多巴胺联系起来(见"前纹状体回路和跨诊断症状的动机减退和精神运动迟缓"),还表明rsFC是一个可修改的影像学生物标志物,用于评估逆转炎症对大脑影响的干预措施的效果。未来针对高炎症患者的研究将使用这种方法,重点关注其他可靶向的底物,如谷氨酸或免疫调节疗法。
总之,一个不断发展的领域描述了内源性先天免疫/炎症标志物与已知对炎症刺激敏感的区域、回路和网络中结构/功能连接异常之间的可靠关联,这与精神病患者的跨诊断症状相关。未来的工作将研究这些关联的特异性/因果性,以及它们作为大脑生物标志物开发针对高炎症患者的治疗方法的潜在用途。























 751
751

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








