在功能性磁共振成像 (fMRI) 中,动态功能连接 (dFC) 通常指在几秒钟的时间尺度上测量的功能连接的波动。这篇观点文章重点关注功能连接动态性测量和解释方面的挑战。采样误差、生理伪影、唤醒水平和任务状态都会导致观察到的功能连接的变化。我们认为,解释功能连接动态性的核心挑战在于区分这些变异来源。将功能连接动态性应用于追踪自发性认知或将其作为神经精神疾病的生物标志物,必须应对这些统计问题以及解释上的复杂性。在本文中,我们对近期文献进行了系统综述,其中滑动窗口分析仍然是主要方法 (79%)。我们指出了这种方法的局限性,并讨论了通过考虑测量的时间尺度和适当的实验控制来改进滑动窗口dFC分析和解释的策略。我们还强调了有助于该领域向前发展的研究方向。本文发表在Imaging Neuroscience杂志。
关键词: 动态功能连接、静息态 fMRI、BOLD fMRI 动态、自发活动、采样变异性、平稳性
1 引言
自 20 世纪 90 年代初以来,BOLD fMRI 一直被用于绘制大脑功能的表征 (Bandettini et al., 1992; Kwong et al., 1992)。值得注意的是,即使在没有施加认知操作的情况下,自发的 BOLD 信号也表现出相关的波动,反映了已知功能系统或网络的结构。这种现象被称为静息态功能连接 (FC),以首次观察到它的不受约束状态命名 (Biswal et al., 1995)。自发现以来,许多研究人员使用静息态 FC 来检查功能网络组织的“静态”特征,这些特征被假设在记录期间是不变的,无论是在健康受试者还是在患有各种神经精神疾病的人群中都是如此 (Bruin et al., 2023; Greicius, 2008; Javaheripour et al., 2021; Sheffield & Barch, 2016)。
重要的是,功能连接会随着许多时间尺度而变化:随着多年的发展 (Graham et al., 2015),随着与昼夜节律和睡眠相关的数小时 (Shannon et al., 2013; Tagliazucchi & Laufs, 2014),以及随着参与者参与各种认知任务的数分钟 (Cole et al., 2014; Krienen et al., 2014)。在无任务状态下,FC 也被观察到在短时间尺度(即不到一分钟)内发生变化 (Allen et al., 2014; Chang & Glover, 2010; Hutchison et al., 2013b)。在这些研究之后,我们使用“dFC”来指代旨在估计 fMRI 功能连接在短时间尺度内变化的策略,特别关注“滑动窗口”dFC(见专栏 1)。之前的综述涵盖了许多研究 fMRI 时间序列动态性的替代策略 (Hutchison et al., 2013a; Keilholz et al., 2017; Liegeois et al., 2017, 2021; Lurie et al., 2020; Pervaiz et al., 2022; Preti et al., 2017)。我们的目标不是概括这些内容。相反,我们的目标是强调和阐明在当前文献中最常用的 fMRI dFC 分析中出现的统计和解释问题。这些问题在之前的报告中已经提出,但没有像现在这样强调 (Hindriks et al., 2016; Laumann et al., 2017; Liegeois et al., 2017; Lurie et al., 2020; Preti et al., 2017)。
| 专栏 1:平稳性与非平稳性 FC 如果表征某个过程的统计量的期望值随时间保持不变,则称该过程是平稳的 (Liegeois et al., 2017; Lurie et al., 2020)。重要的是,平稳性并不意味着测量值随时间不变。例如,无摩擦钟摆的位置随时间变化。然而,如果没有施加外力,钟摆的周期(即完成一次完整摆动所需的时间)是平稳的。在大脑测量中观察到非平稳性具有特殊意义,因为它意味着潜在生理过程的变化。例如,在静息清醒、困倦和快速眼动睡眠之间脑电图枕叶 α 节律的变化表明不同的神经成分是这些不同大脑状态的基础 (Cantero et al., 2002)。值得注意的是,非平稳脑电图特征反映了数百毫秒时间尺度上电活动的变化,这与基于 fMRI 的 FC 的时间尺度非常不同(见第 2.1 节;专栏2)。 “功能连接性”(FC) 指的是测量 fMRI 信号对之间相关程度的指标。传统的 FC 隐含地假设平稳性,即 BOLD 信号相关性在测量期间(通常为 5-10 分钟)是平稳的。评估静态 FC 的方法包括线性相关 (Biswal et al., 1995; Fox et al., 2005) 和静态独立成分分析 (Beckmann et al., 2005)。 滑动窗口相关及其变体构成评估短时间尺度 fMRI 动态最常用的方法(图 2)。经典滑动窗口相关的计算方法是在短时间段(窗口)(通常为 30-120 秒)内评估 FC,然后进行 K 均值聚类 (Allen et al., 2014)。此过程将 fMRI 数据描述为一系列不同的 FC 矩阵,然后将这些矩阵聚类成状态。滑动窗口相关中的基本假设是,这些窗口上的 FC 变化反映了大脑状态的变化(而不是 FC 采样误差)。因此,滑动窗口相关明确旨在识别非平稳性。回到钟摆的例子,这类似于外力改变摆动的速度或方向。功能连接性变化的分析相当于评估二阶统计量 (FC) 的方差,因此是四阶统计量(见专栏 2)。其他基于滑动窗口的方法通过计算 FC 导出度量的方差来评估动态性。这些其他导出度量可能包括 fMRI 时间导数的乘积 (Mai et al., 2022)、格兰杰因果关系估计 (Qin et al., 2022) 和图论度量,例如节点度、聚类系数等 (Li et al., 2022)(以及更多)。我们将所有这些旨在识别功能连接性中非平稳性的基于窗口的方法称为“dFC”,它们是我们文章的重点。 第二类研究 BOLD fMRI 动态性的方法旨在识别瞬态 FC 事件,即 BOLD 信号中的瞬时共激活模式。例子包括点过程分析 (Tagliazucchi et al., 2012)、事件的血液动力学反卷积 (Petridou et al., 2013)、共激活模式 (CAPs; Liu & Duyn, 2013) 和瞬时共激活模式 (iCAPs; Karahanoglu & Van De Ville, 2015)。这些方法识别状态空间外围 fMRI 信号的极端偏移。这些事件在 fMRI 信号中是一阶的(专栏2)。相关方法侧重于成对 fMRI 信号关系的极端偏移事件,它们是二阶的 (Sporns et al., 2021; Zamani Esfahlani et al., 2020)。值得注意的是,状态空间中极端偏移的存在在形式上与平稳性与非平稳性无关。以此类推,摆动的钟摆在每个周期中都会达到两次极端偏移。钟摆的动力学(包括其极值)完全由平稳正弦波描述。重要的是,fMRI 时间序列的极端偏移是否代表非平稳特征可以通过参考 fMRI 信号的平稳零模型来判断,该模型例如指定其协方差结构(见 Ladwig et al., 2022; Laumann et al., 2017; Liegeois et al., 2017)。 已经提出了许多不依赖滑动窗口的方法来捕捉 fMRI 数据的动态特征。例如,虽然 FC 通常在零滞后进行评估,但也可以在非零滞后测量 FC (Mitra et al., 2014)。FC 滞后结构提供了有关大脑区域之间 BOLD 信号传播的信息 (Bolt et al., 2022)。也可以使用自回归模型来研究信号传播 (Liegeois et al., 2019)。在钟摆的类比中,这些模型类似于一个摆摆动到另一个具有相同周期的摆(同样,在没有外力的情况下是平稳的)。其他评估 fMRI 动态性的方法包括领先特征向量动态分析 (Cabral et al., 2017; Farinha et al., 2022) 和隐马尔可夫模型 (Shappell et al., 2019; Vidaurre et al., 2017),它们将大脑活动建模为一系列状态。其他生成模型已被用于描述 fMRI 数据的动态特征,包括广义拉普拉斯混合模型 (GLMM; Pervaiz et al., 2022) 和多动态对抗生成器编码器 (MAGE) 建模 (Ricchi et al., 2022)。至关重要的是,所有后一种方法都没有明确假设非平稳性(详见 Liegeois et al. (2017) 的扩展讨论)。然而,可以通过与合适的平稳零模型进行比较来使用这些方法来证明非平稳性(例如,在 Ricchi et al., 2022 中)。在我们的观点中,我们不详细讨论这些替代方法。 |
对 dFC 的大部分兴趣源于追踪波动认知的潜力 (Gonzalez-Castillo et al., 2015; Kucyi, 2018; Shine & Poldrack, 2018),以及将其作为神经精神疾病生物标志物的来源 (Filippi et al., 2019)。这些研究目标背后的一个自然直觉是,可以使用 fMRI FC 测量相关的神经动态,就像使用脑电图和基于任务的 fMRI 所做的那样。然而,fMRI FC 中几秒钟量级的变化可能源于几种不同的机制(图 1),包括采样误差、头部运动或动脉 pCO2 波动产生的伪影,以及与困倦和显式任务表现相关的神经驱动变化。我们的观点是,这些潜在的变异来源导致了 fMRI dFC 测量和解释方面的挑战。在这种情况下,我们阐明了适用于 FC 动态性研究的关键概念:专栏 1 讨论了与分析方法相关的平稳性与非平稳性。专栏 2 定义了与大脑机制测量相关的统计阶数和时间尺度。

图1 非神经和神经因素都会导致功能连接性的变异
该图描绘了 fMRI FC 变异性的来源,大致按照它们对功能连接性变异的贡献大小排序。非神经变异来源包括采样变异性和生理偏差/伪影。这些因素的相对顺序可能取决于导出给定 FC 度量的样本的持续时间。特别是,采样变异性与持续时间成反比。(Created in BioRender. Laumann, T. (2023) ).
| 专栏2:影响 dFC 解读的 BOLD 信号的关键特性 统计量阶数:阶数是指一个度量在计算统计量中出现的幂次(即指数)。阶数的概念与分布的矩有关(例如,均值 = 一阶;方差 = 二阶;偏度 = 三阶;峰度 = 四阶)。 时间尺度:时间尺度是指现象发生的时间跨度。在生理数据表征中,时间尺度反映在频谱内容中,即快速或慢速频率的相对贡献。理想情况下,感兴趣的现象与现象的测量之间的时间尺度应该对应(进一步讨论见第 4.1 节)。 |
随着 dFC 领域的快速扩展,上述问题继续影响着大多数出版物。一项 PubMed 查询(2024 年 4 月 18 日)使用检索词“动态功能连接性”识别出 1000 多篇论文,其中 34 篇是综述。为了评估该领域的最新状态,我们对 2022 年和 2023 年上半年发表的“动态功能连接性”文章进行了有限的调查(204 篇文章;参见补充方法;补充表 1)。尽管我们的近期文献调查反映了许多方法,我们发现绝大多数研究 (78.7%) 报告了“滑动窗口相关”方法的变体(专栏 1)。因此,这是我们讨论的重点。其他方法,包括隐马尔可夫模型 (2.4%) 和共激活模式 (2.4%),在文献中所占的比例要小得多(图 2)。这项工作中讨论的一些原则也可能扩展到研究 fMRI 动态性的其他方法;然而,尽管这些方法评估了 fMRI 动态性,但它们不一定评估非平稳性(见专栏 1)。
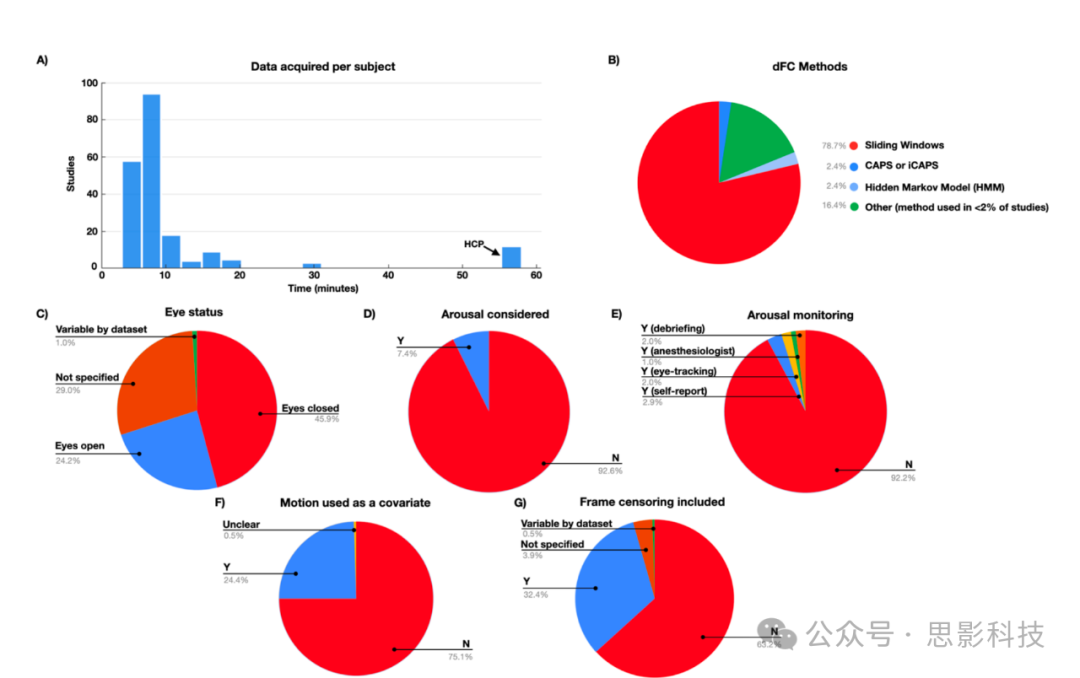
图 2: 对 2022 年和 2023 年初发表的动态 FC 研究的调查结果总结(补充表 1)。
(A) 每位受试者获取的数据在动态 FC 研究中的分布。如果一项研究中包含多个条件/数据集,则在该直方图中将它们作为单独的估计值包含在内。每个参与者数据超过 30 分钟的唯一研究是使用人类连接组项目数据的研究。
(B) 使用不同方法进行动态 FC 分析的研究百分比(滑动窗口、HMM 等)。在不到 2% 的研究中使用的方法归入“其他”类别。
(C) 睁眼与闭眼静息状态研究的百分比。闭眼静息状态与更高的睡眠可能性相关 (Tagliazucchi & Laufs, 2014)。
(D) 将唤醒视为 dFC 潜在原因的研究百分比。
(E) 在扫描期间监测唤醒的研究百分比(以及如何监测唤醒)。
(F) 在统计分析中将运动作为协变量的研究百分比。
(G) 在分析中包含小运动帧审查的研究百分比。
这项工作的第 2 节和第 3 节讨论了这些概念及其对 FC 变异性来源的影响,首先是与采样误差和生理伪影相关的,然后是与神经变异来源相关的。第 4 节回顾了 dFC 在认知和生物标志物方面的应用。第 5 节讨论了改进未来 fMRI 动态性研究的方法。
2. FC 中的非神经变异来源
2.1 采样变异性很大程度上解释了表观 dFC
采样变异性是 FC 测量中一个特别重要但经常被忽视的问题(图 1)。采样变异性(或“采样误差”)与独立测量的次数成反比。所有测量都存在采样误差。然而,由于 BOLD fMRI 信号的时间尺度较慢,采样误差在依赖于短期观察周期的 dFC 中尤其成问题。BOLD 信号反映神经活动的时间尺度(专栏 2)比电生理学中通常遇到的频率慢得多 (Leopold & Maier, 2012),这主要取决于神经血管耦合的动力学 (Hillman, 2014)。特别是,神经驱动的 BOLD 信号主要限于超慢频率(<0.2 Hz;尽管要注意这些频率可能因脑区而异*)(Anderson, 2008; Hathout et al., 1999)(但也参见 Lewis et al., 2016)。因此,滑动窗口 dFC 必须应对在 30-120 秒的样本中准确测量波动频率小于 0.2 Hz 的信号之间的相关性。
采样变异性还取决于度量的统计阶数(见图 4)。阶数是指一个度量在计算统计量中出现的幂次(即指数)(专栏 2)。均值是一阶统计量,而方差是二阶统计量。因此,统计量的阶数反映了度量分布中越来越复杂的方面。在 fMRI 的背景下,任务诱发反应是一阶的,因为每个体素的反应以一次幂进入度量,通常是跨试验平均的。FC 统计量在 fMRI 信号中是二阶的,因为相关性是作为从成对脑区提取的两个信号的归一化乘积来计算的。由于滑动窗口 dFC 估计 FC 的方差,因此它是四阶统计量。这些阶数和时间尺度的差异导致 FC(和滑动窗口 dFC)度量在其统计特性上与任务诱发的 fMRI 度量根本不同。
首先考虑静态 FC 的情况。FC 采样变异性对数据量的依赖性已通过对个体采集的非常大的数据集进行了实证证明 (Anderson et al., 2011; Gordon et al., 2017; Laumann et al., 2015)。这些研究表明,可靠地估计静态 FC 需要大量数据(约 30-100 分钟或更多),具体取决于 FC 估计值的空间精度和 BOLD 信号被伪影破坏的程度 (Gordon et al., 2017; Laumann et al., 2015; Noble et al., 2019)。鉴于在静息态研究中通常获得的每个个体的数据量较小(例如,5-10 分钟),静态 FC 中的采样误差可能是导致难以使用 FC 作为生物标志物的主要原因。为了说明这个问题,我们对真实的 BOLD fMRI 数据进行了模拟(图 3)。从该模拟得出的 FC 置信区间与相关性的大小和可用数据量成反比。当相关性较弱且数据量较小时,相关性估计的不确定性最大(比较图 3 左图中的深蓝色阴影区域和黑色阴影区域)。因此,在非常短的时间窗口(例如,<2 分钟)内测量 FC(或 FC 的变化)的能力是有限的,尤其是在相关性较弱的情况下(见图 3 左图插图)。应该注意的是,该模拟反映了二元相关性;替代策略,例如降维或数据聚合可能会减少采样变异性。然而,采样误差与数据量成反比的基本原则保持不变。在实践中,我们发现即使使用包含降维的多元策略,识别可靠的 dFC 统计量仍然难以捉摸 (Laumann et al., 2017)。
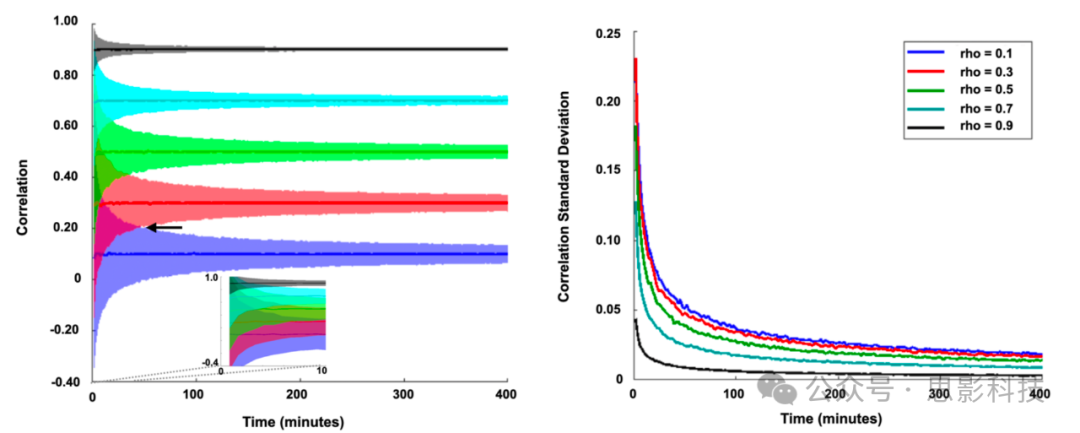
图 3:采样误差对静态 FC 测量的影响
在 1000 次实现中,模拟了在一定固定相关值 (rho) 范围内的二元 BOLD 时间序列。左图显示了以数据量为参数测量的相关性置信区间 (+/- 1.96 SD)。请注意,随着数据量的增加,相关性的期望值与 rho 匹配的精度越来越高。置信区间随着数据量的增加而变窄。插图放大了少于 10 分钟数据量的置信区间。少量数据(<2 分钟,这是滑动窗口的典型值)不允许区分 rho = 0.1 和 rho = 0.7,因为置信区间重叠;实际上,箭头指示 rho = 0.1 和 rho = 0.3 的置信区间不再重叠的位置,这大约发生在 50 分钟处。右图显示了以数据量为参数的 1000 次实现中相关性的标准差。请注意,当相关性强 (rho = 0.9) 时标准差最小,当数据量低(例如,<2 分钟)时标准差最大。注意:模拟的功率谱与 Laumann 等人 (2015) 报告的真实 BOLD fMRI 数据匹配;因此,给定样本持续时间下的相关性估计标准差反映了该特定处理流程产生的自由度。神经活动的内在时间尺度在大脑中略有不同 (Raut et al., 2020);因此,相关性估计标准差也可能略微取决于 ROI 的选择。
遵循此逻辑,滑动窗口 dFC 中采样误差造成的不确定性会加剧。由于 FC 是二阶统计量(专栏 2),因此旨在测量 FC 中时间方差的 dFC 代表四阶统计量(数学统计中的一个基本结果是 n 阶统计量的方差是 2n 阶统计量;Weatherburn,1962)。统计量的阶数越大,采样误差就越大(图 4)。值得注意的是,这些考虑最直接地适用于 FC 方差的估计(如在滑动窗口中)。明确包含时间滞后(而不是非平稳性)的 FC 度量,例如 Liegeois 等人 (2021) 和 Mitra 等人 (2023) 使用的度量,在 fMRI 信号中是二阶的(静态 FC 也是如此)。其他 fMRI 动态性度量,例如隐马尔可夫模型 (HMM),具有此处未讨论的其他采样误差特征。
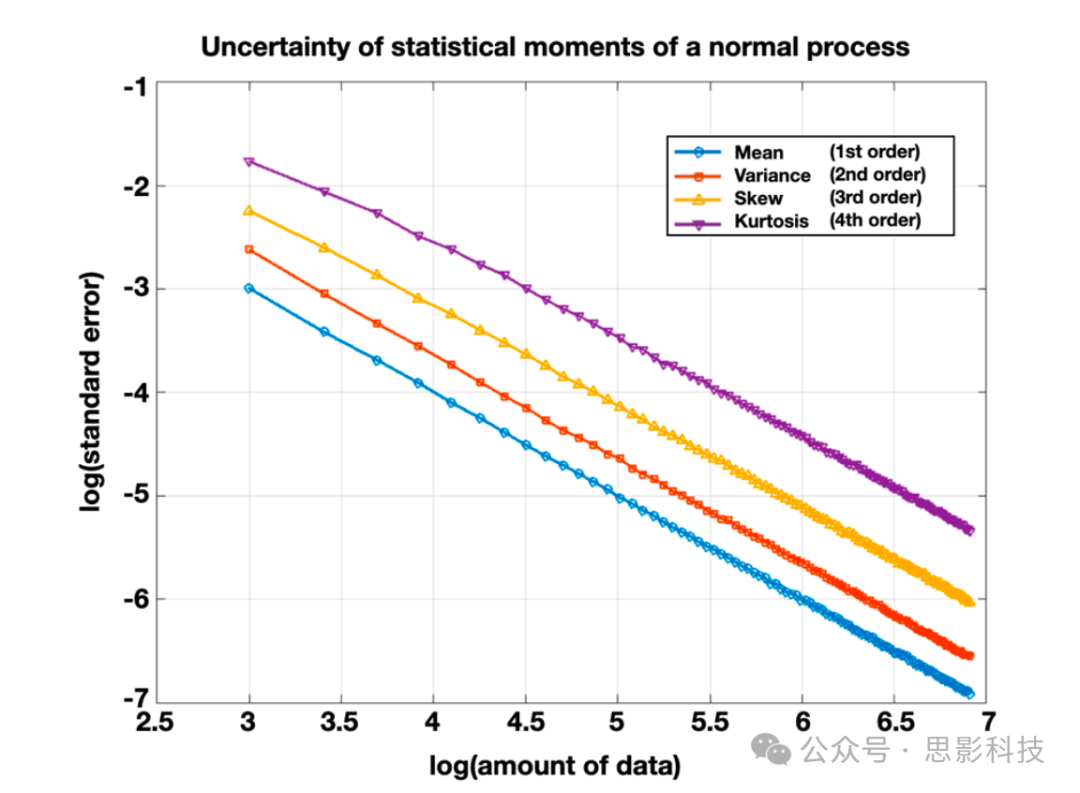
图 4:从随机正态分布变量导出的统计量(1、2、3、4 阶矩)的不确定性作为数据量的函数。统计量是从均值为 1、标准差为 1 的随机正态偏差的递增样本量生成的。在每个样本量下计算了一万次实现。y 轴表示每次实现中每个估计值的标准误差的对数。估计值的不确定性随阶数增加(均值 = 1 阶;方差 = 2 阶;偏度 = 3 阶;峰度 = 4 阶)。因此,需要越来越大的样本量才能获得更高阶统计量的等效可靠性。
根据图 4 的预期,滑动窗口 dFC 的可靠性在经验上低于静态 FC。评估滑动窗口 dFC 可靠性的研究通常报告较低的组内相关系数 (ICC) 值,即 ICC < 0.5,具体取决于测量细节 (Choe et al., 2017; Smith et al., 2018; Zhang et al., 2018, 2022)。实际上,可靠的滑动窗口 dFC 测量可能需要至少 10 分钟的样本持续时间 (Hindriks et al., 2016)。此外,如上所述,对于静态 FC,根据 BOLD 信号的大小、空间精度和 fMRI 脉冲序列的对比度噪声比,可能需要更多数据 (Triantafyllou et al., 2005)。分割方案会影响可靠性,这取决于分割与底层功能组织的匹配程度(例如,组平均模板在不同个体中错误定位功能数据;(Gordon et al., 2017))和分割的大小,这会影响数据平均的区域。对于具有强相关性的 ROI 对,可靠性最高(图 3)。因此,滑动窗口 dFC 的可靠性往往对于表现出最高静态 FC 可靠性的 ROI 对最高。重要的是,作为一般规则,增加窗口持续时间(即数据量)将提高 FC 估计的可靠性(如图 3 所示)。
我们认为,前面的考虑突出了测量 FC 动态性的实际挑战,并表明需要扩展数据采集以获得足够的统计功效。在本期 FC 动态性文章的调查中,每个参与者收集的数据中位数为 8 分钟(见图 2)。唯一接近一小时完整数据的论文使用了一个共同的数据集(人类连接组计划 (HCP; Smith et al., 2013))。因此,大多数现有的静息态研究没有采集到足够的数据来可靠地估计个体内的静态(零滞后)FC,更不用说更复杂的时间结构了。
数据量较小时,FC 估计的采样变异性会很高,从而增加 FC 估计中明显的非平稳性。为了确定明显的动态 FC 是否代表 FC 中的真正非平稳性而不是采样误差,将结果与空模型进行对比是有用的 (Liegeois et al., 2021)。为了进行强推断,空模型应准确匹配测量数据的相关静态 FC 属性:也就是说,模型和实际数据应具有相同的静态相关结构、频谱内容和 AR 属性(有关更广泛的讨论和具体策略,请参见 Liegeois et al. (2017))。
与我们前面关于采样变异性的讨论一致,静息态 fMRI 动态性的测量通常相对于空模型表现出有限的差异 (Casorso et al., 2019; Laumann et al., 2017; Liegeois et al., 2021)。最近至少有一篇论文表明,与静态 FC 相比,动态 FC 估计的额外收益很小 (Matkovic et al., 2023)。单时间点“事件”分析也是如此,其中已表明,在一对区域之间观察到事件的可能性随着它们之间静态 FC 的大小而增加 (Ladwig et al., 2022; Novelli & Razi, 2022)。Nadarajah 和 Pogány (2016) 给出了这种依赖关系的显式代数表达式。因此,事件或 CAP (共激活模式)的存在可能与静态连接组一致。包含与信号传播或滞后相关的特征的平稳空模型(例如,AR 模型;Casorso et al., 2019; Liegeois et al., 2017, 2019)与纯零滞后 FC 模型相比,提供了对真实 BOLD fMRI 数据的更完整描述。然而,滞后结构的存在并不意味着 FC 的非平稳性(专栏 1)。未来的工作应扩展适当空模型的使用,以确定 dFC 测量是否提供了非平稳性的统计学显著证据。通过扩展 fMRI 数据收集,可以更可靠地检测到与平稳性的微小偏差,从而提高此类工作的价值。
2.2 生理偏差和伪影引起的变异性
除了采样变异性之外,FC 测量还对 fMRI 伪影和来自(即使是亚毫米级)头部运动和动脉 pCO2 变化的生理偏差敏感 (Laumann et al., 2017; Power et al., 2012, 2020a, 2020b; Satterthwaite et al., 2012; Van Dijk et al., 2012)。此类伪影分布广泛,并在整个大脑中系统地偏向 FC 测量 (Laumann et al., 2017; Power et al., 2012, 2020a, 2020b; Satterthwaite et al., 2012; Van Dijk et al., 2012)。重要的是,这些影响会随着头部运动或呼吸变化而在短时间尺度上发生变化 (Power et al., 2020a, 2020b)。因此,非神经信号和 fMRI 伪影会导致 FC 中出现明显的动态变化 (Laumann et al., 2017)。
在寻找 dFC 生物标志物时,伪影问题因头部运动和呼吸在不同人群中系统性差异而加剧。与典型对照组相比,许多精神病样本的头部运动更大 (Castellanos & Aoki, 2016; Picci et al., 2016),儿童的头部运动大于成人 (Power et al., 2012)。头部运动和呼吸在不同任务中也会系统地变化 (Birn et al., 2009; Engelhardt et al., 2017)。此外,头部运动与许多行为测量 (Siegel et al., 2017) 和身体特征 (Bolton et al., 2020) 相关。
解决这些伪影和偏差来源需要伪影减少策略,即“去噪”(例如,减少全局呼吸信号和瞬态运动伪影的策略)(Power et al., 2015; Satterthwaite et al., 2019)。此类策略的有效性已在静态 FC 测量中得到广泛证明 (Ciric et al., 2017; Parkes et al., 2018; Power et al., 2014)。大多数 dFC 研究也实施了某种形式的去噪(例如,干扰回归和/或异常值排除)。然而,许多研究只是在有限的程度上这样做。在我们对近期文献的调查中,只有少数出版物包含某种形式的运动审查 (32%),当与全局信号衰减(例如,通过全局信号回归或 CompCor)结合使用时,它代表了减少静态 FC 中运动偏差的最佳策略 (Ciric et al., 2017)。已经提出了在分析后期阶段解决运动的其他策略,例如使用运动相关测量作为协变量 (Satterthwaite et al., 2019)。然而,这些策略仍然相对较少被采用 (24%)。
去噪在滑动窗口 dFC 中已被证明尤其具有挑战性,其中瞬态效应具有超大的影响 (Nalci et al., 2019)。因此,我们认为未来一个重要的研究方向是开发和系统评估解决 dFC 中头部运动和生理伪影去噪的特定挑战的策略。值得注意的是,Joliot 等人 (2024) 最近报告说,全局信号回归是消除困倦和警觉状态之间 FC 差异的最有效方法,这可能有助于观察 dFC 的神经和非神经(例如,相关的呼吸变化,见第 3.2 节)原因。他们还提出了 FC 分布的高斯标准化作为一种不太激进的方法来最小化唤醒效应。
3. 神经快速变化的三个来源
考虑到第二部分提出的问题,回顾功能连接(FC)中已充分证实的非平稳性特征是很有用的。在接下来的部分中,我们将探讨实验任务和唤醒度改变期间神经驱动的FC变化。
3.1 任务状态与FC的适度变化相关
当参与者执行各种认知领域的任务时,FC会发生改变,从感觉运动学习范式(Bassett et al., 2011)到工作记忆(Cohen et al., 2014; Finc et al., 2020; Shine et al., 2016)、持续注意(Al-Aidroos et al., 2012; Rosenberg et al., 2016)和观看电影(Betti et al., 2013)。任务诱导的变化可以相对广泛,发生在皮层和皮层下不同网络内部和之间(Betti et al., 2013; Gratton et al., 2016; Krienen et al., 2014)。一些FC变化可能代表“任务通用”效应(Cole et al., 2014; Gratton et al., 2016; Krienen et al., 2014),而另一些则特定于特定的认知需求(Al-Aidroos et al., 2012; Cole et al., 2014; Gratton et al., 2016; Krienen et al., 2014; Porter et al., 2023; Rosenberg et al., 2016; Shirer et al., 2012)。重要的是,对基于任务的FC变化进行无偏估计需要去除任务诱发的信号,以避免FC估计与诱发信号混淆(Cole et al., 2019)。这些与任务相关的效应足够一致,因此可以根据FC模式(使用先前训练的分类器)解码任务状态(Gonzalez-Castillo et al., 2015; Porter et al., 2023; Rosenberg et al., 2016; Shirer et al., 2012)。
已经提出了许多生理机制来解释不同任务环境中FC的变化。FC的变化可能是因为任务相关脑区的神经信号变得更加一致(Nir et al., 2007)。这一观点与“通过一致性进行交流”(CTC)的理论有关,该理论源于对猕猴局部场电位的相关观察(Fries, 2005)。其他证据表明,任务会抑制参与区域的自发活动,这种现象被称为“刺激抑制”(Churchland et al., 2010; Cohen & Maunsell, 2009; He, 2013; Ito et al., 2020)。选择性抑制自发活动可能会影响区域之间的BOLD FC。任务状态(和唤醒)引起的FC变化也可能由神经调节剂活动的改变介导(Turchi et al., 2018),其分布式投射会影响大脑皮层的广泛区域。Laumann & Snyder(2021)对这些观点进行了更详细的阐述。
对任务相关FC变化的观察使得人们对使用dFC方法解码无任务状态下的认知内容持乐观态度。然而,我们认为谨慎是必要的:与无任务状态下的认知内容相关的FC变化不太可能大于任务诱导的FC调制,而后者在数量上是适度的(Cole et al., 2014; Gratton et al., 2016, 2018)。例如,在Gratton等人(2018)的研究中,我们检查了午夜扫描俱乐部数据集中FC的相似性,该数据集包括来自9名个体在10天内的数据,他们在每天完成5项不同的任务。任务执行与FC的显著变化相关,但这些变化远小于个体间的稳定差异。常见的任务调制和日常变异分别解释了跨阶段和受试者FC总变异的约5%。个体参与者在不同任务状态下表现出特异的调制,这些调制大于共同效应,但这些效应仅解释了总变异的约10%。这些因素中的每一个都远小于人与人之间稳定的差异,后者占总变异的50%或更多。类似地,Cole等人(2014)发现,稳定的FC架构核心解释了人类连接组计划数据中跨任务和静息状态的FC组平均估计值中超过80%的变异。这些发现表明,BOLD信号相关结构中可归因于任务状态的变化是存在的,但相对微妙。我们的观点是,这些小的效应量加上FC估计在短时间尺度上的不可靠性(图3)表明,可能需要大量数据才能可靠地检测与认知相关的dFC效应。
3.2 唤醒改变功能连接
对dFC的解释还必须考虑唤醒度变化的影响。不同程度的唤醒程度反映为不同程度的FC变化。FC的较大变化与昏迷或其他意识障碍(Boly et al., 2009; Martinez et al., 2020; Pizoli et al., 2011)和药物诱导的镇静(Boveroux et al., 2010; Mhuircheartaigh et al., 2010; Palanca et al., 2015)相关。睡眠阶段的转变与FC的适度变化相关(Larson-Prior et al., 2009; Samann et al., 2011)。特别是,慢波睡眠(SWS)导致初级皮层区域的FC增加,高于高级区域(Boly et al., 2012; Tagliazucchi & Laufs, 2014)。这种局灶性在BOLD波动幅度的测量中尤为明显(Fukunaga et al., 2006; Tsai et al., 2014)。唤醒依赖的FC变化非常明显,以至于可以根据fMRI判断睡眠阶段(Tagliazucchi & Laufs, 2014)。使用这种分类器,已经证明,如果闭上眼睛,三分之一名义上清醒的受试者会在静息状态扫描开始后3分钟内进入第一阶段睡眠。
在清醒期间(例如,与咖啡因摄入、嗜睡相关)(Poldrack et al., 2015; Rack-Gomer et al., 2009),睁眼与闭眼(Bianciardi et al., 2009; Laumann et al., 2015)以及昼夜节律(Shannon et al., 2013)相关的唤醒波动与显著但更适度的FC变化相关。值得注意的是,相对较高的受试者内部静息状态FC变异性被发现定位于初级运动和视觉区域(Hindriks et al., 2016; Laumann et al., 2015),这与这些唤醒模式一致。鉴于这些发现,我们认为唤醒应被视为FC中神经驱动的非平稳性的常见来源。
与上述相对缓慢的FC变化(以分钟到小时的数量级变化)相比,大规模一阶BOLD信号模式也被用于跟踪短暂的唤醒事件(Chang et al., 2016)。使用同步脑电图-fMRI,已经表明,全局BOLD信号瞬变与与神经调节活动相关的离散电生理特征相关(Liu et al., 2018)。因此,BOLD fMRI中大的和快速的一阶变化可能与唤醒有关。然而,重要的是,唤醒水平会调节呼吸、心率和头部运动。全局BOLD信号也受到这些相同生理指标的显著影响(Birn et al., 2006; Power et al., 2017; Wise et al., 2004)。因此,唤醒、心肺生理、运动和BOLD信号从根本上是纠缠在一起的(Power et al., 2018; Raut et al., 2021),这使得对观察到的dFC效应的解释变得复杂。例如,唤醒相关的神经活动是否直接驱动全局FC动态,或者BOLD fMRI动态是否受到呼吸变化的间接影响?对此类问题的调查对于该领域的未来至关重要(参见Joliot等人(2024)最近的一项探索)。
尽管有大量证据表明唤醒水平会影响FC,但在FC动态研究中,唤醒仍然严重被忽视。在我们对近期文献的调查中(图2),只有8%的研究在静息状态扫描期间监测了唤醒。此外,46%的研究在闭眼状态下收集静息状态数据,这已知会加速进入睡眠(Tagliazucchi & Laufs, 2014),而29%的研究没有指定眼部状态。只有8%的研究将唤醒视为dFC差异的潜在原因。鉴于唤醒是FC非平稳性的一个可能原因(例如,使用峰度测量;Laumann et al., 2017),我们建议在未来的工作中系统地监测和考虑唤醒对dFC的解释。
鉴于第二节和第三节中讨论的证据,我们现在考虑动态功能连接(dFC)的应用。我们考虑文献中提到的两个主要应用:(1)使用 dFC 跟踪自发认知;(2)使用 dFC 作为神经和精神疾病的生物标志物。
4.1 动态功能连接与不受限认知的关系
认知神经科学领域的大量文献将电生理学和基于任务的功能性磁共振成像(fMRI)与不同的认知过程联系起来(Beppi 等人,2021 年;Huettel,2012 年)。因此,将此研究方向扩展到静息状态下观察到的 BOLD 信号的相关性,即静息态功能连接,是很自然的。自发功能连接动态跟踪意识内容的概念已被多次阐述(Fazelpour & Thompson,2015 年;Northoff 等人,2020 年;Rabinovich 等人,2015 年)。
鉴于这些考虑,我们简要讨论了将自发 BOLD 信号与持续认知联系起来的两条主要证据线。第一条证据线是将静息态 fMRI 信号与认知联系起来,它依赖于 fMRI 信号与电生理学或任务表现的自发波动之间的关联(Falahpour 等人,2018 年;Goodale 等人,2021 年;Keilholz,2014 年;Kucyi 等人,2017 年;Sadaghiani 等人,2010 年)。例如,最近一项关于“大脑解码”的研究表明,静息态 fMRI 信号可以适度地预测认知内容(自我相关性和效价)(Kim 等人,2024 年)。这些研究提供的证据表明,在 fMRI 信号和不受限认知之间找到关联是可能的。
然而,重要的是,在上述引用的实验中,感兴趣的 fMRI 测量指标是大脑活动图,即 BOLD 信号的一阶测量指标,而不是功能连接的测量指标(见专栏 2)。此类实验与传统的基于任务的 fMRI 的唯一区别在于,认知状态的变化是由受试者自发产生的,而不是实验施加的。因此,这些实验证明了持续认知内容与静息态 BOLD 信号的一阶测量指标之间的相关性。然而,它们并没有证明 dFC(即二阶统计量的波动)与认知之间的联系。
第二条研究路线明确地研究了功能连接的变化与“心智游移”之间的关联(例如,Gonzalez-Castillo 等人,2021 年;Kucyi,2018 年)。在许多实验中,扫描后访谈† 用于评估静息态扫描期间的思维内容。在这些实验中,发现了静态功能连接测量指标与报告的思维内容之间的适度对应关系(Gorgolewski 等人,2014 年;Wang 等人,2018 年)(Wang 等人的最高典型相关系数 r = 0.28)。已经获得了另一套此类数据集(Cremona 等人,2023 年;Tsuchida 等人,2021 年),但将认知内容与这些数据中功能连接的变化联系起来的结果尚未发表。这些研究可能提供了自发认知与静息态功能连接之间的联系。然而,这些实验是横断面的,因为它们检验了不同人群的功能连接与访谈回答之间的关系。因此,尚不清楚这种关系是由个体内部功能连接的状态差异(例如,一个人在之前的扫描中想到的悲伤记忆)还是个体之间功能连接的特征差异(例如,与该人内在网络结构相关的负面思维倾向;Lynch 等人,2024 年)驱动的。鉴于已知功能连接的特征效应很大(Finn 等人,2015 年;Gratton 等人,2018 年;Miranda-Dominguez 等人,2014 年;Seitzman 等人,2019 年),这使得对观察到的效应的解释变得复杂。
因此,虽然用 dFC 跟踪自发认知可能在直觉上很吸引人,就像用一阶 BOLD 信号所做的那样,但我们认为需要额外的证据来建立这些测量指标之间的强关联。在评估这些发现时,重要的是要记住,虽然所有认知都源于神经活动,但并非所有神经活动都必然与认知相关。此外,功能连接(一种二阶统计量)仅代表神经活动的一种特定测量指标,其生理相关性仍然是一个持续争论的问题(Pezzulo 等人,2021 年)。我们之前曾论证,自发神经活动(静息态功能连接依赖于此)与可塑性相关的机制比持续的意识内容更密切相关(Laumann & Snyder,2021 年)。因此,在我们看来,功能连接(或 dFC)不必主要与持续的自发认知相关。
我们认为,将 dFC 与自发持续认知联系起来的一个关键挑战是时间尺度。认知过程以 10 毫秒到 100 毫秒的时间尺度演变(Hammer 等人,2024 年;Snyder 等人,1995 年)。因此,一阶 BOLD 响应(可以在几秒的时间尺度上测量)或具有更快时间分辨率的方法(例如,脑电图、皮层脑电图)非常适合跟踪认知内容,尽管通常需要事件平均才能证明其稳健效应。然而,fMRI dFC 可能更适合测量以分钟或更长时间尺度演变的大脑过程,例如唤醒、情绪或广泛认知模式的变化。使用 dFC 跟踪自发认知过程必须解决方法上的局限性(例如,与认知对功能连接的影响相关的微小信号变化,认知时间尺度与可靠估计功能连接所需时间之间的不匹配)和解释上的歧义(例如,确定效应是由状态还是特征驱动的,以及它们是否与唤醒或其他现象相关,而不是特定的认知内容)。正如我们将在第五节中讨论的那样,广泛的重复测量设计可能是解决这些问题的一种策略。
4.2 关于使用 dFC 作为生物标志物
dFC 的主要应用是作为神经或精神疾病的生物标志物(综述见 Filippi 等人,2019 年);在我们的文献调查中,81% 的研究测量了临床人群的功能连接动态,通常与对照组进行比较。例如,有人假设在抑郁症的情况下过度沉思可能表现为异常的功能连接动态(Kaiser 等人,2016 年)。因此,测量的功能连接变化率或不同功能连接状态的停留时间可能存在差异。据报道,将功能连接动态信息添加到静态测量中可能有助于预测行为变量 (Ikeda 等人, 2022 年;Pervaiz 等人,2022 年;Vidaurre 等人,2021 年)。
然而,将 dFC 视为潜在的生物标志物必须应对第 2.1 节中提出的统计风险和第 2.2 节中讨论的伪影问题。正如最近指出的那样,静态功能连接与许多认知和神经精神特征的关联很小(Marek 等人,2022 年),并且受到功能连接测量本身可靠性的限制(Choe 等人,2017 年;Gell 等人,2023 年;Honari 等人,2019 年),尽管可以通过多变量策略提高可靠性(Spisak 等人,2023 年)。因此,dFC 测量在特征方面比静态功能连接更具可复制性和信息量的程度尚不确定。
关于功能连接动态与精神或行为变量的关联,还有一个重要的解释性考虑。如上所述,自发 fMRI 信号的波动与生理变量(例如,嗜睡和呼吸模式)本质上纠缠在一起,而这些变量本身可能与感兴趣的 fMRI 变量密切相关(Power 等人,2018 年)。睡眠动态改变在许多神经精神综合症中很常见。例如,已知帕金森病患者在睡眠潜伏期测试中会出现白天过度嗜睡和快速眼动睡眠(da Silva-Junior 等人,2014 年)。同样,睡眠障碍通常是抑郁症的核心特征。此外,呼吸模式可能会受到各种行为状态的影响,例如焦虑。因此,观察到的 dFC 测量值与精神或行为变量之间的相关性可能代表唤醒或动脉 pCO2 波动对 BOLD 信号的次级效应(Birn 等人,2006 年;Wise 等人,2004 年),而不一定是神经病理学的主要表现。如果非特异性生理变量驱动 dFC,那么基于 dFC 的生物标志物在预测治疗靶点或提供对潜在神经病理学的理解方面的能力将有限。未来的研究应考虑这些对 dFC 关联的潜在替代解释,以改进生物标志物的开发。
第五节 结论和未来方向
我们已经讨论了在测量和解释 BOLD dFC 时出现的问题。功能连接会在几分钟的时间尺度上发生明显变化,伴随唤醒和任务状态的波动,尽管程度不大。即使在静态功能连接的测量中,抽样误差也是一个重大问题,这在滑动窗口 dFC(四阶统计量)中进一步加剧。此外,fMRI 数据中不同程度地混杂着伪影,如果没有得到充分抑制,这些伪影会导致功能连接动态的错误表象。
我们认为,dFC 的应用必须应对这些测量问题。鉴于与 dFC 测量相关的可靠性较低,识别 dFC 生物标志物可能需要比静态功能连接大得多的效应量。使用 dFC 跟踪自发认知还必须应对解释性问题,即 dFC 效应是否反映了参与者的特征、特定的认知内容、广泛的认知模式或唤醒的改变。
为了使这些观点具体化,可以考虑一项实验观察,即抑郁和非抑郁个体之间的 dFC 存在显著差异。乍一看,结果似乎可以直观地解释,与先前关于沉思在抑郁症中作用的心理学理论相联系。然而,目前的考虑提出了其他解释的可能性。例如,人们可能会问:(1)结果是否与静态功能连接的差异相关,以及/或者在分析中是否使用了合适的零模型?对观察到的效应的一种简洁解释可能是,静态功能网络组织的差异区分了两组。(2)是否收集了足够的数据并进行了去噪以排除抽样变异性和伪影?如果不是,那么有理由质疑非神经效应是否驱动了两组之间的差异,例如呼吸频率或扫描仪中的运动差异。(3)观察到的两组之间的差异是否可以用非认知因素(例如,扫描仪中的睡意)来解释?鉴于唤醒会改变功能连接,其程度通常大于任务状态,因此此类因素的重要性可能至少与心理动机的结构一样重要。因此,对观察结果的强有力解释至少需要额外的分析来排除这些替代解释。
鉴于上述考虑,我们建议未来对 BOLD fMRI 动态的研究将受益于采用类似的质疑思路。解决这些问题的特别有希望的途径包括:包含扩展数据收集的实验设计以克服抽样变异性(Laumann 等人,2015 年),有效的去噪方法以减少非神经伪影(Parkes 等人,2018 年;Power 等人,2014 年;Satterthwaite 等人,2019 年),以及用于检验统计显着性的适当零模型(Ladwig 等人,2022 年;Laumann 等人,2017 年;Liegeois 等人,2017 年)。此外,大多数先前的 dFC 研究都是横断面设计的。对个体进行重复测量的设计可能对解决与 dFC 相关的解释复杂性特别有用。例如,如果在一个人处于不同情绪状态时进行多次测量,那么检测抑郁症的 dFC 生物标志物可能会更成功。同样,识别自发认知的功能连接标记将受益于对个体进行重复采样,以确定差异是由状态而不是特征驱动的。除了设计方面的考虑,我们还提倡继续探索唤醒对 BOLD 动态的影响,既可以潜在地将这种现象作为功能连接动态的一个混杂因素来解决,也可以将其作为本身值得研究的重要神经驱动过程来研究(Chang 等人,2016 年;Coppola 等人,2022 年;Joliot 等人,2024 年;Tarun 等人,2021 年)。
我们也认识到继续开展开发不依赖于滑动窗口分析的跟踪 BOLD 动态的新方法的重要性。其中一些方法(专栏 1),例如,滞后结构的自回归建模(Liegeois 等人,2019 年)和隐马尔可夫模型 (HMM)(Vidaurre 等人,2017 年)避免了滑动窗口 dFC 固有的膨胀抽样误差问题(见图 3 和图 4)。将这些方法与多变量分析策略相结合可能在提高功能连接动态与行为测量之间关联的可靠性方面更有用,就像其他基于功能连接的方法一样(Spisak 等人,2023 年,但也参见 Tervo-Clemmens 等人,2023 年)。在我们看来,无论采用何种方法,在解释观察到的效应时纳入零模型和考虑唤醒都可能很重要。
























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








