点击上方“小白学视觉”,选择加"星标"或“置顶”
重磅干货,第一时间送达一种用于微创成像和传感的磁粒子成像方法与植入式生物电子电路
Zhiwei Tay , Han-Joon Kim , John S. Ho , and Malini Olivo
摘要
微创且生物相容的植入式生物电子电路用于长期监测体内的生理过程。然而,目前缺乏一种能够低成本、便捷地在体内成像设备的同时提取传感器信息的方法。磁粒子成像(MPI)具有零背景信号、高对比度和高灵敏度,能够提供定量图像,非常适合这一挑战,因为磁信号不会随着组织深度的增加而被吸收,并且不会产生辐射剂量。本文展示了如何通过封装和磁耦合超顺磁性氧化铁纳米粒子(SPIOs)到设备电路上,轻松地将常见的植入式设备修改为可由MPI成像。这些修改后的植入式设备不仅通过MPI提供空间信息,而且还能够通过我们的手持MPI读取器传输传感器信息,通过调制谐波信号,通过电阻或电容传感器进行开关或频率转换。本文提供了一种优化的MPI成像技术的证明概念,用于提取植入式设备的空间信息以及通过植入电路传输的其他信息(如生物传感)通过编码在磁粒子光谱中。4D图像展示了3D位置和对变化生物指标的响应而改变的颜色色调。利用MPI的独特成像特性的生物电子电路的生物物理传感可能在生物医学和诊断中实现广泛的微创应用。
关键词
磁粒子成像
植入式设备
无线
生物电子电路
重建
引言
磁粒子成像(MPI)是一种新兴的成像方式,能够直接检测和成像磁性纳米粒子。这些纳米粒子可以在活体内使用,并通过MPI安全地成像以获取生物分布数据。由于它只检测纳米粒子,因此它具有追踪器样的对比度和纳摩尔级的灵敏度,与纳米粒子质量呈线性定量关系,不会因为组织厚度而出现信号衰减,并且由于其典型的超顺磁性氧化铁(SPIO)成像剂,不会产生电离辐射剂量。MPI的一些重要应用包括干细胞追踪、癌症成像、急性肠道出血检测、肺部成像以及中风和脑部成像。其他示例包括心血管成像、实时手术器械引导和图像引导的高温疗法。
电路组件的微型化进展和生物相容性涂层使得近年来植入式传感器电路成为可能。这些电路已用于从检测用于吻合手术的内部缝线的伤口裂开到深层组织间隙中的葡萄糖监测等多种应用。这些微装置与基于对比剂的生物传感器相比,具有更高的灵敏度、更广泛的可能传感目标,以及在人体内部长期持久的优势。另一方面,对比剂方法在它们可以感知的度量上往往有限制,并且如果生物可降解,体内寿命会短得多。在超小型深层组织植入物的一个关键挑战是提供外部电源,因为机载电池供电被证明非常笨重。已经开发了近场和远场方法,取得了不同程度的成功。
将收集到的传感器数据以最小的功率传输到外部接收器是另一个挑战。鉴于上述挑战,非侵入性成像方式将是一个引人注目的候选者,因为它们已经设计用于探测和提取深层组织空间的信息。因此,我们寻求将深层组织植入物适应成像剂,并将传感器信息编码到成像信号中。通过这一策略,可以利用成像机制为植入物供电,并在不需要任何机载电池的情况下启用信息的向外传输。此外,成像方法提供了(1)比现有近场供电策略更深的操作范围,(2)为分布的相同植入传感器阵列提供空间信息,其中基于频率的条形码可能不理想,最后(3)空间跟踪移动的植入电路,如无线无束缚的胃肠道、肺部或血管系统中的微型机器人。
使用成像方法对微型植入物的使用并不是全新的。麻省理工学院Jasanoff实验室最近的工作已经展示了使用植入式生物电子电路与现有成像方法结合的潜力。他们的研究集中在磁共振成像(MRI)方法上,在那里他们展示了对电或光信号响应的局部MRI信号的调制。在另一项研究中,展示了配备传感器的可控微型机器人,其中传感器失谐调制了其在MRI图像中的高信号。此外,还提出了被动和主动导管电路,用于基于MRI的干预性成像。Susil等人展示了一种双线电生理(EP)导管,该导管同时记录心内电图并接收MR信号以进行主动导管跟踪。Bilgin等人开发了一种MRI调谐的自共振射频微电路,用于干预性MRI期间的现场温度传感。该传感器在MR图像中有一个高信号,随着局部温度的升高而衰减。除了MRI,还在先前关于植入式X射线基血压微型传感器用于冠状动脉支架监测和X射线可视化传感器检测腹膜透析导管内感染的研究中调查了X射线兼容传感器。

上述现有的方式各有其限制。光学方法只适用于浅层植入,而MRI方法严重依赖于设备与组织背景的对比度,并且可能由于设备在MRI图像中的易感性伪影而受到影响。超声方法面临着将现有传感器与声学指数变化耦合的挑战,以及无法放置在声学阴影区域的问题。相比之下,MPI没有这样的限制,因为磁场可以深入且均匀地穿透空气、骨骼和组织;在肺部和胃肠道中表现良好。它还具有追踪器样的对比度,并且无论组织背景如何,都能产生相同的信号。然而,到目前为止,还没有研究调查MPI在微创成像和与植入式生物电子电路通信方面的潜力。

在这项工作中,我们展示了MPI有潜力提供空间信息,并通过磁粒子光谱内编码的传感器信息传输,我们可以将其显示为图像颜色色调(例如,高温为红色,低温为蓝色),如图1所示。此外,我们详细阐述了如何修改MPI成像方法,使植入电路能够将信息编码到成像信号中。特别是,与MRI或基于辐射的模态不同,我们展示了一种手持MPI成像探头,由于它不使用昂贵的MRI低温制冷剂或像计算机断层扫描(CT)或X射线那样的辐射屏蔽,因此有可能更便宜或更小尺寸。这种零辐射剂量的手持成像探头特别适合于植入传感器的频繁监测。

这项研究将与MPI系统设计师以及植入式传感器设计师相关,以开发改进的传感器策略,以推进生物电子传感能力以及新的成像模态MPI的应用范围。
理论
MPI的一般工作原理在先前的研究中已有详细描述。为了简要介绍MPI的工作原理,MPI利用低频驱动场与背景中的强电磁梯度线圈相结合,在强磁场梯度的中间产生一个敏感的低场区域。零点在视场中进行光栅扫描或沿着Lissajous轨迹移动,当它通过它们时,从SPIO纳米粒子产生非线性磁化响应,作为MPI信号的谐波驱动载波频率。这些MPI信号的高次谐波被记录并通过系统矩阵或x空间方法重建为3D MPI图像,定量显示视场中SPIO纳米粒子的空间分布。

A. MPI信号与生物电子电路信号读出的耦合
来自SPIO纳米粒子的MPI信号可以通过电路传感器通过几种途径进行调制,例如(1)激励幅度的变化和(2)激励频率的变化。我们将在这项工作中重点关注第一条途径。如图2所示,有两种策略来实现所需的(1)激励幅度的变化。生物电子电路可以通过感应屏蔽机制调制来自MPI扫描仪的传入激励(驱动)磁场,屏蔽的强度可以由与感应屏蔽串联的可变电阻进行调制,该屏蔽包裹在SPIO纳米粒子胶囊周围。第二种策略,一种共振方法,也是可行的,因为MPI使用SPIO纳米粒子的单音激励,因此该机制将依赖于将共振电路移出共振来减少流动的电流量,从而减少屏蔽。这种共振方法通常会增加而不是减少来自MPI扫描仪的传入磁激励,在机制上与共振感应耦合不同。如果次级线圈(植入的生物电子共振电路)处于共振状态,则会增加产生的磁通量,并且通过将电路移出共振,会强烈调制,从而显著减少传输的功率和因此SPIO纳米粒子感觉到的局部磁场。
B. 非旋转外部MPI读取器(FFL)的3D成像理论,用于提取位置和传感器读出信息
在植入式传感器领域,数据传输通常涉及使用小型外部读取器设备,该设备在近场或中场与植入物通信。因此,尽管我们的概念验证意味着我们的传感器可以由任何MPI扫描仪设计使用(常规的内孔式如MRI,新型的开放式或单面设计等),但我们试图修改MPI成像设置,使其更类似于广泛用于植入设备的小型外部读取器环境(图3)。虽然手持读取器设置将比现有的更大、更复杂的MPI扫描仪设计具有更低的灵敏度和分辨率,但我们利用在植入设备中高浓度SPIO的优势,这些在体内未被稀释,有效地为我们提供了理想的成像点源,以补偿读取器设备的较低性能。必须指出,在极高浓度下,一些纳米粒子,如Resovist™,已被证明由于超过阈值浓度的粒子间偶极-偶极相互作用,信号与追踪器质量的线性关系会偏离。
对于我们提出的NPIC设备,重要的是确保所有植入设备的示踪剂浓度相同。我们通过对每个设备的纳米粒子信号进行基线校准,并关闭屏蔽,以确保所有设备信号的等式。

本研究中使用的MPI成像设置与现有的单面MPI设备不同,旨在为4D成像(3D位置+基于谐波的“颜色”维度)定制固定点源。通常,该设置基于从外部读取器设备投影到躺在XY平面的活体受试者中的Z定向FFL选择场几何形状(图3a)。此时,可以通过简单地沿XY(机械)移动FFL在FOV上实现二维投影扫描。为了获得Z坐标信息,而不必像标准投影MPI那样通过大量角度旋转MPI扫描仪或成像主体,我们的策略是利用先验知识,如植入SPIO的已知质量,以及驱动场随着Z深度的减弱而减弱的事实。这在图3e中突出显示,其中较高谐波(第7谐波)的信号强度与MPI扫描仪的距离相比,比较低谐波(第3谐波)的信号强度下降得更快,因为SPIO随着距离的增加而经历驱动场强度的下降。这导致高次谐波与低次谐波的比率随着Z深度的可预测变化。因此,我们利用这一点来重建Z坐标,以获得MPI图像中我们的“点源”的3D位置。
然而,必须考虑更复杂的重建,以将Z坐标编码与传感器编码解耦,因为植入电路通过在SPIO点源周围通过小屏蔽线圈或共振线圈调制传入驱动场来编码传感器信息。首先,考虑到实际应用,我们假设在有限数量的设备中存在一个投影XY平面角度,使得每个Z线上只有一个设备。然后问题退回到同时求解单个设备的Z位置和传感器读出值r。请注意,r通过校准函数S(r)影响SPIO的屏蔽或共振因子。
总体上,图像重建工作流程按照以下阶段进行:
XY重建,第一次MPI通过:沿Z轴的FFL的2D投影图像。由于2D图像重建按照投影x空间MPI重建进行,MPI信号的相关成像方程类似于Goodwill等人[38]如下所示:
其中是FFL在X、Y坐标的即时位置,[T/A]是沿FFL的MPI接收线圈的灵敏度值。由于FFL和MPI接收线圈在图3a所示的机械上一起移动,因此只有由于在z距离上的线圈的衰减,z方向上的灵敏度变化。[Am^-2]是纳米粒子的磁矩,表示不考虑FFL速度的Langevin函数的一阶导数,与典型的x空间理论不同,因为驱动激励沿着与z轴对齐的FFL轴。FFL仅在x-y方向上横向移动,因此卷积算子右侧的项只是基于纳米粒子特性参数、梯度场[T/m]和固定驱动场振幅及驱动场频率归一化到SPIO的饱和场的校准2D点扩散函数。
调整XY成像平面的角度,确保每个像素中最多有一个NPIC,并重复步骤1。由于,植入的NPIC的总数是已知的,算法在粗分辨率下检查像素上超过阈值强度值的计数是否等于:
计算像素中唯一NPIC的z坐标:获取“感知”到的H场。使用每个NPIC的[X,Y]坐标,重建现在切换到仅对具有NPIC的像素进行1D计算z坐标。我们假设SPIOs不相互作用,由于SPIO在FFL内,背景场为零,并且由于1 kHz的低驱动频率,响应是绝热的。那么,无论纳米粒子密度如何,对于校准的粒子类型,第5次和第3次高次谐波的比率然后仅仅是纳米粒子“感知”到的最终有效驱动场的函数(将包含NPIC屏蔽和z深度处驱动场衰减的因素)。
如图5面板2所示,函数对于非零值的是一个表现良好的单调递增函数,因此对于FOV内的NPICs是可逆的(因为屏蔽从未达到100%,并且在7厘米深度内的下降是有限的)。因此,通过测量MPI信号的,可以通过取函数的逆来计算。
计算像素中唯一NPIC的z坐标:从接收线圈灵敏度随z距离的衰减中获取z坐标。NPICs将SPIOs密封在体内环境中,并且SPIOs仅与MPI扫描仪和传感器电路磁耦合。因此,NPICs具有固定且已知的纳米粒子密度。由于NPIC现在沿着FFL(z)的轴线定位,并且驱动场轴沿着FFL,这是一个“零维”MPS测量,背景梯度场强度值。因此,方程1简化为:
MPS信号强度是沿z对齐的FFL的接收灵敏度图的函数,因为纳米粒子常数,纳米粒子数量[mol],“感知”到的驱动场项在大括号内是已知的。这表明,通过校准,可以通过解来找到NPIC的z坐标。接收灵敏度的衰减和驱动场振幅随SPIO与单面发射器和接收器的距离增加而增加的净效应在图3e中绘制,并显示最大操作深度为7厘米。超出此值,当前设备的驱动振幅和接收灵敏度太低,无法记录所需的信号高次谐波。
评估NPIC传感器对SPIO的影响,即屏蔽因子,并从MPI信号中获取NPIC传感器读出值。此时,已经使用方程1和2获得了NPIC的[X,Y]坐标,并且使用方程5获得了z坐标。最后一个未知数是传感器读出值,它是影响SPIOs的屏蔽因子的参数。FFL固定为沿着驱动线圈轴并随驱动线圈移动以扫描FOV。因此,对于沿着z方向的驱动线圈轴定位的信号产生纳米粒子,最终在z方向的有效驱动场,
其中是0到1之间的屏蔽因子,括号内的项是驱动场振幅随z深度的衰减。请注意,对于具有多个环路的实际驱动线圈,大括号内的距离衰减项将是各个环路的求和项,可以通过数值方法解决。对于基于共振的设置,值可能大于1。
为了完成最后一个未知数的重建,可以通过用已知的和从步骤3和步骤4获得的NPIC坐标来解决。函数根据传感器的不同而变化,但它是一个表现良好的单调函数,通常由图8c和8f中的曲线形状表示,因此可以通过取的逆函数来获得传感器读出值。
III. 方法
A. 磁粒子成像设备
本研究中的MPI测量是从Berkeley Arbitrary Waveform Relaxometer的改进设计中收集的,该设计已被修改为成像其外部的物体(与通常将样品插入孔中的用法相比)。这种relaxometer设计已在先前的工作[31]、[32]、[33]中得到验证。这与机械2D运动和永磁阵列结合使用,以建立选择场,通过在透明舞台平台(薄丙烯酸板)上移动relaxometer机构的2D平移来实现成像,该平台包括20厘米长×10厘米宽×10厘米深的成像视场。
B. MPI扫描工作流程
图像重建步骤在理论部分中有详细的数学描述。对于实际的扫描过程实施,首先选择一个适当倾斜于垂直Z轴的“X-Y”平面。这是通过一个薄的、透明的、坚硬的丙烯酸板来实现的,其长度和宽度尺寸与2D视场的尺寸相匹配,放置并固定(角度和位置)在成像主体上。如果第一次MPI扫描显示FFL投影轴上重叠的NPICs,则可能需要一次或两次调整角度。使用2轴垂直精密数字水平仪(Digi-Pas DWL-1900XY)测量丙烯酸板相对于重力垂直的角度。由于MPI设备的平坦接收端与丙烯酸板齐平,并在其表面上平滑移动,这确保了MPI设备(和FFL)轴始终与板垂直,并确保了与重力垂直的恒定FFL轴角度。然后通过机械光栅/滑动整个MPI FFL设备(包括选择场和驱动/接收线圈)穿过丙烯酸板来执行单角度投影x空间MPI扫描[38]。
获取成像数据后,重建算法按照理论部分的描述进行。由于我们的重建方法不依赖于与典型MPI FFL投影重建方法不同的重建投影,我们只需将倾斜(校正)角度定义为新的参考X-Y平面,并使用与零倾斜时相同的方法重建3D体积。一旦获得了倾斜参考平面的植入设备的3D坐标,就执行坐标转换步骤,将它们移动到以z为重力垂直轴的坐标参考中。在患者主体的情况下,患者的身体轴也适当地与重力垂直轴对齐,以便转换后的3D MPI图像可以准确地叠加在患者身体轮廓或MRI/CT解剖扫描上。
C. 磁性纳米粒子(MNPs)
在设备中使用了直径为130纳米的Perimag™纯SPIO纳米粒子。这些是具有70%(w/w)氧化铁的多核簇状粒子,以交联右旋糖酐为基质。纳米粒子以25 mg/mL的库存浓度嵌入在植入式电路中,体积约为10 µL。有关Perimag™的性能和表征的详细信息在先前的MPI工作中有所描述[11]。
D. 植入式电路
电路由一个基本的LC谐振器组成,该谐振器串联连接了一个传感器或开关电路。我们在医用级硅酮导管管上绕制了一个AWG 33铜线的电感器。电感器的两端连接在一个毫米级柔性印刷电路板上,上面有电容器和传感器(图3c)。整个植入式电路围绕着一个中空的、含液体的医用级硅酮导管管,该导管管完全用生物相容的聚二甲基硅氧烷(PDMS)密封。可以在该区域注入并密封大量的SPIO纳米粒子(或非SPIO MNPs)。与大多数其他植入式传感器/电子设备[39]、[40]、[41]一样,该设备设计不是生物可降解的。由于PDMS密封胶的长期体内稳定性,MNP液体完全与外部隔离,可以维持稳定的浓度。此外,根据我们之前使用类似结构[42]、[43]的工作,预计该设备和MNPs在体内稳定数月。对于传感器,我们使用了芯片NTC热敏电阻(NTCG 1608,TDK公司,日本)和薄膜电阻压力传感器(SEN0295,DFRobot)。
IV. 结果
A. 手持MPI读取器能够通过组织层深度获取谐波信息
我们在图3所示设置中的设备灵敏度测量显示,灵敏度足以达到7厘米深度。由于我们的重建至少需要检测到两个谐波,当第5次谐波由于我们手持设备的驱动振幅和接收灵敏度都随距离下降而接近噪声底时,我们无法使用数据。然而,我们当前MPI接收器的灵敏度图叠加在人类侧面轮廓上表明,如果植入在躯干前部或后部7厘米以内,植入在人体内的植入式传感器设备,如肠道中的设备,仍然可以被手持读取器检测到(图3d)。这里,我们假设了一个普通男性(70公斤)的侧面轮廓,躯干厚度为20厘米,作为我们最初的概念验证。需要进一步提高接收器的深度灵敏度,以适应更大的人体对象。尽管我们的便携设备在绝对术语中比现有的大型MPI系统灵敏度低,但我们利用了能够在NPIC内部高度集中(25 mg/ml)的纳米粒子剂量的能力。这些就像理想的点源,因此即使随着深度的灵敏度下降,仍然可以被检测到。
B. MPI通过板载SPIO纳米粒子对植入电路进行3D空间编码,同时提取传感器信息
传统的近场方法无法在无线通信中对植入电路进行成像,因为读取器的宽灵敏度区域和缺乏空间编码。图4中的结果表明,MPI能够成像植入式电路内的SPIO胶囊并提供空间编码。由于每个植入设备的尺寸都是几毫米,因此使用我们在演示中使用的大约1厘米的设备间距是合理的。从工作流程的角度来看,我们还展示了如何利用初始2D投影扫描的信息和已知的FOV内放置的设备数量。必须注意,由于相同的尺寸和内部相同的SPIO质量,每个设备实际上是彼此相等的点源。因此,可以稳健地检测到同一Z线上的多个设备(2D投影图像中的点源计数少于已知的植入计数)。这使用户可以选择另一个成像角度,以确保每个Z线上只有一个设备,这是我们重建所必需的,如理论部分2D中所解释的。将已知SPIO质量在设备内的已知SPIO质量的预校准测量数据集的传输和接收灵敏度图以及谐波比率输入到我们新的重建算法中,如图5所示。从成像获取数据中,我们能够成功地获得3D位置以及作为第四个“颜色”维度的传感器信息。

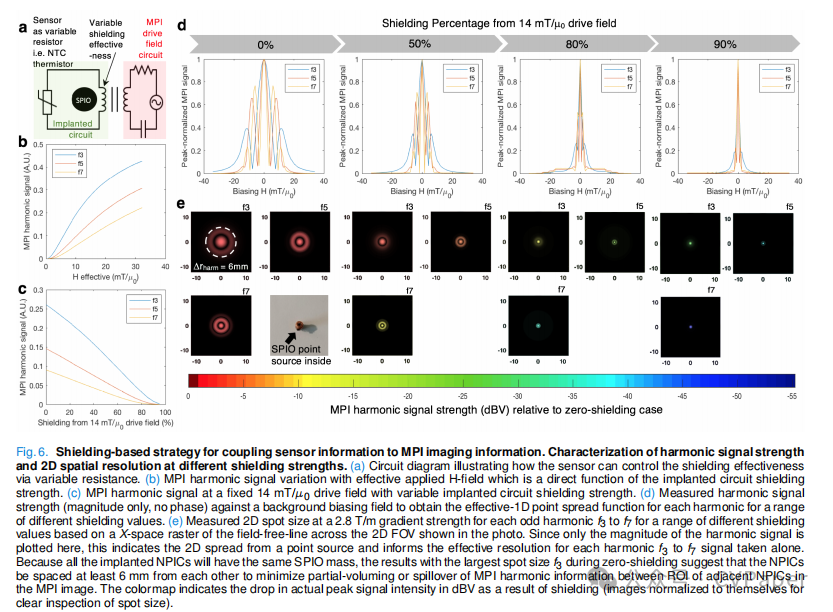
C. 电磁屏蔽方法是将生物传感读出与MPI信号耦合的有效方式
图6展示了基于屏蔽策略能够有效地调制MPI信号,并且可以在图像重建中稳健地提取出来,以反映传感器电路提供的屏蔽水平。在MPI信号的相对谐波比率以及总MPI信号中都有大量的变化。由于SPIO被封装在电路内并且不会随时间衰减,总MPI信号的变化也可以与生物传感读出相关联。

从成像的角度来看,图6d、e中的点扩散函数和斑点大小显示,第3次谐波信号可以显著扩散到周围空间,半径高达6毫米。尽管对于Perimag™纳米粒子,具有2.8 T/m梯度,人们期望基于全宽半高的空间分辨率更接近3-4毫米,这只是因为标准重建将所有高次谐波叠加以给出尖锐峰值。如果像我们基于谐波的“颜色”和Z坐标重建所需的那样,独立地在空间中测量每个谐波,那么必须最小化2D像素上的谐波数据的部分体积效应。因此,我们在2.8 T/m梯度下测量了空间中的f3、f5和f7处的模谐波信号,以记录谐波信号下降到峰值的<20%的距离,这在零屏蔽情况下大约是14 mT/µ0使用浓缩的Perimag™粒子的6毫米。这在我们的背景下可以说是足够的,因为在FOV中的每个植入设备中的SPIO质量是相等的,因此不必担心大信号源会掩盖较小的信号源。可以通过将设备的动态范围设置在50到90%屏蔽之间来实现改进,这会产生更窄的斑点尺寸,如图6e所示。
D. 将生物传感信息耦合到MPI读出的共振电路方法是可行的,但成像性能较差
图7展示了基于共振的策略能够有效地调制MPI信号,并且可以在图像重建中稳健地提取出来,以反映传感器电路的失谐和调谐状态。然而,由于对入射驱动场的大共振放大,SPIOs会经历一个非常大的有效场,这可能会覆盖基于梯度的空间定位和编码。如图e所示,第三个谐波的2D斑点大小几乎达到了10毫米半径,这将导致设备间距在1厘米或更小的情况下的部分体积问题。然而,调谐和失谐状态之间的大强度变化将有助于轻松检测表现为偏离正常调谐状态的异常生物状态,并且仍然适用于二进制传感器读出(异常vs正常)。
E. 各种指标的传感概念验证,即温度和力量
NPIC设备设计与各种传感器兼容,我们展示了使用温度、压力和应变传感器的高灵敏度。从图8中,我们展示了屏蔽策略可以有效地将NTC热敏电阻的输出耦合到我们的MPI谐波信号中,从MPI信号中提取温度数据。在f5:f3谐波比率中,统计学上显著的变化和紧密的误差条反映了从MPI谐波信号中稳健读取温度。同样,使用电路中的力量传感器将力量数据编码到MPI信号中,增加了一个开路切换开关来模拟拉伸断裂的情况,这将表现为开路。
结果表明,在生理温度范围内,温度读数的准确性为±0.2°C,压力/应力传感器的力量读数误差为1-3%。
V. 讨论
A. 与植入生物电子电路的无线通信的传统非成像方法
现有的生物电子植入传感器的工作直接通过板载电源或近场功率传输与传感器通信。通常传感器间隔较远,以便外部读出设备可以通过接近度指定传感器。密集的传感器阵列都与单个外部读出设备通信,将依赖于频率编码或条形码来识别信号源到各个传感器,但这缺乏传感器确切位置的空间信息,如果传感器在体内移动,将会失败。例如,Kalidasan等人[18]使用植入电路来检测缝线断裂,并依赖于修改缝线以从中央植入设备扩展检测范围。断裂事件被检测为整个区域的单个二进制读出,无法确定缝线断裂位置。一般来说,传统的与植入传感器的无线通信方法限于非成像背景。
通过添加MPI成像剂并将生物电子传感器数据编码到MPI谐波信号中,我们可以利用MPI物理学为数据传输提供额外的空间定位层,这在上述标准方法中是不可能的。
在这个成像背景下,可以利用许多真正的好处。首先,我们可以使用预校准的、集中的SPIO纳米粒子量,这些粒子由于MPI具有零背景信号从身体中,并且所有信号必须来自设备纳米粒子,因此更容易成像和重建,利用强大的先验(固定总信号)。此外,与大多数体内MPI成像背景不同,整个纳米粒子剂量可以高度集中,安全地包含在设备内,不会经历高水平的体内稀释。由于现实的生物传感应用只会有有限数量的植入传感器,并且体内没有原生SPIO信号,有效的,成像问题退回到在3D空间中定位已知数量的理想、相等点源。因此,MPI数据集是有利的稀疏,使得容易和快速的成像重建,最小化图像伪影。
B. 与先前工作和其他成像方式(MRI、光学和超声)的比较
现有的非放射性成像方式,如MRI,先前已被用来成像植入传感器[22]。然而,现有的成像方式各有其限制(图1)。光学方法只适用于浅层植入。MRI方法严重依赖于设备与组织背景的对比度,如果低信号的SPIO设备移动到本地低信号的身体区域,可能会导致对比度差。此外,可以预期设备在MRI图像中引起的易感性伪影。此外,大多数MRI扫描仪都昂贵且笨重,与通常使用的便携式读取器[18]或我们工作中展示的手持MPI不同。从理论上讲,由于其紧凑、便携和易于使用的特性,超声应该是一个强有力的候选方式。然而,将现有传感器与声学指数变化耦合存在挑战。此外,传感器不能放置在被空气界面或骨骼遮挡的区域。
与此相反,MPI没有这样的限制,因为磁场几乎可以均匀地穿透空气、骨骼和组织。MPI还具有积极的对比度,零背景信号,因此无论身体区域如何,都提供明确的定量,这对于植入设备非常理想。
据我们所知,这是第一项研究使用MPI在植入微电路上的研究。我们使用的屏蔽策略使MPI信号能够编码传感器数据,在概念上类似于Kor等人[44]中提出的MPI饱和线圈,那里有从选定的局部区域调制MPI信号。虽然Kor等人的方法通过磁饱和机制进行,并旨在从SPIO生物分布(肝脏)中局部抑制不需要的MPI信号,但我们的方法通过可变的电磁屏蔽机制进行。它调制了SPIO感受到的驱动场的振幅,并且也不使用外部饱和线圈(我们的线圈是植入微电路传感器的一部分)。
C. 生物电子植入成像的最优MPI驱动参数
MPI使用感应传感器,如拾取线圈,因此信号与磁通量变化率的比率成正比[1]、[30],由SPIO示踪剂的松弛调制磁化率设定。先前关于MPI波形优化的工作表明,两个临床安全的最优选择是70 kHz的低幅度或1 kHz的高幅度波形[45]。在这项研究中,我们专注于低频方法(1 kHz和38 kHz),以更好地匹配广泛使用的MPI硬件的较低频率(0.4 kHz 20 mT/µ0由Murase等人[36]和25 kHz 18 mT/µ0由Rahmer等人[46])。
较低的频率也更适合超铁磁MPI链,这些链最近已被证明比典型的SPIO具有更好的成像质量[47]、[48]、[49]、[50]。这些链已被证明在有机溶剂中表现良好,因此可以成为微尺度生物电子植入物中的首选成像剂,其中微电路保持胶囊使得在体内使用有机浸泡的SPIO链是可行的。此外,有趣的特性,如存在阈值激励幅度增加信号100到1000倍[47]、[51],将与屏蔽和共振微电路策略强烈协同,用于具有可调ON - OFF阈值的高灵敏度生物传感器。
D. 生物电子组件和传感器与MPI方法的适用性
用于调制SPIO纳米粒子周围传入激励磁场的传感器是根据前一节中的机制选择的。幅度调制可以通过电阻传感器实现,用于测量体温、pH值等[52]。例如,由于负温度系数(NTC)热敏电阻的电阻随着温度升高而降低,因此随着温度升高,线圈中的电流流量增加。结果,线圈的屏蔽效应会随着温度逐渐变化,这种变化将在MPI图像中可见。晶体管可以用作开关元件,实现开-关调制,这是幅度调制的极端情况。由于强屏蔽效应,基极和发射极之间的生物电信号可以出现在MPI图像中,并且通过屏蔽线圈的光电晶体管也可以检测到基因突变神经元的生物发光。当我们在LC谐振电路上使用电阻传感器或晶体管时,会看到激发磁场的放大。与没有共振的屏蔽效应相比,当电阻降低或电路闭合时,图像中可以看到增加的谐波。
频率调制是通过LC谐振电路中的电容传感器进行的[52]。电容传感器可以通过检测由材料的介电性质或压力波动引起的电容变化,将材料的电容或压力波动转换为电信号,通过改变材料的电性质或两个电极之间的物理距离。我们可以测量生化变化,也可以测量体内物理变化。例如,连接到手术部位的电容应变传感器可以用来在伤口破裂时发出警报。
在这里,我们使用小型陶瓷电容器来缩小LC谐振电路的尺寸。然而,包括铁电材料在内的一些电容器,如钛酸钡(BaTiO3)[53],由于在强磁场中稳定性较低,因此不适合在此使用。铁电材料能够在小包装中提供高电容,但由于其与场强非线性变化的电容,它们会产生不需要的谐波。由于铁电材料的谐波可能比SPIO纳米粒子的谐波大,具体取决于它们的体积,因此我们必须避免在这项研究中使用基于铁电的电容器。
E. 稳健3D重建和传感器读出的实现考虑
有许多因素,如温度、体内稀释、粘度,可能会导致现场与校准环境的偏差,从而导致3D重建和传感器读出中的错误。然而,我们成像植入设备的独特背景和MPI的独特特性为我们提供了关键的好处,确保了结果的稳健性:(1)设计在NPIC中良好密封的高浓度SPIO具有已知的铁质量,避免了任何体内稀释效应的负面影响;(2)由于内部SPIO室被设计为完全与体内环境隔离,因此液体组成、粘度和浓度与校准时保持相同,因此几乎不受环境变化的影响;(3)与MRI不同,解剖差异对设备植入部位的易感性效应(例如组织-空气界面)已知对MPI扫描[54]的影响可以忽略不计;最后,(4)建议将植入式设备放置在距离皮肤1厘米以上的深度。远离皮肤,体温已知受到高度调节,并且受到外部温度变化的屏蔽。尽管根据实际植入部位的解剖位置,确切温度的空间可变性有一定的差异,但这可以通过植入部位的温度计测量,以及在手术植入或注射设备之前对设备进行快速校准来解决。
F. 安全考虑
MPI驱动波形可能会引起磁刺激和组织加热(通过比吸收率(SAR)),因此激励频率和幅度和必须保持在人类安全限制内[55]。对于1kHz驱动场,计算出在皮肤表面测量的37 mT/µ0幅度是人类躯干的限制,当我们的MPI扫描仪/读取器设备垂直应用于躯干轴时。图3e显示,即使在深度的磁场衰减下,这种幅度仍然可以提供足够的谐波。
对于植入微电路,一个担忧是,为了进一步微型化植入电路上的电容器和其他电路元件,可能需要转向更高的谐振频率。然而,由于SAR问题,MPI安全限制将随着频率的增加而变得更加严格。在这方面,基于屏蔽的策略比基于共振的策略更加灵活,因为它使用低频率。
除了磁场对生物组织的影响外,在长时间扫描期间,由于NPIC线圈中长时间感应的电流,可能会发生NPIC设备上的不可忽视的加热效应。以前的MPI研究已经使用MPI对干预导丝进行了成像[15]、[56]、[57]。在MPI条件下,一些导管导丝报告了加热效应,但必须指出,大多数导管的温度升高可以忽略不计,作者将此归因于不同金属成分的铁磁行为导致的不同的滞后损失[57]。在不引起任何加热的情况下,一些设备中检测到了MPI信号,表明对MPI图像产生影响并不一定需要显著加热。
为了最小化线圈中的感应电流和相应的加热,我们选择使用1kHz的低频率。此外,通过修改扫描序列,如采用两阶段过程,将显著减少总扫描时间,以进一步最小化加热。在第一阶段,使用较低的驱动幅度,这些幅度感应的电流/加热较少,在初始扫描中只旨在获得2D图像,从而获得植入设备的2D像素坐标。在第二阶段,为了询问每个设备的深度和传感器信息,将必须使用较高的驱动幅度。为了在高驱动幅度下最小化加热,而不是再次扫描整个FOV,扫描轨迹将只跳转到有设备的坐标,每个NPIC短暂地(<0.2秒)进行“ping”,在跳跃时间内不施加驱动场以允许冷却。因此,这大大减少了与NPIC的驱动场相互作用,净加热量,并确保通过在对每个NPIC进行更高幅度询问之间允许足够的冷却时间,来确保稳健的z坐标和传感器编码。
G. 潜在的临床用例
虽然这项研究仍然是一种概念验证,但一些特别需要空间信息的潜在临床用例在图2中简要说明。案例1将是跟踪和读取移动植入传感器,例如通过胃肠道的药丸。临床用例的关键优势在于能够为每个传感器读数提供精细的空间位置信息,因为它沿着整个胃肠道移动。因此,这里有价值的参数是药丸的准确3D位置。其他方法,如“药丸相机”,只能记录时间,并基于相机图像粗略估计其在胃肠道中的位置。
案例2将是术后监测深部内部手术,其中一系列植入物可以监测愈合、缝线断裂等。关键的潜在参数测量是(1)随着愈合进展而释放的生化愈合标记物,(2)由于从缝线破裂的吻合口泄漏的胃液/胆汁引起的pH值变化,最后(3)由于感染引起的局部炎症而导致的内部肿胀的应变或压力基础传感。这可能有助于以空间信息的方式检测感染或癌症复发事件,用于术后延长时间段。
H. 当前研究的局限性
由于这是一项概念验证研究,当前NPIC系统存在几个局限性:(1)成像深度目前限制在7厘米,这要求设备植入在前部或后部7厘米以内;(2)在长时间的成像期间,微电路中显著电流流动产生的热量是一个担忧;(3)当前的图像重建工作流程假设每个Z线上只有一个设备,这可能会使成像过程复杂化,因为需要调整FFL的角度。解决这些实际实施问题的一些策略是:(1)通过使用更大的接收线圈和/或产生更强信号的MNPs,如超铁磁纳米粒子[47],这些纳米粒子的信号强度是铁质量的20倍,可以提高成像深度;(2)通过使用较低驱动幅度的MPI最小化NPIC中感应电流和加热的MPI扫描策略,首先定位2D投影平面上的所有微设备,保存空间坐标,然后只跳转到这些坐标以查询传感器值。这与在高驱动幅度下覆盖整个2D投影平面的扫描轨迹不同;(3)利用先验知识,即实施了多少NPICs,以及初始扫描来计算和推荐尝试的角度,可以将“收敛”到适当的FFL成像角度的时间减少到最小数量的迭代。固有地,MPI具有稀疏的成像背景,因为只有植入设备中的SPIOs发出信号,而生物组织没有信号,这使得更容易快速识别适当的成像角度。此外,找到成像角度的限制也存在于临床使用的模态中,如超声,其中操作员可能需要改变成像角度以找到声学窗口。因此,如果适当的成像角度可以通过最小数量的迭代快速找到,那么当与当前的临床成像工作流程一起查看时,这个限制可能是可以接受的。
VI. 结论
在这项工作中,我们展示了通过MPI可以检测到的植入式基于线圈的换能器,可以作为阵列成像,以空间区分来自不同植入物的生物电子信号,从而实现以空间分布的方式远程感测生物指标。这些设备由感应耦合的谐振电路组成,它们响应电、热或光信号而改变其属性,从而在不需要板载电源的情况下调制局部磁粒子成像信号。我们展示了修改MPI成像技术以提取空间信息以及由植入电路(例如,生物传感)传输的其他信息,这些信息编码在磁粒子光谱中,并呈现为随变量生物指标变化的颜色色调。利用MPI的类似示踪剂成像特性的生物电子电路的生物物理传感可能在生物医学和诊断中实现广泛的微创应用。
声明
本文内容为论文学习收获分享,受限于知识能力,本文对原文的理解可能存在偏差,最终内容以原论文为准。本文信息旨在传播和学术交流,其内容由作者负责,不代表本号观点。文中作品文字、图片等如涉及内容、版权和其他问题,请及时与我们联系,我们将在第一时间回复并处理。
下载1:OpenCV-Contrib扩展模块中文版教程
在「小白学视觉」公众号后台回复:扩展模块中文教程,即可下载全网第一份OpenCV扩展模块教程中文版,涵盖扩展模块安装、SFM算法、立体视觉、目标跟踪、生物视觉、超分辨率处理等二十多章内容。
下载2:Python视觉实战项目52讲
在「小白学视觉」公众号后台回复:Python视觉实战项目,即可下载包括图像分割、口罩检测、车道线检测、车辆计数、添加眼线、车牌识别、字符识别、情绪检测、文本内容提取、面部识别等31个视觉实战项目,助力快速学校计算机视觉。
下载3:OpenCV实战项目20讲
在「小白学视觉」公众号后台回复:OpenCV实战项目20讲,即可下载含有20个基于OpenCV实现20个实战项目,实现OpenCV学习进阶。
交流群
欢迎加入公众号读者群一起和同行交流,目前有SLAM、三维视觉、传感器、自动驾驶、计算摄影、检测、分割、识别、医学影像、GAN、算法竞赛等微信群(以后会逐渐细分),请扫描下面微信号加群,备注:”昵称+学校/公司+研究方向“,例如:”张三 + 上海交大 + 视觉SLAM“。请按照格式备注,否则不予通过。添加成功后会根据研究方向邀请进入相关微信群。请勿在群内发送广告,否则会请出群,谢谢理解~























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








