搭桥动脉粥样硬化及再狭窄是冠状动脉旁路移植术(Coronary Artery Bypass Grafting, CABG)后的主要并发症,严重制约冠心病患者的长期生存率。因此迫切需要有效的措施改善或延缓搭桥血管狭窄的形成,进而减少缺血事件的再发生。寻找直接靶向内皮细胞死亡和炎症的调控因子,有望在内皮功能损伤早期进行干预,突破当前动脉搭桥慢性血管重构防治的瓶颈。
目前认为内皮损伤、血栓形成、免疫激活和内皮功能障碍是引发搭桥动脉血管重构再狭窄的主要因素。而血管平滑肌细胞(SMCs)的增殖是血管损伤后内膜形成的主要原因。受体相互作用蛋白激酶1(RIPK1)是RIP家族中第一个成员,从其被发现就成为细胞信号转导领域的研究热点,目前RIPK1已经成为制药界中重要的药物靶标。有研究报道,RIPK1的三种底物(RIPK1、DAB2IP和Drp1)分别调控着细胞死亡、炎症和替代线粒体自噬途径(图1)。因此,内皮RIPK1是否能通过特定底物调控动脉旁路移植中的内膜形成是一个关键问题。
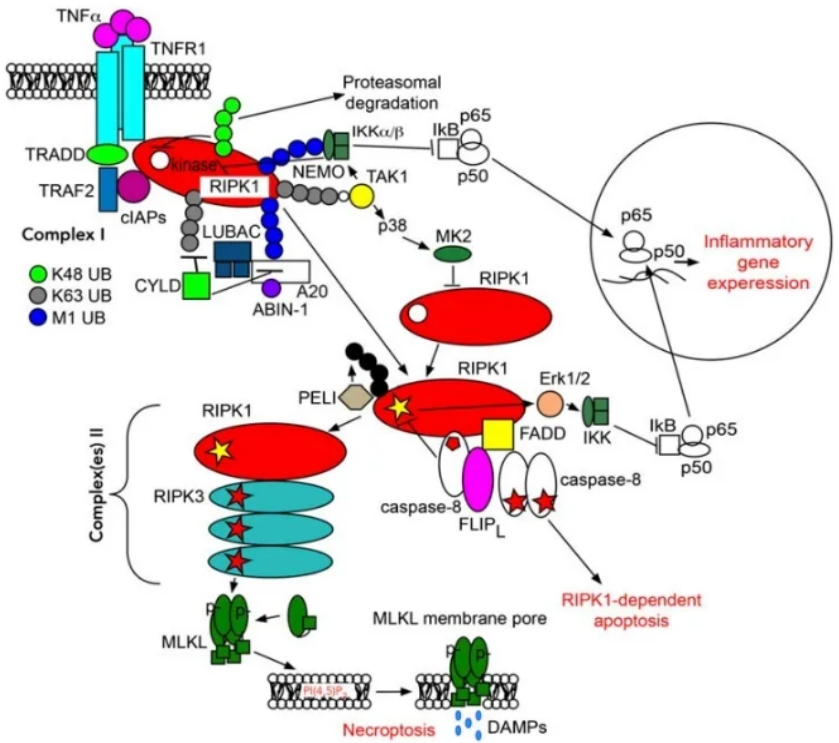
图1 RIPK1在细胞炎症和凋亡起重要作用(图片转自Innodrugs)
浙江大学徐清波,中南大学陆瑶及翁良共同通讯在Science Advances 发表题为“Endothelial RIPK1 protects artery bypass graft against arteriosclerosis by regulating SMC growth”的研究论文。此研究在华盈生物的协助下进行细胞因子广筛抗体芯片实验,再辅以免疫共沉淀(co-IP)实验和质谱(LC-MS/MS)实验,揭示了内皮细胞RIPK1对自体动脉搭桥术后平滑肌细胞增殖和血管重构的重要影响和作用机制。

01 构建动脉旁路移植血管小鼠模型
研究人员首先建立了一个小鼠动脉旁路移植模型(图2A),该模型复制了CABG中人类血管重建病理的关键特征,包括管腔狭窄和内膜增厚(图2B)。免疫荧光分析发现增厚区域主要由SMCs组成(图2C),对粘附因子和炎症细胞的检测发现动脉旁路移植造成一定的内皮激活和功能障碍,引发炎症浸润(图2D)。
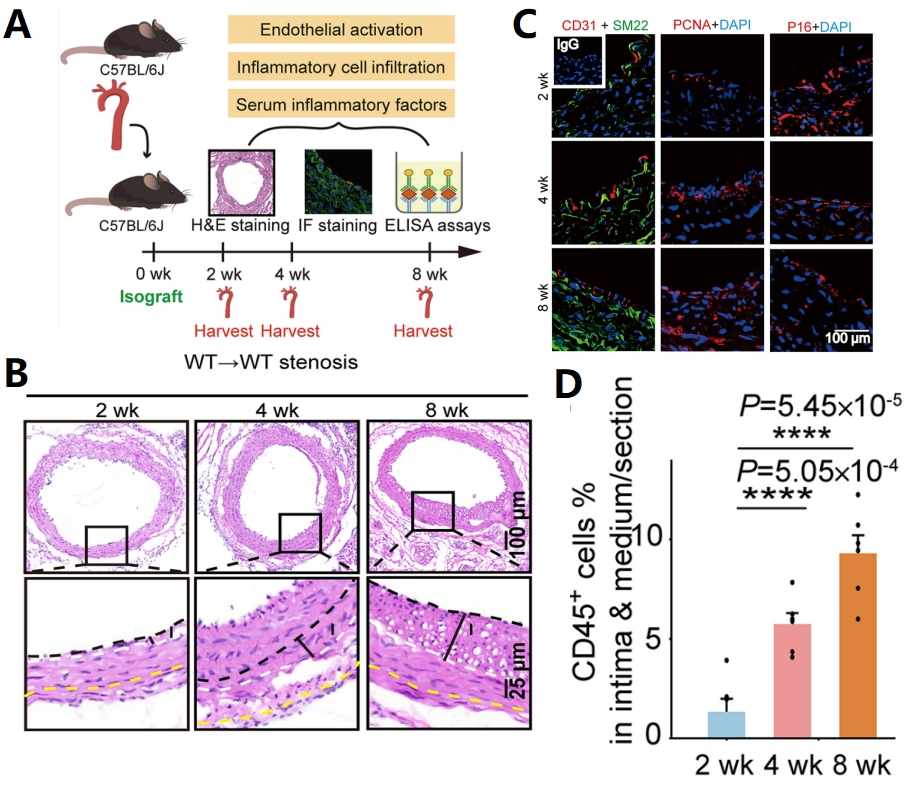
图2 动脉旁路移植血管小鼠模型及表型特征
02 构建RIPK1特异性敲除小鼠动脉旁路移植血管模型
为了研究ECs和SMCs之间的相互作用,研究人员首先构建了内皮细胞RIPK1特异性敲除(KO)小鼠的动脉搭桥模型(图3A)。发现搭桥术后野生型小鼠中出现逐渐进展的以新生内膜增厚和平滑肌异常增殖为特点的向心性狭窄(图3B),并伴随以炎症激活状态(图3C-E)。
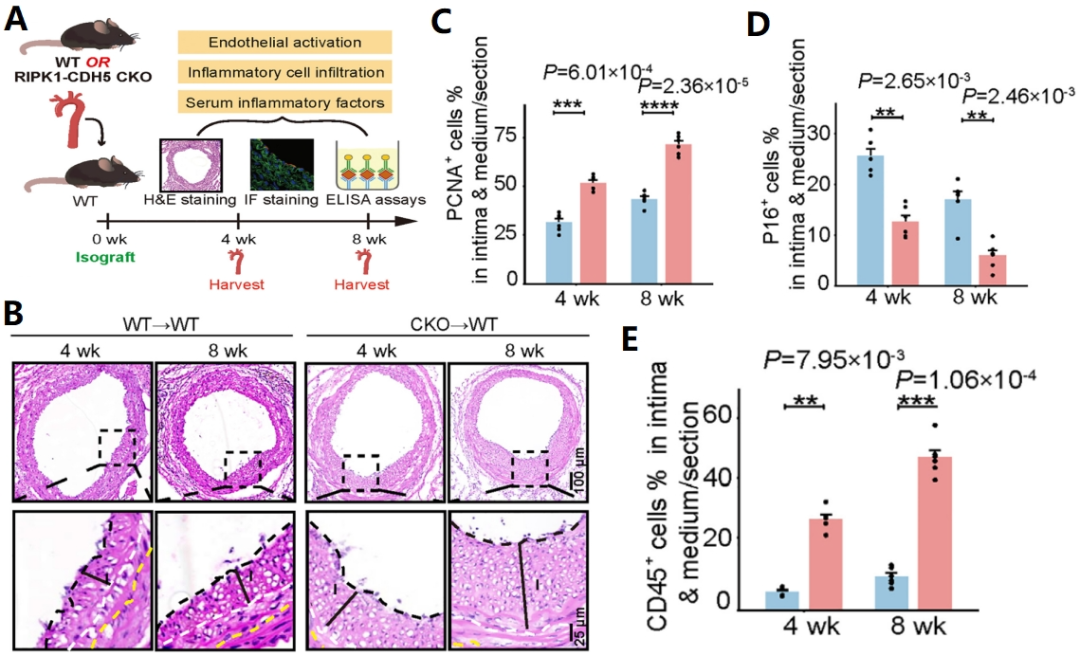
图3 RIPK1特异性敲除小鼠搭桥动脉病理重构
随后将ECs和SMCs通过直接培养或间接培养的方式(图4A),借助流式细胞术和免疫荧光分析,发现ECs中RIPK1的缺失可以通过直接调节ECs和SMCs之间的相互作用来显著促进SMC的增殖(图4B, C)。
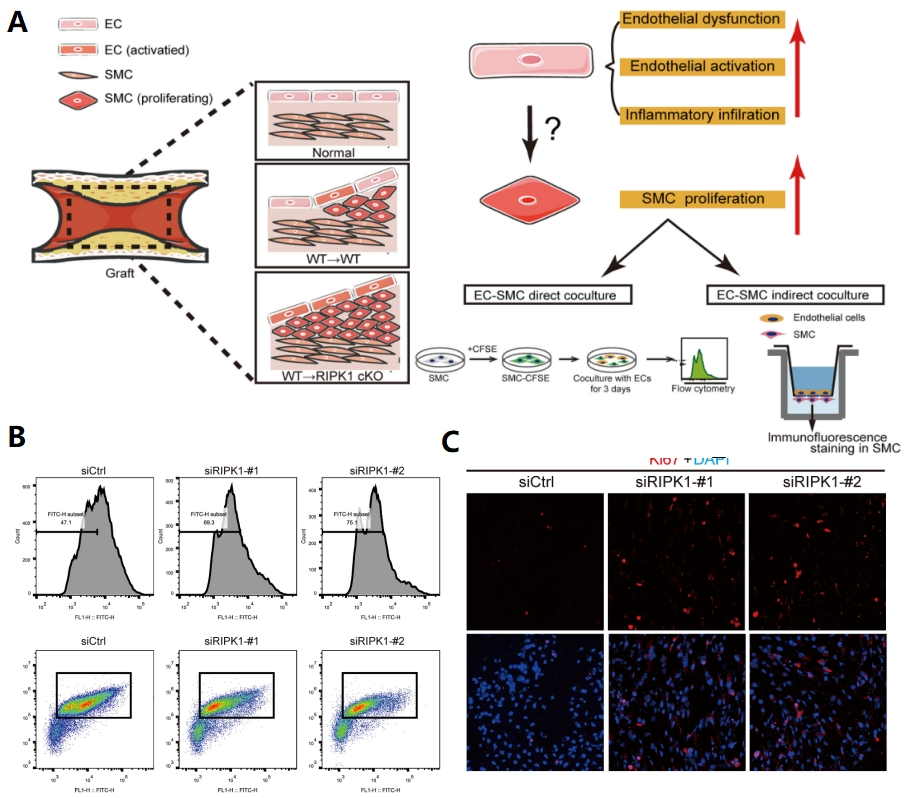
图4 ECs和SMCs直接培养或间接培养实验
03 细胞因子广筛抗体芯片确定关键功能蛋白
细胞因子广筛抗体芯片是将高度特异的细胞因子捕获抗体结合在经化学修饰的玻璃片基上,再通过高亲和的配对检测抗体进行信号放大,实现对微量细胞因子的有效检测。华盈生物推出的细胞因子广筛抗体芯片技术,一次性可对上千种细胞因子进行同步筛选和检测,特别适合大量候选细胞因子的筛选和检测研究。
为了确定ECs中RIPK1 KO刺激SMC增殖的潜在机制,研究人员使用L507细胞因子广筛抗体芯片(华盈生物提供该研究中的抗体芯片检测服务)筛选了内皮细胞RIPK1敲除后的相关分泌蛋白,发现分泌型Sonic Hedgehog蛋白(N-Shh)改变最为显著(图5A-C)。并进一步通过ELISA、qPCR、免疫荧光等方法分别在体内和体外共同验证了内皮细胞特异性敲除RIPK1后N-Shh的分泌状态和异常增殖的平滑肌细胞中下游Shh信号通路的激活状态(图5D, E)。之前研究报道,细胞释放的N-shh可与膜受体PTCH1结合,并激活Hedgehog信号通路。RIPK1 cKO中转录因子GLT1(Hedgehog信号通路的靶基因)的高表达(图5F),表明ECs中RIPK1的敲低增加N-shh分泌,激活了SMCs中的Hedgehog通路。
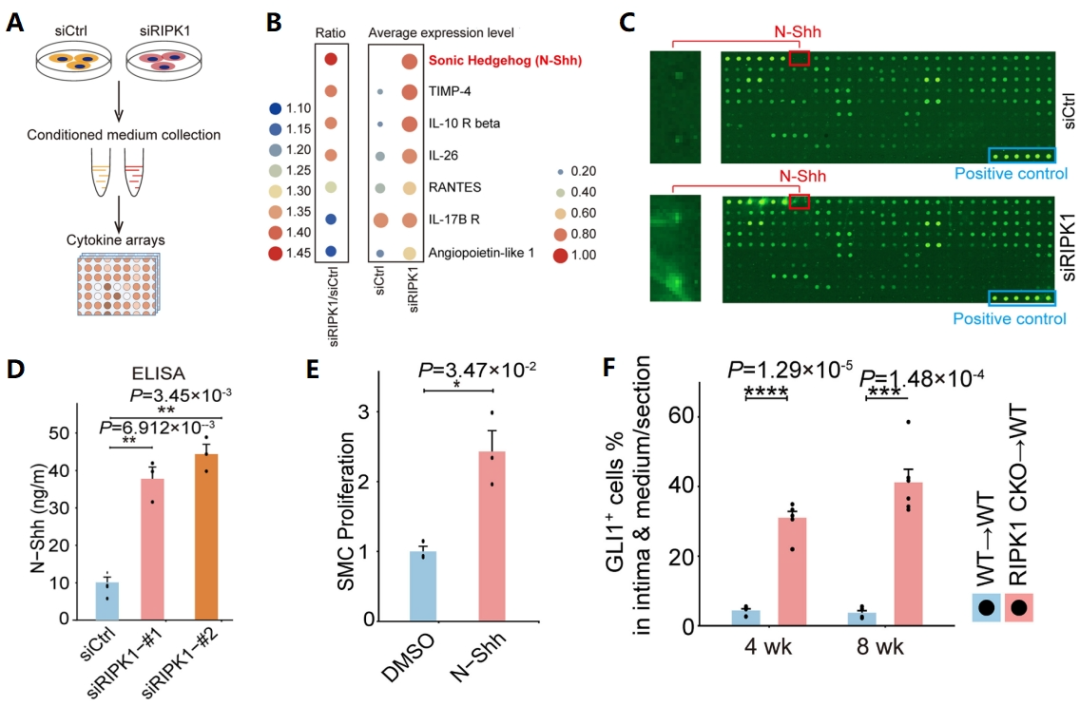
图5 L507细胞因子广筛抗体芯片确定作用靶点
04 RIPK1通过调控N-Shh分泌调控血管重构的机制研究
为了进一步探究内皮细胞RIPK1通过调控N-Shh分泌进而导致SMCs增殖和搭桥血管重构的分子机制,研究人员首先利用BIOPLEX数据库预测潜在的结合蛋白,通过免疫共沉淀(co-IP)实验验证了仅EEF1AKMT3与RIPK1存在明显蛋白质-蛋白质相互作用(图6A)。通过体外激酶实验发现EEF1AKMT3被RIPK1蛋白磷酸化(图6B),通过LC-MS/MS质谱分析,确定了在搭桥动脉中EEF1AKMT3是真正的RIPK1底物,磷酸化位点在Ser 26处(图6C)。又通过翻译表面传感(SUnSET)实验和体外甲基化实验验证了EEF1AKMT3可以通过调节翻译相关蛋白EEF1A的K165甲基化来促进核糖体蛋白的合成途径,最终介导细胞N-shh的分泌(图6D, E)。最终,研究证明内皮细胞RIPK1 KO可以增加Shh分泌,促进SMC增殖和新内膜的形成。
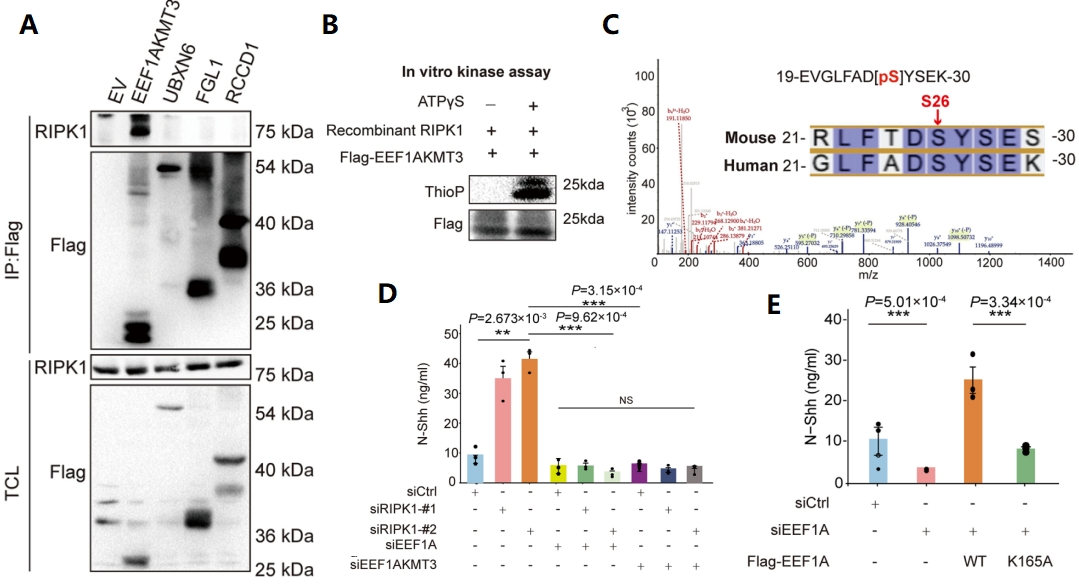
图6 RIPK1通过分泌N-Shh调控血管重构的机制研究
05 RIPK1-EEF1AKMT3-Hedgehog信号通路改善血管重塑
通过在RIPK1 cKO移植模型中局部应用GDCO449(Sonic hedgehog信号通路抑制剂),发现原位靶向平滑肌细胞的Sonic hedgehog信号通路能够显著缓解内皮细胞敲除RIPK1引发的平滑肌细胞异常增殖和搭桥动脉重构,主要表现在:狭窄明显减轻(图7A, B),增殖SMCs减少(图7C),炎症因子和炎症浸润减少(图7D)。
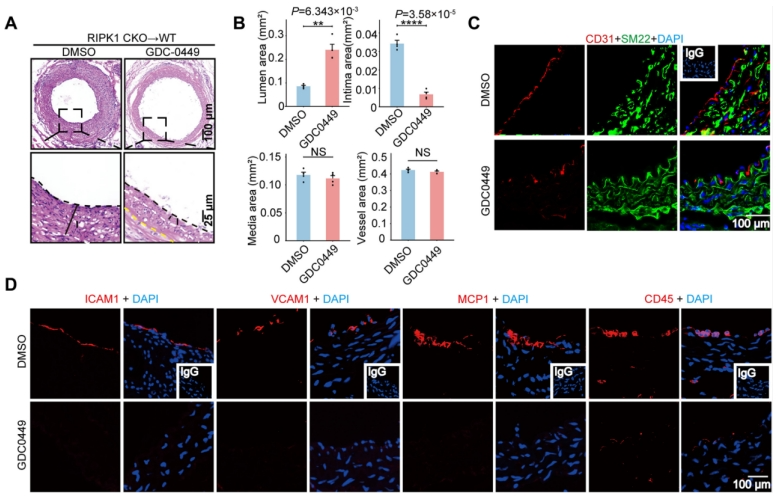
图7 RIPK1-EEF1AKMT3-Hedgehog信号通路改善血管重塑
总结与讨论
综上,该研究表明内皮细胞RIPK1-EEF1AKMT3 S26 - EEF1A K165-Hedgehog信号通路通过调节核糖体蛋白合成功能,干预N-Shh分泌并参与内皮-平滑肌细胞通讯,共同调控搭桥动脉重构(图8)。抑制内皮-平滑肌细胞激活的Sonic hedgehog信号通路可能是预防搭桥动脉粥样硬化及再狭窄的新方法。
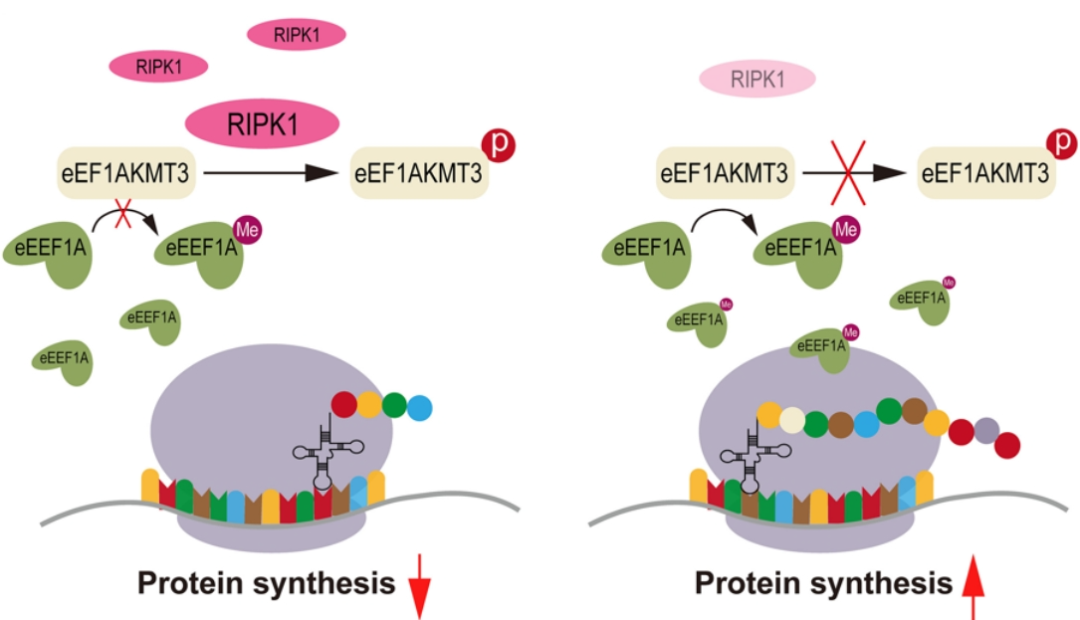
图8 RIPK1对搭桥动脉血管重塑的机制探究
细胞因子广筛抗体芯片优势:
l 少量样本即可筛选大量指标:100 uL的液质样本即可检测上千种细胞因子检测指标
l 比传统ELISA等技术更省样本、成本和时间
l 芯片上每种抗体设置2或4个技术重复,保证数据质量
l 华盈生物已经完成多种类型的检测,服务有保障。如:血清、血浆、细胞上清、组织上清、脑脊液、尿液、房水、泪液、玻璃体、唾液、宫腔液、宫颈刮片、关节液、肺泡灌洗液、骨髓灌洗液、龈沟液、细胞、组织、外泌体等

业务咨询400-869-2936或17316301592(微信同号)
相关文献
Lu Y, Leng Y, Li Y, et al. Endothelial RIPK1 protects artery bypass graft against arteriosclerosis by regulating SMC growth. Sci Adv. 2023 Sep;9(35):eadh8939.
![]()
1)J Hepatol (IF: 18.946):第二军医大学团队发现新的乙肝病毒基因亚型可预测中期肝癌的预后
4)Nat Commun:上海中医药大学研究团队揭秘牛蒡子苷元对糖尿病肾病保护机制
| 工作邮箱:market@wayenbiotech.com
| 官网链接:www.wayenbio.com





















 1140
1140

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








