开发用于检测过氧化氢和pH值的耐用微电极
1.0 引言
阴极电刺激先前已被研究作为一种方法治疗植入物相关感染并促进骨愈合(艾伦斯贝格尔、克拉克、坎蒂等)
Eq.1 2O₂ + 4e⁻ → 4OH⁻
Eq.2 O₂ + 2e⁻ + H₂O → H₂O₂
Eq.3 H₂O + 2e⁻ → H₂ + 2OH⁻
pH值的升高和过氧化氢(H₂O₂)的电化学生成均被假定为阴极刺激的抗菌因素。卡尔巴科娃等人,2007年研究表明,在钛上施加低水平阴极电流可增加巨噬细胞和成骨样细胞中H₂O₂的水平。多项研究显示,长时间阴极极化可在阴极周围引起碱性偏移(施耐德、鲁道夫、鲍泽和特福特,2018;斯托德利、德比尔和拉平斯科特,1997)。因此,深入理解电刺激对局部pH值和H₂O₂浓度的影响,可能有助于阐明其抗菌机制。
电化学传感器是检测溶液化学变化的常用工具(莱万多夫斯基和贝内纳尔,2014)。这些传感器通常为安培传感器(如溶解氧、H₂O₂)或电位传感器(如pH值、离子选择性)。安培传感器通过在传感电极上施加固定电位来工作,测量产生的电流,并将其与溶液中被还原或氧化的反应物相关联。溶液中H₂O₂的安培检测已有充分研究(Hall, Khudaish, & Hart, 1998)。利用铂阳极,所产生的电流来自过氧化氢的氧化(方程4)可用于测定溶液中的浓度(S. Ben‐Amor, Devin, Rigoulet, Sojic, & Arbault, 2013;Salem Ben‐Amor 等,2014;Kishi, Fukasawa, & Umeda, 2010)。
Eq.4 H₂O₂ → O₂ + 2H⁺ + 2e⁻
直接测量H₂O₂的一个难点在于其高反应性和不稳定性(Sanford 等,2010)。为了确定阴极电刺激对H₂O₂浓度的影响,关键在于能够实时且具有空间精度地测量H₂O₂(O’Connell、Lewis 和 Wain,2015)。电化学传感器的开发为解决这一问题提供了灵活的方案。H₂O₂的安培检测此前已在体内实现,但尚未在骨科植入物的电刺激过程中实现(Tamasko 等,2007)。
尽管常规pH计非常有价值,但在需要进行任何程度的空间测量时,其应用较为困难(Jamali 等,2014)。微加工正成为制造微电极传感器的日益普遍的方法,但这些方法需要更专业的设备(Chu 等,2015;Nguyen 等,2014;Wang、Suzuki、Hayashi、Kaneko 和 Sunagawa,2006)。通过将离子选择性膜涂覆在移液电极上,可以实现pH传感器的小型化(Deng、Buijs 和 ten Cate,2004)。然而,这类电极需要填充液,且易碎,并具有有限保质期。制备固态微电极的一种常用方法是将微米级金属丝密封在拉制玻璃毛细管内(Lowe、Wallace 和 Neufeld,2012)。该技术可用于制备可作为pH传感器使用的铱/氧化铱(IrOx)微电极(Dexter 和 Chandrasekaran,2000)。此方法的一个局限性在于采用拉制玻璃移液管制备的传感器耐久性较低。此外,氧化铱微电极也是体内pH测量的优选方案,因为氧化铱具有生物相容性(Tabata 等,2016;Zhou,2008)。
在这项工作中,开发了一种快速且低成本的耐用微电极制备方法。该方法包括可用于检测过氧化氢的铂丝微电极和用于pH测量的IrOx电位电极。此外,还开发并评估了基于针头的微电极的制备方法,并在体外模型中进行了验证。本工作旨在评估这些传感器,以评估它们是否可作为在体内电刺激期间测量pH值和H₂O₂的候选者。
2:材料与方法
2.1:材料
使用加州精细线材公司的100微米直径铂丝制备过氧化氢微电极,使用e‐filaments的127微米直径铱丝制备pH微电极。硫酸、盐酸、氢氧化钠、氯化钠、30%过氧化氢和磷酸盐缓冲液购自费舍尔科学公司。琼脂、过氧化氢酶、聚四氟乙烯和氰化钾购自西格玛‐密里博雷公司。所有溶液均使用18 MΩ milli‐Q水配制。电化学测试采用Gamry Reference 600恒电位仪进行,所有电位均以银/氯化银为参比,除非另有说明。
2.2 制备工艺
2.2.1 电化学蚀刻
首先,两种类型的金属丝均被蚀刻成细尖状,以在制备工艺结束时最大限度地减少暴露的金属丝长度。该过程使用2‐4厘米长的金属丝,以减少贵金属的使用量并降低电极的最终成本。
将100 μm的铂丝首先使用浓氰化钾(KCN)溶液蚀刻至~5微米。蚀刻过程在化学通风橱内进行。取一段2 cm长的铂丝,用包裹了铝箔的鳄鱼夹夹住,并将鳄鱼夹连接至交流电源。采用石墨电极完成蚀刻电路。蚀刻过程中,向电池施加约4V的交流电压,可通过观察导线上气泡的形成来监控过程。然后将铂丝在KCN溶液中缓慢上下移动,直至蚀刻完成。完成后,用去离子水彻底冲洗铂丝。
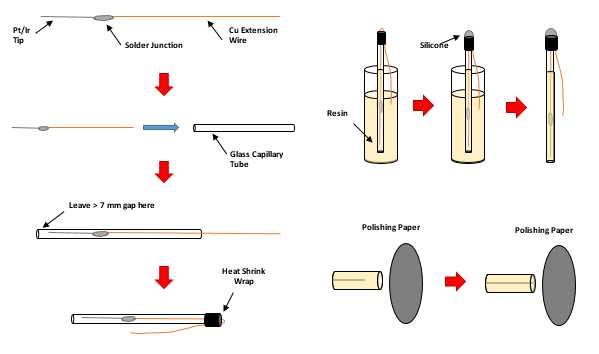
将铱丝在0.5 M硫酸溶液中进行刻蚀。首先,将铱丝连接到直流电源的正极,石墨电极连接到负极。电极被放入玻璃池中,直流电源设置为10伏特。该过程大约需要10分钟,将铱丝蚀刻成细尖状。蚀刻过程完成后,用去离子水冲洗铱丝。为了确认蚀刻后铱丝的最终尺寸,使用日立SU‐70进行扫描电子显微镜(SEM)观察。将蚀刻后的铱丝固定在碳导电胶带上,并在2千伏的加速电压下进行成像。图1显示了铂丝和铱丝蚀刻后的末端形貌。

2.2.2 组装
随后,将工作电极丝的未蚀刻端焊接至一根15厘米长的铜延长线。然后将该组件穿入玻璃毛细管中,以延长线端为引导,确保蚀刻尖端不受损伤。该毛细管长约10厘米,内径为1.5毫米。
在此步骤中,保持金属丝蚀刻端的完整性至关重要。若蚀刻尖端发生弯曲、折痕或断裂,将显著增加后续抛光步骤的难度并影响其重现性。同时,还需在玻璃毛细管的工作电极端预留至少7毫米间隙,以确保整个工作电极在固化过程中完全嵌入树脂中。装配过程的最后一步是使用热缩管固定铜线组件。将铜线弯折至毛细管边缘后,套上2毫米直径的热缩管,并用热风枪将其紧密收缩固定在铜线和毛细管上。
2.2.3 树脂包埋
使用由15份树脂(#M136)与2份固化剂(#M138)按体积配制的Metlab环氧树脂。混合环氧树脂时需非常缓慢,以避免在树脂中产生气泡,有助于其干燥得清晰且均匀。树脂配制完成后,将其倒入2毫升离心管中,并将微电极组件放入其中。树脂通过毛细作用缓慢充满离心管,当树脂上升完毕后,用硅胶封住管口。硅胶的作用是密封离心管,防止外界物质进入,并形成气密密封,防止树脂从管中滴出。放置硅胶后立即微电极从树脂中取出后,外部擦拭干净,并静置固化24小时。
2.2.4 抛光
这一步是整个过程中最关键的步骤,因为过度抛光会导致电极直径过大。树脂固化后,需要去除堵塞工作电极与溶液接触的玻璃毛细管和树脂部分。采用逐级细化的砂纸进行湿法抛光,直到电极尖端略微露出为止。首先使用600目砂纸和水去除大部分材料,当金属丝接近树脂末端时,改用1200目抛光纸和水继续抛光。在抛光过程中,始终使用体视显微镜从侧面观察尖端,以检查工作电极是否可能暴露。通过恒电位仪向电极施加电流,以确认工作电极已暴露且具有导电性。
2.2.5 基于针头的构建
对于某些应用,希望能在凝胶样品或in vivo模型中使用这些传感器。为此,将玻璃毛细管替换为22号不锈钢针,并将环氧树脂替换为生物相容性材料。为了防止铱丝或铂丝与针头之间发生电接触,首先将微丝浸涂聚四氟乙烯(PTFE),并在干燥箱中固化。然后在PTFE涂层的导线上涂覆医用级硅胶,并将其从针头的斜面侧穿入,直至从另一侧穿出。在针尖处小心地添加额外的硅胶,以确保微电极固定牢固。硅胶经过24小时固化后,将铜线焊接至铂丝或铱丝上,并将其穿过10 mL鲁尔锁注射器,然后在注射器内注入少量硅胶。对于基于针头的H₂O₂电极,只要通过工作电极的电流保持较小(皮安到纳安),针头本身可用作对电极和参比电极。为了连接针体,在针头近端缠绕一段额外的铜线,并用热缩管固定。两根连接导线均使用绝缘胶带固定在注射器上。对于pH电极,则使用外置Ag/AgCl参比电极。图2展示了整个制备工艺的概要。

2.2.6 pH传感器功能化
为了使铱微电极对pH值敏感,采用循环伏安法(CV)在铱表面生长氧化铱层。在此过程中,工作电极为铱微电极,电解液为0.5 M硫酸。将电极的电位以每秒3000毫伏的扫描速率在‐250毫伏至+1250毫伏之间进行扫描,共完成8000个循环。循环伏安法完成后,立即将探针从硫酸中取出,并置于磷酸盐缓冲盐水(PBS)中过夜。此步骤可使探针的开路电位漂移趋于稳定。该方案适用于树脂包埋和针型铱电极。
2.3 电极表征实验
2.3.1 循环伏安法
采用循环伏安法(CV)确认铂电极在安培检测H₂O₂时应保持的最佳电位。CV扫描范围为‐100毫伏至+1000毫伏,扫描速率为每秒100毫伏,共进行三个循环。CV实验在不含H₂O₂,以及含有0.88毫摩尔/升和8.8毫摩尔/升浓度的条件下进行。每种浓度重复实验三次。
2.3.2 校准
为了根据电流值计算过氧化氢的未知浓度,有必要制作校准曲线。本实验使用搅拌板上的三电极体系,包括银/氯化银参比电极和铂丝对电极。将探针保持在+800 mV的电位,电流允许稳定五分钟。电流稳定后,每隔30秒加入六次8.8 mM H₂O₂的10 μL等分试样,每次增加1 微摩尔/升的H₂O₂浓度。由于电极响应的线性特性,该曲线随后用于将测得的电流与H₂O₂的未知浓度相关联。为确保重现性,校准共进行了三次。
2.3.3 H₂O₂分解研究
氧化铱微电极
2.3.4 铱/氧化铱微电极校准
pH探针的校准曲线是在pH值为2、4、7、10和12的pH缓冲液中制作的。将探针放入每种缓冲溶液中,并相对于银/氯化银参比电极测量电极电位,持续五分钟。使用稳定后的电位测量值绘制校准曲线。为评估重现性,氧化铱电极经过三次独立制备后完成校准。
2.3.5 针头电极校准
H₂O₂微电极在琼脂凝胶电解质模型中进行校准。通过将0.9%氯化钠溶液溶解于去离子水中并进行高压灭菌制备1.5%琼脂凝胶电解质。高压灭菌后,将10 mL体积的溶液分装至不同的玻璃容器中,并冷却至40°C。冷却后,加入H₂O₂以调节浓度,从0微摩尔到50微摩尔,每10微摩尔为一个增量。待凝胶完全固化后,使用该凝胶电解质样品对基于针头的H₂O₂传感器进行校准。采用手动显微操作器将传感器插入和抽出琼脂。使用恒电位仪向铂微电极施加 +800 mV电压,不锈钢针同时作为参比电极和对电极连接。
氧化铱微电极在类似的凝胶电解液模型中进行了校准。高压灭菌后,通过添加1 mL的1M盐酸和1M氢氧化钠,将凝胶的pH值调节为酸性和碱性。分别地。首先在pH缓冲液中对电极进行校准,然后通过平行插入凝胶并使用外置Ag/AgCl参比电极来测量凝胶的pH值。这样做的目的是为了观察传感器在多次插入凝胶后是否仍对pH值变化保持敏感性。
3:0 结果
H₂O₂微电极
循环伏安法验证了在铂上检测H₂O₂氧化的最佳电位。图3显示,在存在H₂O₂的情况下,电流在约+300 mV开始增加。对于0.88 mM的H₂O₂溶液,电流在约+600 mV达到平台,而对于8.8 mM的H₂O₂溶液,则在+800 mV达到平台。选择+800 mV作为检测电位,以确保在尽可能宽的浓度范围内实现H₂O₂的完全氧化。
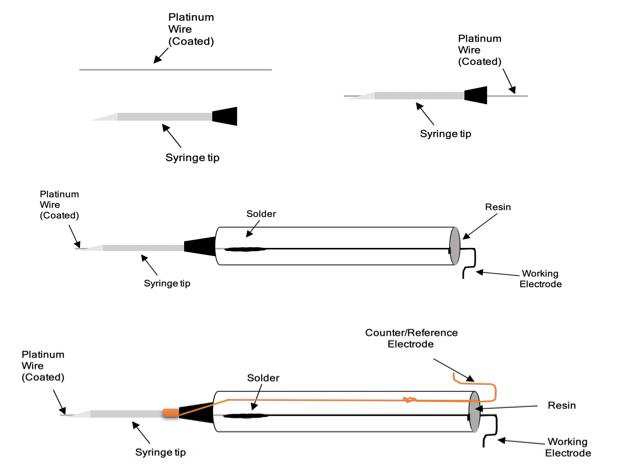
图4显示了为H₂O₂微电极生成的校准曲线。在校准测试中确定的检测下限为1 μM的H₂O₂。该校准曲线的斜率为34.1 pA/μM,R²值为0.9964。校准曲线的灵敏度表明,该微电极能够准确检测H₂O₂浓度中1 μM的变化。
H₂O₂分解研究作为验证传感器功能的第三种形式进行。该探针测量了1 mM的H₂O₂添加量,并能够监测过氧化氢酶对H₂O₂的降解过程,如图5所示。在= 300秒时加入过氧化氢酶,信号立即出现衰减。
图6(a)显示了传感器在琼脂凝胶模型中的电流响应。图6(b)中的校准曲线显示了由三次独立实验生成的校准曲线。这表明,在凝胶中H₂O₂浓度每增加10 微摩尔,测得的电流呈线性增加。
氧化铱微电极
在图7的循环伏安法中可以观察到氧化层在暴露的铱丝上生长的证据。通过约+800 mV处的铱氧化峰的存在来评估电极是否被正确制备。
氧化铱微电极在不同pH值下的响应稳定性如图8(a)所示。图8(b)显示了使用氧化铱微电极生成的校准曲线。该曲线线性度很高,平均斜率为每pH 76.7毫伏,R²为0.996。斜率为负,因为探针的开路电位随着pH变得更碱性而降低。
图9显示了pH针状电极的测试结果。该电极被插入三种不同pH值调节的琼脂凝胶样品中,从酸性凝胶开始,逐渐过渡到更碱性的凝胶。电位测量值通过校准曲线转换为pH值,该校准曲线是在将电极插入琼脂之前使用pH标准缓冲液制作的。该结果表明,该电极能够在凝胶介质中跟踪pH值的变化。
4.0 讨论
许多商用微电极和传感器平台价格昂贵,且需要专用设备来操作。制备传统玻璃毛细管微电极的设备也较为昂贵,且该方法需要大量练习才能掌握。本研究中开发的方法展示了一种简单的制备两种不同类型微电极的工艺,这些微电极不仅耐用,而且显著低于商用产品的成本,且无需任何专用的微加工设施。本研究中进行的初步测试表明,这些电极可用于液体和凝胶电解质样品中。
此处描述的H₂O₂微电极经过表征以展示其性能。如图4所示,该传感器的平均灵敏度为34.1 pA/μM。其检测限为1 μM,表明它适用于预期H₂O₂浓度为μM的应用场景。钛等金属的阴极刺激可能导致产生μM水平的H₂O₂(Park等,2015年)。研究发现,电极的灵敏度受参比电极与传感电极之间距离的显著影响。为了实现1 μM的灵敏度,参比电极必须直接连接到传感器。由于电极的耐用性,连接参比电极时可能损坏传感器的担忧得以缓解。H₂O₂降解实验的结果表明,该传感器能够实时跟踪H₂O₂的变化。理论降解速率为每分钟每过氧化氢酶单位消耗1 μM的H₂O₂,实验中添加了2000至5000单位的过氧化氢酶。H₂O₂几乎90秒后完全消除,表明添加了约2000个活性单位的过氧化氢酶。
基于针头的H₂O₂传感器的实用性也得到了评估。该电极构型将针头同时用作对电极和参比电极,从而无需采用三电极电化学构型,这在体内应用中具有优势。在琼脂凝胶模型中,能够检测到10 微摩尔浓度的H₂O₂,这为利用该传感器检测体内升高的H₂O₂浓度提供了概念验证。
本研究的一个局限性在于未确定针型传感器的检测限。未来的工作将采用相同的琼脂凝胶模型定量评估电化学生成的H₂O₂量。
固态氧化铱pH传感器相比其他类型的微型化pH电极具有更高的耐久性和可重复使用性。本文开发的电极在pH值范围2‐12内表现出典型的超能斯特pH响应,为76.7 毫伏/pH(Hitchman & Ramanathan, 1988)。由于铱是一种生物相容性材料,因此其作为体内pH传感工具受到了关注。最近的研究表明,此类传感器能够在大鼠模型中测量迷走神经刺激期间的pH变化(Cork 等,2018)。氧化铱pH传感器还被用于龋齿的定量诊断研究(Tabata 等,2016)。本文描述了一种制备基于针头的pH电极的方法。通过测量调整过pH值的琼脂凝胶中的电位,对电极性能进行了定性评估。电极电位趋势与酸性、中性和碱性pH凝胶的标准校准相符。然而,由于无法用常规pH计测量凝胶的pH值,该针头pH电极的准确性尚不确定。
当制备与琼脂凝胶中含有等量酸或碱的相似体积的磷酸盐缓冲液时,测得其pH值分别为pH为1和13。该结果与针头电极在酸性和碱性琼脂凝胶中记录的数值相似。本研究表明,该pH电极在插入凝胶样品后仍能正常工作。与H₂O₂微电极类似,未来的工作将利用此传感器测量电化学产生的pH变化。
5.0 结论
本研究展示了一种快速且低成本的固态pH值和H₂O₂微电极制备方法,适用于实验室使用。此外,还制备了基于针型的电极,并在体外模型中进行了测试。只要适当维护,这些电极可反复更新和重复使用。需要注意的是,该方法制得的电极具有微米级的活性感应区,但电极尖端的直径受限于所用玻璃毛细管/针头的尺寸。此外,这些耐用电极已被发现可用于凝胶样品的测量,该应用作为体内测试的初步研究。























 1万+
1万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








