引 言
基于国家的政策法规向创新药的倾斜,国家带量采购、仿制药一致性评价、医保控费等医改政策高压下,仿制药的利润逐年下降,改良型新药在国内的受热程度逐年上升,开发具有独特的品种成为企业发展的主要方向, 由于全新药物开发时间长、风险大、成本高,一般企业承受不起,故将苗头对向改良型新药。
2019年1月至2020年8月,FDA批准了38个新剂型药物(type3-new dosage,见下表),我们对38个品种审评报告进行了梳理,翻译整理出FDA审评员的审评观点,以期能够梳理出产品立项目的、临床前安全性评价、临床药理学评价、有效性和安全性评价的实验项目和要求。
我们将逐一整理38个品种的审评报告(未公开审评报告数据除外),欢迎各位同仁留言指导。

图 /秋水仙碱口服溶液(0.6mg/500ml)(申请号:210942)
01
概述
2018年3月30日,申请人(AVION PHARMS)提交了秋水仙碱口服液用于预防成人痛风发作的注册申请。本次申请中,申请人引据Col-probenecid复方制剂的有效性和安全性数据,以及文献报道的秋水仙碱有效性和安全性数据。申请人提交了3项临床药理试验:一项相对生物利用度及食物影响试验,以Col-probenecid复方制剂作为参比制剂(ANDA084279);两项以支持与其他药物合用时进行剂量优化的药物相互影响PK试验。审评员认为注册路径以及提交的临床药理学数据是合理的。
申请人没有开展秋水仙碱口服液有效性和安全性临床研究,产品研发基于BE试验(Col-probenecid复方制剂作为参比制剂,ANDA084279)。文献报道的两项随机、安慰剂对照双盲临床试验作为主要证据,证明秋水仙碱可以显著降低成年慢性痛风患者痛风发作次数。五项文献报道的开放或回顾性研究进一步提供了主要证据。每项试验均纳入慢性痛风患者,代表了目标适应症人群。总之现有大量充分证据能够秋水仙碱的有效性和安全性。
本次申请中,申请人提交了一项关键临床药理学研究(Study-RMG-COL-PK001),证明秋水仙碱口服溶液与参比制剂具有生物等效性,BE等效性评价AUC、Cmax指标均落在80.00~125.00%范围内。Study-RMG-COL-PK001采用项单次、随机、三臂交叉空腹试验设计,纳入34名男女健康受试者(年龄为18~55岁),剂量校正后PK参数AUC0-∞、AUC0-t、Cma几何均值比分别为x 100.5%(90%CI=93.9,107.6),101.2(90%CI=94.1,109.0)、98.5(90%CI=88.5,109.6)。食物对秋水仙碱口服溶液AUC没有影响,进食高脂、高热量餐后Cmax略有下降(约为19%)。
申请人开展了两项药物相互作用试验-一项考察与弱、中强度、高强度CYP3A4酶抑制剂(氨氯地平、环丙沙星、泊沙康唑)的药物相互作用,另外一项与p-gp抑制剂(卡维地洛)的药物相互作用。试验结果显示与氨氯地平、环丙沙星、卡维地洛有有显著相互作用,与合用泊沙康唑后秋水仙碱的AUC和Cmax分别增加2.3倍、3.1倍,说明秋水仙碱与泊沙康唑有显著相互作用,具有临床意义,。几项文献病例报告显示当秋水仙碱与强效p-gp以及CYP3A4酶抑制剂(克拉霉素、酮康唑)、中强度CYP3A4酶抑制剂(如环丙沙星)、强效P-gp抑制剂(如环孢霉素)合用时,会出现秋水仙碱毒性。申请人开展的药物相互作用试验结果为具体药物,并不能外推到其他药物。根据文献病例报告数据,应在说明书中常规性地提醒医护人员应注意合并用药,推荐进行剂量调整,并密切关注秋水仙碱毒性。
02
受益-风险评估
维度 | 证据和不确定性 | 结论与理由 |
疾病 分析 | 痛风是一种炎症性关节炎,由于尿酸结晶沉积在滑膜液和组织中所致;痛风最初可引起急性、受累关节肿痛,但可发展为慢性关节炎; 美国大约6百万痛风患者 | 痛风是一种严重的炎性关节炎受损,严重影响患者生活质量。 |
目前治疗选择 | 目前批准的预防痛风发作的药物包括秋水仙碱(片剂或胶囊),秋水仙碱-丙磺舒复方制剂NSAIDs和激素类药物可以用于急性和慢性关节炎 | 秋水仙碱为患者提供了新的治疗方案 |
受益 | 据文献报道,秋水仙碱相对于安慰剂可以降低慢性痛风患者痛风发作次数 关键相对生物利用度研究显示秋水仙碱口服溶液与参比制剂具有生物等效性 | 秋水仙碱口服溶液的临床益处基于已经确认的秋水仙碱/丙磺舒有效性(NDA012383)、已经发表的文献、以及与参比制剂的生物等效性。 |
风险和风险管理 | 治疗剂量、肝肾功能不全调整剂量后一般是耐受的; 使用秋水仙碱的风险包括胃肠道毒性、骨髓移植和神经肌肉毒性 申请人开展的临床没有新的安全性问题 秋水仙碱与泊沙康唑相互作用具有临床意义,Cmax和AUC分别增加2.3倍和3.1倍。 | 秋水仙碱的安全性已经充分确认; 申请人开展的研究没有新的安全性问题; 说明中将会注明与CYP3A4或P-gp抑制剂或CYP3A4和P-gp具有相互作用 |
03
研究项目
3.1临床微生物学:
不适用
3.2设备及相关问题:
不适用
3.3非临床安全性评价:
没有开展新的安全性评价试验,引用ANDA084279非临床研究数据。
3.4临床药理学
3.4.1研究项目汇总
研究 | N | 试验设计 | 主要结果 |
RMG-COL-PK001 | 34 | 在健康受试者中开展的随机、开放、3臂生利用度试验研究,比较秋水仙碱口服溶液0.6mg相对于秋水仙碱&丙磺舒片(0.5mg/500mg)在空腹或餐后的生物等效性研究 | 具有等效性 高脂、高热量餐可影响Cmax |
RMG-COL-PK002 | 24 | 一项在健康成年受试者开展的开放、两周期序列研究,评价磷酸卡维地洛缓释胶囊对秋水仙碱口服液单次PK的影响 | 与卡维地洛无显著相互作用 |
RMG-COL-PK003 | 24 | 一项在健康成年受试者开展的开放、两周期序列研究,分别评价泊沙康唑肠溶片、盐酸环丙沙星片、苯磺酸氨氯地平片对秋水仙碱口服液单次PK的影响 开放、两周期序列研究在健康成年受试者中对秋水仙碱口服液单次PK的影响 | 与环丙沙星、氨氯地平无显著相互作用,与泊沙康唑有相互作用 |
3.4.2试验结果
3.4.2.1 RMG-COL-PK001
在健康受试者中开展的随机、开放、3臂生利用度试验研究,比较秋水仙碱口服溶液0.6mg相对于秋水仙碱&丙磺舒片(0.5mg/500mg)在空腹或餐后的生物等效性研究
流程图:

图1 RMG-COL-PK001试验流程图
试验结果:
结果显示:经剂量校正后,空腹条件下秋水仙碱口服溶液与参比制剂(秋水仙碱/丙磺舒)具有生物等效性(表2)。高脂、高热量餐可以影响Cmax相对于空腹降低约19%,餐后Cmax秋水仙碱口服液和参比制剂不等效。
表1空腹试验秋水仙碱口服溶液与参比制剂(秋水仙碱/丙磺舒)生物等效性试验评价结果

表2餐后秋水仙碱口服溶液与参比制剂(秋水仙碱/丙磺舒)生物等效性试验评价结果


图2 空腹试验秋水仙碱口服溶液与参比制剂(秋水仙碱/丙磺舒)生物等效性试验药时曲线对比
3.4.2.2 RMG-COL-PK002
题目:一项在健康成年受试者开展的开放、两周期序列研究,评价在健康成年受试者中磷酸卡维地洛缓释胶囊对秋水仙碱口服液单次PK的影响。
流程图:筛选→第一周期:秋水仙碱口服液→清洗期→第二周期:卡维地洛缓释胶囊滴定用药2天,第二天同时服用秋水仙碱口服溶液(备注:均在清单餐饮后30min进服药物)
结果:卡维地洛不影响秋水仙碱的药代动力学

图3卡维地洛缓释胶囊对秋水仙碱口服液PK参数的影响
3.4.2.2 RMG-COL-PK003
题目:一项在健康成年受试者开展的开放、两周期序列研究,分别评价泊沙康唑肠溶片、盐酸环丙沙星片、苯磺酸氨氯地平片对秋水仙碱口服液单次PK的影响。
流程图:
表3 RMG-COL-PK003试验流程图


结果:与环丙沙星、氨氯地平无显著相互作用,与泊沙康唑有相互作用

图3环丙沙星片、苯磺酸氨氯地平片、泊沙康唑缓释片对秋水仙碱口服液PK参数的影响
3.5有效性和安全性试验
申请人未开展有效性和安全性试验,引用文献数据。
审评员观点:使用文献报道的临床试验数据作为主要注册申请依据有其不足。例如试验设计中纳入受试者可能不是目标作用人群,因为安全问题原始数据和病例报告不能获得,如果坐着没有提到脱落情况则无法计算脱落率,不能进行进一步的统计分析。总之本申请使用的两项随机对照临床研究设计合理规范,能够很好解释秋水仙碱用于预防成年慢性痛风患者痛风发作的有效性和安全性。其他开放和回顾性试验进一步支持了秋水仙碱有效性和安全性。
04
作者总结
急性痛风是一种常见且复杂的关节炎,是尿酸产生过多或尿酸排泄不良导致的。在夜晚,急性痛风患者的关节部位经常会突然性地出现严重的疼痛、水肿、红肿等症状。急性痛风最常见的发病部位是在大脚趾。
在美国,大约有870万人受急性痛风的影响,秋水仙碱是治疗急性痛风的常用药,目前美国秋水仙碱的市场约为8亿美元。秋水仙碱可以抑制发炎部位的白细胞聚集,使白细胞吞噬尿酸的作用减弱,减轻急性痛风的反应,达到迅速止痛的目的。
但是,秋水仙碱会对内脏产生副作用,使用秋水仙碱治疗急性痛风的医生经常需要调整剂量或中断患者治疗,以解决药物与其他治疗(例如肾透析)的相互作用。怎样调整秋水仙碱的剂量,来满足肾脏和肝脏有损伤的痛风患者的需求是一个亟需解决的难题。ROMEG Therapeutics解决了这一难题,与市场上现有的秋水仙碱胶囊相比,该公司开发的GLOPERBA口服液可以让医生轻松调节患者的剂量。另外,美国大约有15%的老年患者吞咽困难,无法吞服固体药丸,GLOPERBA口服液可以让他们轻松服药。
开发新剂型一般均需要进行验证性临床研究,甚至探索性临床研究及验证临床研究。秋水仙碱口服溶液凭借生物等效性和文献报道的有效性和安全性数据获得审批,对申请人来说这应该是好的结果。
通过审评报告我们可知,引用文献报道的临床数据用于注册申请时,应考虑纳入标准是否符合申报的适应症,是否能够提供原始数据和病例报告,是否详细记录不良反应,能否提供数据供审评员进一步的统计分析。
对于如下两个问题,还希望大家能够留言指导:
1. 参比制剂选择:据审评报告所述,本品种没有开展临床有效性和安全性试验,而是基于秋水仙碱/丙磺舒复方制剂的有效性和安全性数据(ANDA084279)及文献报道的秋水仙碱临床数据,所以BE试验选择秋水仙碱/丙磺舒复方制剂做为参比制剂。秋水仙碱0.6mg片剂已经在美国上市,选择秋水仙碱/丙磺舒复方制剂为参比制剂是否合适呢?
2. 餐后Cmax并不等效,是因为Cmax差异无临床意义吗?如何评价Cmax有无临床意义?
今天品种分享就到这里了,欢迎大家继续关注我们下一个分享品种。品种名称暂时保密。
声 明
如需转载,请在留言区留言,转载时请注明出处。
关于我们
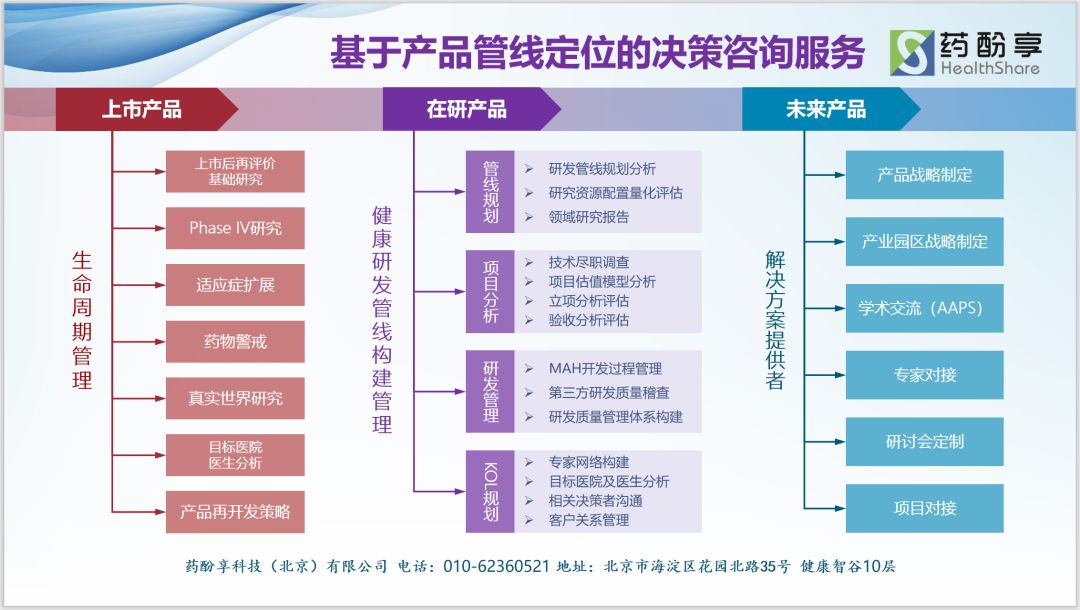
药酚享的工作内容
药酚享超越了传统的“报告-交付”的咨询模式,通过“跟进式”的研究、研讨与分析,提供覆盖整个医药项目生命周期的专业化服务,与客户建立长期的”伴随式“成长关系。
我们为研发及生产企业提供:既往产品战略分析、重点领域研发管线规划、在研项目量化评估、项目监理管理、产品生命周期管理、KOL大数据分析管理、研发质量管理体系构建服务;
我们为流通医药企业提供:基于产品的战略转型规划、基于项目的研发管线设计、基于MAH的项目监理管理服务;
我们为创新医药企业与投资者提供:创新项目推介、项目尽职调查、NPV模型构建等服务。























 2450
2450

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








