血管在协调大脑内的神经元细胞网络的正常发育中发挥重要作用,血管与脑内其他细胞存在信号交流。
2018年8月24日国际著名期刊Science在线发表题为“Endothelial Dab1 signaling orchestrates neuro-glia-vessel communication in the central nervous system”的文章。文章采用了多种血管分析方法,值得我们学习。
1. 血管网络分析
Fig 1F,G,Isolectin B4(IB4)染色的视网膜血管网络分析,统计指标为血管的径向长度(vessel radial length)。

补充材料中分析了血管密度(Vessel density):

血管网络分析作者采用2011年PLOS ONE上发表的血管分析工具AngioTool(doi: 10.1371/journal.pone.0027385)。
文章自发表以来得到了Cell,Science,Nature等国际知名期刊的广泛引用,下图是AngioTool工具的引用情况:

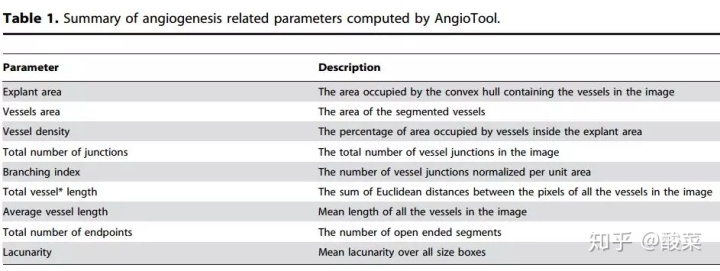
AngioTool界面友好使用简单,可以获得很多数据,可获得数据如下:

值得注意的是,Vessel percentage area是血管阳性的面积和发现血管总面积的比例也就是Vessel density。下面是各个指标的具体意义:
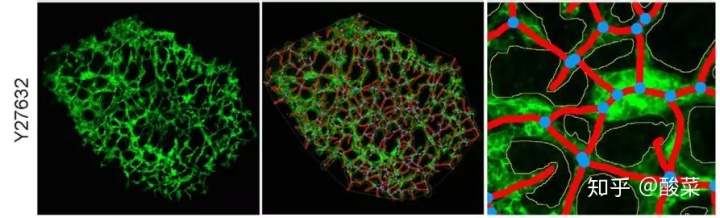
AngioTool分析效果:
AngioTool下载地址:https://ccrod.cancer.gov/confluence/display/ROB2/Home

官网不仅提供了软件还提供了示例图片供下载:

那么如何像Science使用AngioTool分析血管网络呢?官网人性化的提供了详细的使用教程:https://ccrod.cancer.gov/confluence/display/ROB2/Quick+Guide,供大家自行学习。

2. 神经血管单元完整性的评价
神经血管单元有神经元-胶质细胞-血管构成,包括神经元、星形胶质细胞、小胶质细胞、血管内皮细胞、血管周细胞、基底膜以及细胞外基质。Fig6 D,E,Alexa Fluor 555 cadaverine(Cad-A555)全脑荧光评价神经血管单元完整性。

Cadaverine分子量小,脂溶性高,通常用来评价血脑屏障的破坏,作者使用Alexa Fluor 555荧光标记的Cadaverine。深度麻醉小鼠后,50μl Cad-A555(1 mg/ml)眼窝静脉窦后注射。Cad-A555在成年小鼠需要经过20分钟循环,新生小鼠需要2小时。充分循环后进行4%多聚甲醛灌注,取脑组织后固定3小时,显微镜全脑成像。
3. 使用ImageJ分析视网膜血管丝状伪足
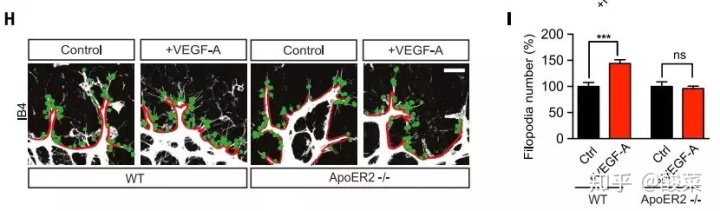
在Fig2 H,I中作者使用IB4标记视网膜血管,分析血管向外生长出丝状伪足(Filopodia)的数量。
打开ImageJ软件,File,Open打开待分析图片:
点击 point工具,右击,选择Multi-Point工具 ,手动点击进行计数:
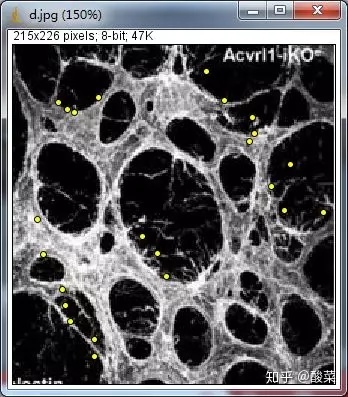
点击Analyze,Measure,可以看见此时计数数量为23个,保存图片即可。
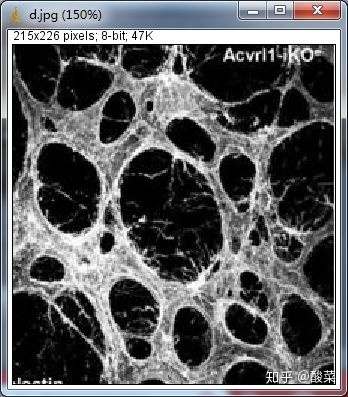
4. 使用ImageJ分析小管形成实验图片
小管形成实验是测量在体外血管生成一种快速的,可量化的方法。内皮细胞结合条件培养基并接种于基底上,易形成三维网状结构,之后通过ImageJ软件对小管结果进行定量分析。
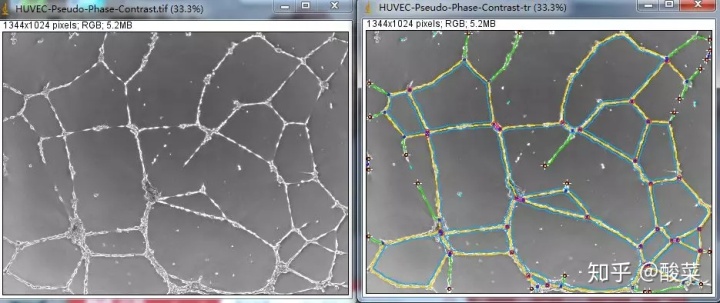
作者在补充材料中使用小管形成实验分析了成管的长度(Tube length)和分支点的数量(Branch point)。

打开ImageJ软件,File,Open打开待分析图片:

点击Angiogenesis Analyze插件,界面如下:

点击

,右键选择对应的图片类型为:Analyze HUVEC phase contrast,等待程序自动分析。
图片分析结果如下:
数据如下图所示:

得到数据包括总长度分支点等。
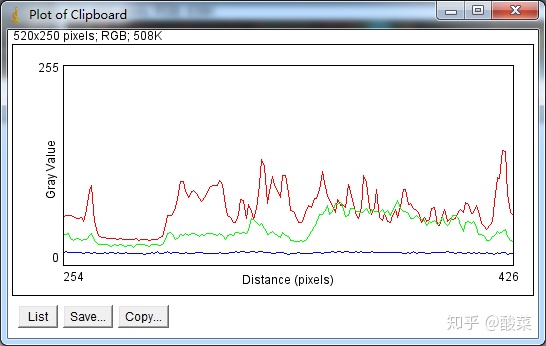
5. 使用Plot profile显示Aqp4与血管分布位置关系
Fig7 F中作者使用ImageJ工具Plot profile表示水通道蛋白4(Aqp4)与血管分布的位置关系:
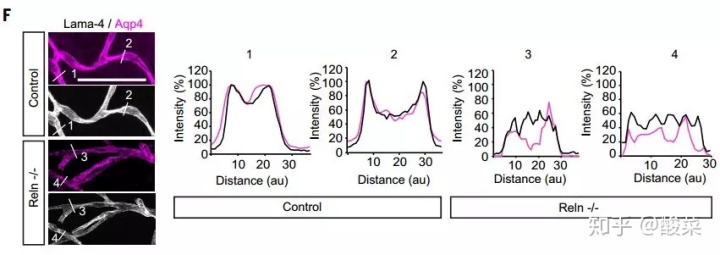
不同荧光在同一空间分布,例如两个蛋白都定位在核内或胞浆,可以通过Plot Profile工具得到的随着划线distance的荧光的灰度值来实现。
首先打开RGB格式图形,使用

划线(划线为黄色位置),如下图:
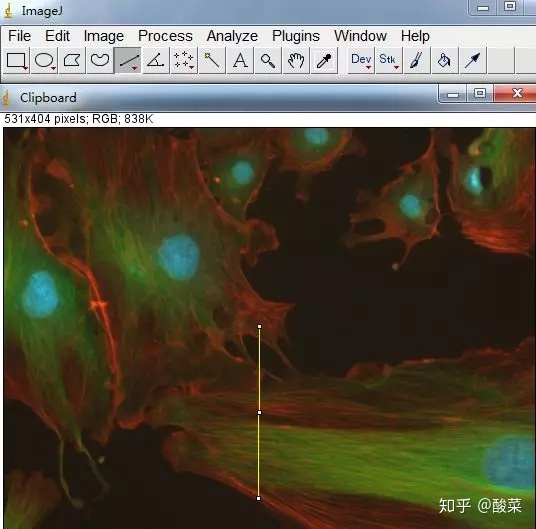
点击Analyze,Tools,Color profile,得到如下结果,List导出数据即可。

本文首发于“解螺旋精选”微信公众号
转载请注明:解螺旋·临床医生科研成长平台







 本文介绍了如何使用ImageJ分析血管网络、评价神经血管单元完整性,并详细展示了血管丝状伪足、小管形成实验的分析步骤。同时,讲解了如何使用Plot profile分析Aqp4与血管分布的关系,以及ImageJ中撤销上一步的操作。
本文介绍了如何使用ImageJ分析血管网络、评价神经血管单元完整性,并详细展示了血管丝状伪足、小管形成实验的分析步骤。同时,讲解了如何使用Plot profile分析Aqp4与血管分布的关系,以及ImageJ中撤销上一步的操作。
















 1万+
1万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








