麻醉是临床前脑卒中研究的一个主要混杂因素,因为镇静患者很少发生脑卒中。此外,麻醉作为神经毒性或保护剂影响脑功能和脑卒中结局。到目前为止,还没有一种方法适合在对清醒动物进行血流动力学成像同时大规模记录脑功能的同时诱导中风。由于这个原因,人们对中风后的头几个小时以及相关的功能改变仍然知之甚少。在这里,我们提出了一种策略来研究卒中血流动力学和卒中诱导的功能改变,而不需要麻醉的混淆效应,即在清醒状态下。功能超声(fUS)成像用于连续监测脑卒中发作后3小时内65个脑区/半球的脑血容量(CBV)变化。在清醒的大鼠中,使用一种适合永久性大脑中动脉闭塞的化学血栓形成剂诱导局灶性皮质缺血。早期(0-3小时)和延迟(第5天)的fUS记录能够表征缺血的特征,扩张性去极化和体感觉丘脑皮质回路的功能改变。脑卒中后丘脑皮质功能在脑卒中后早期和后期时间点(0-3小时和5天)均受到影响。总的来说,我们的方法有助于对血流动力学和脑功能进行早期、持续和慢性评估。当与中风研究或其他病理分析相结合时,这种方法旨在增强我们对生理病理学的理解,从而开发相关的治疗干预措施。
1. 引言
中风是一种多方面、多相的病理,在实验条件下很难模拟。事实上,与临床相比,临床前中风模型存在几个限制将实验焦点缩小到几个条件。在这些限制中,人们可以强调将在有意识的动物模型中成像中风,解决中风后脑功能,以记录超急性中风血流动力学相结合的复杂性,这些对于设计及时有效的治疗策略至关重要。
第一个限制是,在临床前研究中使用麻醉似乎阻碍了从动物到患者的过渡,因为大多数中风发生在清醒或睡眠的患者中,但很少发生在镇静的患者身上。此外,麻醉剂会破坏大脑功能,改变神经血管耦合,同时通过充当神经毒性或神经保护剂,对代谢、电生理、温度、血压和组织结果产生不同的影响。
迄今为止,只有少数几组成功地诱导醒着的啮齿动物中风。此外,中风后网络和功能改变已经被少数临床前研究解决,提供了从分钟开始的功能网络重组的证据。然而,这些研究大多集中在皮质读数上,无法捕捉到脑深部区域,如丘脑继电器,如何在功能和/或时间上受到中风侮辱的远程影响。
直到最近,对超急性卒中引起的血流动力学的实时监测仅限于几种方法,但通常集中在脑表面。另一方面,最近一种测量脑血容量变化(CBV)的神经成像方式fUS 成功用于测量清醒啮齿动物的脑功能,以解决中风后早期功能重组,并在全脑范围内追踪中风引起的血流动力学。然而, 目前还没有研究进一步利用这种策略来结合中风血流动力学和清醒啮齿动物的全脑功能改变。
在本研究中,我们报道了清醒大鼠的脑卒中诱导和躯体感觉功能的改变。利用对清醒啮齿动物成像的最新改进联合直接应用于大脑中动脉(MCA)的化学血栓形成剂,我们能够在清醒大鼠中诱导MCA闭塞(MCAo),同时捕获中风发作后长达3小时内+65个脑区持续的血流动力学变化,包括缺血和扩散性去极化。最后。我们研究了体感丘脑皮质功能反应如何从早期(0-3小时)到中风后晚期(5d)时间点逐渐改变。

图1 实验程序
2. 结果
2.1 动物
关于动物使用、实验和排除标准的报告见补充文件1。大鼠1号在对照实验结束后被排除,因为成像窗口太前,无法同时捕捉到皮层和丘脑的反应。大鼠2号被排除,因为在基线(中风前)期间血流动力学反应不一致。大鼠#9出现早期卒中后再灌注,被排除在卒中分析之外,对大鼠#9的对照期(卒中前)进行分析。所有成像会议大约在上午8点开始,与他们的活动阶段结束密切一致。
2.2 清醒大鼠脑卒中诱导的实时成像
我们首先开发了一种专门的程序,用于在清醒头部固定的大鼠中进行脑卒中诱导和相关诱发功能缺陷的实时成像(图1A)。每只大鼠接受两个颅窗,分别进入左MCA远端分支(图1B,左)和选定的脑区进行成像(图1B,右)。后者在bregma-2和4mm之间进行,允许联合监测体感觉须-桶通路的双侧丘脑皮质回路,包括丘脑腹后内侧核(VPM)和初级体感觉桶-野皮层(S1BF)。此外,所选的冠状横断面包括丘脑后核(Po)、丘脑网状核和以传递与须相关信息而闻名的纹状带腹侧部分,并将S1BF的传出投射直接传递到其他皮层和皮层下区域。在成像之前,大鼠接受了广泛的训练,以便在实验装置中接受舒适的约束(图1C),适合在清醒状态下记录脑功能和脑卒中诱导的fUS。数据采集后,在定制开发的数字大鼠图谱上记录和分割冠状截面,以提供由中风或诱发活动引起的灌注变化的动态视图。
为了克服传统卒中模型的局限性,我们通过化学血栓形成氯化铁溶液(FeCl)阻断MCA远端分支,同时对清醒大鼠进行fUS成像(图2A)。应该提到的是,在抑制期和闭塞过程中,大鼠没有表现出任何明显的疼痛或不适迹象(例如发声、攻击性)。fUS实时捕获MCA闭塞(MCAo),并通过大信号下降证实,即局部缺血,位于左半球皮层(图2B和C),如中风发作后3小时和5d的uDoppler图像所示图2B)。中风引起的血流动力学变化在中风发作后连续记录了长达3小时,记录并分割为69个区域。我们首先提取了左半球S1BF皮层,并检测到MCA闭塞后rCBV突然下降至基线水平的40%。随后,中风发作后3小时rCBV逐渐下降至基线水平的30%(图2C)。其次,我们提取了MCAo后大脑前动脉直接供应的皮质区域的平均rCBV变化。图2B中的紫色和黑色区域表示信号的连续和瞬态增加。它表征了与左半球扩张性去极化(SDs)相关的血流动力学事件(图2D),同时导致右半球出现轻微且稳定的低血症。在所有MCAo大鼠的缺血周围区域观察到SD事件,并且表面上是随机发生的(图2E)。然而,与SDs相关的血流动力学事件在动物中显示出相似的钟形和时间过程(图2F)。

图2 清醒条件下氯化铁(FeCl)-脑卒中诱导
2.3 中风引起的丘脑皮质功能的改变
阻断中脑区前1小时和阻断后3小时内,大鼠接受电动梳子对须交替传递到左右垫的机械刺激(图3A)捕捉功能电路的时空动态。在中风前,感觉诱发的刺激对两者都引发了稳健且具有统计学意义的功能反应。对侧半球体感觉诱发反应的时间分析证实,VPM、Po和S1BF区在左刺激和右刺激下均被显著激活(图3C)。我们还检测到S2、AuD、Ect (p<0.0001)和PRh (p<0.001)皮质和VPL核的活性显著增加,接收S1BF直接传入投射的脑区,VPM或Po核。值得注意的是,在中风前阶段,在皮层和皮层下区域没有观察到由于胡须刺激的重复性而导致的习惯化或敏化。
中风后,左垫刺激的活动图引发了与中风前相似的反应模式。然而,右脑垫刺激显示S1BF皮层完全没有功能性反应,VPM的反应显著降低(图3B)。在中风发作后的3小时内,在对侧(右)半球的皮层和丘脑区域仍然检测到左须刺激的功能性反应。然而,右须刺激的功能反应仅在皮层下核中检测到,而与中风前和另一个半球的反应相比,这些反应减弱了(图3B和C)。此外,在皮质水平(图3B和C)。
为了更好地评估中风对功能反应的影响,我们将中风后的记录时间分为三个部分,每个部分1小时,并将其与中风前的1小时进行比较(图3D)。脑卒中前的时间图显示,S1BF、VPM和Po区域在刺激期间信号显著增加,且左右刺激之间高度一致(黑色图,图3D),很好地拟合了之前观察到的血流动力学响应函数。事实上,血液动力学反应的特征是,须刺激时信号快速增加,在4.0秒后达到峰值,S1BF为18.2±1.3%(4.0秒,18.6±1.2%)基线水平,VPM为4.6±0.5%,Po为2.9±0.7%。
在中风发作后的第一个小时内,左半球的功能反应在S1BF、S2和AuD中消失,在VPM中显著下降,而在Po和VPL(图3D)与脑卒中前反应相比。对于右半球,S1BF和VPM的功能反应在中风发作后1小时内保持不变。在接下来的2小时内,S1BF信号变化显示出明显的渐进性活动下降。
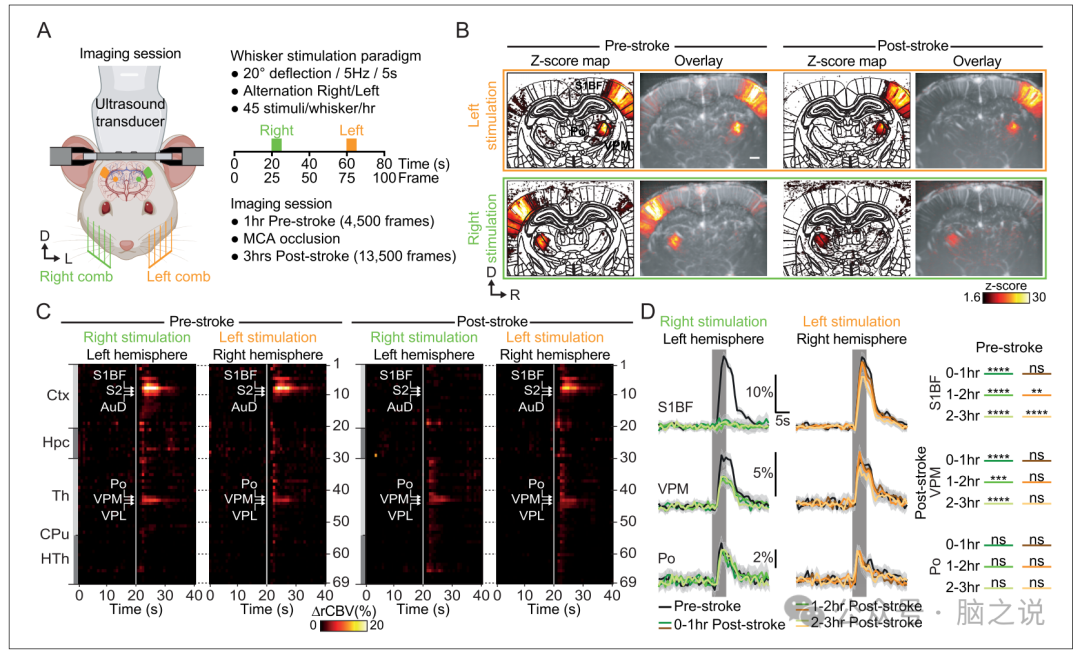
图3 中风后早期须状到桶状丘脑皮层回路的改变
2.4 体感觉丘脑皮质通路的延迟改变
这项工作的第二个目的是评估fUS在初始损伤后几天内识别潜在延迟功能改变的能力。两只动物在5天后,在与中风后早期相同的实验、刺激、成像和处理条件下进行成像。考虑到在这个时间点只有两只大鼠进行了成像,这里提出的研究结果应被视为初步或概念证明。额外的数据对于验证将是必不可少的。因此,没有对这部分研究进行统计分析。
在MCA闭塞5天后,我们首先将超声探头放置在成像窗口上并调整其位置(使用显微操作器),使用Bmode(形态学模式)和使用脑血管地标的uDoppler成像从卒中前会话找到记录平面(图2B)。左须刺激的功能反应仍然在右半球(即对侧),皮层和皮层下水平检测到(橙色;图4)。对于脑卒中后早期成像期,右须刺激的功能反应仅在皮层下核中检测到,而在皮层水平未检测到(绿色;图4)。
其次,我们提取并比较了在中风后5d收集的功能反应的时间图与在中风前和中风后3小时从同一两只动物获得的功能反应的时间图(图4B)。在这个较晚的时间点,左侧S1BF的功能反应(深绿色图,左面板,图4B)。与中风前(黑色图)相比,S2和AuD的功能反应仍然消失(黑色图),而与中风后3小时时间点(绿色图)相比,功能反应略有增加。在中风发作后5d的VPM中检测到的反应(深绿色图,左面板,图4B)不仅与中风前信号(黑色图)相比,而且与中风后3小时的痕迹(绿色图)相比,都大幅下降。有趣的是,血流动力学反应函数的振幅和峰值时间都与中风后早期信号(即中风后3小时)非常相似;然而,在中风后5d信号中,峰后时段在很大程度上受到了抑制。与中风前和中风后3小时的信号相比,从Po核提取的中风后5d信号也观察到类似的血流动力学反应函数变化(左面板,图4B)。VPL也有类似的观察结果)。
关于右半球(右图,图4B),与中风前的反应相比,左须刺激的S1BF功能反应仍然减少,但与中风后3小时检测到的痕迹保持一。对于左侧VPM,右侧VPM血流动力学反应的幅度和峰值时间与卒中前和卒中后3小时的值一致,但峰后信号减弱。与脑卒中前和脑卒中后3小时的反应相比,从Po和VPL提取的功能反应没有变化。
3. 讨论
通过这项概念验证研究,我们记录了有意识大鼠MCAo后局灶性脑缺血的连续脑血流动力学记录的可行性。利用功能性超声成像,我们能够提取出这种皮质性卒中的多个特征参数。然后,我们报告了功能性感觉运动丘脑皮质回路在卒中后早期和晚期是如何改变的。与高度侵入性的常规策略(如剪断或缝合)相比,这里使用的FeCl模型非常适合研究清醒状态下的中风。事实上,使用FeCls需要较少的操作,可以保持硬脑膜的完整,并大大降低出血的风险和动物损失。此外,FeCl模型密切模仿人类中风的关键特征,包括局灶性缺血、血栓形成、血管持续数分钟的进行性闭塞、血管再通的可能性和半阴影组织。然而,为了充分有效地闭塞感兴趣的血管,在慢性条件下,有必要打开颅骨并稳定颅窗。值得注意的是,MCA窗口的最佳制备是非常关键的,因为FeCls的应用是在缩小的视场下进行的。事实上,正如动物使用报告中提到的,有一只大鼠由于自发性MCA再灌注而被排除在分析之外,从而降低了成功率。
除了跟踪大的血流动力学变化之外,fUS成像技术的一个优点依赖于其跟踪稀疏脑区细微血流动力学变化的能力。因此,我们评估了诱发功能反应在卒中诱导后的早期和晚期时间点是如何重组的。在将信息从须传递到皮层的几个区域,包括丘脑的VPM和Po核,以及体感桶区皮层的S1BF,检测到机械须刺激的功能反应。在参与信息多感觉整合的S2皮层也观察到反应,当听觉皮层接收S1BF的直接传出投射时,而丘脑的VPL核通过皮质丘脑投影连接。
在局部缺血影响下提取的左半球功能反应显示,在中风发作后的第一个小时内,须-脑桶通路发生了原发性改变。虽然S1BF反应的突然丧失主要是由局灶性缺血引起的,但VPM反应的立即但部分下降可能是由于皮质丘脑对VPM的兴奋性反馈的直接丧失,甚至来自丘脑皮质兴奋性的抑制。这种皮质反馈的缺失表明,抑制的功能反应可能是由VPM对须刺激的内在活动所驱动的。初始损伤后5天,丘脑核(VPM和Po)遭受延迟和强大的功能改变(图4B),正如先前在其他丘脑接力中证实的那样,可能与淤裂有关,之前的特征是组织染色,代谢,功能和灌注减少。从右半球(即对侧)提取的S1BF的功能反应在中风发作后不久显着下降(图3D),并且在第5天仍然检测到,可能是由皮质兴奋性丧失引起的。VPM反应的后期下降可能是由皮质丘脑调节对VPM的预测来解释的。
除了研究从须到桶的体感回路之外,fus的全脑能力为研究中风影响的大脑回路和功能打开了大门,使用转基因系结合光/化学遗传策略,因为这项技术在小鼠研究中已经完全成熟。
4. 材料
4.1 动物
实验程序由鲁汶天主教大学动物护理委员会根据国家实验动物使用指南和欧盟动物实验指令批准。成年雄性Sprague-Dawley大鼠体重在250-400 g之间。在习惯化期间,每个笼子养两只大鼠,在23℃的暗/光循环中饲养12小时,自由饮水,并控制食物的获取(15克/只/天)。初始手术后,将大鼠单独饲养。
4.2 身体约束和头部固定
将大鼠习惯在工作台上,并穿上吊带服,在一到两周内逐步增加约束时间,从几分钟(5分钟、10分钟、30分钟)增加到几小时(1和3小时)。对头固定的适应始于手指间头柱的短时间(5-30秒)和温和的头固定。然后将头柱固定在夹子之间,固定时间逐渐增加,与使用吊带相同。对于身体约束和头部固定,最初的挣扎和发声随着疗程的增加而减少。如前所述,当大鼠在长时间的约束期内保持静止和平静时,习惯化就完成了。在所有身体约束和头固定的习惯过程中提供水和食物凝胶。适应后,按照如下所述进行颅窗成像(图1A-C)。
4.3 外科手术
MCA颅窗:用异氟醚麻醉大鼠,固定在立体定位框架内。通过捏爪时没有反射来证实麻醉的深度。硅胶塞用于在闭塞手术前保护窗口并方便进入MCA。然后,使用骨螺钉和牙水泥将定制设计的不锈钢头柱固定在动物头骨上(图1B,左)。
颅窗成像:在恢复和适应头固定后,在距矢状缝2 -4 mm和6 mm之间进行第二次颅窗。这个颅窗旨在覆盖体感须到桶通路的双侧丘脑皮层回路。还使用了硅胶塞来保护窗口,并添加了头罩来保护它。
4.4 位置
头柱的机械固定确保了超声探头在成像过程中的简单和可重复定位。超声波探头确实固定在一个微操纵器上,可以进行光线调节。为了找到感兴趣的平面,我们使用了大脑地标(例如大脑表面、海马、上矢状窦、大血管)。请注意,由于头槌被小心地放置在相对于颅骨地标(bregma和lambda)的相同位置,因此在动物中感兴趣区域的位置最小。
4.5 氯化铁溶液诱导化学血栓性脑卒中
一旦身体被束缚并头部固定,覆盖MCA窗口的硅胶塞被移除,允许应用20%氯化铁溶液到MCA。一旦使用uDoppler图像的实时显示视觉检测到缺血,用生理盐水冲洗溶液以停止反应。
4.6 须刺激模式
两个刺激梳分别由步进电机控制,用于向左右须垫提供5 s的机械5 Hz正弦振幅-20°偏转。对于每个须垫,试验间隔为1分钟和20秒,不进行刺激。因此,传递到同一须垫的两次刺激之间的有效延迟从开始到开始为80秒。在整个成像过程中,刺激块连续传递,与fUS采集时间锁定(图3),以便随后分析fUS时间序列内的血流动力学反应。
4.7 功能超声成像
采集冠状多普勒图像的获取使用15 mhz线性探头,该探头由128个压电元件组成,间隔100 um 连接到专用超声扫描仪,并由高性能计算工作站控制。这种配置使我们能够以100 μ m的横向分辨率、110 μ m的深度分辨率和300 μ m的高度分辨率对脑血管系统进行成像。该软件生成的超声序列改编自mac等人,2018年和Brunner等人,2021年,使用五个倾斜平面波生成大脑的超快图像。每个平面波重复6次,对记录的回波进行平均,以提高信噪比。将五幅平面波图像以500 Hz的帧率添加到复合图像中。为了获得单张血管图像,我们在0.5秒内获得了一组250张复合图像,这是额外的每张图像之间包含0.3 s的暂停,以便有一些处理时间来显示图像,以便对实验进行实时监控。这组250张复合图像混合了血液和组织信号的信息。为了提取血液信号,我们应用一个低通滤波器(切断15 Hz)和一个SVD滤波器,消除20个奇异值。该滤波器旨在选择轴向速度高于-1 mm/s的血液运动的所有信号。为了获得血管图像,我们计算血液信号的强度,即功率多普勒图像。该图像近似与脑血容量成正比。总的来说,这个过程可以在几个小时内以1.25 Hz的帧率连续获取功率多普勒图像。然后,使用专用GPU架构对采集的图像进行处理,实时显示数据可视化,并存储以供后续离线分析。
4.8 组织病理学
阻断后24小时处死大鼠,对梗死组织进行组织学分析。大鼠接受戊巴比妥致死注射。使用蠕动泵,经心脏灌注磷酸盐缓冲盐水和4%多聚甲醛。收集脑并进行过夜后固定。在振动机上切片50 μ m厚的横跨MCA区域的冠状脑切片,并使用甲基紫染色程序进行分析。切片用DPX贴片介质贴片,用明场显微镜扫描。
参考文献:Functional ultrasound imaging of stroke in awake rats.























 1127
1127

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








