题目:Systematic Review of Synthetic Computed Tomography Generation Methodologies for Use in Magnetic Resonance Imaging-Only Radiation Therapy
杂志:International Journal of Radiation Oncology*Biology*Physics
论文地址:https://sci-hub.tw/10.1016/j.ijrobp.2017.08.043
Abstract
与计算机断层成像(Computed Tomography, CT)相比,磁共振成像(Magnetic Resonance Imaging, MRI)提供了优越的软组织对比度,CT常用于放射治疗计划(Radiation therapy treatment planning, RTP)和病人定位验证,从而提高目标清晰度。配准这两种模态用于RTP,然而这带来一种系统性的错误(什么错误?)。实现一个仅MRI的放射治疗工作流是有利的,因为这个错误将被消除,病人路径简化,病人剂量减少。和CT不同,MRI中的信号强度和电子密度之间没有直接关系。然而,已经报告了各种MRI-only的RTP方法。对这些方法进行了系统的审查。遵守PRISMA方针。对Embase和Medline数据库进行了搜索(1996-2017.3)以查找用于MRI放射治疗的合成CT扫描(sCT)的研究。61篇文章符合纳入标准。本综述表明,MRI-only的RTP技术可分为3类:(1)bulk density override; (2)atlas-based; (3)voxel-based techniques,这些技术都能从MRI图像生成sCT扫描。体积密度覆盖技术使用单一均匀或多个组织覆盖。在某些情况下,前者产生了较大的剂量学误差(>2%),后者经常需要人工骨轮廓线(??)。基于Atlas技术既使用了单一和多个地图集,并包括包含模式识别技术的方法。临床可接受的sCTs被报道,但不典型的解剖导致了一些错误的结果。
Introduction
在放射治疗领域,人们对将磁共振成像(MRI)整合到patient pathway(患者路径?治疗流程?)越来越感兴趣。MRI对靶器官和危急器官的勾画优于CT,这是由于传统上认为MRI具有更优越的软组织区分能力。这是特别重要的,因为RTP技术的使用越来越多,在这种技术下,高剂量区域可以在目标周围形成正形,在该区域以外的剂量急剧下降。
MR图像通过刚性或可形变配准与CT融合,用于RTP所需的剂量计算。然而这引入了配准的不确定性,对前列腺和头部患者误差估计在0.5-3.5mm之间(典型报告的1个标准差,??),误差贯穿整个治疗过程。单独使用MRI可消除这种错误,以及简化放射治疗工作流程和减少患者接受的伴随剂量,减少剂量对在放射治疗期间需要多次扫描的儿科患者特别有利(why?)。MRI-only放射治疗的目标时将CT扫描从工作流程中移除,取而代之的是只使用MR图像。由于MRI引导的治疗技术的发展,如MRI-linac,MRI-only计划越来越有吸引力。在这里,利用模态提供的解剖和功能信息,可以使用MRI进行在线自适应放射治疗。
单独使用MRI进行RTP时的一个挑战是,MRI信号强度与电子密度不是唯一相关的,就像CT的情况一样(CT电子密度不是唯一相关??)。相反,MRI信号主要取决于质子密度和组织弛豫特性。这意味着,如果没有某种形式的电子密度校正,MRI扫描不能直接用于RTP期间的剂量计算。此外,在常规的MRI序列中,骨皮质信号是缺失的。因此radiat,使用图像作为位置验证的参考,这是图像引导放射治疗(Image-guided radiation therapy, IGRT)必不可少的,是MRI-only放射治疗的另一个并发症(缺点??)。软组织匹配在一些中心是常用的,因此使用这种技术的IGRT也需要考虑MRI-only放射治疗工作流程。
已经开发了一些技术,试图引入MRI-only的放射治疗工作流程。这些方法从MR图像中生成一个synthetic CT(也称伪CT或替代CT),可用于RTP和IGRT的潜在定位验证。前列腺和头颈部的sCT图像见图1。
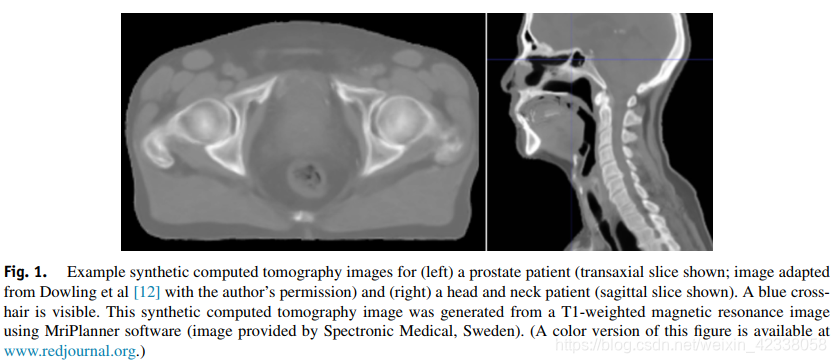
本文系统地回顾了文献中用于生成sCTs的方法,为了MRI-only RTP和用于MRI-only放射治疗流程中。这是放射治疗中一个越来月受关注的课题,因此对sCT方法的回顾是有必要的。最近发表的一篇review是由Edmund和Nyholm于2015年11月再Scopus数据库中搜索了MRI-only RTP和正电子发射断层成像(Positron emission tomography, PET)-MRI衰减校正的sCT生成方法。作者总结了sCTs的性能度量值,并讨论了与报告相关的问题。这篇文章带来了最新的搜索,本文通过对Medline和Embase数据库的系统检索,旨在提供不同的方法及其潜在的临床应用的总结。
在引入MRI-only放射治疗工作流程之前还有其他相关因素需要研究。这包括需要放射治疗的治疗位置(例如在MRI模拟器上)对患者进行扫描,以及需要在大视野(FOV)上对与MR图像相关的几何畸变进行校正和评估。虽然这些因素对于MRI-only的计划是必不可少的,但这些问题不在本审查的范围之内。
Methods
系统地回顾了使用PRISMA(review的一种方法)指导方针。从1996年到2017年3月,使用已定义的标准检索Embase和Medline数据库(附录1.1;可在www.redjournal.org查询)。文章包括有关MRI和放射治疗。此外,这些文章在标题或摘要中要么引用“MRI-only”、“sCTs”、“bulk density”,要么引用这些术语的同义词。
在数据库搜索之后,删除重复的文章,并筛选符合资格的记录。文章包括了有关用于MRI-only放射治疗流程的sCTs的生成。关注PET-MRI衰减校正方法的文章不包括在内。这些方法在MRI-only RTP使用类似的技术,报道了新的sCT生成方法产生高质量的结果。然而,系统地回顾这些文章超出了本综述的范围。搜索过程中发现的所有与PET-MRI相关的文章都进行了扫描,以确保不排除与MRI-only放射治疗流程中使用sCTs相关的信息。
本研究仅考虑了外部射束放射治疗,因此排除了近距离放射治疗(什么方法??)研究。近距离放射治疗,以及立体定向放射外科(SRS)治疗,可以使用MRI-only的放射治疗流程作为标准做法。这些假设整个体积是水等量的(Water Equivalent, WE)。与SRS技术细节和程序有关的文章被排除在外;然而,报道SRS患者的新型sCT生成的文章也被包括在内。文章讨论MRI在放射治疗中的应用,将MRI整合到放射治疗工作流程中,使用MRI进行癌症筛查,以及使用MRI对肿瘤进行分期和勾画的文章均未包括在内。MRI几何畸变评估、MRI-only放射治疗工作流程的质量保证(QA)、MRI扫描的基准标记评估和配准技术细节是实施MRI-only放射治疗工作流程的重要方面。然而,对这些技术进行系统综述超出了本综述的范围,因此与这些主题相关的文章被排除在外。会议程序没有得到审议。这些可以包含有效的方法;然而,大量的相关摘要在本综述中无法处理。
对保留的文章进行了引文搜索。每个包含的研究都被分配了一个方法论类别。对每个类别构建了一个数据表。这些表格提供了已发表的技术的总结,包括每个研究的关键发现和其他相关因素,如研究规模,解剖部位,以及适当的治疗技术。下面讨论每种方法的临床可行性。
Results
系统搜索过程的流程图可以见图2。数据库搜索产生了517条记录。重复删除后,留下393条记录。在这些文章中,有44篇符合纳入标准,从引文搜索中又找到了17篇文章。因此,本综述共收录61篇文章。
将文章排除在综述之外的原因见表1。文中给出了每种原因所排除的文章数量。


用于RTP的sCTs的生成可以分为3个主要的方法类别。这些技术包括bulk density assignments、atlas-based 技术和voxel-based技术,后者被细分为单独使用标准MRI序列的技术和使用超短回波时间(UTE)序列的技术。研究报告了使用一系列指标的结果;将讨论与这些可比性有关的问题。
值得注意的是,只有56项研究的结果被报道。这是因为其中5项研究,虽然与MRI-only放射治疗流程的sCT生成高度相关,但没有直接测试新的sCT方法。
Bulk density override techniques
从磁共振图像生成用于剂量计算的数据集的最简单方法是对整个患者体积应用容重覆盖,将其分配为WE电子密度。这已被用于脑部(15-19)以及前列腺和头颈研究(20-23)。
从表2可以看出,假设整个体积的密度均匀,与CT扫描的计划不均匀相比,可能导致超过2%的剂量差异。Korsholm等(32)认为2%的MRI剂量计算误差在临床上是可以接受的(假设CT计算剂量误差为1%)。此外,由于缺乏骨分割,该技术很难创建用于患者定位验证的参考图像。


另一种方法是将MR图像中的组织分成不同的类别,并为每一类分配一个电子密度或Hounsfield单位(HU)值。在大多数情况下包括2或3个分类:软组织和骨骼(在一些情况下有空气)。有报道称,与均匀密度覆盖相比,使用这些技术可获得更好的剂量测量结果,即前列腺、脑、头部和颈部部位(22、23、25、26、28-34)。虽然大多数研究在MRI上进行了结构分割,但其他研究(32,33)在MRI上绘制了骨轮廓,先进行CT扫描,然后将结构转移到MR图像上,再覆盖密度。在只使用mri的放射治疗工作流程中,这是不可能的。这些研究被包括在这篇综述中,然而,因为这些结果对于评估MRI-only计划的容积密度覆盖技术是有用的。图3总结了文献中应用的覆盖。

这些研究的剂量学结果表明,该技术有潜力应用于临床,当骨头被分割时,通常报告的剂量差异小于2%(表2)。然而,骨皮质在常规MR影像中的表现限制了其优势。骨皮质T2*弛豫时间很短(1),因此在常规MRI中表现为信号空洞。这使得很难区分骨头和空气,并导致许多研究诉诸于手工骨轮廓。这是费时且不实际的日常临床使用。此外,一些伪影,如与牙科植入物有关的伪影,会使头部的分割更加困难。
Stanescu等(26)尝试了一种半自动的头部骨分割方法。这里,一个点被放置在需要分割的结构附近。然后使用阈值法分割结构。作者指出,在某些情况下,术后需要手动调整,尤其是颅骨的下半部。Stanescu等人(29)使用基于atlas的分割方法分离骨头,然后应用容积密度覆盖。如有必要,再次使用手动调节。这些方法可能意味着体积密度技术在未来的临床工作流程中更有用,尽管人工调整轮廓并不可取。文献中关于最合适的骨密度分配存在争议(表2)。文献中关于最合适的骨密度分配存在争议(表2)。密度分配范围由1.19-2.10 g/cm3。Hoogcarspel等(35)指出,剂量误差的产生是由于分配单一骨密度,而不是将骨头分离成单个成分。
据报道,容及密度覆盖法有不同程度的剂量准确度。这可以部分解释为使用不同数量的组织分类,以及通过分配不同的骨密度值。(组织分类越多,越精确。骨密度分类越多,越精确)
虽然大多数研究没有说明用于剂量计算的规划算法,但较早的研究可能使用较简单的模型。因此,这些研究在准确模拟非均匀性区域,特别是低密度变化以及光子和电子散射方面可能存在更多的不确定性。在评估剂量学差异时应考虑到这一点。
通过分割骨骼和分配体积密度,可以创建病人定位的参考图像。使用核磁共振成像(MRI)生成的具有容重覆盖的数字重建x线照片(DRRs)与ct衍生的进行了比较,前列腺和脑科患者的DRRs (16, 19-21, 24, 27)。Doemer等(34)比较了前列腺患者的锥形束CT (CBCT)与mri之间的差异。前后方向移动0.15 - 0.25 cm位置差异最大。作者假设在这方面的分歧是最大的,因为在MRI扫描中肠道准备问题。
在下面的章节中,我们将讨论生成sCT的其他方法。一些研究将生成的sCTs的结果与容积密度技术的结果进行了比较。在这种情况下,容积密度结果在相关表格中列出
Atlas-based techniques
基于atlas的技术通常使用单一的标准MRI序列来产生一个sCT(12)。这确保了扫描时间保持在最低限度,减少了病人移动的机会(12)。这也意味着扫描协议是直接实施在临床环境。sCT生产的过程可以完全自动化,定位验证的参考图像可以生产,以及OARs的自动轮廓。Sjolund等人(36)指出,基于atlas的技术对于图像伪影是相对稳健的,因为它们依赖于之前的训练信息。
最简单的图谱技术使用单个或平均的图谱,例如,Dowling等人(37)开发的用于前列腺计划的图谱。用平均的图谱技术,来自一个数据库的病人成对的核磁共振成像和CT扫描是共同配准的。然后创建一个平均的核磁共振图谱,可能会有一组匹配的器官轮廓。通过确定数据库中每一次MRI扫描所需的变形以达到平均图谱,将相同的变形应用于相应的配准的CT扫描并找到这些变形的平均值,就可以创建平均CT图谱。要为传入的MR图像创建一个sCT,平均的MRI图谱将被配准到传入的MRI扫描。然后将这些变形应用到平均CT图谱,产生相应的sCT。器官轮廓可以类似地应用。
Dowling等(37)通过a验证了他们的方法“left -one-out”方法是sCT评估中常用的方法(结果见表3)。这里的训练图谱是用除一个病人外的所有病人来确定的。被排除患者的扫描被用作输入,以测试模型。剂量的差异被发现主要归因于MRI和CT扫描之间患者外部轮廓的变化。该组的额外工作证实sCTs和CTs的主OARsHU值没有显著差异(38)

Demol等(3)使用单一图谱作为大脑的基线MRI-only放射治疗。在这里,使用了1名患者的MRI和CT共同配准,而不是一个平均的地图集。作者报告了使用这种方法的显著剂量学误差。此外,还发现,对于一个被切除了一大块头骨的试验患者,sCT被指定为该区域的骨头。
有几个小组报告说,使用多幅地图集和基于局部块的模式识别方法可以提高sCTs的质量(图4)。通过将atlas技术与这些方法相结合,降低了图像配准中的不确定性影响(39)。
Uh等(39)使用多图谱法生成sCT。在这里,对脑部病人的CT和MRI扫描被严格地同时配准。当一个新病人输入MRI图像,将所有MRI图像进行变形以匹配输入图像,并将这些变形应用到相应的图谱ct上。最终的sCT是通过结合变形的CT图像,使用模式识别的方法计算出来的。在这里,sCT中每个体素的强度是变形图谱ct体素强度的加权平均值。地图集中相同位置的体素,以及相邻体素的数量(一个补丁),都有助于预测。
============================
Voxel-based techniques
另一种生成sCTs的方法是通过基于体素的技术。这些包括使用标准或专门的序列,如UTE成像。有些技术使用这两种方法的混合。这些方法利用多个序列的MRI强度创建sCTs。使用基于体素的技术,不需要将传入的MR图像精确地配准到地图集(12,44),而且如果使用统计方法,不需要分割图像(45)。这些技术在处理非典型解剖(12,44)病人时装备良好,并显示出从空气中分离骨头的能力(34,45)。
Voxel-based techniques: Standard MRI sequences
许多作者开发了基于体素的技术,使用常规的临床MRI序列(结果见表4)。


芬兰赫尔辛基的一组(46人)设计了一种使用骨盆部位T1/T2加权MR图像生成sCT的方法。磁共振和CT图像使用骨解剖配准,MR图像归一化。随机选取每个患者皮质骨、小梁骨和骨髓内的40个体素。利用识别点对应的HU值和MRI强度生成模型。作者还转换了骨外组织的MRI强度(48)。采用1000点分析骨盆软组织HU值与MRI强度的关系。该模型将MRI强度划分为肌肉、脂肪和尿液的阈值切面,并指定体积HU值。在这些组织之间,通过线性插值将MRI强度转换为HU值。
本研究还建立了一种脑病人骨和软组织700点转换模型。在对骨进行自动轮廓后,分别对骨和软组织建立模型。软组织分配后,液体、白质、灰质和头皮采用容积覆盖法。在这些组织之间,使用线性插值将MRI强度转换为HU值。
同一组(47)进行了一项体模研究,以确定使用该技术时RTP骨后的剂量偏差。Korhonen等人(49)研究了前列腺患者sCTs的骨轮廓误差及其对剂量计算的影响。Korhonen等(53)评估了前列腺sct来源的DRR。研究了用这种方法建立的用于质子治疗的前列腺sCTs的剂量计算精度(54)。
Kim等人(51)使用T1和t2加权的MR图像和共同配准的CT图像创建前列腺患者的sCTs。骨头的轮廓是人工绘制的。MRI上所有剩余的低强度体素被指定为空气,并在这些区域使用了一个大容量的HU覆盖。创建一个真值表,根据核磁共振强度将剩余的体素划分为组织类别。这些体素的信号强度是用所有磁共振图像的加权和计算出来的。将使用此方法生成的sCTs与使用容积密度覆盖方法生成的sCTs进行比较(52)。
Yu等(50)使用t1加权图像为头颈部患者绘制气道轮廓(手动和插值)。利用统计特征生成MRI的致密骨、海绵骨和软组织掩膜。体素的MRI强度被映射到每个组织各自的CT数范围。
Voxel-based techniques: UTE imaging
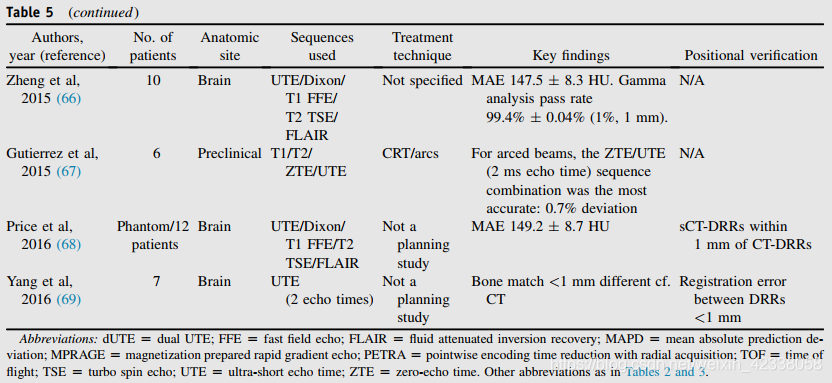
单纯核磁共振规划的一个挑战是,使用标准的核磁共振序列很难区分皮质骨和空气。这使得一些作者花费大量时间手工绘制骨骼或气道的轮廓,在某些情况下需要依靠CT信息。双重UTE(dUTE)可成像T2*松弛时间短的组织,如骨(55),使空气和骨更容易分割。使用这些序列的技术结果见表5。些方法单独使用UTE序列,而另一些则将它们与标准序列结合使用。到目前为止,这些技术只在脑部病人身上进行了临床试验。

Rank等(59)和Rank等(60)采用了二维的(2D)涡轮自旋回波序列与质子密度加权,以及三维(3D) dUTE序列。通过寻找2例脑患者对应的MRI和CT图像集的体素相关性,确定组织分类器的模型参数。该分类器将图像集的MRI强度以及邻域和坐标信息作为输入。对于一个被测试的病人,属于一个特定组织类的体素的概率被确定使用这个模型。
瑞典Umea的一组(45,56)使用回归模型在头部区域生成sCTs。使用了双UTE,以及t2加权的三维自旋回声采样完美,使用不同翻转角度演化(空间)序列进行应用程序优化对比。额外使用空间序列可以将T1值较长的组织与空气区分开来。在模型中,每一个MR图像和CT图像被视为一个变量,每个体素的信号强度作为变量的样本。两个额外的图像,为每个MRI扫描使用平均值和标准偏差的体素在27体素邻域。这些也被作为模型变量输入。使用高斯平均回归,每个体素的期望CT数被确定使用模型中的变量。该方法考虑了空间位置,以帮助区分位于不同界面的组织(57)。Johansson等人(61)试图使用并行成像来减少生成sCT所需的成像时间。作者评价了不同的平行成像方法。
Jonsson et al .(44)和Jonsson et al .(63)报道了这种方法用于颅内靶点的DRRs评估。这些作者报告,最大的差异是在鼻后腔周围。Yang等(69)比较了UTE-MRI导出的DRR和常规脑病患者的DRRs。





















 238
238











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








