作者,Evil Genius
2025基本上也就结束了,很多粉丝、学员面临毕业,博士倒还好,选择面大一点,基本都走的科研岗,进高校进医院,当然也有不少进企业,出国等,当然现在也很卷了,每年近20万的博士毕业生,竞争也很激烈。
那么硕士呢?很多硕士咨询我职业规划的问题,如果读完硕士选择了就业,该如何规划自己未来3-5年的路呢?
其他的职业方向我不是很清楚,当然大家在一个圈子,基本上都是生信的,或者和高通量测序相关的,所谓的职业规划,我就是把自己踩得坑分享出来,避免大家重蹈覆辙。
如果大家选择生信作为职业方向,大家首先要考虑以下几个问题,
1、有没有代码基础,R是最低要求,最好是linux、R、python都会,现在公司很难从头培养了,如果卷的背景下,公司都希望能直接上手做项目。
2、有没有一作的SCI组学文章,或者参与了组学的项目并且是核心分析人员,这个面试肯定会问,我当初在上海上班当过面试官,面试的时候更加关注参与的组学经历。
3、自己有没有扎根生信的打算,大家要明白,学生时代学到的生信知识和经验,在公司层面是远远不够看的,这里面巨大的鸿沟需要大家尽快弥补,说一个最简单的例子,大家看我天天看文献,总结方法,传授经验,这就是日常工作,就这我也不算这个行业的优秀者。
如果上面大家满足并且想好了,那么大家励志的一生基本上就开始了。
第一步,选择公司,大公司,上市公司为主,诺禾、华大、兰卫等等,大家要注意,投递简历的时候一定要确定自己的技能方面够用,R至少要会,linux和python尽量会,有的公司面试直接给代码题,让你在短时间完成(这样的公司比如普瑞等),大家一定要打好基础,再去面试,不然真的是在浪费机会。
第二步:坚持,选择了一家公司,并且被录用了,那就扎根下来,好好学习,带项目,积累经验,打磨技术,这个时间是多少呢?在24的培训课上提到过,最少要3年,当然,如果没有经济压力,最好活到老学到老。
第三步:处理诱惑,大家在坚持的过程中会面临很多的诱惑,比如失恋,同一批进来的人有的已经升职加薪了,你还在原地,别人跳槽后更好了,别人有房有车,自己还在几百块的出租房住等等等等,心理落差很大,当然也是我的亲身经历,但是一定要认清自己,千万不要别人怎么做,我们就怎么做,坚持自己才是正解。
第四步,实力足够之后,努力扩展。
都是肺腑之言,我在诺禾干了3年半,兰卫做了2年,24年回到了太原,目前在太原也待了2年了,期间干了很多事,也做过很多的错事,大家有则改之,无则加勉。
还有一点忠告就是,一开始大家可以选择北上广,一线城市,待个3-5年,后续就要考虑退到二线定居生活了,像很多北京的就落户天津定居了。
不知道大家有没有想好做生信分析?也有人问我为什么回到了太原,其实有很多老朋友,老学员知道我23年经历了一场变故,回到太原也是在父母身边照看,期间主要的培训内容基本都是在太原完成的,理由很简单,太原这个地方,单细胞空间除了做培训完全没有用武之地。
当然也就是做做培训,每年也会有人骂我,黑我,说我是骗子等等等等,只能说每条路都不好走,都要承受压力,大多数人都是很好的,努力求学,让自己变的更优秀。如果大家对培训感兴趣,有一个问题需要大家考虑,哪怕只有一个人骂你,他会在各个群里骂你,而且骂的很难听,甚至别人要报警抓你,不明真相的人很多都会跟风,这样的压力,自己能承受么?
比如这篇文章提到的状况文献分享--全面的肿瘤-免疫特征分析揭示肉瘤样肾细胞癌中矛盾性免疫敏感性的介导因素
如果大家经历过类似的情况并且坚持了下来,在我心目中,你可以称自己为强者。
又要打广告了啊,一切的一切,都建立在自己能力的基础上,第一步走不动,后面无从谈起,大家如果选择生信职业,尤其是当下最好的空间转录组,多组学方向,一定要提前布局一下,学学技能,学学思路,根据需求参加一些培训。
2025番外--linux、R、python培训
生化小课---基因组与单细胞空间多组学
2024年外显子分析系列课程
2025年单细胞空间系列课程
2024年单细胞空间系列课程
2023空间转录组课表
今天废话说的有点多了,因为跟即将毕业的硕士生聊,看到了当初的自己,那种迷茫,手足无所,未来的不确定性,简直如出一辙。
好了,我们分享文献,应该是中国人发的,但是单位是美国的

知识积累
能够在发育时间点上对多层组学信息进行空间定位,使得探索驱动大脑发育、分化、脑区化和疾病相关改变的机制成为可能。
空间ARP-seq:在同一组织切片上同时分析染色质可及性(ATAC)、全转录组和约150种蛋白质。
空间CTRP-seq:同时分析组蛋白修饰(H3K27me3)、全转录组和蛋白质组。
研究者将这些技术应用于:
发育:从新生到幼年阶段的小鼠大脑,并与发育中的人脑进行比对。
疾病:溶血卵磷脂(LPC)诱导的局灶性脱髓鞘(神经炎症)小鼠模型。
最终目标是全面揭示大脑发育和神经炎症背后的分子机制。
结果1、发育中大脑的多重CODEX成像分析总结
设计了针对小鼠(23种抗体)和人类(19种抗体)的抗体组合,覆盖了大脑发育和神经炎症中的主要细胞类型。
分析了小鼠从出生后第0天到第21天以及人类从妊娠中期到婴儿期的大脑样本。
细胞分布与发育动态:
- 星形胶质细胞/神经祖细胞: 标志物GFAP的表达从P0天的脑室区开始,随后扩展,并在P21天的胼胝体中尤为丰富。
- 增殖细胞: Ki-67+的增殖细胞密集分布于脑室区,随着发育进行,其数量和分布范围逐渐减少,表明祖细胞走向终末分化。
- 神经元: 神经元标志物(如CUX1/2, TBR1, CTIP2)显示出严格的皮层特异性分布,定义了不同皮层层次。这些转录因子的蛋白表达水平在发育后期有所下降。
少突胶质细胞与髓鞘形成:
- 少突胶质细胞标志物OLIG2广泛表达。
- 成熟髓鞘标志物MBP和MOG在P7-P10天才开始出现,其表达首先局限于胼胝体的外侧部分,随后才在P21天扩展至整个胼胝体和皮层。这清晰地揭示了髓鞘化遵循 “由外向内” 的进展模式。
- 免疫细胞: 大多数免疫细胞亚型主要定位于脑膜区。CD169+细胞在脑膜和脉络丛中含量丰富,它们是与发育相关的边界相关巨噬细胞。
跨物种比较:
在人类大脑发育中,尽管某些转录因子蛋白水平在婴儿期有所下降,但考虑到细胞密度后,其表达域实际上随脑体积增大而扩展。
髓鞘化在婴儿期显著增强。
基于DBiT的空间三组学分析技术总结
两项空间三组学技术
空间ARP-seq技术
目标:同时分析染色质可及性(ATAC)、全转录组 和大量蛋白质。
工作流程:
样本准备:使用甲醛固定冷冻组织切片。
蛋白质标记:与带有DNA条形码的抗体孵育,以标记目标蛋白质。
表观基因组标记:使用携带通用接头的Tn5转座酶处理,在开放的染色质区域插入适配器。
转录组标记:加入带有生物素标记的poly(T)接头,与mRNA的poly(A)尾结合,准备进行反转录。
空间条形码编码:利用两组垂直的微流控通道,将空间条形码(Ai和Bj)导入组织,形成一个2D网格。每个像素(尺寸为20或15微米)都拥有独一无二的空间条形码组合。
建库与测序:分别收集带有空间条形码的cDNA(来自mRNA和抗体)和gDNA片段,构建独立的文库进行新一代测序。
2. 空间CTRP-seq技术
目标:同时分析组蛋白修饰(H3K27me3)、全转录组 和蛋白质组。
工作流程:与ARP-seq类似,关键区别在于使用靶向H3K27me3的抗体,并通过蛋白A偶联的Tn5-DNA复合物进行CUT&Tag反应,来捕获特定的组蛋白修饰信息。
围产期大脑空间分子动态总结
技术整合与空间域鉴定:
- 通过对P0至P21小鼠大脑进行空间ARP-seq分析,成功鉴定出22个RNA聚类和15个ATAC聚类。
- 使用SpatialGlue工具进一步整合RNA和ATAC数据,定义了18个精细的空间域。这些空间域与已知脑解剖结构高度一致,并实现了比单独CODEX技术更精确的脑区划分,例如清晰区分了皮层II/III层与V层。
髓鞘化的时空动态:
- 空间多组学数据一致证实,髓鞘关键基因(如 Mbp 和 Mog)的染色质可及性和RNA表达在P0-P5的小鼠胼胝体中不存在,而是在P7-P10期间被诱导激活的。相应的MBP和MOG蛋白也在稍后阶段出现。
关键转录因子与细胞类型:
- 在纹状体中,调控形态发生的转录因子Foxp4的表达和染色质可及性在出生后逐渐消失,而Foxp1和Foxp2则持续占主导地位。
- 通过整合已发表的单细胞RNA-seq和ATAC-seq数据,成功将空间数据中的聚类映射到特定的细胞类型。例如,定位于胼胝体的聚类被鉴定为髓鞘形成少突胶质细胞,且仅在P10和P21的样本中出现。
跨物种保守性与人类大脑发育:
- 对人类发育中大脑V1区的分析揭示了转录组谱在 prenatal 和新生儿期对细胞类型的关键定义作用,其空间模式与MERFISH数据高度匹配。
- 观察到蛋白质(如CD56)与RNA表达在发育早期相关性更强。
-
关键基因(如皮层中的 RBFOX3 和从妊娠晚期开始在白质中占主导的 MBP)的RNA表达和染色质可及性模式与CODEX观察结果一致。

结果2、大脑皮层染色质可及性的时空动态总结
RNA表达 + 染色质可及性
基因表达模式的分类:
- 通过整合分析,鉴定出13-15种不同的RNA表达模式和7-10种ATAC模式,共同形成了27-30个独特的组合基因集。
- 投射神经元(PNs)亚型(CPNs, SCPNs, CThPNs)的标志物基因显示出特定的时空表达模式,可分为三类:主要受空间驱动、主要受时间驱动、以及受时间和空间共同驱动的“二元”模式。
RNA表达与染色质可及性的解耦现象:
- 这是最关键的发现之一。尽管许多皮层特异性转录因子(如Bcl11b, Cux1/2)的RNA表达与染色质可及性一致,但一个关键的基因子集出现了不匹配。
- 与RNA表达相比,这些基因的染色质可及性在时间上滞后,在空间上更弥散。例如,Sox4、Sox11、Sox5和Plxna4等基因的ATAC信号变化晚于其RNA表达的变化。
- 这表明,在出生后发育阶段,尽管一部分皮层基因的RNA和蛋白表达下降,但它们仍保留着早期发育阶段转录状态的“表观遗传记忆”,其染色质仍保持开放状态。
皮层开放染色质的空间扩散:
- 观察到层特异性转录因子(如Fezf2, Tbr1)的染色质可及性会扩散到其他皮层。例如,Fezf2的RNA表达局限于V层,但其染色质可及性却延伸至VI层。
- 研究者推测,尽管染色质处于开放状态,但Polycomb介导的抑制机制可能阻止了这些层特异性基因的异位表达。
少突胶质细胞生成与髓鞘化的时空轨迹:
- 少突胶质前体细胞(OPCs)和髓鞘形成少突胶质细胞(MOLs)的基因程序在时空轨迹上与CThPNs和SCPNs(深层的投射神经元)高度重合。
- 髓鞘相关基因(如Mbp, Mag)的表达在第VI层和V层(深层)水平最高,而上层(II/III)的CPN神经元的髓鞘化发生较晚。
- 重要的是,这些髓鞘化相关基因的染色质可及性在P5时就在多个皮层层中提前增加,预示着后续的髓鞘化程序,体现了“染色质预激活”。
跨物种比较(人与小鼠):
- 人类大脑V1皮层的分析显示,多数模式因子(如BCL11B, TBR1)的层状分布和发育后期表达降低的模式与小鼠相似。
-
少突胶质生成和髓鞘化相关基因的时间表达模式在小鼠和人类之间高度一致。与神经发生相关的基因相比,髓鞘相关基因更频繁地出现ATAC信号先于RNA表达的现象,且在人类妊娠中期就已可检测到其染色质预激活。

结果3、胼胝体髓鞘化的空间多组学分析
髓鞘化的时空模式与染色质预激活:
- 时空模式: CODEX和空间ARP-seq数据均证实,髓鞘蛋白MBP和MOG的表达在P7-P10天首先出现在胼胝体的外侧部分,到P21天时扩展至整个胼胝体,呈现出 “由外向内” 的进展模式。
- 染色质预激活: 关键发现是,在髓鞘基因(如 Mbp, Mog)开始表达之前(P0-P5天),它们在后续将表达的区域已经出现了染色质可及性的提前开放。这表明存在染色质预激活机制,为后续的基因转录和髓鞘化做好了准备。
双向髓鞘化模型:
- 通过对胼胝体进行精细分区分析,研究者提出了一个双向髓鞘化模型,挑战了单纯的“由外向内”模式。
- 少突胶质前体细胞/定向少突胶质前体细胞(OPCs/COPs,R4聚类)的早期应答在中央胼胝体(P0天)开始。
- 与此同时,在P5-P10天,外侧胼胝体已同时开启了少突胶质细胞的分化进程,并且髓鞘化基因程序(R6聚类)已在外侧激活。
- 因此,髓鞘化是一个定时、顺序、双向的过程:OPCs/COPs首先迁移并在外侧分化,随后是第二波向内侧的迁移和分化。
投射神经元对髓鞘化的协调作用:
- 在缺乏神经元胞体的胼胝体中,检测到了来自不同皮层投射神经元的轴突标志物表达。
- 外侧胼胝体富含皮质丘脑投射神经元和皮质下投射神经元(CThPNs/SCPNs) 的轴突,这些轴突更早被髓鞘化,且与成熟的神经传递基因相关。
- 内侧胼胝体则富含胼胝体投射神经元(CPNs) 的轴突,这些轴突髓鞘化较晚,且仍与轴突发生相关基因相关。
-
病毒追踪实验证实: 在P10天,位于外侧的CThPN轴突已经髓鞘化,而位于内侧的CPN轴突则刚开始髓鞘化。

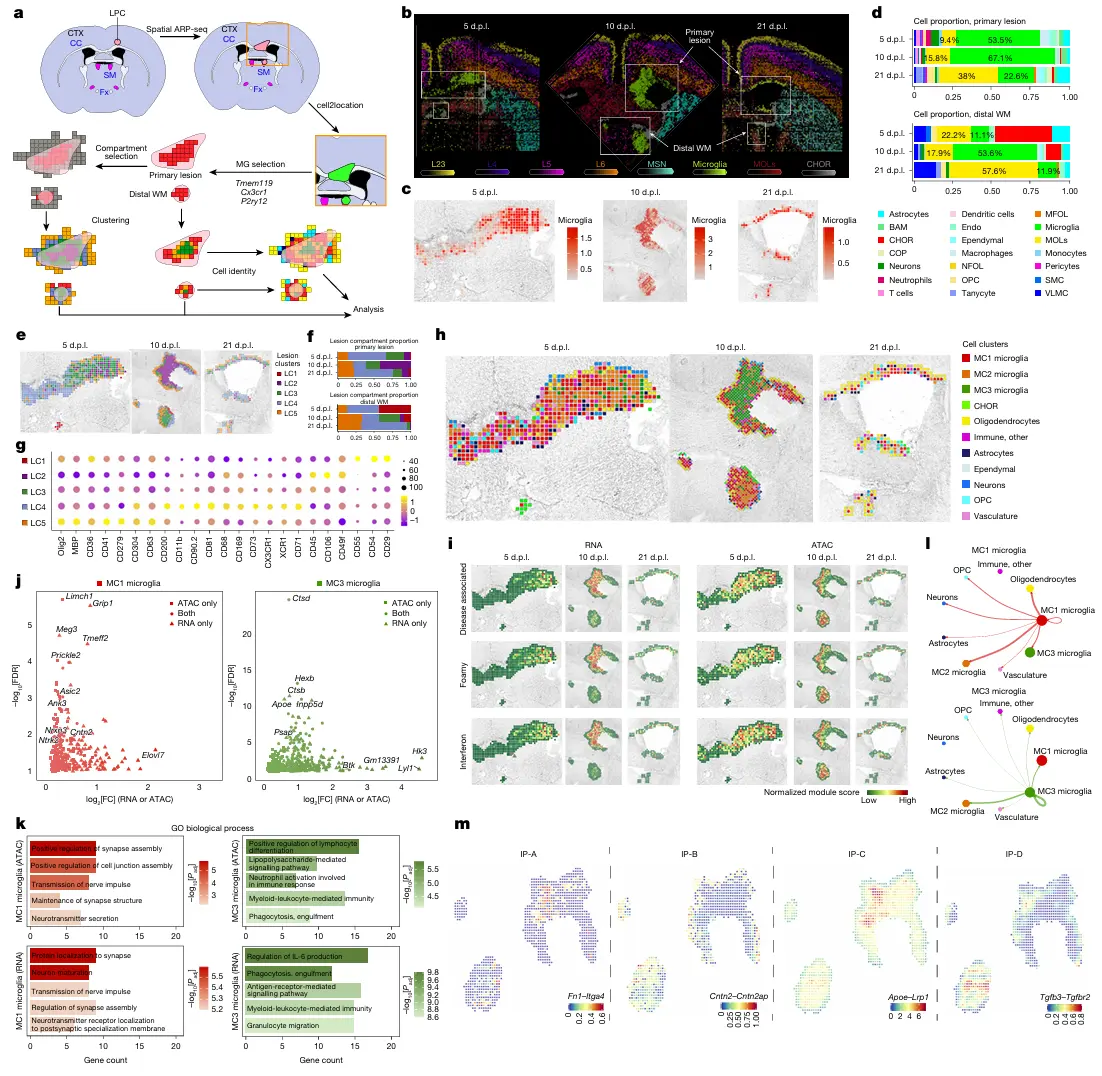
结果4、局灶性脱髓鞘与再髓鞘化的空间图谱分析
CODEX、空间ARP-seq和空间CTRP-seq技术
损伤与修复的细胞动态(基于CODEX成像):
- 脱髓鞘期(损伤后5-10天): 在损伤核心区,髓鞘形成少突胶质细胞(MOLs)和髓鞘丢失。同时观察到显著的星形胶质细胞增生(GFAP+) 和巨噬细胞/小胶质细胞(CD11b+) 在病灶处聚集。
- 再生启动期(损伤后5天): 在损伤区域已出现少突胶质前体细胞(OPCs) 的应答(OLIG2+和PDGFRα+)以及增殖活性(Ki-67+) 的增加,标志着再生过程的开始。
- 再髓鞘化期(损伤后21天): 病灶区域显著缩小,成功的再髓鞘化(MBP染色恢复) 得以实现,同时星形胶质细胞和小胶质细胞的浸润明显减少。
空间多组学揭示分子图谱(基于空间ARP-seq和CTRP-seq):
- 通过空间ARP-seq(分析RNA和染色质可及性)和空间CTRP-seq(分析H3K27me3组蛋白修饰和RNA),成功绘制了损伤后不同时间点的大脑精细分子图谱。
- 鉴定出多个与脑区对应的聚类,并特别识别出一个由神经炎症特异性引发的聚类(J2)。
- 两种空间三组学技术与CODEX成像结果高度一致,共同验证了细胞类型的空间分布。
意外的远端免疫反应:
- 正如预期,在损伤核心区和脑膜处检测到免疫细胞(CD45+)。
-
一个意想不到的发现是,在远离原发性病灶的髓纹(SM) 中也观察到了免疫细胞的聚集。这表明神经炎症反应并不仅限于病灶局部,还会在远端特定脑区被激活。

结果5、神经炎症中小胶质细胞的动态与远端激活
病灶区的多组学动态与修复:
- 脱髓鞘期(损伤后5-10天): 在病灶区,少突胶质细胞标志物(Olig2, Mog)在RNA、蛋白和染色质可及性水平上均下降,同时其基因组区域伴随抑制性组蛋白标记H3K27me3的富集。
- 炎症反应: 小胶质细胞/巨噬细胞标志物(如 Cx3cr1, Cd86, Csf1r)在病灶区显著上调,且其染色质保持开放(H3K27me3水平低)。
- 再髓鞘化期(损伤后21天): 随着修复完成,髓鞘基因表达恢复,H3K27me3抑制被解除,炎症标志物在核心病灶区消失,但持续存在于脑室周围未完全修复的脱髓鞘区域。
CD11c+ 细胞群的独特动力学:
- 发现一群 CD11c+ 的小胶质细胞/巨噬细胞在损伤后10天数量达到高峰,充斥病灶核心,其中一部分与CD11b共标。
- 至21天,这群细胞从核心区撤退,但仍存在于残余的脱髓鞘区域。这种动态在RNA、ATAC和蛋白水平均得到验证,并与H3K27me3模式相反。
关键发现:小胶质细胞的远端激活:
- 空间多组学揭示: 在远离原发病灶的白质束中,特别是髓纹,检测到免疫细胞(CD68+, CD44+, CD45+)的存在和激活,以及髓鞘基因的下调。
- CODEX成像证实: 在冠状面和矢状面切片中,均观察到CD11b+和CD11c+细胞沿着前-后轴,广泛分布于远端白质束,包括胼胝体压部、穹窿、背侧海马连合等结构。
- 全脑3D成像验证: 利用TRIC-DISCO技术对全脑进行成像,清晰展示了小胶质细胞/巨噬细胞标志物 Csf1r 的信号从注射部位向对侧半球以及沿着胼胝体膝部、压部、穹窿等结构的广泛扩散。

结果6、原发与远端小胶质细胞的异质性动态
病灶分区与功能特性:
通过整合ATAC和RNA数据,在原发和远端区域鉴定出5个不同的功能分区。
- LC2 被鉴定为原发病灶核心,与适应性免疫相关。
- LC3 仅在损伤后10天出现在远端病灶,与先天免疫相关。
- LC5 则富含少突胶质细胞标志物,是修复相关的分区,并高表达免疫抑制受体PD-1。
小胶质细胞亚群的功能特化:
通过对小胶质细胞进行分群,鉴定出三个功能不同的亚群:
- MC1: 表现出支持神经元/髓鞘和吞噬清除的双重特性,主要存在于远端白质和损伤早期。
- MC2: 可能是一种中间状态,介于MC1和MC3之间。
- MC3: 是损伤后期原发病灶核心的主要亚群,表现出强烈的炎症特征。
与已知数据库对比发现,疾病相关小胶质细胞等激活状态在原发病灶预测程度更高,而损伤应答模块在远端白质反而更富集。
空间特异的细胞间通讯:
- 细胞相互作用分析预测,MC1小胶质细胞更倾向于与其他非小胶质的中枢神经系统细胞互动,而MC3则更多与其他小胶质细胞亚群交流。
- 发现了空间特异的相互作用模式:
- 有些相互作用(如Fn1–Itga4)在原发和远端区域类似。
-
而有些相互作用,如TGF-β和BMP信号通路,则更特异性地发生在远端白质区域。
最后,来看看方法(空间分析部分)

























 89
89

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








