
–DOI: 10.1038/s41586-024-07359-3
留意后续更新,请关注微信公众号:组学之心
3D genomic mapping reveals multifocality of human pancreatic precancers
研究团队和研究单位
Laura D. Wood–The Johns Hopkins University School of Medicine

Denis Wirtz–The Johns Hopkins University School of Engineering

1.文章简介
1.1 胰腺癌研究难点
- 胰腺上皮内瘤变(PanIN)是胰腺癌(尤其是胰腺导管腺癌,PDAC)最常见的前体,其体积小且在人体内难以接近,无法肉眼识别,研究起来具有很大困难。
- 传统的2D组织学切片方法无法全面了解PanIN的数量、尺寸、形状及其在组织内的连通性,无法深入了解早期癌症的发展
1.2 研究方法
- 通过分析46个大体正常的人胰腺大块样本(从宏观上看似乎是健康的,没有发现明显的癌变或其他疾病病变),使用机器学习流程CODA,在单细胞分辨率下进行定量3D组织学重建,了解PanIN的数量、尺寸、形状及其在组织内的连通性。
- 作者开发了一种3D建模工作流程,指导多区域显微切割以及靶向和全外显子组测序,阐明PanIN之间和内部的遗传异质性。
1.3 研究的主要结果
- 平均每立方厘米有13个PanIN,推测一个正常成人胰腺中可能含有数百个PanIN,几乎全部具有致癌KRAS突变。
- 大多数PanIN起源于具有不同体细胞突变谱的独立克隆。
- 某些空间连续的PanIN含有多个KRAS突变,不同的KRAS突变定位在这些肿瘤内的不同细胞亚群,表明这些细胞亚群是多克隆起源。
- 体细胞突变,包括KRAS基因的热点突变、CDKN2A和TP53等肿瘤抑制基因的失活突变,驱动了PanIN的发生和发展。
2.CODA–以细胞分辨率对组织进行定量三维重建
CODA是该文章Denis Wirtz研究团队开发的,2022年10月发表在’nature methods’,CODA: quantitative 3D reconstruction of large tissues at cellular resolution,先挖个坑,后面再深入学习一下
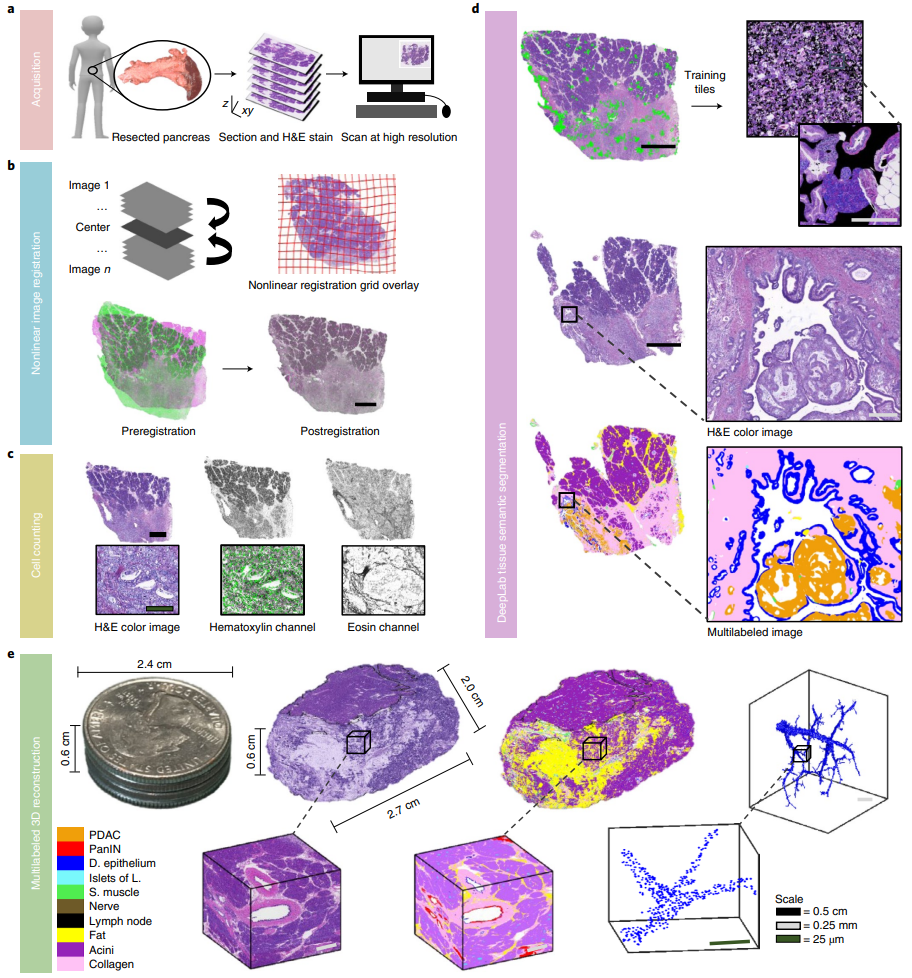
2.1 获取样本
采用福尔马林固定、石蜡包埋的组织样本,每隔4微米切片一次。每隔三个切片进行一次H&E染色(即两个未染色,一个染色),并使用20倍放大的扫描仪扫描这些切片。
2.2 图像配准(Image Registration)
将独立的连续图像映射到一个公共坐标系统中,使用Rigid-body registration进行粗略对齐,然后使用弹性配准方法来考虑局部组织变形。计算图像对之间离散角度的Radon变换,Radon变换的互相关最大值用于registration角度,旋转组织图像的互相关最大值用于平移。弹性registration是通过在全局配准的图像上插值Rigid-body registration网格来实现的。
2.3 细胞检测
采用基于颜色去卷积和归一化的方法进行高通量H&E细胞检测。通过颜色去卷积将HE图像分离成HE通道,并使用Hematoxylin通道图像确定局部二维强度最大值作为细胞核坐标。这种方法通过定量细胞核坐标,而不是细胞核边界,实现了大规模连续切片样本的快速细胞检测,无需训练或手动注释。
2.4 深度学习语义分割
建立了深度学习工作流程用于HE图像中组织学特征的语义分割,识别了胰腺中的九种细胞和组织成分,包括正常导管上皮、胰腺癌前病变、PDAC、平滑肌、腺泡、脂肪、胶原蛋白、Langerhans岛和淋巴结。使用DeepLab语义分割和预训练的ResNet50网络,达到每个样本>90%的精度和召回率,并以每像素2微米的分辨率在3分钟内标注图像。
2.5 3D重建与多标签化
使用训练好的CODA模型对人类胰腺组织的系统评估进行量化,包括正常、癌前和癌性胰腺组织的3D重建,达到亚细胞分辨率。生成多标签3D模型,可以在细胞和组织分辨率下重建标记的组织体积。
3.研究结果
3.1 CODA对胰腺癌组织3D建模和测序工作流程
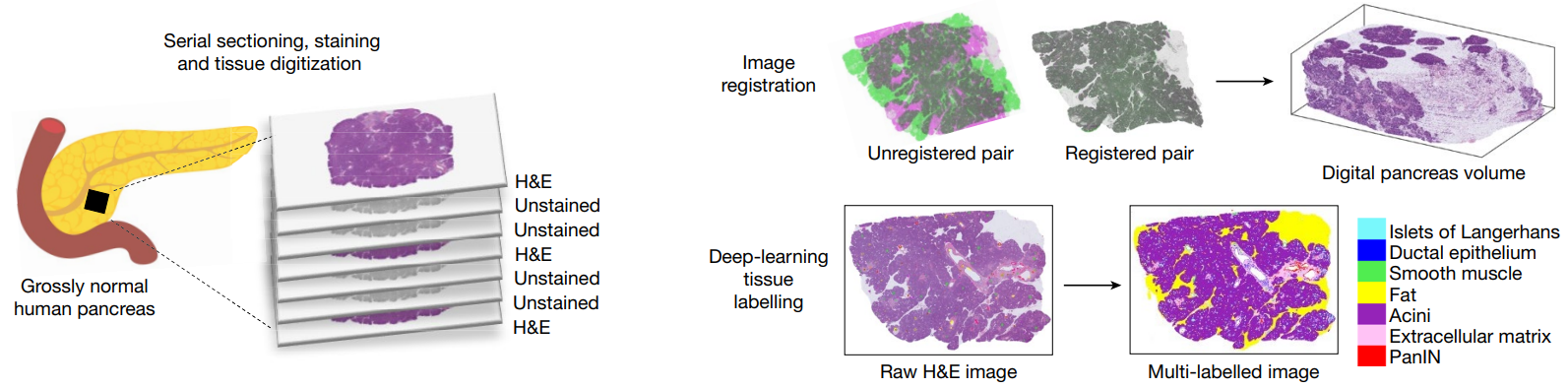
对46个大体正常的胰腺组织块连续切片,每隔三个切片进行一次H&E染色;使用CODA对每块组织块的配准H&E切片来创建数字化体积,随后用深度学习在H&E切片上标记组织的类型,实现胰腺显微解剖结构的3D重建。

其中38块组织进行3D建模分析。另外八块板被3D建模后,中间的未染色载玻片用于3D 引导的多区域显微解剖,用于NGS和WES测序检测空间不同的PanIN。
3.2 量化了3D渲染的PanIN微观解剖特征
在38块大体正常的胰腺组织中,其中12块来自PDAC手术切除的标本,另外26块来自其他不涉及胰腺导管系统的肿瘤的手术切除标本。平均每块组织切割出1,288张切片,平均组织体积为 2.03
c
m
3
cm^3
cm3。36块组织仅含有低级别(LG)PanIN,另外2块组织具有高级别(HG)异型增生的PanIN。

每块胰管均进行了3D建模渲染,展现出PanIN和正常导管上皮的空间分布情况(这里仅展示出一个例子)
在38块胰管组织中,对889个空间上独立的PanIN进行建模,每个胰管组织PanIN数量中位数为21(范围为 4-92)。

(b-c)PanIN平均含有95,021个细胞。大多数PanIN(764/889个(86%))少于 100,000个细胞;266个(30% 的PanIN)少于 1,000 个细胞。
(d)作者对每个组织块中的正常导管细胞进行量化,计算导管上皮内肿瘤细胞的百分比。发现30%的导管上皮细胞是肿瘤性PanIN细胞。尽管单个PanIN仍然很小,但在大多数情况下,它们的累积存在占据了导管系统的四分之一以上。
(e)平均总体PanIN负担为每
c
m
3
cm^3
cm3 13 个PanIN。
(f)推测全胰腺组织含有PanIN的数量。

(A-D)与非导管疾病患者相比,PanIN负担在PDAC患者的这一指标更高(虽然没有统计学意义)。在性别、年龄或采集组织的位置方面,PanIN负担没有统计学上的显著差异。
(E-F)与非导管疾病患者相比,PDAC患者受PanIN影响的导管系统百分比和PanIN细胞数量同样更高。
(G-L)PanIN细胞比例与正常导管细胞比例 (P = 0.0015) 和细胞外基质中的细胞 比例(P < 0.001) 显着相关。PanIN 细胞和腺泡细胞的相对比例之间存在显著的负相关性 (P < 0.001),但与脂肪或胰岛细胞均无相关性。
作者推断,PanIN与纤维化和腺泡细胞脱落有关,但需要进一步研究以确定因果关系。一种可能性是炎症导致PanIN并导致纤维化和腺泡细胞脱落;另一种可能性是PanIN阻塞胰管导致纤维化和萎缩。
3.3 CODA指导的NGS可实现3D基因组学
作者将3D解剖工作流程与多区域 DNA 测序相结合,对另外8个大体正常的胰腺标本进行了研究。虽然平均标本尺寸较小(平均体积0.91
c
m
3
cm^3
cm3),但平均总体PanIN负担(每
c
m
3
cm^3
cm3 15个PanIN)与之前的队列相似。这8个板总共产生了109个空间上独立的PanIN,其中37个的大小满足单独显微切割和测序。大多数PanIN(34/37)只有LG发育不良,有3个是含有HG异型增生的PanIN,还在两个组织块内深处发现的PDAC区域进行了显微切割。总的来说,作者使用定制的靶向NGS面板对37个PanIN的99个区域以及PDAC的5个区域进行了测序,测序基因包含154个已确定的癌症驱动基因和所有已知的胰腺导管肿瘤的主要驱动基因。
在PanIN中,胰腺驱动基因KRAS、GNAS、RNF43、TP53和KDM6A中发现了单核苷酸变异(SNV)和小插入缺失突变(indel)。在ERBB4、RET、ATRX、STK11、NF1、FLT3和 FGFR3中也发现了不太常见的体细胞突变。每个PanIN都从目标组中发现了14个体细胞突变,而PDAC包含35个体细胞突变。其中,KRAS是最常见的突变基因。

(A-B)六个PanIN发生KRAS p.Q61H突变(16%),而31个在第12个密码子中至少发生一个突变(86%)(19 个 KRAS p.G12D;15 个 KRAS p.G12V;5 个 KRAS p.G12R;和 1 个 KRAS p.G12C)。在靶向测序分析中,54%的PanIN仅包含KRAS的体细胞突变。
(C)在WES测序中观察到从LG PanIN到HG PanIN再到PDAC的突变负担呈增加趋势,且 PDAC 的负担明显高于 LG PanIN。

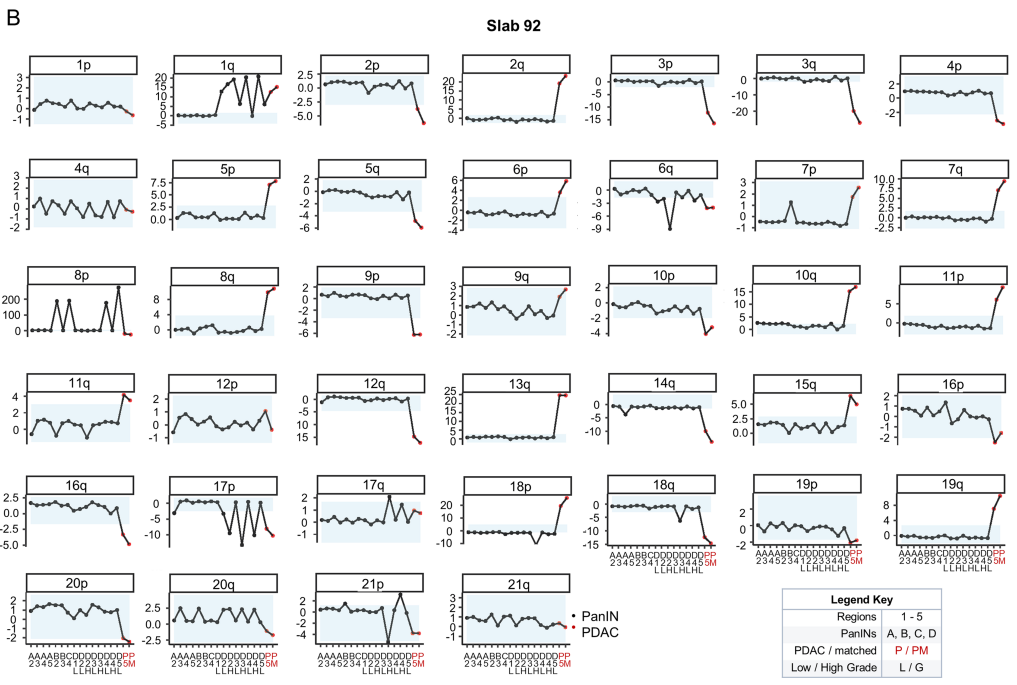
作者对所有全外显子组测序(WES)样本进行了拷贝数分析。
(A-B)在胰腺上皮内瘤变(PanIN)中,拷贝数增加和丢失较为罕见。92号组织块中的多个PanIN获得了8p染色体;92号和117号组织块中的PanIN中发现了18p染色体的丢失;两个同时含有低级别(LG)和高级别(HG)成分的不同PanIN中均存在1q染色体的增加,分别是92号的PanIN D和104号的PanIN D;其中104号的HG成分增加最多。值得注意的是,92号中的PanIN D的HG成分含有TP53的17p染色体丢失以及TP53的点突变,表明该关键肿瘤抑制基因发生了双等位基因变异。与PanIN样本相比,所有胰腺导管腺癌(PDAC)样本均存在大量拷贝数增加和丢失。
从低级别PanIN中的较少拷贝数变异,到高级别PanIN和PDAC中的变异不断增加,表明此类变异发生在致癌作用的较晚阶段。这些发现强调了在胰腺癌进展过程中,拷贝数变异在不同阶段的作用和重要性。
3.4 PanIN的起源与侵袭传播
所有八个经过3D基因组分析的胰腺组织板都包含多个空间上不相连的PanIN。
①104号组织块

(a-b)104号组织块中四种PanIN都有不同的KRAS突变,但突变都不同。在同时具有LG和HG异型增生的两个PanIN(C 和 D)中,PanIN内的LG和HG有相同的KRAS突变,而不连续的PanIN之间没有相同的突变,无论共享的异型增生程度如何。
(c)WES数据显示,除了 KRAS 热点外,PanIN D和PDAC之间没有共同的体细胞突变,这证实了作者关于不同克隆起源的假设。即使多个空间上不同的 PanIN 紧密相邻,它们的突变也反映了独立的起源。
②98号组织块

98号组织块全是LG PanIN,其中C、D和E;F、G、H和I有相同的KRAS突变。(c)中的展示的是有相同KRAS突变的PanIN F、G、H和I在组织中的空间分布;(d)中的结果显示PanIN F、G 和H共有7个相同的体细胞突变,尽管它们被组织中正常的非肿瘤性胰管区域隔开。提示LG PanIN可能会在胰腺内扩散。
③92号组织块
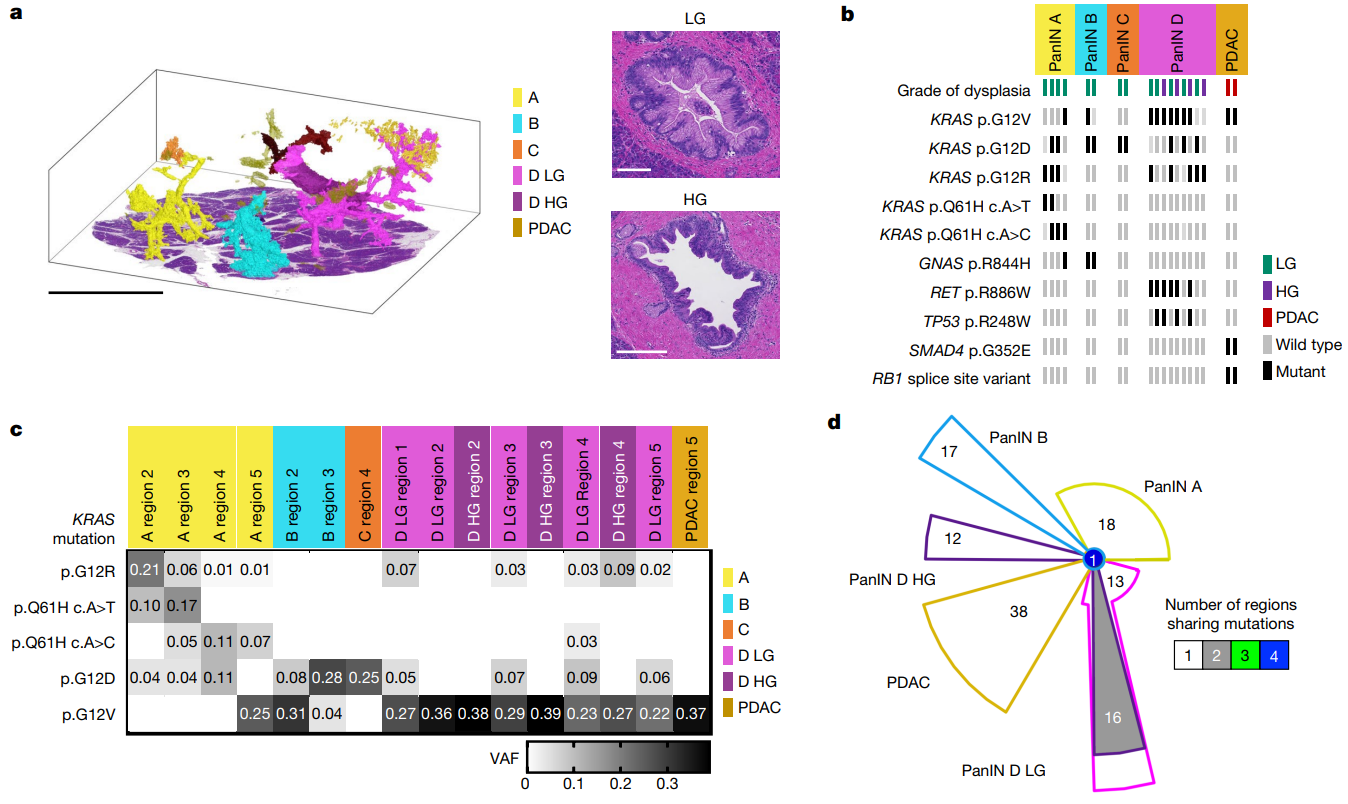
(a-b)而在92号组织块中,A、B和C是LG PanIN;D是LG + HG PanIN,它们具有多个类型KRAS突变,这种异质性在HG成分中显著降低。特定于单个LG区域的TP53 p.R248W突变也存在于大部分HG区域中,表明在进展为HG PanIN时TP53突变克隆扩增。在3.3 part的最后一幅图的拷贝数分析中,仅在PanIN D的HG成分中发现了17p的丢失,进一步说明了TP53随此PanIN进展而改变。
(c)通过对PanIN A和D的变异等位基因频率(VAF)证实了PanIN内的KRAS突变异质性,结果分别显示5种和4种不同的KRAS突变。PanIN B 中,G12V 具有区域 2 中的 KRAS 突变中最高的 VAF (24%),而 G12D 较低 (5%)。区域 3 则显示相反的情况:最高 VAF 是 G12D (22%),而 G12V (2%) 最小。这意味着任何一个KRAS突变体都不能是另一个的亚克隆后代,这进一步增加了它们出现在独立克隆中的可能性。
(d)与其他组织块一样,空间上分离的PanIN没有发现任何共享的体细胞突变,这意味着这些不同区域的PanIN在遗传上是独立的,它们各自拥有不同的体细胞突变谱系。
由于 KRAS突变被认为是PanIN发育过程中非常早期的事件,因此单个空间连续的PanIN 中存在多个KRAS突变表明某些PanIN具有多克隆起源。
3.5 评估具有多个KRAS突变的PanIN 92号组织块

为了评估多重KRAS突变反映多克隆起源的假设,作者使用PICTograph重建了具有多重KRAS突变的PanIN A和B的进化过程。通过对分配突变的不确定性进行建模,PICTograph可以可视化亚克隆之间最可能的祖先关系。每种颜色代表一个不同的亚克隆,在表中具有指定的突变类型。饼图代表每个亚克隆的分布比例。
为了进一步证实不同的KRAS突变发生在不同的群体中,作者通过 KRAS G12 点突变特异性RNA原位杂交 (ISH) 绘制了每个PanIN中KRAS突变细胞的空间位置。研究使用单独的BaseScope ISH探针对每个组织块的一到两个区域进行检测,分别针对G12D、G12V、G12R和G12C。

(c)这幅图表明不同PanIN区域中KRAS G12点突变的定量结果,以及相应的体细胞突变频率(VAF)。PanIN A、B、C、D区域都有不同的G12点突变,其突变频率和突变数量有所不同。箭头标记了NGS发现KRAS Q61H突变的区域。
(d)(左图)是一个包含正常导管上皮和PanIN区域的组织切片,蓝色标记表示正常的导管上皮细胞,红色标记表示PanIN细胞。(右上部分)显示了KRAS G12R突变在PanIN细胞中的检测结果,红色点表示检测到KRAS G12R突变;红色虚线勾勒出PanIN细胞区域,蓝色虚线勾勒出相邻的正常导管上皮区域。(右下部分)展示了红色和蓝色标记区域的放大视图,进一步细化了KRAS G12R突变在细胞中的具体位置。
说明KRAS G12R突变仅在PanIN细胞中检测到,而在相邻的正常导管上皮中未检测到。提示KRAS G12R突变与PanIN的病变特征密切相关,而不是正常组织的一部分。

(e)展现出不同区域内KRAS G12D和G12R突变的空间分布。在通过测序识别出的具有多个KRAS突变的单个PanIN 中,不同 KRAS 突变探针的空间分布几乎没有重叠。这种多维度的分析方法帮助揭示如PanIN和癌变过程中KRAS突变的空间特征,对理解胰腺癌的分子机制具有重要意义。
4.研究总结与局限性
4.1 总结
- PanIN具有普遍性和多灶性:通过3D方法,我们能够对人类胰腺组织中的PanIN进行定量分析,发现一个完整的胰腺可以包含数百个PanIN。这种高负荷量显示出单个PanIN的进展风险极低。多灶性PanIN的产生机制尚不明确,可能是胰腺中某些诱导事件促成了PanIN的发育,或者初始PanIN促进了后续PanIN的发展。这些结果对胰腺癌的早期检测和预防干预具有重要意义。
- 3D基因组映射和遗传异质性:研究通过3D基因组映射发现PanIN内部的驱动基因和乘客基因突变存在显著异质性,包括七个PanIN具有多个KRAS突变。多个KRAS突变表明这些PanIN可能具有多克隆起源。这一发现得到了计算进化重建和KRAS热点突变原位检测的支持。在胰腺IPMN中也观察到多克隆性,而PDAC则通常由单一KRAS突变驱动。
- 与其它器官癌前病变对比:胰腺中大量的癌前病变与其他器官不同。结肠腺瘤虽也可多灶性出现,但一般在没有遗传性癌症易感综合症的情况下,全结肠内发现的腺瘤少于五个。结肠腺瘤由双等位基因肿瘤抑制基因丧失引发,而PanIN由单等位基因原癌基因激活引发。与皮肤中的获得性痣(可能的黑色素瘤前体)相似,但皮肤病变数量远少于胰腺中的PanIN数量。这些差异可能需要新的早期胰腺癌前病变的研究范式。
4.2 局限性
- 手术切除的组织可能不完全代表正常胰腺。
- 样本年龄范围有限,未来需要在非疾病胰腺中进行更广泛的年龄跨度评估。
- 尽管进行了38个板块的3D建模,综合3D基因组分析仅限于8个板块。然而,通过多区域处理,最后只得到了37个独立PanIN的突变景观。
- 由于DNA数量不足,未能解析部分PanIN的遗传起源。



























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










