第十章【醛和酮】
1.亲核加成反应
知识点
通式
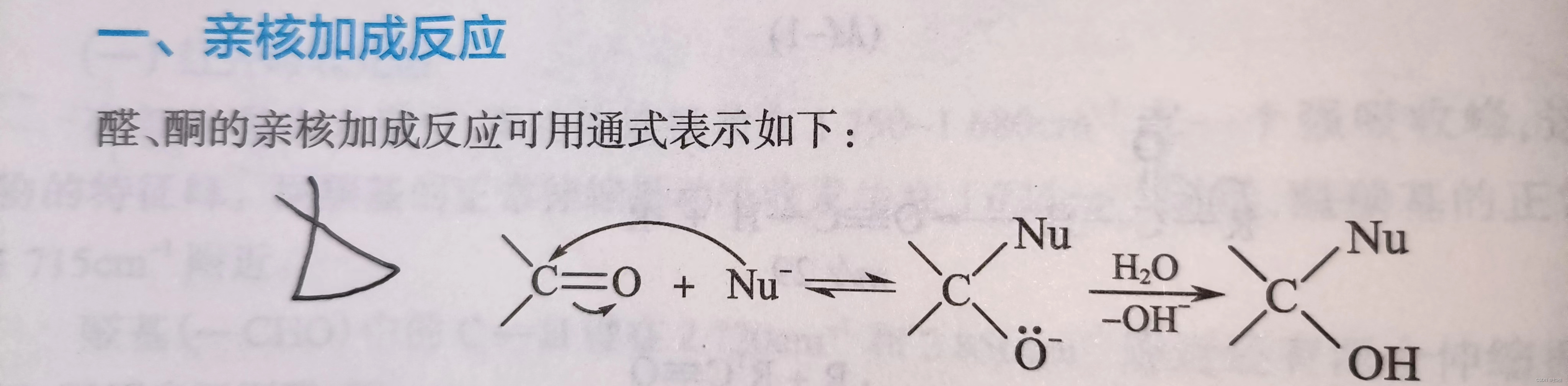
反应活性
不同的醛、酮与同一种亲核试剂反应时,反应活性有差异。例如下图,描述了脂肪族醛、酮系列中的反应活性次序。
有电性和立体两个影响因素,一眼即可理解。简单来说,在羰基上,烷基越少越优先反应,如果拥有相同数量的烷基,那么就比较烷基的简单程度,越简单的烷基越优先反应(这里只考虑脂肪族)。

相关习题
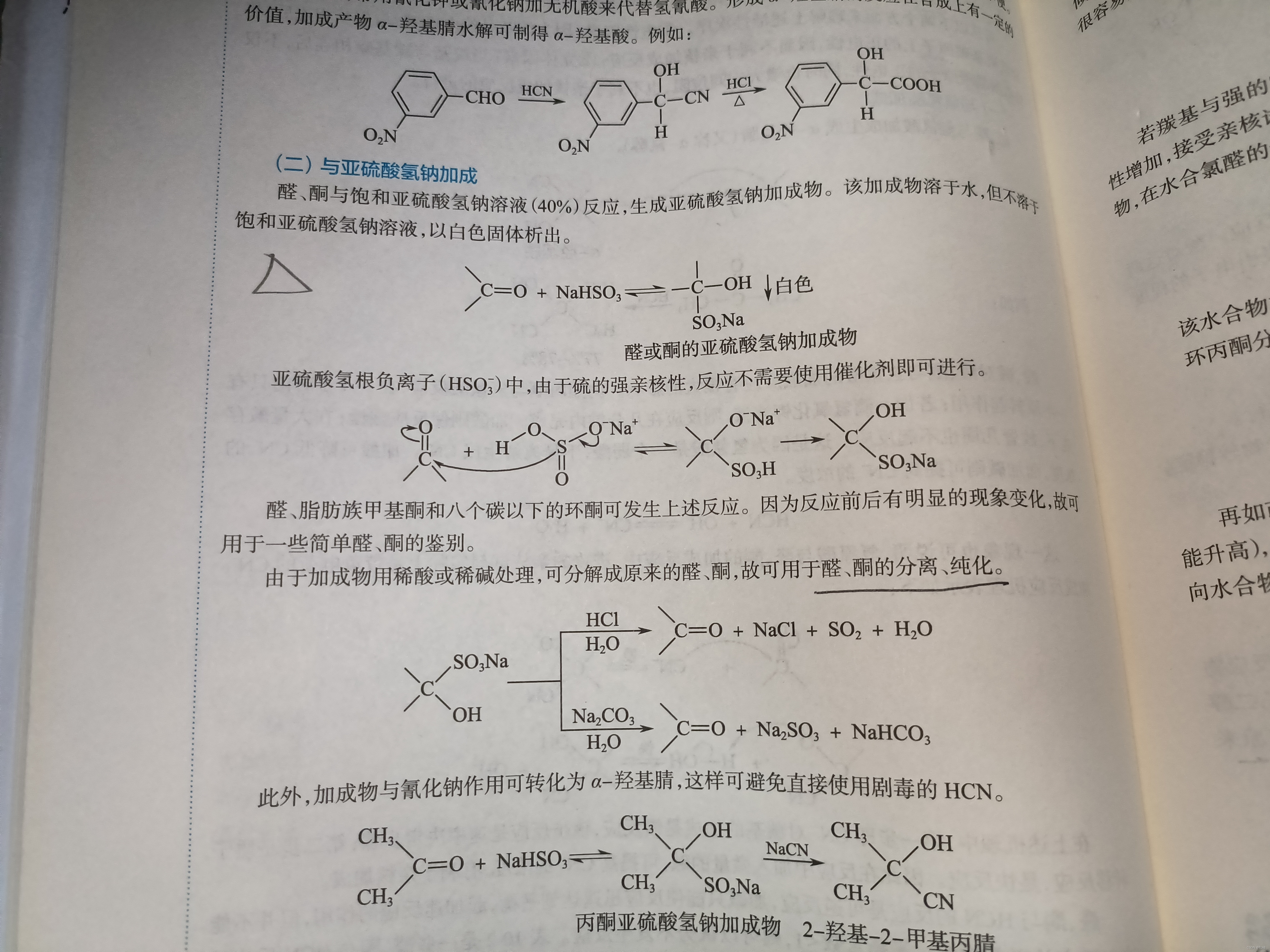
1.与亚硫酸氢钠加成
H
S
O
3
−
HSO_3^-
HSO3−是一种亲核试剂,这里变成了
S
O
3
N
a
SO_3Na
SO3Na的具体原因要看机理。

亚硫酸氢钠的加成的原书内容
机理如书上所示,总的来说还是向着最稳定的形态转化。
另外,关于亚硫酸氢钠与羰基的加成产物,要注意的点是:
- 加稀酸、稀碱可以分解回原来的醛或者酮
- 与氰化钠反应,可以得到原来的醛或者酮与氢氰酸的加成产物,这样可以避免使用剧毒的氢氰酸。
2.与氢氰酸加成
在氢氰酸的加成机理中,
- 第一步反应,也是决定反应速率的慢反应,发起进攻的其实是 C N − CN^- CN−离子
- 第二步反应是快反应,进行质子转移
因此使用
N
a
C
N
NaCN
NaCN也能进行氢氰酸的加成,因为有了关键一步的
C
N
−
CN^-
CN−。

3.与胺及氨的衍生物加成
没什么好说的,还是加成!只不过变成了氨基上的氮原子的孤对电子攻击羰基,然后进行加成。

4.与醇加成
羰基在无水酸性催化剂的作用下与醇加成,先生成不稳定的半缩醛,再生成稳定的缩醛。

总结
记住通式,记住亲核试剂与碳基会发生加成反应。
加成的步骤大概分为下面两部分
- 进攻羰基
- 质子转移
2.α-活泼氢的反应
醛、酮的α-氢受到羰基影响,酸性增强。

知识点
1.α-氢的酸性
α-氢的酸性强弱取决于与α-碳相连的官能团的吸电子能力,吸电子能力越强酸性越强。
例如下面的官能团:
- 硝基( N O 2 NO_2 NO2)
- 羰基( C = O C=O C=O)
- 酯基( − C O O − -COO^- −COO−)
- 氰基( C N − CN^- CN−)
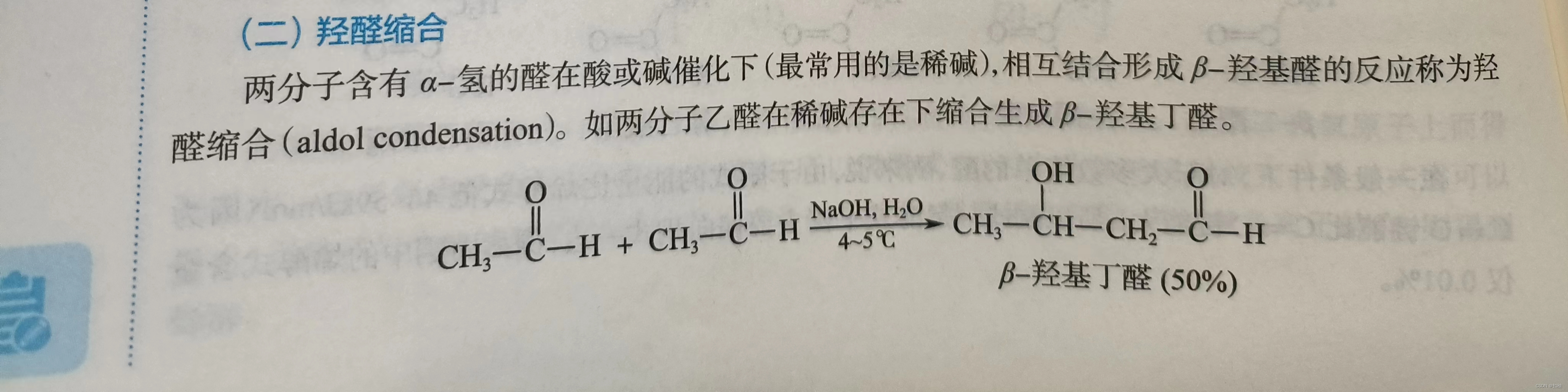
2.羟醛缩合
两个含有α-氢的醛可以在酸或碱的催化下,相互结合形成β-羟基醛,这成为羟醛缩合。
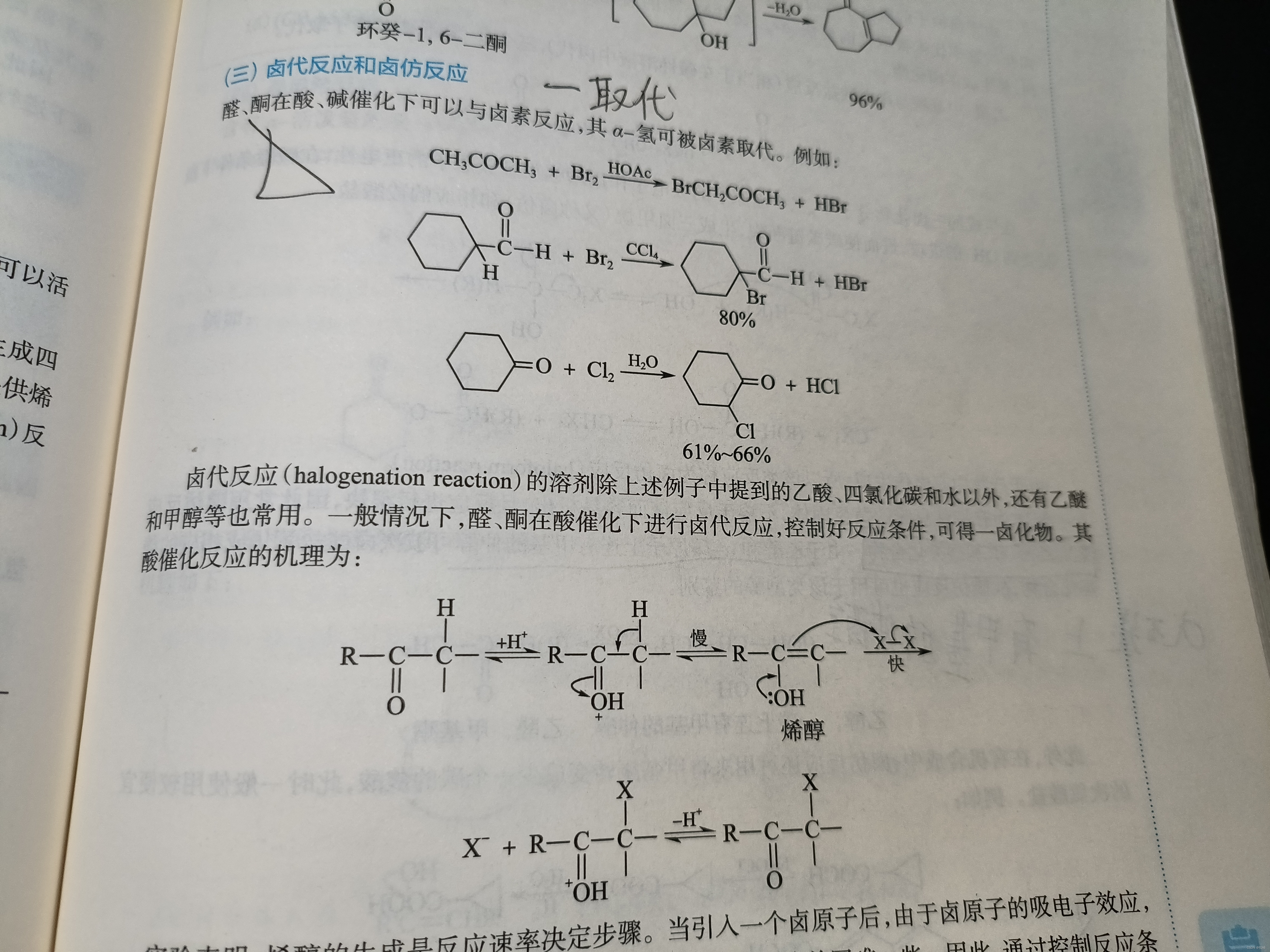
3.卤代反应和卤仿反应
醛、酮在酸或者碱的催化下,卤素取代α-氢,可得一卤代物。
相关习题
1.卤代反应和卤仿反应
题1:溴分子和带有α-氢的酮
在羧酸的催化下,取代羰基的α-氢。

题2.卤酸盐与α-碳上连有甲基的仲醇
可以理解为:
-
N
a
O
C
l
NaOCl
NaOCl
氧化羟基,使其变成酮,并且三个α-氢都被卤代。 - 由于卤素原子的吸电子作用增强了羰基碳原子的正电性,在碱性环境下受到
O
H
−
OH^-
OH−的进攻,导致碳碳键断裂,然后,羰基(
C
=
O
C=O
C=O)与氢氧根(
O
H
−
OH^-
OH−)结合变成了羧基(
C
O
O
H
COOH
COOH)。

相关资料:

2.羟醛缩合
α-氢被氢氧根的进攻生成碳负离子- 该
碳负离子又进攻另一头的羰基后形成环 - 然后再夺取水中的
氢质子,生成β-羟基醛 - 然后羟基被稀氢氧化钠
水解成双键。

总结
一句话概括:醛和酮的α-氢较为活泼,
3.氧化反应
知识点
1.醛的氧化
醛可以被强氧化剂(高锰酸钾,重铬酸钠)和托伦试剂氧化成羧酸。
- 与托伦试剂反应会产生银,也就是
银镜反应 脂肪醛与斐林试剂反应会产生砖红色氧化亚铜,芳香醛则不会反应,可用于区分两种醛。

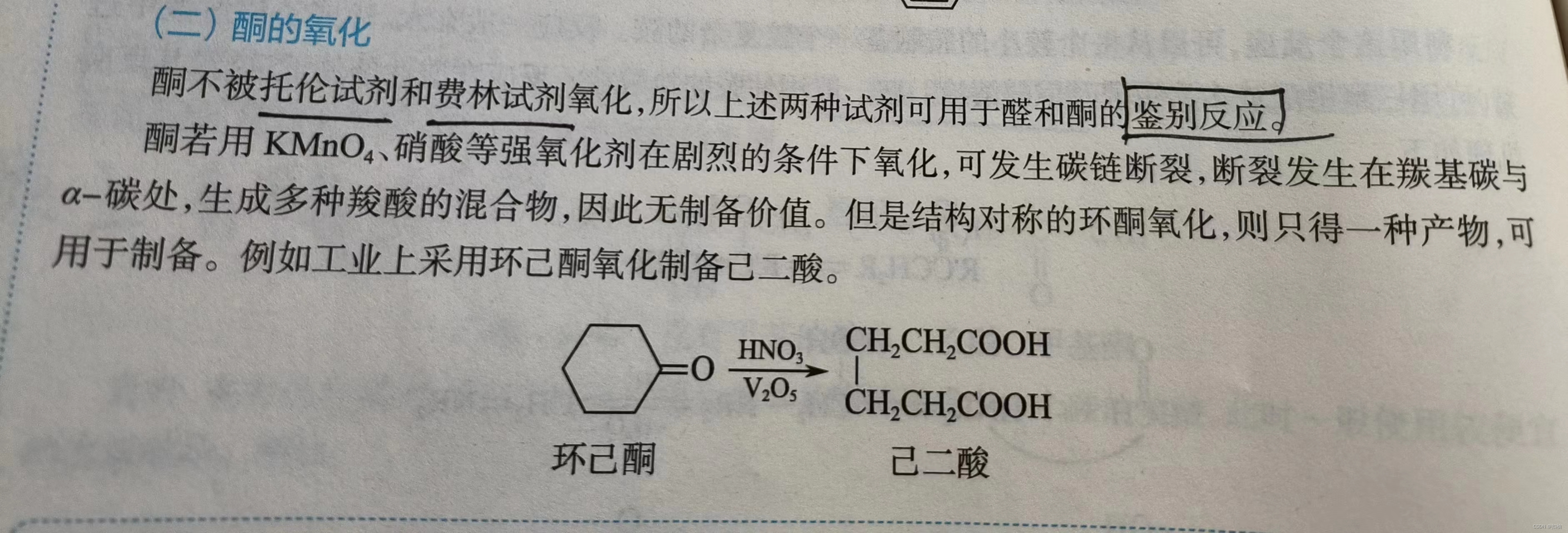
2.酮的氧化
酮可以被强氧化剂氧化,但是不能被托伦试剂和斐林试剂氧化,这个特点可以区分醛和酮。
氧化种发生的碳链断裂发生在羰基的α-碳上。
制备的应用:环己酮氧化制备己二酸
相关习题
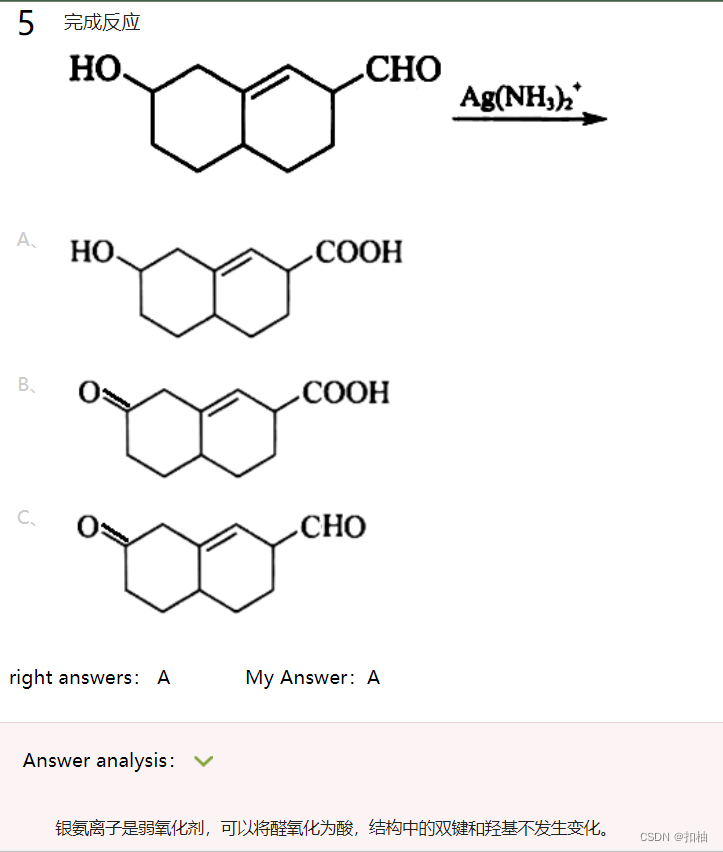
醛的氧化
题1.银镜反应
托伦试剂是弱氧化剂能氧化醛基。
总结
- 醛能被
强氧化剂和弱氧化剂氧化成羧酸,但是斐林试剂仅能氧化脂肪醛,不能氧化芳香醇 - 酮只能被
强氧化剂氧化,不能被托伦试剂以及斐林试剂氧化
4.还原反应
知识点
1.羰基还原成亚甲基
克莱门森还原法(酸性环境,浓盐酸 + 锌汞)

沃尔夫-基希纳-黄鸣龙还原法(碱性环境,肼和氢氧化钾)
对酸不稳定的化合物使用,同样能将羰基还原为亚甲基。特点是有氮气放出。
2.羰基还原成醇羟基
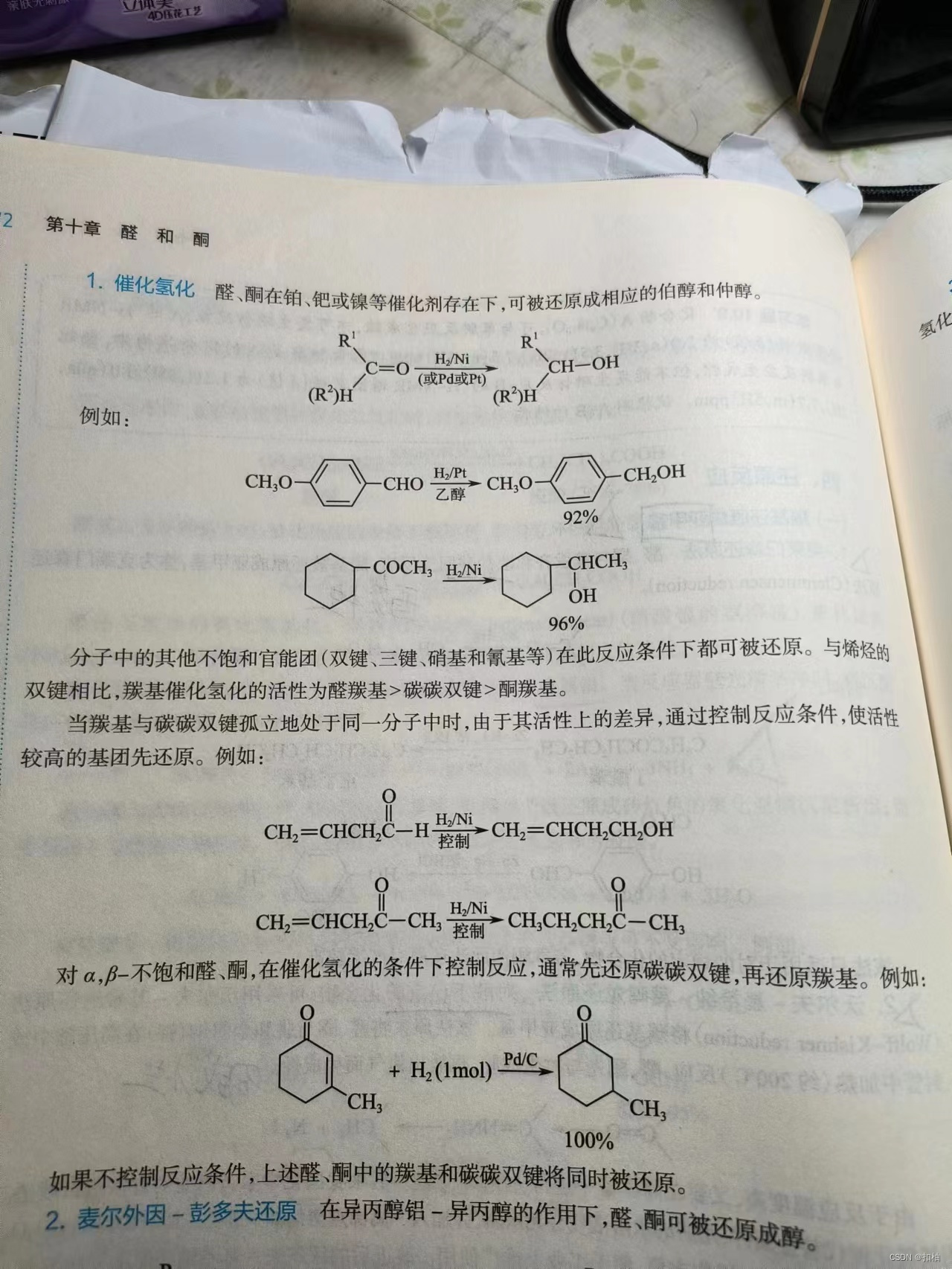
催化氢化
在
N
i
Ni
Ni、
P
d
Pd
Pd、
P
t
Pt
Pt等的催化剂下,羰基被氢气氢化,得到相应的醇。
用金属氢化物还原
两种方法:
- N a B H 4 / 乙醇 NaBH_4 / 乙醇 NaBH4/乙醇
-
L
i
A
I
H
4
/
乙醚
LiAIH_4 / 乙醚
LiAIH4/乙醚,
无水条件(因为 L i A I H 4 LiAIH_4 LiAIH4极易水解)
注意:
- 碳碳
双键和碳碳三键都不能被上述两种氢化物还原。 N a B H 4 NaBH_4 NaBH4无法还原羧基和酯基。而 L i A I H 4 LiAIH_4 LiAIH4则可以。
本质:
- 氢负离子与羰基亲核加成。

相关习题
催化氢化
克莱门森还原法,将羰基还原成亚甲基。

用金属氢化物还原
用金属氢化物将羰基还原成醇羟基。

总结
锌汞和浓盐酸将羰基还原成亚甲基沃尔夫-基希纳-黄鸣龙还原法在碱性条件下将羰基还原成亚甲基催化氢化,将羰基还原成醇羟基金属氢化物,将羰基还原成醇羟基
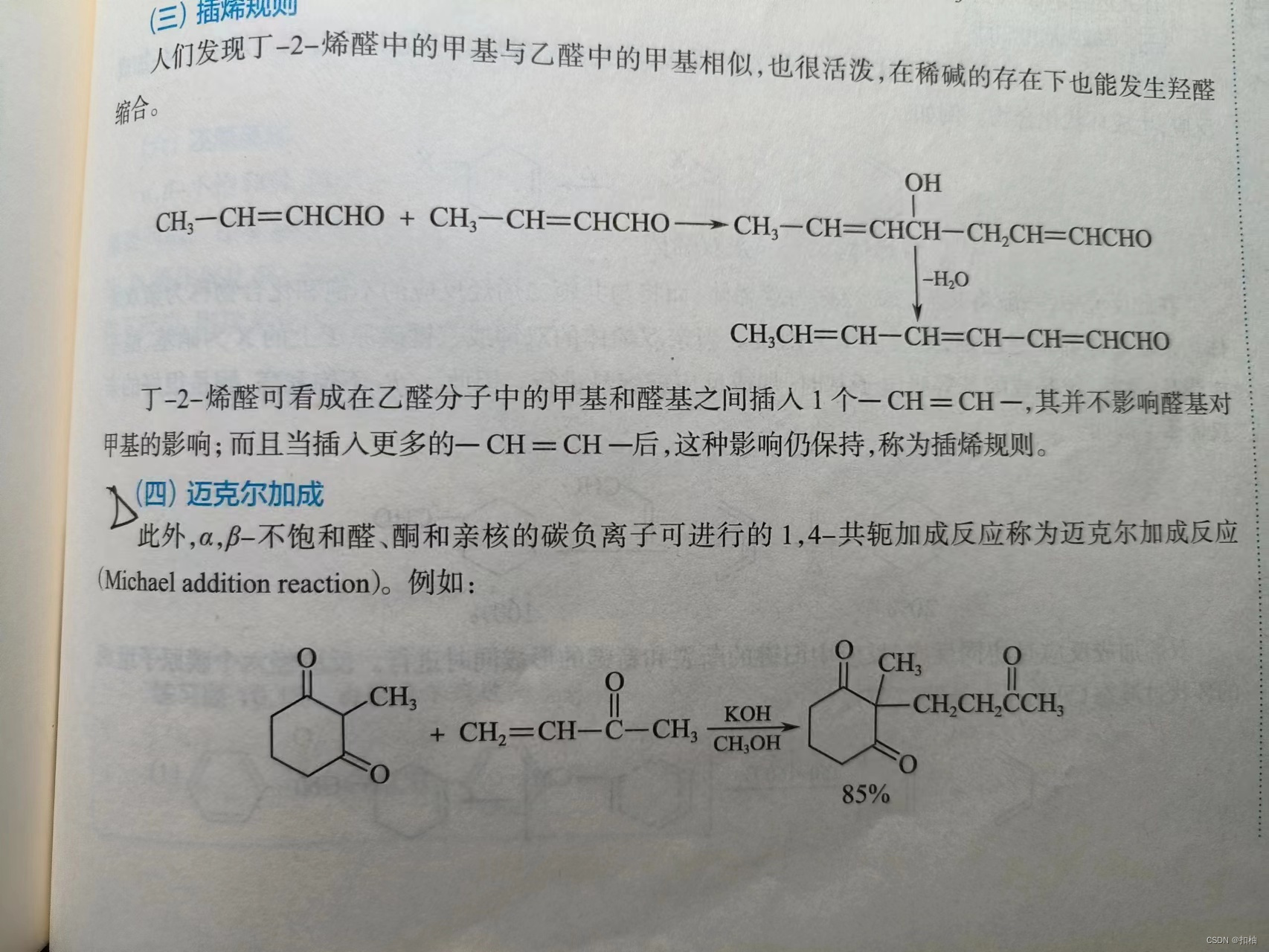
5.α-β不饱和醛、酮
知识点
1.亲核加成
亲核试剂进攻羰基,与羰基的碳原子连接,然后质子与氧原子连接。
-
与
氢氰酸、亚硫酸氢钠加成:- 以
1-4加成为主
- 以
-
与
有机炔钠(例如 C H ≡ C N a CH \equiv CNa CH≡CNa)、有机锂化合物(例如 P h L i PhLi PhLi)加成:- 以
1-2加成为主
- 以
-
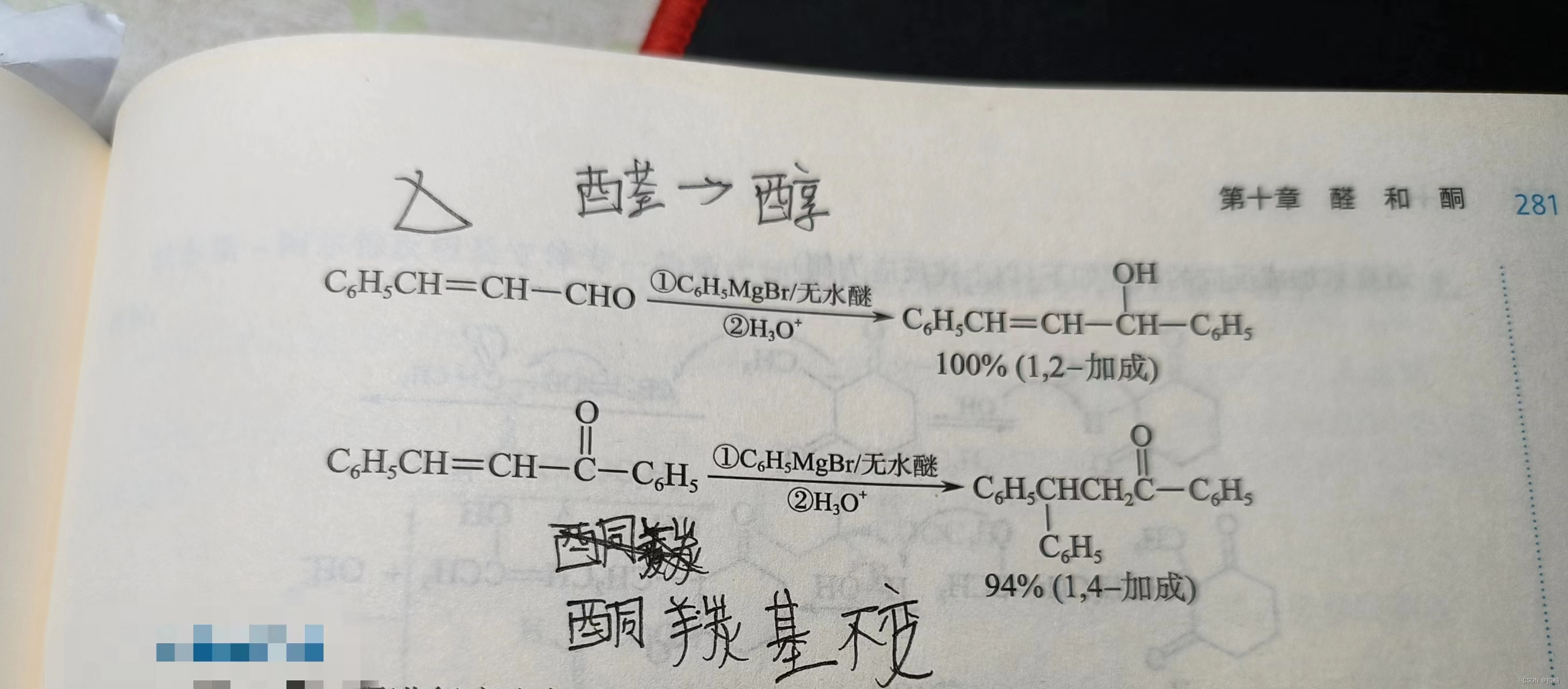
与
格氏试剂加成:- α-β不饱和醛、酮的
体积较小时,以1-2加成为主 - α-β不饱和醛、酮的
体积较大时,以1-4加成为主
- α-β不饱和醛、酮的
至于对α-β不饱和醛、酮体积大小的判断,请看下图。
注意:
1-4加成的时候,如果在1号位置上加成的是质子,将会发生互变异构,因此这里1-4加成的结果中,质子会加到3号碳上。
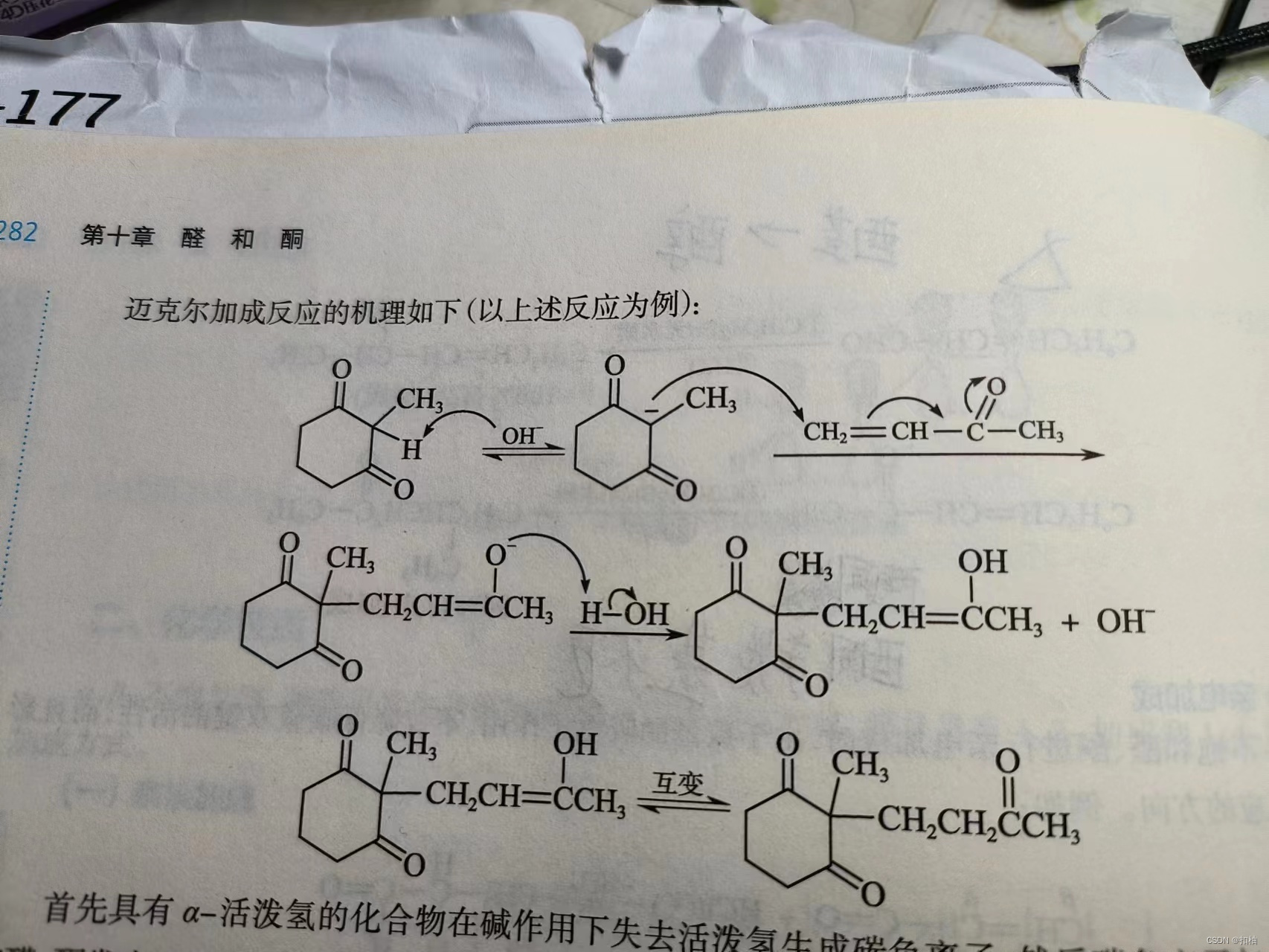
2.迈克尔加成
α-β不饱和醛、酮跟碳负离子进行1-4共轭加成反应称为迈克尔加成。
迈克尔加成与亲核加成
区别在于:
- 亲核加成是亲核试剂直接在
α-β不饱和醛、酮的对应位置进行加成 - 迈克尔加成是亲核试剂攻击碳原子产生
碳负离子,然后α-β不饱和醛、酮的4号位置与这个碳负离子连接。
共同点在于:
- 迈克尔加成也会出现
互变异构,导致原本加成在1号位上的氢质子最后来到了3号位上。
相关习题
1.亲核加成
体积较小时,以1-2加成为主。

第十一章【羧酸和取代羧酸】
酸性
知识点
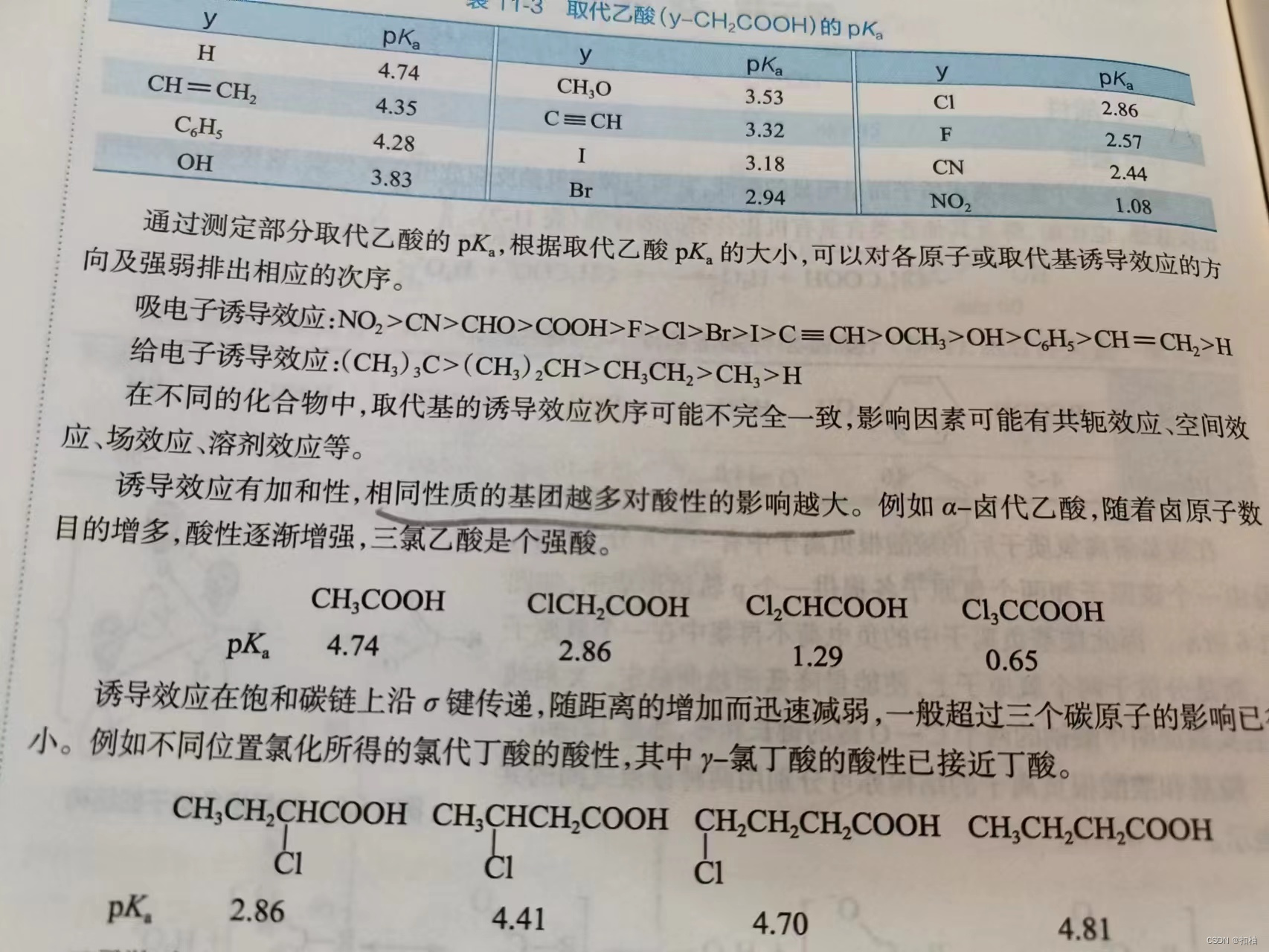
1.酸性
羧酸的酸性比碳酸,酚要强。
在脂肪族一元羧酸中,甲酸的酸性最强。
关于给电子基和吸电子基的影响:
-
烷基的
给电子诱导效应不利于羧酸根的负离子负电荷分散,导致稳定性降低,酸性降低,烷基的给电子诱导效应越强,酸性越弱。 -
如果取代基是硝基、氰基、醛基等
吸电子诱导效应,羧酸的酸性会得到增强。吸电子诱导效应越强,酸性越强。 -
吸电子诱导效应大小关系:
N O 2 > C N > C H O > C O O H > F > C l > B r > 三键 > O C H 3 > O H > C 6 H 5 > 双键 > H NO_2 > CN > CHO > COOH > F > Cl > Br > 三键 > OCH_3 > OH > C_6H_5 > 双键 > H NO2>CN>CHO>COOH>F>Cl>Br>三键>OCH3>OH>C6H5>双键>H -
给电子诱导效应大小关系:
( C H 3 ) 3 C > ( C H 3 ) 2 C H > C H 3 C H 2 > C H 3 > H (CH_3)_3C > (CH_3)_2CH > CH_3CH_2 > CH_3 > H (CH3)3C>(CH3)2CH>CH3CH2>CH3>H -
上述的基团的酸性增强或降低的效果是可以由多个基团
叠加的。
相关资料:
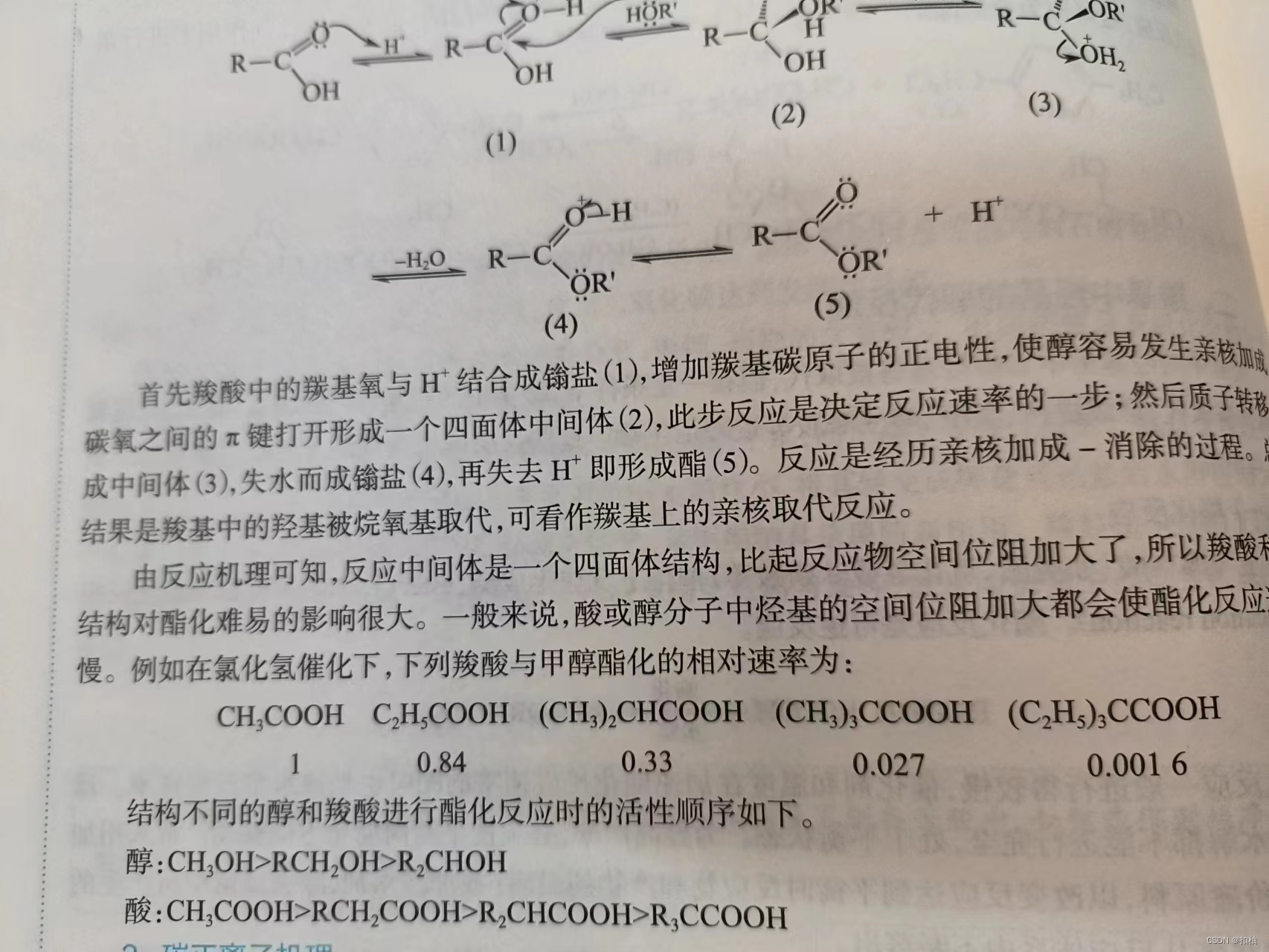
2.酯化反应
酯化反应的速率受到反应物的构造的影响。总的来说,构造越复杂,空间位阻越大,反应越慢。
3.α-氢的反应
相关习题
1.酸性
题1
羧基、烯烃、炔烃都是吸电子诱导效应基团,它们的关系是: 羧基 > 炔烃 > 烯烃 羧基 > 炔烃 > 烯烃 羧基>炔烃>烯烃,并且它们对酸性的增强效果是可以叠加的。
按照上文讲解酸性上的关系理解即可。

2.酯化反应
题1
苯甲酸(1)没有取代基,因此它的羰基碳的电正性相对于其衍生物来说最高。这意味着它对亲核试剂的丙醇来说更加活跃。
对于2,4,6-三甲基苯甲酸(2)和2,4-二甲基苯甲酸(3),甲基是给电子基团,会通过诱导效应(+I效应)向羰基碳原子提供电子密度。这会减少羰基碳的电正性,从而降低羧酸与醇的反应速率。由于2,4,6-三甲基苯甲酸具有三个甲基基团,其给电子效应比2,4-二甲基苯甲酸的两个甲基基团更强,因此2,4,6-三甲基苯甲酸会有更低的反应速度。
因此,这些酯化反应的速度排序(由快到慢)是:
(1)苯甲酸 >(3)2,4-二甲基苯甲酸 >(2)2,4,6-三甲基苯甲酸。

题2
- (1)CH3OH (甲醇) 是一个一级醇,拥有一个甲基作为唯一的取代基。
- (2)CH3CHOHCH2CH3 (异丙醇) 是一个二级醇,拥有一个更大的立体障碍。
- (3)CH3CH2CH2OH (正丙醇) 也是一个一级醇,但分子较甲醇更大。

























 970
970

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








