
基于大电极电刺激诱导粗聚焦皮层激活的成功,使用植入微电极的皮质内微刺激(ICMS)可以调节神经活动,并在更精细的空间分辨率下诱发行为反应。在ICMS中,口腔内植入的微接触点向周围组织注入电荷,产生离子电流流,使可兴奋细胞的细胞膜去极化,并在局部改变神经活动。这种能力使各种应用成为可能,如建立神经活动和行为之间的因果关系,调节注意力和学习和产生感知和感觉。在所有这些不同的应用中,ICMS的总体技术目标是产生有针对性的、高分辨率的神经元调制,能够在较长的一段时间内引起稳定的感知或感觉。由于ICMS经常诱导轴突通道激活神经元,实现这一目标需要(1)组织电极界面的亚细胞接近和稳定性,(2)刺激电极可靠地产生相同的、高度局部的电荷注射。

当前的ICMS电极明显比脑组织更坚硬,导致组织-电极界面不稳定,并且在神经元反应中存在实质性的“时空模糊”。在慢性植入期间,组织电极界面恶化。神经元变性和探针周围胶质瘢痕的形成改变了刺激引起的电场,从而改变由此产生的神经和行为反应。可能与界面退化有关,在慢性应用中,通常需要大量和不断增加的刺激振幅来维持行为反应,这将加速刺激电极的恶化,并增加组织损伤的风险。在最近的一个病例中,检测阈值没有随时间的增加而增加,观察到很大的日常变化。目前尚不清楚这些显著的变化是由于不良组织反应的变化、电极的退化,还是由于神经组织的兴奋性或功能反应的内在变化。
直观地说,促进设备-组织整合可以提供一种方法,通过增强电极-神经元的邻近性来提高ICMS的分辨率和稳定性。基于生物物理原理,植入没有胶质疤痕封装将减少电极和目标神经元之间的分离,这将减少激活阈值,减少激活的神经元数量,提高焦点性,消除时变异物组织反应,并导致高分辨率、长期稳定的神经调节(图1)。在实验上,改善设备-组织整合显著提高了记录的效率、密度和寿命。然而,一个完整的组织-设备界面对ICMS的影响尚未确定。在这项工作中,我们设计了器件的灵活性,并开发了超柔性刺激电子线(StimNET电极),以同时满足在组织电极界面上的强大电荷注入和亚细胞稳定性的要求。我们在小鼠模型中使用了一套光学学、电学、行为学和组织学方法来评估神经调节的有效性、分辨率、稳定性和组织相容性。我们证实了这些组织整合电极产生空间受限的神经元激活,并在显著减少的刺激电流下引起纵向稳定的行为检测,而没有神经元降解或胶质瘢痕。
这些结果强调了紧密的组织-电极整合在刺激效果中的重要性,并为持久、高分辨率提供了一条途径,低电流下的神经调节,以减少组织恶化或脱靶副作用恶化的风险。
研究方法强电荷注入的刺激
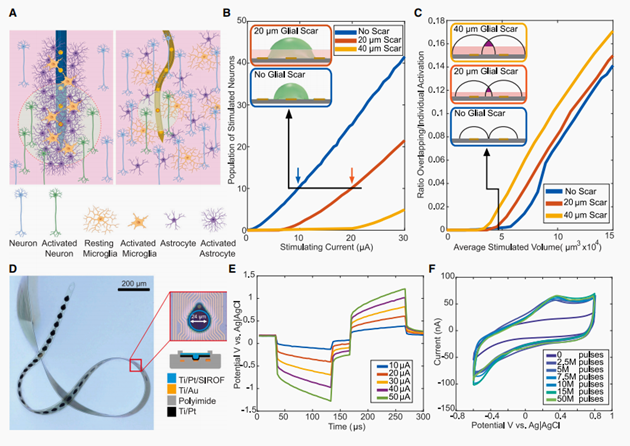
图1 工程组织集成的柔性电极,以提高微刺激的效果
我们首先进行了原理证明有限元模型模拟,以比较不同神经胶质瘢痕厚度(0、20和40 mm)下神经元的激活阈值。神经胶质瘢痕的缺失减少了激活相同数量的神经元所需的电流,并降低了激活的组织体积(图1B)。这种效应与神经胶质瘢痕的厚度有关:瘢痕越薄,刺激非瘢痕组织中神经元所需的电流越小,在阈值时总组织激活(包括神经元和神经胶质瘢痕组织)的总体积越小。同样,当激活不被神经胶质瘢痕所占据的相同组织体积时,神经胶质的扩散更小,没有神经胶质瘢痕。此外,由于电流的扩散通过减少神经胶质瘢痕而减少,当刺激附近的两个接触时,组织激活的空间重叠减少了(图1C)。与在相同组织激活体积下有疤痕的刺激部位相比,没有疤痕包裹的近距离刺激部位提供了最具空间差异的组织激活。
数值模拟的结果促使我们通过优化组织-电极界面来最大限度地提高ICMS的功效。我们选择大幅减少皮质内电极的基底厚度,以最小化弯曲刚度,并提供紧密的组织-电极整合。我们之前的研究表明,在慢性植入过程中,总厚度为1 mm的纳米电子线(NETs)形成了一个亲密的组织-电极界面,具有完整的脑-血屏障,亚细胞尺度上的组织-电极稳定性,电极附近没有神经元降解和胶质瘢痕。然而,超薄绝缘层(0.5 mm)和多层器件结构对没有结构和功能破坏的持久刺激带来了重大挑战。通过迭代测试和设备优化,我们实现了超柔性的StimNET电极,在相似的形式因素下,与记录网相比具有相似的超柔性刺激(图1D)。我们专注于以下方面的修改。首先,为了减少附近迹线之间的串扰风险,提高生物相容性,我们将基质材料从SU-8光刻胶转换为聚酰亚胺(PI),这是一种更强的拉伸强度,并采用PI的多层平面微加工(STAR方法)。其次,为了提高NET微触点的电荷存储容量和电荷注入容量,我们在微加工过程中,在晶圆尺度上对Au触点进行了IrOx溅射。第三,为了预防覆盖IrOx垂直墙上的潜在裂缝,我们抵消了通孔和接触点。最后,也是重要的是,为了减轻分层的风险,我们在IrOx顶部的每个接触点周围使用PI微制作了一个帽环(厚度为0.3 um)作为额外的机械加固(图1D)。优化后的StimNET电极柄厚度为1 um,帽环处厚度为0.3 um,宽度为1800 um,宽度从100 um到36 um。该设备有32个单独定位的微触点,用于直径为24um的记录和刺激。相邻触点之间的中心中心间距为60 um。
为了验证StimNET电极的电荷注入和存储容量,我们在体外进行了电压瞬态测量和循环伏安法(CV)。个人微接触StimNET电极输出电流高达50 uA同时保持最大阴极和阳极驱动电化学电位偏移的水窗口[0.6-0.8V](图1E),例如,最大极化电极界面最负极化Emc=0.41-0.04 V和最正极化EuA=0.22-0.4 V的电流。StimNET电极的电荷注入容量为1.1 mC/cm2,与具有溅射IrOx、阴极第一脉冲、无电压偏置的刚性电极的典型电荷注入容量相当。
图1F显示了一个具有代表性的脉冲测试,我们在500 Hz刺激一个接触点,对5000万脉冲使用30 uA双相电荷平衡脉冲,并在脉冲过程中周期性地以100 mV/s的扫描速率获得CV。除了最初电荷存储容量的增加,以及Ir3+/Ir4+氧化还原位点持续氧化的增加,40在250万到5000万刺激脉冲之间,CV几乎没有变化。这些结果表明了StimNET电极的高电荷注入和存储能力,并支持了其在刺激过程中的持久性和鲁棒性。
在清醒的动物中,ICMS诱发的神经元激活的高通量定量
评估ICMS疗效长期在单细胞分辨率,我们共同植入颅窗口和StimNET电极的躯体感觉皮层你1-GCamp6s小鼠和执行双光子(2P)Ca2+成像在ICMS(图2)植入后至少2周,此时手术创伤已经消退。

图2 在清醒的动物中,ICMS诱发的神经元激活高通量
与之前大多数使用麻醉动物的ICMS空间激活模式的研究不同,我们对清醒动物的神经元激活进行了2pz-堆栈成像,以消除麻醉的混杂效应。我们在50 Hz连续刺激,同时获得1 3 1 3 0.4 mm(z间距2 mm),每个大约需要30秒(STAR方法)。刺激范式是不敏感的时间响应奇异脉冲但允许准确量化的体积神经元持续活跃在刺激:50 Hz刺激诱发相对快速上升的Ca2+荧光提高信噪比。在本研究中,我们关注的是种群激活的量化,而没有分析时间动态。
图2B显示了一组在刺激过程中获得的具有代表性的Ca2+图像,在刺激过程中,细胞由于自发或ICMS诱发的激活而发出荧光。为了从自发活动的背景中量化ICMS诱发的神经元激活,我们使用了一个随机ICMS试验与基线试验交替进行的试验结构(自发活动,无刺激)进行每对受刺激试验和基线试验之间的差异测量和分析(STAR方法)。使用定制的自动数据采集管道,我们能够在一个典型的3小时会话中获得300-400z堆栈,其中包含随机刺激通道和电流块,以及7到9个副本。4个电流水平和3个刺激通道的代表性试验显示Ca2+荧光有明显的调节(图2C;试验序列被识别并按电流和刺激通道分组,以呈现清晰)。
然后我们开发和使用计算效率矩阵操作计算配对刺激和基线之间的差异,确定体素被任何电流和刺激网站,量化激活的概率在n重复,并实施概率阈值(这里我们设置为75%)在所有试验识别区域一直激活只有在刺激(图2D)。最需要计算的步骤,分割来识别由ICMS诱发的单个神经元,只进行了一次,将所有试验在同一成像部分聚集在一起。这一管道极大地提高了成像处理的吞吐量,使得在多个刺激参数下识别三维(3D)中的单个神经元及其位置成为可能(STAR方法)。此外,由于在分割前使用不同刺激部位和不同ICMS电流的所有试验的激活区域都被一起识别出来,分段神经元不太容易发生小的漂移,这有助于比较跨刺激部位和电流的神经元激活模式(STAR方法)。

图3StimNET电极在低电流下引起空间定位的神经元激活
StimNET电极在低电流下引起空间定位的神经元激活
为了绘制神经元激活的三维空间分布,我们刺激了躯体感觉皮层第2/3层StimNET电极的个体部位,在组织深处ICMS至500 mm时同时进行叠加成像,并确定了诱发神经元及其位置。在2 uA的低ICMS电流下,我们检测到电极附近的少量细胞的激活(图3A)。
直观地看,ICMS诱发神经元的数量随着ICMS电流的增加而增加(图3B)。我们比较神经元的数量和位置激活相同的刺激网站在四个电流水平(2、5、7和10 uA)来确定神经元的比例持续激活在两个相邻的电流水平,例如,神经元的部分激活在2 uA也激活在5 uA。在我们测试的所有三对电流中,至少85%被低电流激活的神经元也被高电流激活(图3B),由于StimNET电极的机械顺应性,支持了组织-电极界面的短期稳定性。此外,我们量化了体积神经激活密度作为电流的函数,并将3D激活密度投影到2D中进行可视化(图3C;平均5只动物,11个成像阶段,21个刺激点)。神经元的激活高度局限于2 uA刺激部位的附近,这是一种以前很少研究的低电流。一旦电流增加到5 uA以上,所需的电流诱导神经元激活在以前的研究中,激活模式成为空间分布正如之前的研究,与高密度激活近端刺激电极和稀疏激活超过200毫米。同样,ICMSevoked神经激活的空间范围,定义为从任何诱发神经元到刺激部位的最大距离,从2到5 uA显著增加(图3D),但随着ICMS电流的进一步增加而保持相对不变。作为方向比较,神经丛探针(刚性硅电极)需要更高的15-30 uA的电流,才能在清醒的动物中引起可区分的神经元激活。44这些实验结果支持了我们的模拟(图1B),并证实了超柔性StimNET电极可以在极低的电流下引起焦点激活。
神经元的激活是空间选择性的,诱发神经元的数量是纵向稳定的
ICMS的大多数应用将来自于在一段时间内通过邻近接触激活离散神经元群的能力。因此,我们通过纵向2P Ca2+成像(STAR方法)评估了StimNET电极的空间选择性,即每个接触激活的独特群体与总激活群体的比例。如果两个相邻的接触导致神经元完全不同、不重叠的激活,则空间选择性为1,而如果它们激活完全相同的种群,则空间选择性为0。
图3E显示了在5 uA刺激两个空间相邻接触时具有代表性的神经元激活模式。根据微加工的定义,中心到中心的距离估计为60毫米,因为我们的植入方案导致最小偏差,这在我们之前的工作中得到了证明。每一种接触都引起了独特的神经元激活,只有少数细胞被两种接触共同激活。为了量化空间选择性如何随着ICMS电流和刺激接触的分离而变化,我们在四个电流水平和三个接触距离下刺激和同时进行体积成像。在2 uA的低刺激电流下,空间选择性为>95%,即使接触点之间的距离仅为60mm(36mm)。正如预期的那样,增加刺激电流显著降低了所有测试的接触间距的选择性(图3F)。特别是,最低的电流具有最高的空间选择性。对于任何给定的刺激电流,增加接触分离提高了选择性。值得注意的是,120 mm的中心到中心的分离足以对所有测试的电流实现>90%的空间选择性,这验证了StimNET电极在高选择性神经调节中的应用。我们在刺激期间纵向重复Ca2+成像,直到颅窗混浊,这在这组动物中发生在植入后约9周。从纵向成像系列中,我们绘制了神经元激活的空间图,并量化了在刺激激活后的两个相邻接触时被激活的神经元数量和空间选择性作为时间的函数。相同的刺激部位和电流诱发的神经激活的空间模式在时间上是相似的,而每个接触点每周激活的实际神经元都有轻微的变化(图3H)。在整个实验过程中,相同电流下激活的神经元数量和相同刺激参数下的空间选择性保持稳定(图3G)。这些结果表明,在慢性时期,来自StimNET电极的相同电流激活了相似数量的神经元,并保持了相同的高水平的空间选择性。
StimNET电极可以在低电流下引起稳健的、长期稳定的行为检测
为了评估通过长期植入刺激的低振幅ICMS的行为可检测性,我们开发并使用了一个去/不去任务,其中缺水、固定头部的小鼠被训练将一个轮子超过角位移阈值,以获得水奖励(STAR方法;图4)。行为测试在StimNET电极植入后几周开始,持续了226天(n = 5)。行为测试的最后一天对应于1-5只小鼠植入后的第308、294、284、264和242天。我们使用了100 Hz的刺激频率,这是在人类患者中进行的ICMS实验中常用的频率。随机试验的间隔时间间隔(2-6s)基于ICMS的时间预期阻止小鼠转向(图4B)。我们通过训练小鼠在刺激前抑制冲动转弯,确保了转向不是随机的,而是ICMS刺激引导的反应(图4B,插图)。一个具有代表性的心理测量曲线(图4C)显示,在整个任务中,动机都很高(随机试验中对阈上刺激的反应为100%),冲动和随机转向很少(阈下刺激下接近0%)。为了有效和准确地测量多个部位的行为检测能力,我们使用了自适应阶梯方法,其中根据动物的表现提高或降低ICMS的振幅来估计阈值。在图4D所示的一个典型例子中,最后四次逆转的刺激电流为1 uA均无响应和2 uA均无响应),导致检测阈值为1.5 uA。这种高通量的方法允许我们在一个疗程中单独量化跨越皮层深度的10-17个接触的阈值。
我们首先将多达226天的整个实验时间内的所有测量结果连接起来,并检查了行为可检测性作为皮层深度的函数。我们发现了不同皮质层间阈值的显著差异(图4E)。使用Dunn的事后校正进行配对比较显示,浅层皮质层L1和L2/3的检测阈值明显高于更深的皮质层L4-L6,而L4的阈值最低。检测阈值的层间差异与其他使用刚性层流探针的ICMS行为研究相似。
重要的是,StimNET电极的行为检测阈值很低。图4F显示了使用L4-L6中的所有接触从所有测量过程(38个接触,总共362次接触)中确定的阈值。5种动物的平均阈值分别为1.12、0.35、0.88、1.14和0.37nC/cm2其中3种阈值均低于1nC/cm2。每只动物的最低单次测量阈值分别为0.21、0.08、0.17、0.33和0.17nC/cm2,均远小于0.5nC/cm2。特别是,在小鼠2中,受试者和疗程的最低测量值为0.08 nC/cm2(0.5 uA),其精度受到我们的刺激器在1 uA时的当前分辨率的限制。阶梯法的最后四次逆转的电流分别为0(100%无响应)或1 uA(100%响应),导致电流阈值为0.5 uA。
然后,我们使用L4-L6层深层皮层的StimNET电极接触仔细检查了ICMS行为检测的时间依赖性。由于L4、L5和L6的接触提供了相对较低的检测阈值,我们一起分析了来自L4-L6的所有数据,而没有区分细微的深度差异。在所有动物中,L4-L6中所有刺激部位的平均检测阈值,有一个初始衰减,可以在前20-70天内被经验描述为指数曲线。阈值在很长一段时间内保持稳定,变化不大(图4G)。稳定阶段的电荷注入阈值比初始阶段要低得多,在初始阶段检测阈值降低。从选择的单个通道中获得的检测阈值的纵向稳定性也更优越。在图S3A中的两个例子中,阈值在大部分时间内保持不变,并且在153天(小鼠5)和226天(小鼠2)内最多变化1 uA。为了确保这些结果的可靠性,我们检查了阶梯法的最后四次逆转中的刺激电流,这导致了阈值的量化。在过去的四次逆转中,80%的去反应和不去反应之间只有1 uA(我们的刺激器的分辨率)的变化,支持在所有阶段的高保真检测。
值得注意的是,在两种动物(小鼠2和5)中,来自单个刺激部位的1.5 uA(0.25nC/cm2)足以在长时间内引起并保持稳健的行为检测。据我们所知,这提供了在行为检测或神经元激活方面的慢性ICMS研究的最低阈值(图4H)。此外,我们还探讨了是否可以通过改变刺激频率来进一步减少整体电荷注入。我们绘制了频率阈值依赖关系,并发现通过使用6 Hz的低频,我们在轻度升高的电流阈值下将每秒的电荷注入减少了一个数量级(图4H)。我们的刺激参数远低于电荷密度的损伤阈值,由香农的标准在典型的k常数值k = 1,1.5和2.54参数也远低于电荷每相阈值4nC/cm2,更准确地描述组织损伤效应时刺激微电极根据先前的研究。这些结果表明,StitNET在显著的低电荷注射下引起了稳健、长期、长期稳定的行为检测。
在其中一种动物(小鼠3)中,在电压瞬态测量过程中,一个估计为40 uA的大直流电(DC)被意外地传递了几秒钟。这种电流和持续时间通常被用来在组织中产生电解损伤。该事件立即提高了L4-L6中所有接触者的检测阈值,并稳定了99天,平均阈值为4.45 ± 0.33至13.73 uA。检测阈值随后在116天内下降,最终稳定在4.87 ± 2.14 uA,与事件发生前的值相似。在这种情况下,检测阈值的变化与我们的假设相一致,即紧密的组织-电极整合是导致我们获得的低阈值的原因。这可以解释为我们意外地传递的较大的直流电流破坏了局部组织,这增加了从可兴奋的神经元到刺激部位的平均距离,因此需要更高的电流来引起相同的行为反应。随着时间的推移,组织愈合,这降低了神经元到StimNET电极的平均距离和使用它的检测阈值。
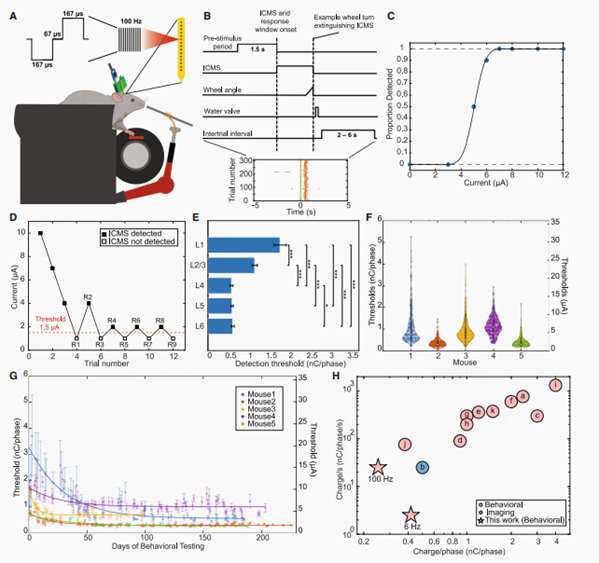
图4 刺激物在低电流下引起强大的行为检测
慢性ICMS后,StimNET电极保持紧密的组织-电极整合和正常功能
我们通过体内成像和死后免疫组化相结合研究了设备-组织界面的性质。植入后2个月获得的体内2P成像的典型例子显示,与植入的StimNET电极周围和密切接触的致密、健康的血管网络。神经元种群共同驻留在StimNET电极的微米范围内,而刺激接触,没有神经元变性的迹象(图5A)。这些观察结果与我们之前报道的没有刺激的紧密组织整合在定性上一致。为了量化组织对慢性植入和StimNET电极刺激的反应,我们对StimNET电极周围的组织进行了免疫组化评估,并比较了刺激部位、被动(植入但无刺激)部位和对照组(未植入的对侧半球)(图5B)。NeuN的荧光强度随距离StimNET电极的距离没有变化,表明距离StimNET电极附近的神经元密度与对照组相同。Iba-1和GFAP的荧光强度在StimNET电极的50 mm范围内有轻度升高,但没有小胶质细胞或星形胶质细胞的包封(图5B和5C)。重要的是,这些标记物的刺激部位和被动部位之间没有差异。这些结果表明,StimNET电极支持相同的稳定,紧密集成接口与脑组织记录网,组织设备接口大大改善其他刚性或柔性电极,和研究中使用的刺激电流在安全限制,没有引起组织损伤。

图5 植入时长与神经元变性情况
接下来,我们研究了StimNET电极的功能完整性。每只动物的刺激脉冲数分别为470万、330万、240万、390万和110万(分别为1-5只小鼠),个体接触部位的脉冲计数从12000到190万脉冲不等。表现最长的动物(行为测试中的小鼠1)在植入308天后继续行为检测低振幅刺激,直到其后端连接器失败,突出了StimNET电极在体内的寿命。
我们分析了在接受行为测试的动物中,StimNET电极的阻抗作为植入后几天的函数。来自多个动物的StimNET电极在1 kHz时的阻抗在37周的慢性时间内显示出稳定性。这与之前的研究报告在长期植入期间阻抗显著增加或减少形成了对比。在其他电极中观察到的阻抗变化归因于组织-设备界面上的生物和非生物故障,如神经胶质瘢痕封装、设备绝缘损伤、腐蚀和分层。我们测量的稳定阻抗与我们之前报道的完整的组织界面一致,表明StimNET电极没有这些生物和非生物失效。此外,我们在长期的实验中反复测试了电荷注入能力。.图5E显示了植入后第16周(第114天)和第42周(第293天)(第0周/第0天和第26周/第179天)来自代表性接触的8 uA双相脉冲的电压瞬变,该脉冲输出超过925,000次脉冲。波形形状和振幅没有明显变化,进一步突出了StimNET电极在体内大量电荷注射时的慢性装置稳定性。
我们评估了刺激部位的纵向记录质量,作为设备和组织-设备界面完整性的额外指示,因为生物和非生物的失败都会导致记录质量的下降。图5F显示了每个动物在42周内由相同的刺激通道记录的自发活动的代表性波形。经过数十万到近200万的刺激脉冲后,StimNET电极接触仍然捕获了高振幅波形,而信号振幅没有可见的衰减。为了纵向量化记录质量,我们部署了三个常用的指标,峰值振幅、噪声水平和信噪比(SNR),每个指标作为植入后来自代表性动物(小鼠2)的所有刺激通道的函数(图5G-5I)。.在整个280天里,噪声水平保持不变,并且没有观察到峰值到峰值的振幅或信噪比随着时间的推移而下降。稳定的记录性能进一步支持了StimNET电极在慢性ICMS后保持了紧密的组织-电极整合和正常功能。
结论
在这项研究中,我们设计了目前最薄、最灵活的穿透微电极阵列StimNET电极,用于强大的ICMS。在皮质内植入的8个月期间,这些设备上的每一次微接触在体内刺激了多达190万次脉冲,而没有生物或非生物失败的迹象。在这项研究中,StimNET电极在体内输出的刺激脉冲数与最近对ICMS的人类研究中使用的脉冲数相同,ICMS的植入时间更长。这些结果表明,StimNET电极具有显著的超快氧化性,且具有1 mm的总厚度,支持ICMS的长期应用。
我们利用体内成像、行为和组织学技术的综合应用来解读神经元激活的空间范围,量化纵向行为可检测性,并全面表征组织-电极界面。我们对多种模式的应用从以往的研究中脱颖而出,这些研究通常采用单一模式,并使我们能够从整体上阐明StimNET电极诱导的ICMS的神经调节作用。我们显示低阈值的1-2 uACa2+成像和行为检测,纵向稳定神经元激活和高水平的空间选择性的时间框架几个月,和健壮和稳定的行为检测长期226天记录低电流1.5 uA,日常变化小至1 uA最大。
参考文献:
Low-threshold, high-resolution, chronically stable intracortical microstimulation by ultraflexible electrodes
—— End ——
仅用于学术分享,若侵权请留言,即时删侵!

投稿请点击 脑机接口社区学术新闻投稿指南
加入社群
欢迎加入脑机接口社区交流群,
探讨脑机接口领域话题,实时跟踪脑机接口前沿。
加微信群:
添加微信:RoseBrain【备注:姓名+行业/专业】。
加QQ群:913607986
欢迎来稿
1.欢迎来稿。投稿咨询,请联系微信:RoseBrain
投稿请点击 脑机接口社区学术新闻投稿指南
2.加入社区成为兼职创作者,请联系微信:RoseBrain



一键三连「分享」、「点赞」和「在看」
不错每一条脑机前沿进展 ~
























 1万+
1万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










