
AbMole(奥默生物)是ChemBridge在中国的唯一官方指定合作伙伴。
来自四川大学华西医院的XueYing Zhang,Rui Gao,ChangTeng Zhang,Tao Zhu,以及Chan Chen等多名研究人员在Signal Transduct Target Ther期刊(IF=39.3)上,发表了题为“Extracellular RNAs-TLR3 signaling contributes to cognitive impairment after chronic neuropathic pain in mice”的文章,并揭示了慢性神经病理性疼痛后认知功能受损的新机制。
据研究统计,大约11%到40%的人患有慢性疼痛,寻找慢性神经病理性疼痛诱发认知功能障碍的关键调控因子,探索有效的治疗靶点,对于预防认知障碍具有重要意义。
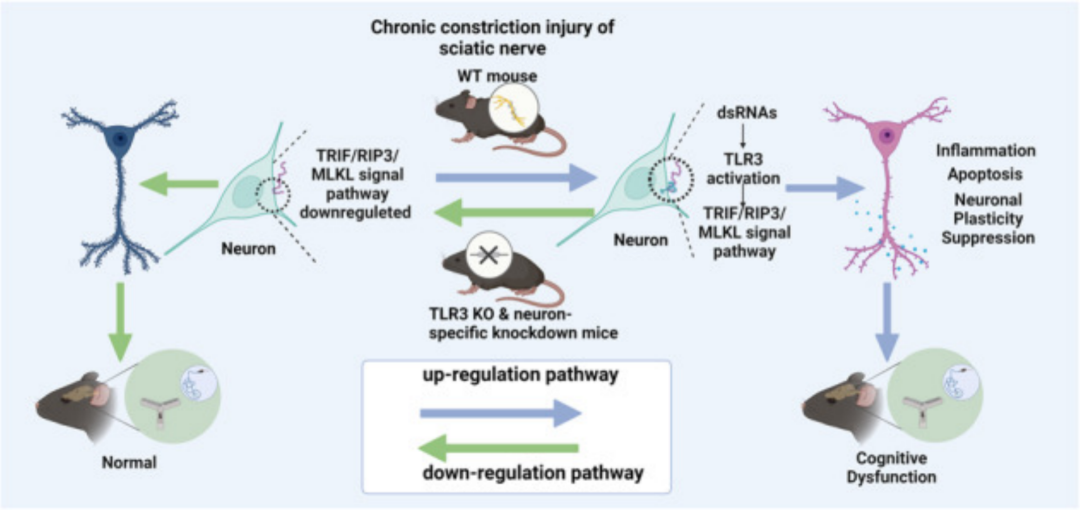
研究人员通过坐骨神经慢性压迫损伤(CCI)来模拟小鼠慢性疼痛后的认知障碍,并进行旷场试验(OFT),Y型迷宫等行为学实验,发现CCI能导致小鼠神经病理性疼痛伴认知功能下降。随后用免疫荧光染色检测CCI后的TLR3水平,发现海马神经元中TLR3表达明显增加。
接下来,研究人员选用TLR3基因敲除(KO)和神经元特异性敲除TLR3(不影响疼痛阈值)小鼠再次进行行为学实验,发现两种小鼠的认知功能均有所增强,并且能降低海马区域的炎症反应和凋亡。WB分析以及高尔基染色结果表明,TLR3在慢性神经病理性疼痛后海马神经可塑性中具有重要作用。
同时,研究人员还检测了海马、坐骨神经和血清中的exRNA水平,发现exRNA [特别是双链RNA(dsRNA)]水平升高,并观察到dsRNA与TLR3的共定位有所增加。进一步研究发现,人工合成的dsRNA类似物poly(I:C)可提高海马中dsRNA和TLR3的水平,加剧CCI引起的认知能力下降,并且该类似物在TLR3 KO小鼠中不起作用。
此外,使用dsRNA/TLR3抑制剂后,可发现CCI小鼠的认知功能有所改善,且经外源RNA处理,神经元中的dsRNA水平显著增加,并与TLR3共定位。
综上所述,研究人员发现靶向dsRNA-TLR3信号通路有可能减轻海马炎症反应、神经元凋亡和神经可塑性变化,从而改善慢性疼痛条件下的认知能力下降,并提示靶向dsRNA/TLR3通路对于伴有认知功能下降的慢性疼痛的研究和预防具有重要作用。
本研究使用了购自AbMole的Capsaicin(M3422,辣椒碱),该产品是辣椒属红辣椒的活性成分,同时也是TRPV1的激动剂,能通过激活TRPV1,以TRPV1依赖的方式诱导自噬(autophagy)。研究人员通过使用1 µM的Capsaicin处理雪旺细胞系RSC 96,诱导exRNAs增加,从而模拟CCI引起的损伤。
更多内容请访问:AbMole官网(www.abmole.cn)























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








