 AbMole是ChemBridge在中国唯一官方指定合作伙伴。
AbMole是ChemBridge在中国唯一官方指定合作伙伴。
由Delilah Hendriks , Jos F Brouwers , Karien Hamer 等人在“Nature Biotechnology”上发表的名为“Engineered human hepatocyte organoids enable CRISPR-based target discovery and drug screening for steatosis”的文章,在该文章中,使用了AbMole的Y-27632(M1817)抑制剂。
非酒精性脂肪肝病(NAFLD)已成为全球范围内日益严重的公共卫生问题,影响着超过25%的全球人口。作为一种多因素疾病,NAFLD不仅与不良的生活方式和饮食习惯密切相关,还受到遗传因素的显著影响。然而,由于缺乏适合人类生理特性的模型系统,针对NAFLD的有效治疗药物开发进展缓慢。近期,一项由Delilah Hendriks及其同事在《Nature Biotechnology》上发表的研究,通过构建人类胎儿肝细胞类器官模型,为揭示NAFLD早期阶段——脂肪变性(steatosis)的分子机制和潜在治疗靶点开辟了新的途径。
研究首先构建了一个基于外源性游离脂肪酸(FFA)加载的脂肪变性模型。通过将野生型(WT)类器官暴露于油酸和棕榈酸的混合溶液中,研究人员成功模拟了西方饮食对肝脏的影响。随着FFA浓度的增加,类器官内脂质滴的积累逐渐增多,最高浓度处理下脂质覆盖率超过40%(图1b, c)。同时,FFA处理还显著抑制了类器官的增殖能力,表现为Ki-67阳性细胞数量的急剧减少(补充图2a, b),这可能与某些脂肪酸(特别是棕榈酸)的脂毒性有关。
为了探究遗传因素在脂肪变性中的作用,研究团队利用CRISPR技术引入了PNPLA3基因的I148M变异,该变异是迄今为止已知的最强NAFLD遗传风险因素之一。通过基因编辑,研究人员成功构建了PNPLA3 WT、PNPLA3 WT/I148M杂合子以及PNPLA3 I148M/I148M纯合子类器官模型。结果显示,PNPLA3基因的不同变异形式对类器官中脂质水平的影响存在显著差异,纯合子变异型类器官的脂肪变性程度最高,其次是杂合子变异型,而野生型类器官在标准培养条件下几乎不积累脂质(图1d, e, f)。
此外,研究人员还观察到PNPLA3蛋白在纯合子变异型类器官的脂质滴上显著富集,这可能与I148M变异增加脂肪变性的风险有关(图1g)。进一步研究发现,PNPLA3基因变异不仅影响类器官的脂质水平,还改变了它们对FFA挑战的反应性。与野生型类器官相比,携带PNPLA3 I148M变异的类器官在轻度FFA挑战下表现出更严重的脂肪变性(图1h, i, j)。
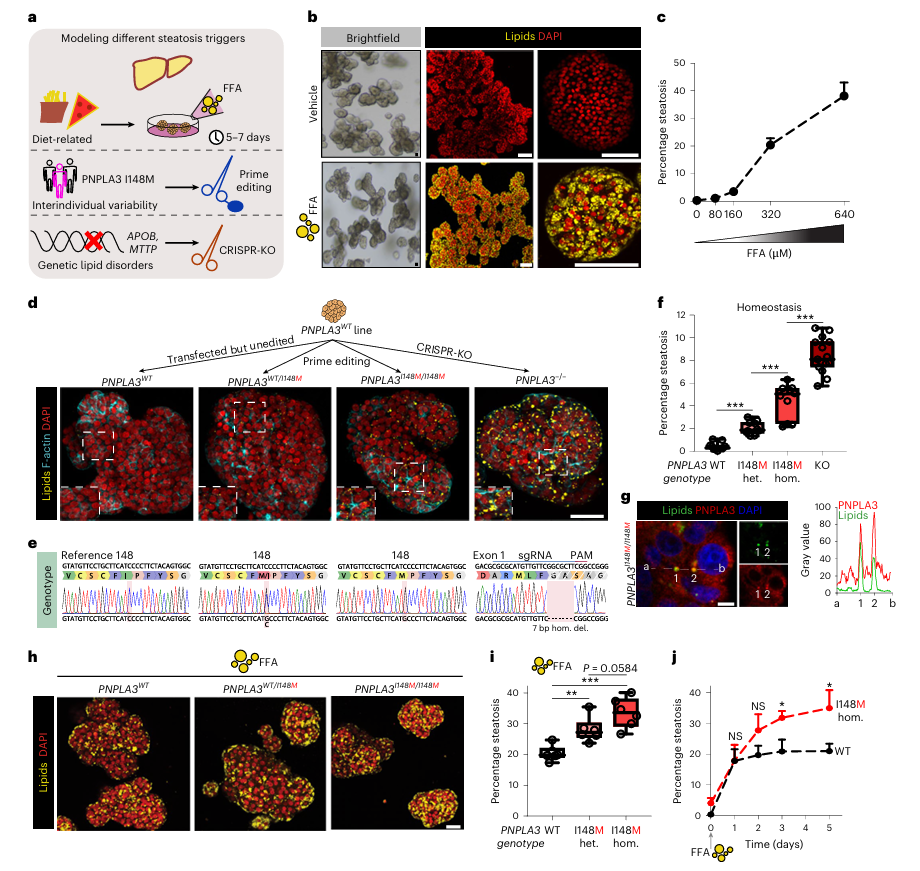
图1:人类胎儿肝细胞类器官中的精确基因编辑评估了脂肪变性的遗传易感性
为了模拟单基因脂质代谢疾病导致的脂肪变性,研究团队构建了APOB和MTTP基因敲除的类器官模型。这些基因在极低密度脂蛋白(VLDL)颗粒的组装和分泌中发挥关键作用,其突变会导致家族性低β脂蛋白血症和abetalipoproteinemia等疾病。通过CRISPR技术敲除这些基因后,研究人员观察到类器官在稳态条件下自发积累了大量脂质,达到约30%的脂肪变性水平(图2d, e)。脂质组学分析表明,这些类器官中甘油三酯(TAG)的积累主要来源于内源性脂质合成(DNL),而非外源性脂质来源(图2f, g)。
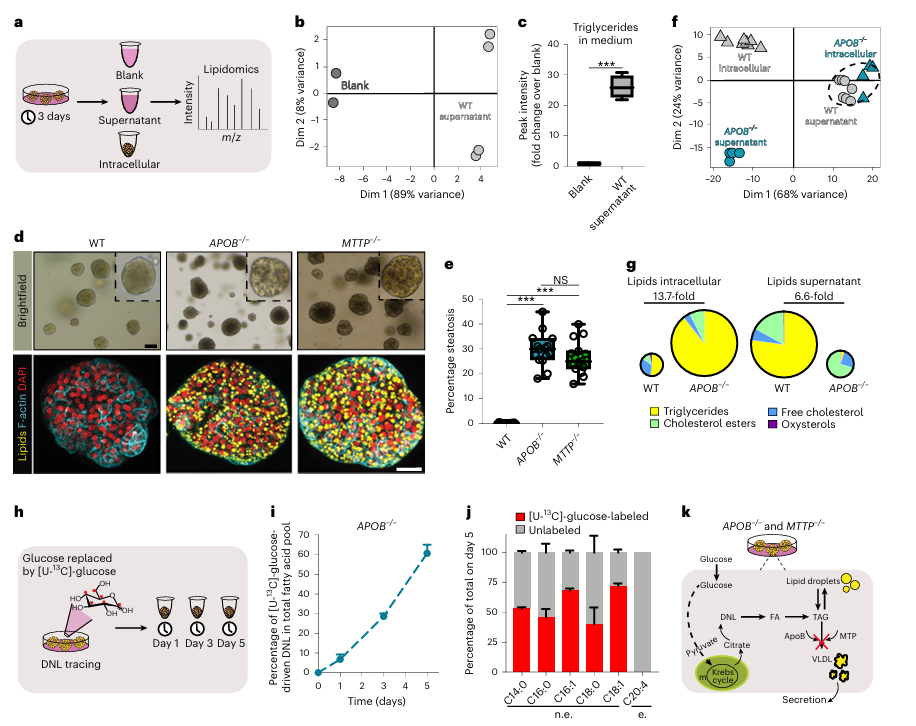
图2:通过引入APOB或MTTP突变产生的DNL产生的脂质积累的类器官模型
为了寻找能够减轻脂肪变性的药物,研究团队对17种候选NAFLD药物进行了筛选。这些药物包括ACC抑制剂、FAS抑制剂、DGAT2抑制剂等,旨在抑制脂质合成途径中的关键酶。结果显示,多种药物在不同脂肪变性模型中均表现出显著的抗脂肪变性效果,特别是ACC抑制剂和FAS抑制剂,它们能够显著减少类器官中的脂质积累(图3b, c, d)。此外,FXR激动剂和重组人FGF19也显示出良好的治疗效果,能够减少约50%的脂肪变性水平(图3c)。
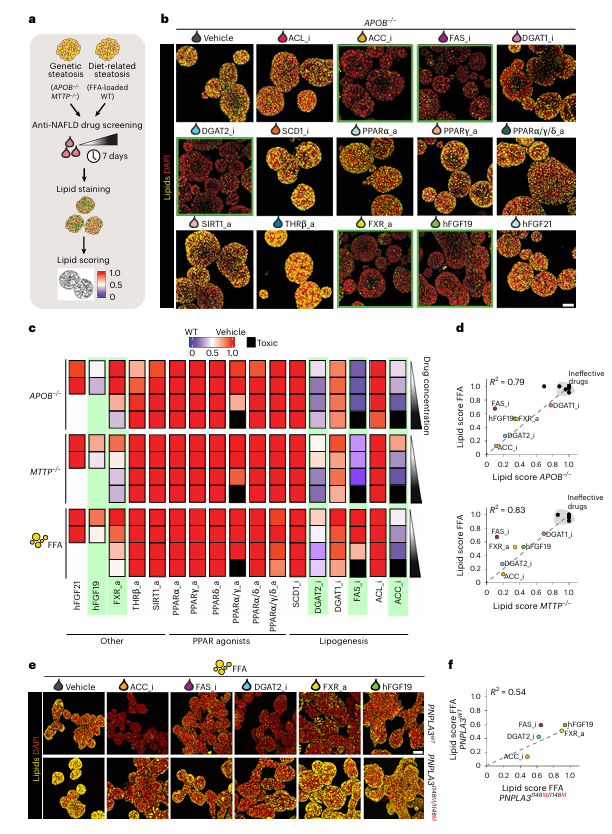
图3:捕捉人肝脂肪变性不同类器官模型中的药物反应
通过RNA-seq分析,研究人员进一步揭示了不同药物对类器官转录组的影响。ACC和FAS抑制剂不仅下调了与糖酵解和脂肪酸合成相关的基因表达,还抑制了与细胞周期和DNA合成相关的基因,提示这些药物可能具有潜在的副作用,如抑制肝细胞增殖和再生能力(图4b, c, d, e)。相比之下,FXR激动剂和FGF19主要通过诱导FGF19信号通路和抑制DNL来减少脂肪变性,同时伴随着一定程度的上皮细胞向间充质细胞转化(EMT)的诱导,这可能解释了FGF19基因在肝癌中的扩增现象(图4d, e)。
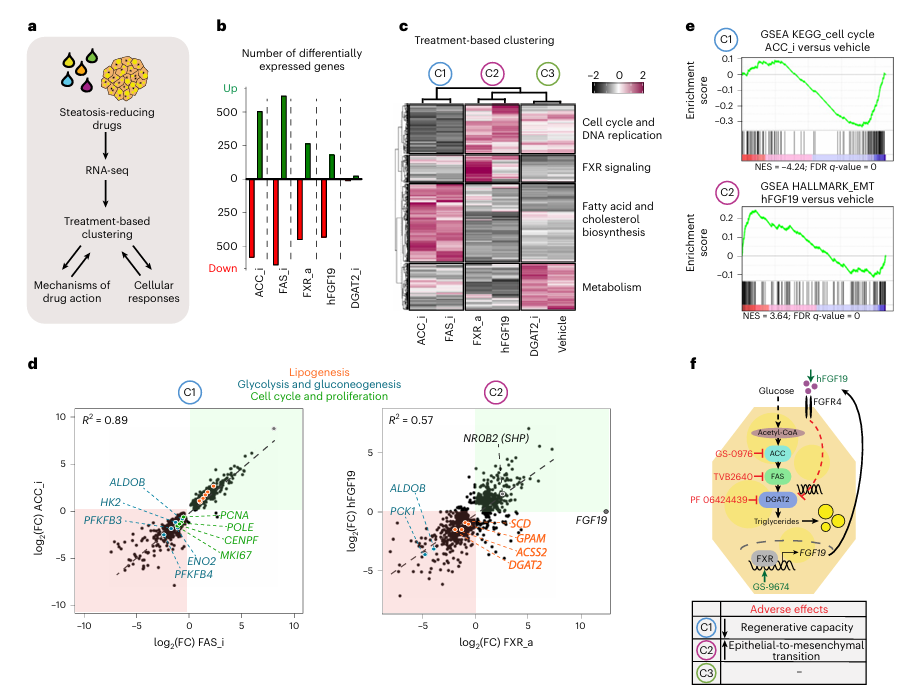
图4:基于转录组的治疗聚类揭示了减少脂肪变性的药物作用和不良反应
为了加速基因编辑和靶点筛选过程,研究团队开发了一个基于CRISPR敲除的筛选平台FatTracer。该平台利用APOB−/−和MTTP−/−类器官作为“天然”脂肪变性模型,对35个与脂质代谢相关的基因进行了系统筛选。结果显示,FADS2基因在这一过程中脱颖而出,成为脂肪变性的关键调节因子(图5c)。FADS2是Δ6去饱和酶,参与多不饱和脂肪酸(PUFA)的生物合成。FADS2敲除加剧了脂肪变性表型,而过表达FADS2则显著减轻了脂肪变性(图6a-h)。
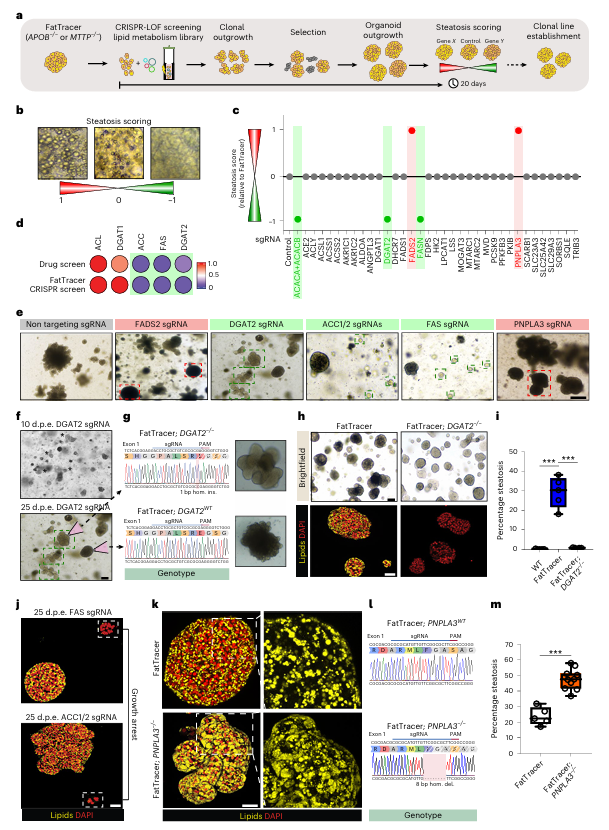
图 5:开发 FatTracer 作为 CRISPR 筛选平台可识别脂肪变性介质
机制研究表明,FADS2通过调节PUFA与DNL之间的平衡来影响脂肪变性水平。FADS2过表达增加了PUFA的丰度,进而抑制了DNL途径,减少了TAG的积累(图6i-m)。这一发现不仅揭示了FADS2在脂肪变性中的作用机制,还为开发针对NAFLD的新药物提供了潜在靶点。
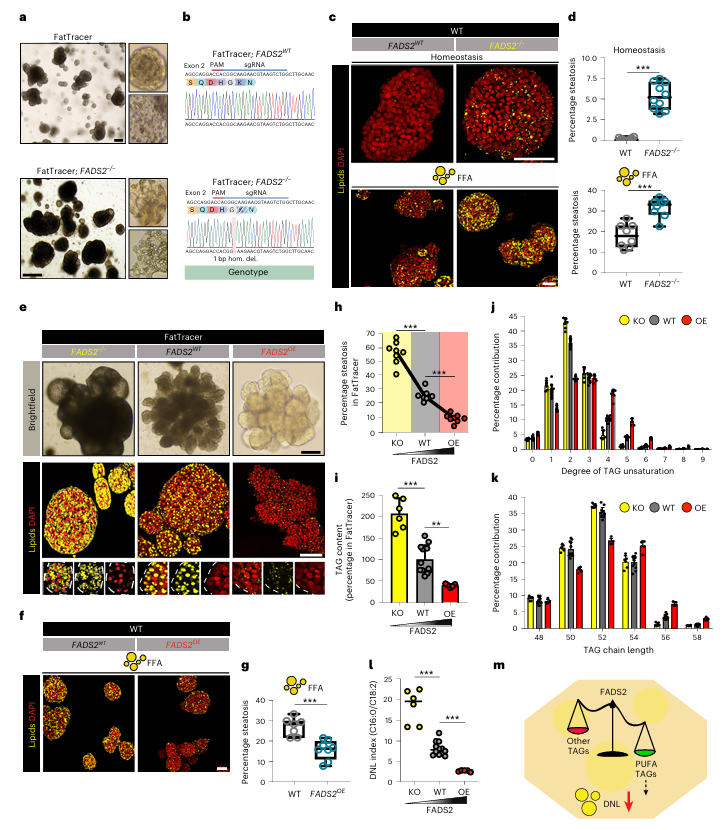
图6:FADS2是人肝细胞脂肪变性水平的关键调节因子
综上所述,本研究通过构建人类胎儿肝细胞类器官模型并利用CRISPR基因编辑技术和FatTracer筛选平台,成功揭示了脂肪变性的分子机制和潜在治疗靶点。未来研究可以进一步探索FatTracer平台在NAFLD其他阶段(如NASH)中的应用,并通过引入其他肝脏细胞类型来构建更复杂的肝脏微环境模型。此外,全基因组范围内的NAFLD风险基因筛选也将有助于发现更多潜在的治疗靶点,推动NAFLD治疗药物的开发进程。这些模型和平台的建立不仅为NAFLD的研究提供了强有力的工具支持,也为其他复杂疾病的研究提供了新的思路和方向。
更多内容请访问:www.abmole.cn






















 902
902

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








