大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
胰腺癌因其病死率高而成为目前最具挑战性的恶性肿瘤之一。考虑到目前的治疗方案诊断较晚,生存获益有限,优化早期检测、预后和治疗反应预测势在必行。近年来大量研究以开发基于液体活检的胰腺癌生物标志物。越来越多研究指出,细胞游离DNA (cfDNA)甲基化分析是一种有前景的非侵入性方法,可用于发现和验证具有诊断或预后潜力的表观遗传生物标志物。本文就胰腺癌中cfDNA甲基化的研究进展进行综述,讨论了DNA甲基化在胰腺癌中的相关性、近期cfDNA甲基化研究及其临床应用,以及将cfDNA甲基化分析应用于常规临床实践的未来方向。
背景介绍(Introduction)
胰腺癌是发达国家死亡率第三高的肿瘤,也是3年生存率最低的肿瘤(5%)。胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是最常见的胰腺癌类型,占所有病例的80%以上。目前碳水化合物抗原19-9(CA19-9)是胰腺癌临床诊断中唯一常规使用的血液生物标志物,其灵敏度(79%)和特异性(82%)相对较低。转移性PDAC患者的CA19-9水平与生存率之间存在关系。 在临床实践中,对于疾病过程中CA19-9水平变化的解释尚未达成共识。
因此,开发基于血液的胰腺癌替代生物标志物势在必行,这些生物标志物有助于早期诊断、精准分层、选择适当的治疗方案、监测治疗反应、评估治疗耐药性、鉴定微小残留病灶和复发风险。液体活检是对循环血液成分中的分子生物标志物进行分析,已成为克服癌症诊断和监测挑战的一种有前景方法(图1)。通过检测和分析血液中循环游离DNA(cfDNA)、循环肿瘤细胞(CTC)和其他生物标志物的基因突变,液体活检为评估肿瘤特征和监测治疗应答提供了一种非侵入性方法。

图1:血液液体活检在胰腺癌诊断和治疗中的应用。循环肿瘤细胞(CTCs)和循环游离DNA (cfDNA)是液体活检的重要生物标志物,可提供非侵入性诊断、预后和治疗信息。特别是cfDNA分析可以揭示引发肿瘤的遗传学变化,如基因突变、微卫星不稳定性(MSI)、杂合性缺失(LOH)或异常甲基化模式。在胰腺癌患者的cfDNA中最常检测到的突变基因是KRAS、TP53、APC、SMAD4和FBXW7。在胰腺癌中,与甲基化相关的循环生物标志物有BNC1、NPTX2、SFRP1、RASSF1A和TFPI2。
在癌细胞中经常观察到异常的DNA甲基化模式变化,这些变化可反映在血液循环中的cfDNA中。检测血流中的这些甲基化变化有望用于早期癌症检测,并有可能通过及时干预改善结局。本文首先对cfDNA在胰腺癌中的研究进行回顾;然后分析了DNA甲基化在胰腺癌背景下的相关性,总结cfDNA甲基化的最新研究,特别强调其临床效用;最后讨论了cfDNA甲基化分析的未来方向、临床转化以及将其应用到常规临床实践中的可能性。
循环cfDNA作为胰腺癌的血液生物标志物
那些存在于血液中的DNA片段被称为循环游离DNA (cfDNA),cfDNA可来源于正常细胞更新、凋亡或坏死细胞以及肿瘤细胞等。在cfDNA中可以检测到肿瘤特异性遗传学变化,包括基因突变、微卫星不稳定性(MSI)、杂合性丢失(LOH)和异常甲基化模式。cfDNA大小为40~200个碱基对(bp),peak值约为166bp,健康个体中cfDNA片段长度中位数比癌症患者大。
与肿瘤组织活检相比,cfDNA不仅更好地描述了肿瘤的完整情况,而且提供了重复采样和分析的可能性,从而可以纵向评估cfDNA浓度的动态变化、鉴定获得性耐药突变和监测克隆进化。然而将cfDNA作为癌症的血液生物标志物进行分析也有一些局限性。cfDNA诊断和预后效用的一个重要方面是其血浆低浓度,这使检测和分析更为复杂化。据估计,每毫升血浆中约有10-15 ng cfDNA,在大多数早期癌症中,循环肿瘤DNA只占cfDNA的一小部分。这些考虑突出了对超灵敏检测方法的要求。最灵敏的方法是基于聚合酶链反应(PCR)方法,如BEAMing单分子PCR、TAm-Seq、数字PCR和微滴数字PCR。胰腺癌的cfDNA作为一种有前景的早期检测和预后生物标志物受到越来越多关注。最近的研究表明,80%以上的转移性胰腺癌患者中检测到循环cfDNA的遗传学变化,但仅在48%的局限性肿瘤患者中检测到。
胰腺癌在杂合性缺失(LOH)情况下,对微卫星不稳定性(MSI)进行的液体活检研究非常罕见或不存在。Chakrabarti等评估了使用Guardant360技术分析了循环肿瘤DNA中的MSI状态可否预测PDAC患者对免疫治疗的稳健应答。结果表明在83%的患者的组织MSI结果与血浆G360结果一致。此外,在1例患者的肿瘤组织中未检测到MSI,而血浆中检测到MSI。
胰腺癌中最常见的血液生物标志物研究包括对cfDNA循环突变分析,最常见的突变基因是KRAS、TP53、APC、SMAD4或FBXW7。这些突变与肿瘤中发现的突变同时发生,强调了cfDNA作为有价值的胰腺癌血液生物标志物的潜力。一些研究已经证实了在循环cfDNA中检测到KRAS突变与局部晚期或转移性PDAC患者的不良预后相关。此外,一些研究还将检测循环cfDNA中的KRAS突变作为生物标志物,用于监测治疗反应和鉴定胰腺癌耐药的早期迹象。在最近的一项研究中,不可切除胰腺癌患者的cfDNA中存在KRAS突变与不良治疗结果强相关,并提示这一分子评估可作为评估早期肿瘤进展的生物标志物。
目前的研究强调了cfDNA作为预测PDAC患者预后有价值的生物标志物来源潜力。在整个治疗过程中,cfDNA基因图谱变化可作为治疗应答或耐药的早期指标,从而为利用生物标志物进展来指导治疗决策提供了一个有前景的途径。
尽管如此,仍然迫切需要推进更灵敏技术的开发,这些技术能够增强对肿瘤来源的循环DNA检测,并提高预后预测的准确性。超灵敏技术结合和表观遗传标记(如cfDNA甲基化)的整合为提高胰腺癌cfDNA分析的灵敏度和特异性提供了一个有希望的机会(图1)。
DNA甲基化与胰腺癌
近年来,试图鉴定胰腺癌中甲基化标志物的研究越来越多。DNA甲基化可逆,从治疗角度来看具有很高的研究价值。DNA甲基化在CpG二核苷酸胞嘧啶C5位点上添加或移除一个甲基(CH3),CpG二核苷酸主要存在于CpG岛的特定基因组区域中。在哺乳动物中,DNA甲基化模式构建主要由DNA甲基转移酶3 (DNMT3)家族介导,包括DNMT3A和DNMT3B。一旦构建,这些模式随后通过DNMT1作用来维持。在正常细胞中,正确DNA甲基化模式保证了基因表达的正确和精确调控,并维持稳定的基因沉默。因异常甲基化模式被广泛认为是许多类型癌症的表观遗传标志,通常在癌症中观察到低甲基化和高甲基化事件。具体来说,在基因缺失区域和重复序列中,甲基化CpG含量整体下降;从而导致基因组不稳定,激活先前沉默的致癌基因。癌症常表现为基因启动子的局部高甲基化,导致抑癌基因的转录沉默。
目前对胰腺组织活检、细胞系或异种移植模型的大量研究来解读胰腺疾病的特异性甲基化模式,以作为胰腺肿瘤的诊断或预后工具。在胰腺癌中,近80%的病例显示DNMT1表达上调,导致高甲基化。高甲基化被认为是胰腺癌中最主要的异常表观遗传学改变。这种异常高甲基化的影响主要在肿瘤抑制基因中观察到。CDKN2A/p16INK4是胰腺癌中第一个因启动子异常高甲基化而失活的抑癌基因,它在抑制细胞周期由G1期向S期进展,确保细胞周期停滞中起着至关重要的作用。在胰腺外分泌和上皮内肿瘤新鲜冷冻组织、人胰腺癌细胞系和异种移植物中进行的其他研究表明,在胰腺癌中,细胞通过G1期进展的其他负调控因子,如细胞周期蛋白依赖激酶抑制剂CDKN1C/p51KIP2和细胞周期蛋白CCND2的高甲基化和随后的下调。在胰腺肿瘤中,由于异常高甲基化而导致表达降低的其他肿瘤抑制基因包括前脑脑肽原(PENK,在分析的93.3%的肿瘤样本中高甲基化)、细胞因子信号转导抑制基因1 (SOCS-1, 57.1%)、原钙黏蛋白10 (PCDH10, 60.9%)、iroquois同源盒4 (IRX4, 64%)和reprimo (RPRM, 57%)等。
胰腺癌中除抑癌基因异常高甲基化外,某些基因也存在异常低甲基化。这种低甲基化主要发生在特定基因的启动子区,导致其过表达,从而促进胰腺癌细胞的增殖、存活和侵袭。其中一个基因是丝氨酸蛋白酶抑制剂SERPINB5 (Maspin)。据报道SERPINB5基因在87%的胰腺癌细胞系(20/23)、94%的异种移植物(32/34)中完全未甲基化,在86%的原发性胰腺癌(6/7)中低甲基化,该基因甲基化与mRNA表达水平呈负相关。在临床样本中,未甲基化SERPINB5的存在已经证明了其作为胰腺肿瘤特异性生物标志物的潜力,使胰腺导管腺癌(PDAC)与胰腺炎的鉴别成为可能。通过将甲基化和表达谱数据相结合的多组学分析,有令人振奋的证据表明,在胰腺癌组织中,与低甲基化状态相关的特定基因上调,包括磺基转移酶家族1E成员1 (SULT1E1)、胰岛素样生长因子2 mRNA结合蛋白3 (IGF2BP3)和丝裂原活化蛋白4激酶4 (MAP4K4)。这些基因的甲基化和表达谱变化与胰腺癌患者的总生存期显著相关,因此提示它们作为预后生物标志物的潜在效用。另外几个基因在胰腺癌组织中因异常低甲基化而过表达,包括MUC4、CLDN4、LCN2、SFN、TFF2、S100A4、MSLN和PSCA。
此外,近年来,5-羟甲基胞嘧啶(5-hydroxymethylcytosine, 5hmC)作为一种生物学功能尚不明确的氧化形式的5mC,作为癌症诊断和生存的潜在生物标志物引起了极大的兴趣。一些研究报道,5hmC水平在人类癌症中显著降低,胰腺癌被描述为导致游离细胞羟甲基化的疾病特异性变化。
综上所述,表观遗传改变在胰腺癌的发生发展中起着关键作用。因此,对胰腺癌发生的异常表观遗传修饰进行综合分析,对胰腺癌的分子诊断和治疗监测具有重要意义。
胰腺癌cfDNA甲基化研究分析
对胰腺癌血浆中甲基化生物标志物的探索仍处于早期阶段,迄今为此开展的研究数量有限。胰腺癌的cfDNA甲基化模式分析已在全基因组水平以及通过鉴定和描述单个基因或小基因panel来进行。关于全基因组测序方法,已经发表了多项研究。本文主要探究单个基因或小基因panel作为未来临床应用的潜在生物标志物的效用 (表1)。首项关于鉴定血浆中胰腺癌甲基化标志物的研究始于2007年。Jiao等通过甲基化特异性PCR (MSP)检测了83例未经治疗的胰腺癌患者血浆样本中ppENK和p16基因的甲基化状态。ppENK和p16启动子甲基化率分别为29.3%和24.6%。在83例患者中,9例成对的胰腺肿瘤组织切片在相同甲基化的肿瘤患者血浆样本中,p16和ppENK基因的高甲基化率分别为60%和80%。作者得出结论,血浆DNA在检测胰腺癌表观遗传学变化中可能具有替代肿瘤组织的价值。然而对于潜在诊断标志物而言,所获得的灵敏度太低,这可能是由于分析的成对血浆/肿瘤样本数量少。此外,本研究缺乏健康人和良性胰腺疾病患者组成的对照组数据。
表1:血浆/血清中游离DNA甲基化作为胰腺癌诊断和/或预后生物标志物的研究

此后不久,另一项开创性研究发表,表明可以通过使用血浆中循环cfDNA的甲基化谱来检测胰腺癌。Melnikov等分析了30例PDAC患者和30例年龄匹配的健康志愿者的甲基化特征。当时引入了一种名为MethDet56的新技术,该研究使用了包含56个频繁甲基化基因的芯片检测panel。这一创新方法旨在通过甲基化灵敏的核酸内切酶消化标靶序列,然后使用PCR扩增未消化的片段,从而检测标靶序列的甲基化水平。CCND2、PLAU、SOCS1、THBS和VHL等5个基因在PDAC患者血浆中的甲基化水平低于健康对照组,低甲基化模式的灵敏度为76%,特异性为59%。作者将这组基因归类为复合生物标志物,从而确立了其对采用基于血浆的方法检测胰腺癌的一致预测价值。此外,他们认为启动子的非甲基化状态在肿瘤检测方面更有价值。然而这些发现尚未得到后续研究验证,并且将血浆cfDNA中的低甲基化特定基因用作PDAC的生物标志物仍然是一个有争议的话题。
同一研究小组使用他们开发的MethDet56方法,比较30例PDAC患者、30例慢性胰腺炎患者和30例健康对照者血浆cfDNA甲基化,每组年龄、性别和种族分布相似。为了确定血浆中的特异性甲基化谱,研究者选择了8个含信息基因(informative genes )(BRCA1、CCND2、CDKN1C、MLH1、近端和远端PGR启动子区、SYK和VHL)的启动子,以区分慢性胰腺炎和健康对照(灵敏度为78%,特异性为81.7%)。当比较慢性胰腺炎和PDAC时,他们发现14个基因启动子(CCND2、CDKN1C、CDKN2B、DAPK1、ESR1启动子A、MGMT、MLH1、MUC2、MYOD1、PGK1、PGR启动子近端区域、RARB、RB1和SYK)存在差异甲基化(90.8%灵敏度和91.2%特异性)。14个基因启动子中有9个为慢性胰腺炎特异性启动子,5个为两组共有。在这组共有的5个基因中观察到在慢性胰腺炎中高甲基化的基因在PDAC中低甲基化。
几年后,MethDet56方法被用于研究PDAC和结直肠癌(CRC)是否在血浆cfDNA中的共有甲基化标志物。7个基因panel(MDR1、SRBC、VHL、MUC2、RB1、SYK和GPC3)被鉴定为区分CRC或PDAC与健康对照的最佳循环甲基化标签。此外,一项该panel进行的限制性更强的分析结果表明,GPC3是有效区分PDAC和健康对照的唯一基因,而VHL和SRBC是PDAC和CRC的信息基因。
Park J.W.等在2012年发表了两项研究,使用MSP技术在血浆中诊断胰腺癌。第一项是初步研究(16例胰腺癌患者,13例慢性胰腺炎患者和29例健康对照),该研究使用了6个候选基因,这些候选基因基于Sato等人2003年在原发性胰腺癌和正常胰腺导管上皮中获得的结果选择。UCHL1、NPTX2、SARP2、ppENK、p16和RASSF1A基因启动子在PDAC患者和健康对照之间存在差异甲基化,但p16基因启动子在PDAC患者和慢性胰腺炎患者之间存在差异甲基化。慢性胰腺炎是胰腺癌的已知危险因素,继这些结果和之前从胰腺癌细胞学样本中获得结果之后,作者重点研究了一个更大的血浆队列中NPTX2的甲基化状态,该队列包括104例PDAC患者、60例慢性胰腺炎患者和5例良性胆道结石患者。NPTX2甲基化在PDAC组中显著升高(84%的PDAC患者,慢性胰腺炎和良性胆石病组分别为33%和0%;P = 0.016),其灵敏度和特异性分别为80%和76%,且与肿瘤分期的恶化呈正相关。
Singh及其合作者于2020年分析了Park等2012年检测的6种生物标志物中的3种(UCHL1、PENK和NPTX2基因启动子),并将SPARC基因加入研究。从61例PDAC患者、22例慢性胰腺炎患者和21名健康受试者的cfDNA中通过定量MSP (qMSP)获得的绝对拷贝数计算基因甲基化指数(MI)。这4个基因在PDAC中的MI显著高于健康对照组,SPARC MI能够鉴别早期PDAC和慢性胰腺炎。此外,较高的UCHL1 MI与疾病的晚期相关;SPARC和NPTX2基因的高MI与PDAC的低生存率相关。
2013年,Kawasaki等利用MSP技术研究了不同类型癌症患者(包括47名PDAC患者)cfDNA中细胞周期相关基因(APC、DCC、p16、p14、RASSF1A)的甲基化率。RASSF1A和APC的甲基化率最高,分别为34和23.4%,其次为p16和p14。然而本研究缺乏健康对照组,且RASSF1A甲基化百分比在其他类型的癌症如肝细胞癌中相似甚至更高。
同样在2013年,Yi等通过转录组微阵列对4种胰腺癌细胞系中获得的1427个特异性基因进行癌症特异性甲基化过滤后,通过MSP分析了8个候选基因的甲基化状态。bbnc1和ADAMTS1启动子基因在原发性PDAC肿瘤样本中表现出最高的甲基化率(分别为91%和67%;n=123)和癌前胰腺上皮内瘤变(PanIN)样本(分别为70%和25%;n=20)。然后使用甲基化磁珠(Methylation On Beads, MOB)方法在血清样本(42例PDAC患者和26名健康个体)中验证这些生物标志物,这是一种捕获、保留和亚硫酸盐处理微量DNA的纳米技术。在I期PDAC样本中,BNC1的灵敏度达到79%,ADAMTS1的灵敏度达到48%,这两个基因的灵敏度均提高至90%。BNC1和ADAMTS1的特异度分别为89%和92%。结合这两种基因,检测极早期胰腺癌的灵敏度提高(81%),但特异性未提高(85%)。
9年后,同一组研究人员通过qMSP方法在39例PDAC患者、95例匹配的年龄对照和8例慢性胰腺炎患者组成的独立队列中验证了这组有前景的生物标志物。在87.2%和65.1%的PDAC病例中检测到ADAMTS1和BNC1甲基化,而在非癌症患者中分别检测到4.2%和6.3%。两基因组合(ADAMTS1和/或BNC1)改善了个体结果,在患者和对照中分别达到97.4%和8.4%的甲基化水平。该组合也在87.5%慢性胰腺炎样本中显示了甲基化,未能区分PDAC和慢性胰腺炎。在I期、IIA期、IIB期、III期和IV期胰腺癌患者中,ADAMTS1 / BNC1组合的cfDNA甲基化率分别为100%、88.9%、100%,将CA19-9纳入分析后,未见明显改善。根据这些结果,作者强调ADAMTS1和BNC1是在疾病初期阶段cfDNA中早期检测胰腺癌的可靠标志物,这为治愈性肿瘤切除术提供了治疗机会。
2021年,为了提高诊断潜力,同一研究组将LRFN5和PXDN基因加入到ADAMTS1/BNC1联合甲基化panel中。采用MSP法检测106例FFPE组织样本(44例PDAC (I-IV期)、15例PanIN、24例导管内乳头状黏液性肿瘤、15例慢性胰腺炎和8例非癌对照) 中的甲基化水平,并使用MOB和qMSP检测32例血浆(22例PDAC (I-IV期)和10例健康对照)中甲基化水平。
将LRFN5/PXDN添加到生物标志物组中提高了癌前和早期癌症检测的诊断准确性,AUC为0.94。此外,在血浆中获得的4个基因组的灵敏度和特异度分别为100%和90%。本研究纳入的人群具有多样性,增强了研究结果的广泛适用性。血浆样本量明显小于肿瘤组织样本量。作者认为,cfDNA中4基因组的甲基化频率与组织中相当,尽管较低,可能是由于存在肿瘤异质性,这表明这些生物标志物基因对能够血行扩散的肿瘤克隆至关重要。
Henriksen团队采用了一种独特的方法,专注于开发基于cfDNA甲基化的预测模型,用于胰腺癌诊断、生存预测和预后。2016年,Henriksen等人利用优化亚硫酸盐处理方案和两轮MSP和qMSP(外部和内部甲基化特异性引物和探针)评估了基于之前文献的发现选择的28个基因panel。共纳入95例PDAC患者,其中慢性胰腺炎组97例,急性胰腺炎组59例,胰腺良性疾病组27例。基于多变量logistic回归分析,建立了包含8个基因(APC、BMP3、BNC1、MESTv2、RASSF1A、SFRP1、SFRP2和TFPI2)的预测模型(年龄> 65岁),该模型能够成功鉴别良恶性病变,灵敏度为76%,特异度为83%。作者强调了这一预测模型与癌症分期的独立性,并得出结论,认为该模型有可能用作胰腺癌的早期血液诊断工具。
随后,采用相同的28个基因组、相同的PDAC患者队列和相同的实验方法,只发现IV期高甲基化基因的平均数量有非常显著的差异,但在I、II或III期则没有,表明在癌症发生和进展过程中,高甲基化启动子区域有积累。他们开发了能够区分IV期PDAC患者与无远处转移的患者(I、II和III期),以及可能可切除的PDAC患者(I和II期)与不可切除的PDAC患者(III和IV期)的预后预测模型。
同样在2017年,该研究组利用这一队列建立了PDAC患者的生存率与血浆来源的cfDNA中高甲基化基因之间的相关性。作者发现,cfDNA中有10个以上高甲基化基因的患者生存率显著较低,这些基因因胰腺癌分期而异。通过多变量Cox回归分析建立的最终生存预测模型由5个基因(BNC1、GSTP1、SFRP1、SFRP2和TFPI2)和美国麻醉医师协会(American Society of Anesthesiologists, ASA)身体状态评分为3分(表明患者患有严重全身性疾病)组成。除SFRP2基因甲基化与较长的生存期相关外,其他基因甲基化均与较差的预后相关。在Henriksen及其同事所描述的三项研究中,高甲基化被作为定性二元变量进行分析,导致了定量信息的丢失。
2021年,这些研究者对他们之前发表的PDAC诊断预测模型(BMP3、RASSF1A、BNC1、MESTv2、TFPI2、APC、SFRP1和SFRP2)进行外部验证,并研究了CA 19 - 9血清对诊断试验预测性能的额外影响。对346例PDAC(I-IV期)和25例慢性胰腺炎患者的cfDNA样本进行的初始28个基因panel的MSP结果显示,与慢性胰腺炎患者相比,PDAC患者的高甲基化基因数量较高(8.11 vs. 5.60)。诊断预测模型验证的AUC为0.77,略低于2016年的第一项研究(0.86)。作者解释说主要研究是基于训练数据,可能由于过度拟合而高估了测试表现,从而证明了这一差异。将该检测与血清CA19-9值相结合,AUC为0.85(在主要研究中为0.93),作者得出结论,这两种标志物的联合使用可以作为临床上有用的PDAC诊断工具。重要的是要考虑到,除了在验证分析中纳入的对照个体数量少之外,病例和对照在年龄或吸烟方面不匹配,而这两个因素都是影响甲基化状态的重要因素。
Xiao-Bin Li等人于2019年对BNC1和SEPT9基因进行了重新分析,这些基因先前被描述为胰腺癌症的潜在循环生物标志物。qMSP检测结果显示,在57名PDAC患者、14名PanIN病变患者、44名良性疾病患者和53名健康对照中,两个基因的循环甲基化水平存在显著差异,肿瘤患者组的甲基化水平更高。这些标志物与CA19-9联合用于诊断癌症的灵敏度和特异性分别为86%和81.1%。然而,这些标志物可能在大约1/3的良性胰腺疾病以及其他癌症中(如结直肠癌癌症、癌症和肝细胞癌)发生甲基化。
2020年,Shinjo及其同事进行了Illumina Infinium全基因组DNA甲基化分析,灵敏度达到98%,并指出在有KRAS突变的胰腺癌组织中,ADAMTS2、HOXA1、PCDH10、SEMA5A和SPSB4是甲基化最高的基因。随后使用了一种新型且灵敏的方法(MBD-ddPCR)富集偶联甲基化CpG结合蛋白,并在血清样本(47例PDAC患者和14例正常对照)中验证了这5个标记基因的甲基化状态。虽然在癌症患者和对照之间未观察到显著差异,但49%的PDAC患者至少有一个基因甲基化,因此灵敏度为49%,特异度为86%。cfDNA甲基化状态和KRAS突变联合应用提高了诊断性能,灵敏度为68%,特异度为86%。一个悬而未决的问题是,如果将一组良性胰腺疾病患者纳入研究,将如何比较cfDNA甲基化模式。
2020年,Li和同事使用MeDIP-seq技术,将免疫沉淀与抗5-甲基胞嘧啶抗体和DNA测序相结合,从4例PDAC患者和2例健康对照cfDNA中的70个基因中鉴定出143个高甲基化差异甲基化区域。在基因组数据库(TCGA和GEO)中使用LASSO法对143个候选DMRs进行进一步分析,筛选出8个显著区分PDAC患者和健康个体的标记物(TRIM73、FAM150A、EPB41L3、SIX3、MIR663、MAPT、LOC100128977和LOC100130148),灵敏度为97.1%,特异度为98.0%。最后,Kaplan-Meier生存分析结果表明,这8个标志物可能作为胰腺癌早期诊断的潜在生物标志物,但不能作为预后的指标。
Manoochehri及其合作者在2020年描述了SST基因在包括胰腺癌在内的各种肿瘤类型中的高甲基化和下调,作为泛癌症分子生物标志物。结合对不同组织样本进行全基因组DNA甲基化分析的DMRs和先前研究的表达谱数据,结果显示SST是参与细胞增殖、侵袭、迁移、细胞死亡和凋亡以及胃肠道功能的唯一候选基因。通过RRBS测序、焦磷酸测序、qPCR以及对TCGA和GEO数据库数据分析,对PDAC组织样本中SST基因的高甲基化和低表达进行验证,证明SST基因的高甲基化和表达具有预后价值,并与PDAC患者的生存率相关。此外,与Henriksen等人的观点一致,在30例PDAC患者和18例健康对照的血浆样本中,通过ddPCR对SST等位基因进行甲基化分析,结果显示了较高的诊断灵敏度(93%)和特异度(89%)。然而SST甲基化仍不能作为胰腺癌的特异性标志物,而SST高甲基化极有可能作为广泛肿瘤的血液泛癌生物标志物,用于初始分层为高危组和低危组。
Feng Cao等人于2020年开展了5-羟甲基胞嘧啶(5hmC)测序和cfMeDIP-seq,以开发一种稳健且无创的方法,利用cfDNA中的5-甲基胞嘧啶(5mC)和5hmC标志物检测PDAC。通过比较5mC和5hmC peaks分布,分别选择了一组24个和27个5mC和5hmC peaks,这些peaks在训练集和验证集中能够高精度地区分PDAC组和健康组。结合5hmC和5mC的综合预测模型显示出更高的预测灵敏度,尤其是在早期PDAC样本中(综合模型的灵敏度为87.5%,5mC和5hmC模型的灵敏度分别为75%和62.5%),支持联合应用循环游离5mC和5hmC生物标志物进行更准确的肿瘤诊断的可能性。
Majumder等人于2021年开始对他们之前通过RRBS (Reduced Representation Bisulfite Sequencing)文库在PDAC患者组织中鉴定出的13个甲基化DNA标志物进行血浆性能分析。使用TELQAS方法分析两个独立队列的所有阶段PDAC患者(170例)和无癌症对照者(170例)的血浆样本,包括GRIN2D、CD1D、CLEC11A、AK055957、ZNF781、PRKCB、FER1L4、HOXA1、RYR2、LRRC4、GH05J042948、SHISA9和NTRK3。I期、II期、III期和IV期的灵敏度分别为79%、82%、94%和99%,与CA19-9联合检测时,特异度和灵敏度分别高达94%和82%。这项工作代表了在PDAC患者中诊断性甲基化生物标志物组合的最大研究报告结果。然而,本试验应纳入慢性胰腺炎患者队列,以增强上述组合的潜力。
Miller等人基于一项概念验证研究,将ZNF154甲基化作为血液筛查多种癌症(包括胰腺癌)的合适生物标志物。他们利用来自PDAC和无癌供体组织样本的Illumina 450 K甲基化TCGA数据分析了ZNF154在特定CG位置的甲基化。此外,他们还使用cBioPortal从这些样本中收集了突变数据。研究发现ZNF4在86.7%的PDAC样本中呈高甲基化,而在常见的一组PDAC癌基因中有95.3%发生突变(KRAS中为90.7%,TP53、SMAD4或CDKN2A中为4.6%)。接下来,他们通过结合MOB和基于PCR的高分辨率DNA熔解方法(DREAMing)检测了血浆样本中14个ZNF154 CpG位点(包括Illumina CG位点)的甲基化状态。考虑到研究队列较小(I-II期8例,III-IV期17例,正常对照组20例),对晚期胰腺的灵敏度为94.1%,特异度为80% (AUC = 0.85),对早期胰腺的灵敏度为100%,特异度为80% (AUC = 0.87)。此外,他们观察到:(I)在早期样本中未检测到KRAS突变cfDNA;(II)晚期PDAC患者中KRAS突变等位基因频率显著高于对照组;(III) AUC为0.67。作者得出结论,ZNF154显示出作为基于液体活检的癌症筛查实验室检测的良好潜力。建议未来使用更大的血浆样本进行验证,包括不同的癌症类型和分期,并建议考虑将该标志物纳入临床试验。
最后,利用cfDNA甲基化监测疾病进展和对治疗的应答是胰腺癌中很少讨论的一个重要方面。在这方面,Vrba和同事通过定量MSP分析9例转移性PDAC患者治疗前和治疗后4周的血液样本,测试了一种新的10个基因DNA甲基化标签评估肿瘤疗效的能力。虽然队列和监测时间有限,但其结果显示在所有接受治疗的患者中,生物标志物信号均有统计学显著下降。
本文作者最近的一项研究中使用ddPCR分析了44例转移性PDAC患者血浆中NPTX2甲基化水平,以评估其在预后和监测疾病进展中的作用。验证了循环NPTX2甲基化水平不仅可以作为有价值的预后生物标志物,而且可以作为监测转移性PDAC患者的实用工具。因此,在mPDAC患者中,NPTX2甲基化水平的变化与疾病进展和治疗反应之间存在相关性,在预测疾病进展方面优于CA19-9。此外,在许多情况下,循环NPTX2甲基化水平的升高先于CT成像发现疾病进展。
挑战和结论
循环甲基化DNA有望成为胰腺癌检测和治疗的无创生物标志物。本文就液体活检中DNA甲基化作为PDAC诊断或预后工具的最新研究进展进行综述。
液体活检领域(尤其是在处理cfDNA时)面临的一个持续而紧迫的挑战是迫切需要对技术进行标准化和临床验证。这对于从基础研究过渡到临床试验范围并最终推进该领域至关重要。分析的方法学程序和具体目标尚未完全标准化。因此,为了实现实验室间的一致性,并建立一个或多个基因作为临床适用的基于cfdna的胰腺癌表观遗传生物标志物,在大量的患者和健康个体队列中进行验证至关重要。此外,为了便于研究结果的比较,还需要统一鉴定和检测技术,从而确保所开发方法的临床可行性。
另一方面,使用单一生物标志物检测到的表观遗传改变无法捕捉疾病的复杂生物学。从这个意义上说,多种生物标志物的联合无疑可以提高预测能力,并有助于早期诊断、预测预后和治疗反应。
目前已有47项临床试验研究cfDNA甲基化标志物在癌症中的诊断和预后效用。其中9项研究是关于胰腺癌中甲基化血液循环生物标志物的验证,而疾病的早期诊断是大多数(70%)研究的主要目的(图2),尽管没有提供关于分析哪些基因的具体信息。

图2:使用cfDNA甲基化治疗癌症的当前临床试验的图形谱,以及基于cfDNA甲基化的胰腺癌试验的临床干预目标。
- 数据指的是47个临床试验中针对不同癌症类型的67项研究。
- 数据指的是了9项胰腺癌临床试验中的13项不同终点的研究。
综上所述,将循环游离DNA甲基化纳入胰腺癌的临床和精准医学是一个前景光明的现实。为此,有必要共同努力,通过更精心设计的研究,结合灵敏度更强或创新技术的研究,以及增加大规模临床试验样本数量,来验证其疗效和效用。最后,合作研究和资源共享也可为将这一创新方法纳入临床应用铺平道路。
技术推介
易基因微量cfDNA甲基化测序(cfDNA-BS)技术
cfDNA片段化严重,片段大小常在150bp左右,现有甲基化检测技术包括cfMeDIP和微量WGBS等。无法做到碱基分辨、具有抗体特异性和非特异性捕获、覆盖深度低、检测成本高等特点。常规RRBS富集约70-350bp范围酶切片段,如对于CG含量高的片段将被切割的更碎而无法检测,保留下来的片段反而是CG含量低,无甲基化信息的基因片段。
易基因研发cfDNA-RBS技术,特异性捕获CCGG位点两端的DNA,通过亚硫酸盐测序,实现高深度,单碱基分辨检测CG位点甲基化信息。DNA起始量仅需1ng,是目前肿瘤甲基化标志物检测研究的优选技术。
技术优势:
- 超低起始量:100-500ul血浆或1ng cfDNA;
- 测序覆盖度高:20G测序数据,可达10M的CG位点覆盖,涵盖CpG岛、启动子、增强子、CTCF结合位点等多种核心调控区域
- 单碱基分辨率:在其覆盖范围内可精确分析每一个C碱基的甲基化状态;
- 性价比高:成本相对于现有技术大幅降低。
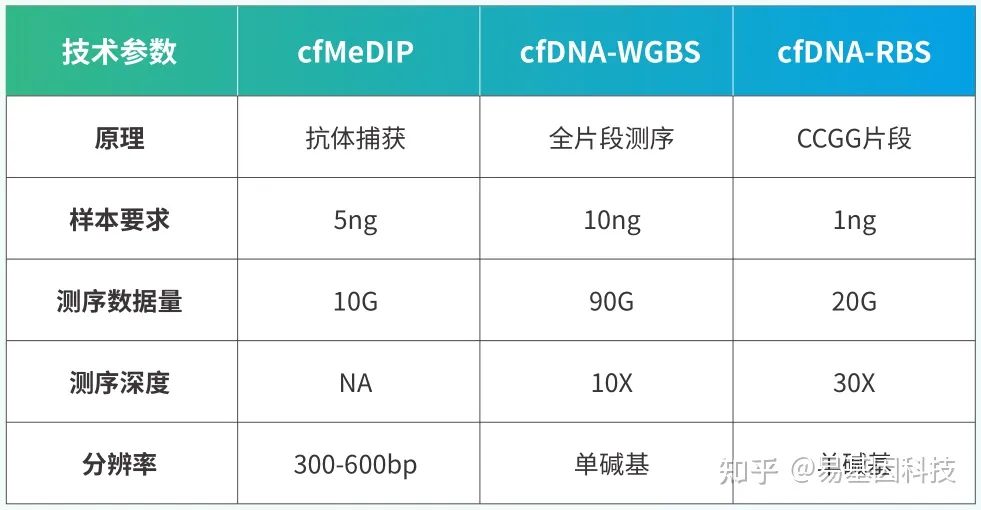
技术指标

应用场景:
- 癌前病变的癌变预警标志物检测
- 肿瘤早期筛查标志物检测
- 肿瘤预后标志物检测
- 药物疗效预测标志物检测
易基因科技提供全面的DNA甲基化研究整体解决方案,详询易基因:0755-28317900。
参考文献:
García-Ortiz MV, Cano-Ramírez P, Toledano-Fonseca M, Aranda E, Rodríguez-Ariza A. Diagnosing and monitoring pancreatic cancer through cell-free DNA methylation: progress and prospects. Biomark Res. 2023 Oct 5;11(1):88.
相关阅读:
精准医学:新发现!全基因组cfDNA甲基化分析或可用于胰腺癌早期诊断应用


























 6674
6674

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








