大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
干旱(Drought)会对植物的生长、发育和生产力造成严重损害,是最具危害性的环境因素之一。植物已经进化出复杂的调控网络和干旱胁迫的抗性策略。作为一种保守的表观遗传调控,DNA甲基化变化可以改变植物对非生物胁迫响应中的基因表达和染色体互作。基因组学、表观基因组学和转录组学等组学技术的发展促进了非模式作物物种表观遗传变异研究的快速增长。本文总结了干旱胁迫下作物DNA甲基化作用的最新研究成果,包括甲基化和去甲基化酶、整体甲基化动态变化、DNA甲基化对基因表达的双重调控、RNA依赖性DNA甲基化(RdDM)通路、可变剪接(AS)事件和长链非编码RNAs(lnc RNAs)。还讨论了干旱诱导的逆境胁迫记忆(stress memory)。这些表观基因组研究结果为制定提高作物抗旱性策略提供了宝贵的潜力。
干旱胁迫导致细胞膨压下降,导致细胞壁的组成和结构发生变化,以及对质膜和细胞壁造成损伤。渗透传感器,如组氨酸激酶(HKs)、DROOPY LEAF1(DPY1)、渗透敏感性Ca2+通道减少HYPEROSMOLALITY-INDUCED CA2+INCREASE1(OSCA1)、钙离子渗透性应激门控阳离子通道1(CSC1)和MID1互补活性(MCAs),能够感知干旱胁迫对植物细胞的影响(图1)。随后,各种信号通路被激活,包括钙信号、ABA依赖性和ABA非依赖性信号以及活性氧(ROS)。转录、转录后、翻译后和表观遗传学水平的多个调控过程被整合到植物对干旱的响应中。近期文献全面综述了干旱胁迫感知和信号通路的分子机制。

图1:渗透传感器介导干旱胁迫信号。MCA、OSCA1和CSC1是 Ca2+ 通道,其在干旱胁迫下被激活,导致胞质钙离子 (Ca2+) 增加。钙依赖性蛋白激酶 (CPK) 可感知胞质溶胶中升高的Ca2+水平,并启动下游信号级联反应。在干旱胁迫下,DROOPY LEAF1(DPY1)被磷酸化,导致多种蛋白质的全局磷酸化,包括STRESS ACTIVATED PROTEIN KINASE6(SAPK6)、丝裂原活化蛋白激酶(MAPKs)、钙依赖性蛋白激酶(CDPKs)和Raf样激酶(RAFs)。位于质膜上的组氨酸激酶 (HKs) 也参与 MAPK 信号通路。
DNA甲基转移酶和去甲基化酶在抗旱性中的应用
通过精确调控维持DNA甲基化和去甲基化的动态平衡对于各种细胞生物过程至关重要。多种不同的酶已被鉴定出能激活或失活特定的DNA甲基化状态。在拟南芥中,CG、CHG和CHH胞嘧啶甲基化分别优先由甲基转移酶1(MET1)、染色体甲基转移酶3(CMT3)和结构重排甲基转移酶2(DRM2)催化。DNA去甲基化由四种DNA糖苷酶家族执行,包括沉默抑制因子1(ROS1)、转录激活因子DEMETER(DME)、类似DEMETER蛋白2(DML2)和DML3。核小体重塑因子REDUCED IN DNA METHYLIZATION 1(DDM1)在维持转座元件的DNA甲基化中起着关键作用。
在作物中已鉴定并功能表征了DNA甲基转移酶和去甲基化酶基团。在水稻中共鉴定出九种DNA甲基转移酶(1种MET、3种CMT和2种DRM)。与拟南芥相比,MET和DRM家族的基因数量重复。与拟南芥同源物类似,OsMET1b、OsCMT3a和OsDRM2分别是CG、CHG和CHH甲基化的主要甲基转移酶。在CMT2中观察到轻微差异,不影响水稻中的CHG甲基化,但在拟南芥中维持CHH和CHG甲基化。表明在拟南芥和作物中存在保守的DNA甲基化机制。
基因表达分析表明,干旱胁迫改变了编码DNA甲基转移酶和去甲基化酶的基因转录水平。在苹果和桑树中,不同时间点的干旱胁迫下观察到DNA甲基转移酶和去甲基化酶基因之间的节律表达,表明DNA甲基化和去甲基化之间的协调响应。
抑制DNA甲基转移酶可能激活应激响应的基因表达。拟南芥中的cmt2和drm2突变体分别表现出对热应激和冷应激的抗性增加。5-氮杂胞苷(DNA甲基转移酶抑制剂)的应用增强了拟南芥的抗冻性。同样,杨树RNAi系中核小体重塑因子DDM1下调通过调控参与激素相关应激响应基因,显示出对干旱诱导的空化具有更高的抗性。注射DNA甲基化抑制剂5-氮杂胞苷的棉花植物也表现出改善的抗旱性。
干旱胁迫下的甲基化谱
植物界中的DNA甲基化水平各不相同。研究发现DNA甲基化水平(CG和CHG)与基因组大小之间正相关。由于不同物种间甲基化区域的大小和水平存在差异,干旱胁迫对DNA甲基化模式的影响也因物种而异。在比较干旱胁迫下的甲基化组时,发现拟南芥的整体甲基化水平保持不变;桑树、亚麻和毛果松(P. trichocarpa)中增加;而在蚕豆、多年生黑麦草和毛白杨(P. tomentosa)中显著减少。此外,在水稻、玉米、豇豆、小麦和P. tomentosa中,干旱胁迫诱导的甲基化水平在干旱敏感型品系中比抗旱型品系中更高,表明DNA甲基化与干旱抗性之间存在负相关。 在三种DNA甲基化环境中,CHH甲基化水平在大多数作物中与干旱胁迫的相关性最高。但在桑树中,CG甲基化水平与干旱胁迫的相关性更高。此外,干旱诱导的CHH甲基化变化主要发生在转座元件序列和/或基因启动子区域。
DNA甲基化与基因表达的相关性
DNA甲基化在不同基因组区域的作用各不相同。基因启动子附近的甲基化通常通过抑制转录因子结合以抑制基因表达。也有大量例外表明启动子甲基化与基因表达之间存在复杂的关系。基因体(Genebody)区DNA甲基化可能与转录延伸、可变剪接以及重复DNA元件抑制有关。通过对转录组和甲基化组数据的综合分析,揭示了在干旱胁迫下,拟南芥和其他作物中DNA甲基化密度与基因表达水平之间相对保守的关系。通常,基因表达水平与基因体甲基化水平(尤其是在CG环境中)和/或远端启动子区域(尤其是在CHH环境中)呈正相关,但与转录起始位点(TSS)、转录终止位点(TTS)和下游区域的甲基化密度呈负相关。转座元件(TE)区域高甲基化可能有助于转座子抑制,且附近TE基因表达水平可能会受到影响。
干旱胁迫诱导的差异甲基化区域在决定应激响应基因的表达水平中发挥重要作用。利用WGBS和RNA-seq技术鉴定出基因表达水平与DNA甲基化相关的候选基因组。其中许多基因在应激响应通路中富集,如激素信号通路、转录因子、程序性细胞死亡和ROS合成。具体来说,干旱胁迫下CHH变化有助于提高与干旱相关转录因子表达,包括AP2、WRKY、MYB、NAC和bHLH转录因子家族成员。
多个关键基因已被鉴定出与DNA甲基化、转录表达和干旱抗性相关。例如在玉米中,ZmNAC111启动子上的DNA甲基化水平增加导致其表达减少并增加干旱敏感性。大麦中HvCKX2.1启动子甲基化由干旱胁迫诱导,并加速大麦嫩芽出苗。此外,苹果中MdRFNR1(苹果抗旱性的正调控因子)表达由其启动子中的MITE插入位点的甲基化诱导。
RNA依赖性DNA甲基化通路
RNA定向DNA甲基化(RdDM)通路是植物中一种独特过程,非编码RNA以序列特异性方式启动de novo DNA甲基化。拟南芥中鉴定的典型RdDM通路产生24个小干扰RNA(siRNAs),这些siRNA与DNA甲基化酶互作以建立de novo DNA甲基化(图2)。siRNA前体最初由RNA聚合酶IV(POL IV)产生,并通过RNA依赖性RNA聚合酶2(RDR2)转化为双链RNA(dsRNA)。然后,dsRNAs通过Dicer样蛋白3(DCL3)片段化成24-nt siRNAs,并加载到Argonaute 4(AGO4)和AGO6蛋白上。由POL V转录的Scaffold RNAs 与24-nt siRNAs互补,并在靶位点被DRM2 de novo甲基化。该过程中需要许多辅助蛋白,POL IV、Sawadee同源结构域蛋白1(SHH1)和SNF2结构域含有蛋白Classy 1(CLSY1)(染色质重塑蛋白)互作;而SHH1与二甲基化组蛋白H3赖氨酸9(H3K9me2) 结合。RNA定向DNA甲基化3(RDM3)是POL V的转录延伸因子,增强AGO4/6和POL V互作。由RNA定向DNA甲基化缺失1(DRD1)、分生组织沉默缺失3(DMS3)和RDM1组装的DDR复合体,需要进行染色质重塑以促进POL V。RDM1通过与AGO4和DRM2互作,在de novo DNA甲基化反应中发挥关键作用。Variegation 3-9同源蛋白2(SUVH2)和SUVH9通过鉴定甲基化胞嘧啶并与DDR复合体互作,有助于在正确位置招募POL V。

图2:拟南芥中典型的RNA定向DNA甲基化通路。
RdDM通路主要通过在新TE插入位点上进行de novo DNA甲基化以及维持现有TEs上稳定甲基化来抑制TE表达。RdDM通路增强了非生物胁迫下被激活的TEs活性,如番茄中一个Rider逆转录转座子TE家族在干旱胁迫下被激活,并通过RdDM通路调控。RdDM通路还与玉米中ZmNAC111、大麦中HvCKX2.1、苹果中MdRFNR1的启动子区域的TE元件甲基化有关。水稻和玉米中干旱诱导的siRNA丰度和DNA甲基化在不同的遗传区域显示出正相关。这些结果表明RdDM通路参与作物对干旱胁迫的响应。
干旱胁迫下DNA甲基化调控的可变剪接
近期证据表明DNA甲基化在调控可变剪接(selective spending,AS)中的作用,部分是通过在可变剪接外显子上的甲基化状态变化。AS是一个能够从单基因生成多种转录本异构体的重要机制,它作为基本的转录后调控过程,影响特定异构体的稳定性、表达或亚细胞定位。约42%~61%的植物基因会经历可变剪接,AS有助于植物发育的各个方面的转录组重编程,包括种子萌发、开花和生物钟。植物AS在获得非生物胁迫抗性中也起着至关重要的作用,尤其在ABA信号介导的干旱抗性中。
基因可以经历两种类型的AS,经典和可变顺式剪接(cis-splicing,顺式剪接),以及遗传和自我反式剪接(trans-splicing,反式剪接)。AS事件由细胞核中的剪接复合体执行,而剪接因子(如丝氨酸/精氨酸(SR)蛋白的成员则促进了这一复合体。三种激酶包括:丝氨酸/精氨酸蛋白激酶(SRPKs)、Pre-mRNA加工因子4(PRP4Ks)激酶和拟南芥FUS3补充因子(AFC),已被确认对剪接体形成和剪接位点鉴定至关重要。这些与剪接相关的激酶在拟南芥、水稻和小麦中的不同表达在非生物胁迫下表明其参与胁迫响应。
与侧翼内含子相比,外显子上的DNA甲基化水平更高。因此,基因体DNA甲基化水平差异分布被视为区分外显子和内含子的标记。DNA甲基化可以影响外显子选择和Pre-mRNA的可变剪接。然而,DNA甲基化与AS事件之间的关系在不同作物的干旱胁迫下有显著差异。玉米基因体DNA甲基化水平与AS事件呈正相关,但与基因表达呈负相关,表明DNA甲基化在响应干旱胁迫时对基因表达和AS具有双重调控作用。亚麻品种中,AS事件在干旱胁迫下迅速积聚,但与基因体甲基化动态无关。在P. trichocarpa中,由于大多数顺式剪接基因中缺少甲基化位点,未发现甲基化与顺式剪接事件之间的关系,表明作物中可变剪接的调控机制不同。
当前对AS与DNA甲基化之间关联的理解仅限于第二代测序技术,这些技术产生短读长,可能无法准确预测AS。最近第三代测序技术的进步,提供了更长读长以直接检测转录本异构体的表观遗传修饰,将为作物非生物胁迫下AS的表观遗传调控提供宝贵见解。
干旱胁迫下长链非编码RNAs和DNA甲基化
长链非编码RNA(long noncoding RNA, lncRNAs)是一类长度超过200 nt的RNA转录本,不会被翻译成功能性蛋白。它们可以影响细胞质mRNA稳定性,并调控mRNA加工的不同阶段,如剪接、转运和翻译。植物lncRNAs参与基本的生物过程,包括春化、生育、光合作用通路和生物/非生物胁迫响应,主要依赖于其组织和条件特异性表达模式。研究表明,在拟南芥、玉米和桑树中,许多lncRNA表达可以响应干旱胁迫。
最近的研究揭示了DNA甲基化与lncRNA互作。lncRNA表达水平在所有三种序列环境中都受DNA甲基化负调控,包括其侧翼和body区域。LncRNA还通过与DNA甲基转移酶互作,在基因启动子中介导DNA甲基化,从而在表观遗传学水平上调控基因表达。
在作物中已经观察到干旱条件下lncRNAs和DNA甲基化的参与。在棉花中,lncRNA可能会剪接成microRNA,microRNAs在干旱胁迫下调控甲基化。在水稻中,lncRNA和DNA甲基化可能通过激活与抗旱能力相关的基因来建立短期干旱应激的记忆因子。需要进一步研究来揭示表观遗传学和lncRNA调控的详细机制。
干旱应激记忆
植物已经进化出一种机制来获取对环境经历的记忆,促进植物适应反复出现的应激。表观遗传应激记忆被定义为由环境输入诱导特定位点上的染色质标记,并可以在未来相同应激下通过细胞分裂传递。这些由环境触发的表观遗传标记包括核小体组蛋白的翻译后修饰(如乙酰化、甲基化、磷酸化和泛素化)以及应激响应位点上的DNA甲基化或去甲基化,如组蛋白H3赖氨酸-4三甲基化(H3K4me3)和组蛋白H3赖氨酸-27三甲基化(H3K27me3)通常分别与基因激活和抑制相关。
植物通过瞬时生物或非生物胁迫而被"启动",并在一段时间内存储应激记忆,以便在胁迫再次发生时做出更快速和有力响应。染色质介导的环境记忆分为体细胞记忆(somatic memory)和传代记忆(transgenerational memory)(图3)。逆境响应通过有丝分裂传递给新生细胞,形成体细胞逆境记忆;通过减数分裂传递给下一代植株,即使后代没有受到逆境影响,形成传代记忆。体细胞记忆通常与启动期间的组蛋白H3K4甲基化和核小体占位有关。如在复水处理(re-water treatment)后维持两个干旱诱导基因(RB29B和RAB18)的H3K4me3对干旱胁迫启动至关重要。

图3:植物中基于表观遗传学和染色质的胁迫记忆。
植物在最初的胁迫暴露后获得应激记忆(priming),可以增强其对后续胁迫的抗性。体细胞胁迫记忆是暂时性的。在体细胞胁迫记忆中表现出H3K4高甲基化、转录记忆、核小体重塑和核小体占有以响应非生物胁迫。传代胁迫记忆会传递给无胁迫的后代植株,不同 DNA 甲基化的可遗传表观等位基因可能参与染色质传代应激记忆机制。
代际或传代胁迫记忆机制远未明确,不同DNA甲基化的表观遗传变异可能参与染色质应激记忆遗传。在拟南芥中,DNA甲基化的表观遗传改变可以跨代遗传,但DNA甲基化状态在六代内的连续代中主要是稳定的,且对反复干旱胁迫不敏感。在五个拟南芥品系中,在轻度干旱下没有发现跨代效应或遗传的应激记忆。相比之下,水稻在反复干旱胁迫和恢复处理下,鉴定出与DNA甲基化相关的短期应激记忆建立。此外在水稻和玉米中,干旱抗性品系比干旱敏感品系在水分亏缺胁迫下的DNA甲基化组的稳定性和遗传性更高。这引发了一个问题,即干旱诱导的DNA甲基化变异如何支撑跨代应激记忆。对白三叶草和草莓的最新研究表明,环境互作介导的部分效应可以遗传,且种群历史有助于适应干旱的稳定表观遗传记忆形成。
结论与未来展望
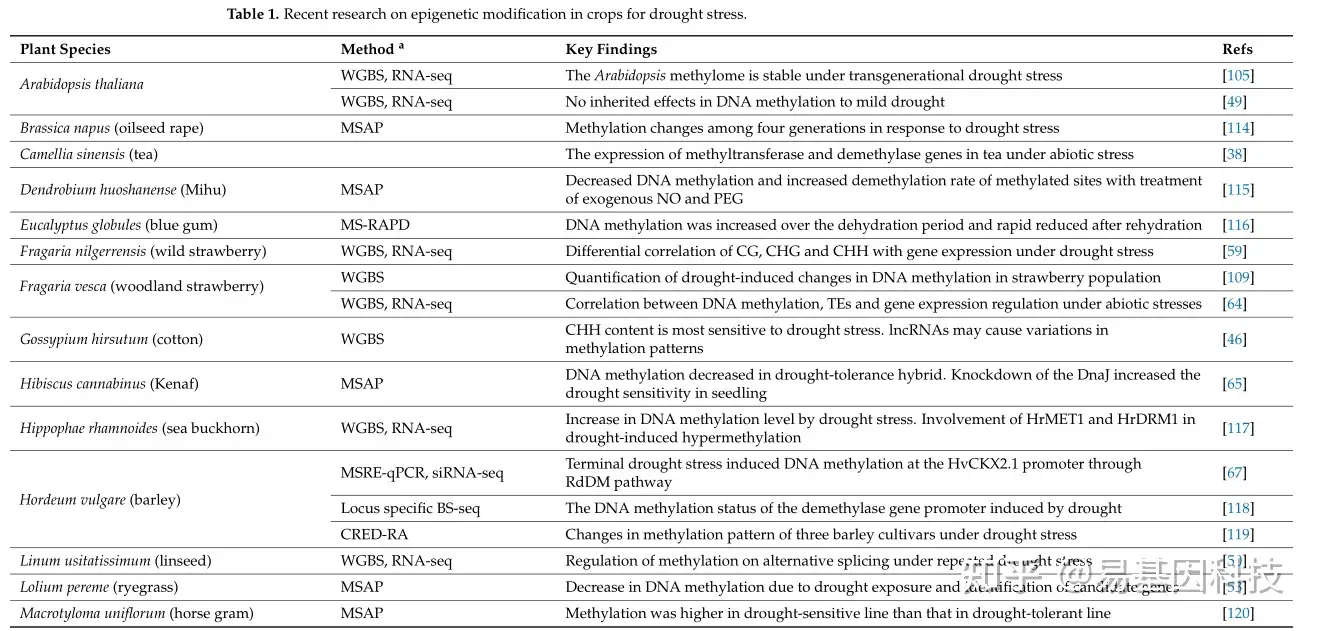
本文总结了不同作物在干旱胁迫下DNA甲基化的最新研究(表1),并提供了对干旱胁迫下表观遗传响应的见解(图4)。干旱胁迫引起的DNA甲基化变化以物种、基因型和组织特异性的方式存在差异。在三种DNA甲基化环境中,不对称的CHH对干旱胁迫高度敏感。大多数现有研究表明DNA甲基化在调控应激响应基因表达中起着重要作用。此外RdDM DNA甲基化可能靶向转座元件(TEs)和基因,以序列特异性的方式在响应干旱胁迫时沉默。在一些作物中,可变剪接(AS)事件和长链非编码RNAs(lncRNAs)在应激响应中发挥关键作用,可能与干旱胁迫下的DNA甲基化有关。然而,需要进一步探索非生物胁迫下AS事件和lncRNAs的表观遗传调控。

图4:DNA甲基化在植物干旱胁迫响应中的作用。
植物基因组中DNA甲基化的位点特异性操作有几种方法可用。其中一种方法是病毒诱导基因沉默(VIGS)技术,该技术可以通过siRNAs激活RdDM通路以沉默基因表达。然而传统的表观遗传修饰方法可能导致DNA甲基化整体变化。近年来表观基因组编辑技术已成功应用于精确染色质扰动,如Tet1或Dnmt3a与催化失活的dCas9融合蛋白已被证明可以调节靶向报告基因启动子区域的甲基化状态。已经开发出一套由催化失活dCas9与优化GCN4尾部融合的表观基因组编辑工具,以及包含九种效应子的文库,用于特定位点的系统性染色质修饰。这些新兴的表观遗传修饰技术将为作物的表观遗传操作提供机会,以改善农艺性状。
全球变暖和降雨量减少等气候变化加速了干旱胁迫的普遍性。迫切需要开发能够适应不可预测极端天气条件的气候弹性作物。表观遗传变异是可遗传变化,使植物能够在不改变DNA序列的情况下响应环境胁迫。了解表观遗传变化与适应干旱胁迫之间的联系将促进重要作物的分子育种。应将表观基因组视为一个整体系统,包括DNA甲基化、组蛋白修饰和RNA介导的基因沉默。随着高通量技术的发展,如第二代和第三代测序、RNA和染色质免疫沉淀(ChIP)测序以及单细胞测序,将更容易绘制出干旱胁迫响应的单细胞分辨率的表观基因组谱。未来发展表观遗传修饰技术并深化对表观遗传机制的理解,将为培育具有遗传性和稳定性以增强抗逆性的作物提供有希望的方法。


关于易基因全基因组重亚硫酸盐测序(WGBS)
全基因组重亚硫酸盐甲基化测序(WGBS)可以在全基因组范围内精确的检测所有单个胞嘧啶碱基(C碱基)的甲基化水平,是DNA甲基化研究的金标准。WGBS能为基因组DNA甲基化时空特异性修饰的研究提供重要技术支持,能广泛应用在个体发育、衰老和疾病等生命过程的机制研究中,也是各物种甲基化图谱研究的首选方法。
易基因全基因组甲基化测序技术通过T4-DNA连接酶,在超声波打断基因组DNA片段的两端连接接头序列,连接产物通过重亚硫酸盐处理将未甲基化修饰的胞嘧啶C转变为尿嘧啶U,进而通过接头序列介导的 PCR 技术将尿嘧啶U转变为胸腺嘧啶T。
应用方向:
WGBS广泛用于各种物种,要求全基因组扫描(不错过关键位点)
- 全基因组甲基化图谱课题
- 标志物筛选课题
- 小规模研究课题
技术优势:
- 应用范围广:适用于所有参考基因组已知物种的甲基化研究;
- 全基因组覆盖:最大限度地获取完整的全基因组甲基化信息,精确绘制甲基化图谱;
- 单碱基分辨率:可精确分析每一个C碱基的甲基化状态。

易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化)和表观转录组学(m6A、m5C、m1A、m7G)、染色质结构与功能组学技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900.

参考文献:
Rao X, Yang S, Lü S, Yang P. DNA Methylation Dynamics in Response to Drought Stress in Crops. Plants (Basel). 2024 Jul 19;13(14) pii: plants13141977. doi: 10.3390/plants13141977. PubMed PMID: 39065503.
相关阅读:
1. Cell|易基因微量DNA甲基化测序助力中国科学家成功构建胚胎干细胞嵌合体猴,登上《细胞》封面
2. Nature | 易基因DNA甲基化测序助力人多能干细胞向胚胎全能8细胞的人工诱导3. WGBS+RNA-seq揭示黄瓜作物的“源-库”关系受DNA甲基化调控
4. WGBS等揭示SOX30甲基化在非梗阻性无精症中的表观遗传调控机制
5. WGBS+RNA-seq揭示PM2.5引起男性生殖障碍的DNA甲基化调控机制
6. WGBS+RNA-seq揭示松材线虫JIII阶段形成过程中的DNA甲基化差异
7. 微量DNA甲基化分析揭示MeCP2在卵子发生和卵巢衰老中的表观遗传调控
8. 单细胞DNA甲基化与转录组分析揭示猪生发泡卵母细胞成熟的关键调控机制
9. 植入前胚胎的全基因组DNA甲基化和转录组分析揭示水牛胚胎基因组激活进展
10. 微量DNA甲基化分析揭示MeCP2在卵子发生和卵巢衰老中的表观遗传调控



























 6745
6745

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








