大多数细胞穿透肽(CPPs)通过不止一种途径进入细胞。例如,它们可以直接穿透细胞膜,将小干扰RNA(siRNA)分子带入细胞质中,从而实现RNA干扰。同时,大多数细胞穿透肽通过内吞途径进入细胞。以阳离子细胞穿透肽R9为例,R9/siRNA复合物可以直接进入细胞质,但大多数会迅速在内体中积累。总体而言,细胞穿透肽的内体溶解活性较差,这表明需要其他肽序列来破坏内体/溶酶体。
1. 构象变化的融合肽
融合肽在中性 pH 值条件下通常处于休眠状态,但其融合功能可在较低 pH 值条件下被激活。当周围环境的 pH 值下降(例如在酸性内体和溶酶体中)时,它们会发生构象变化,例如形成两亲性螺旋。这种转变后的肽通常会自聚形成多聚体簇,并与内体膜融合并破坏内体膜,从而有助于货物释放。与两亲性α-螺旋型细胞穿透肽不同,融合肽通常含有谷氨酸或组氨酸,因为它们的侧链可以响应 pH 值的微小变化而脱质子化或质子化。
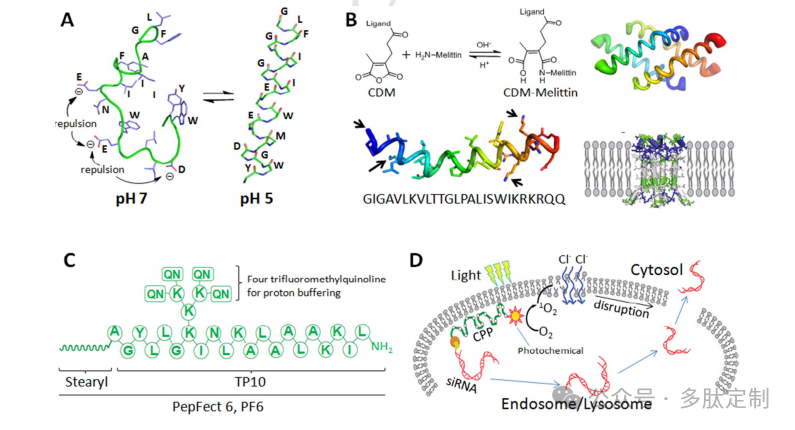
图2.溶酶体破坏肽。A)构象变化的融合肽HA2在中性pH值时呈无规卷曲,在较低pH值时则呈α-螺旋构象。B)通过在蜂毒肽的NH2基团(箭头所示的N端和赖氨酸侧链)进行CDM改性而得到的构象变化肽。蜂毒肽的膜活性在改性后消失,但在溶酶体的弱酸性环境中可恢复,此时它重新折叠成同源四聚体,并通过形成孔隙破坏溶酶体膜。C)在TP10背骨上添加了四个三氟甲基喹啉基团,并对N端进行了硬脂基修饰的化学结构PF6。D)通过用光敏剂修饰CPPs实现光诱导溶酶体逃逸。光激发光敏剂触发单线态氧(1O2)的生成,从而裂解溶酶体膜,使siRNA逃逸。
源自血凝素(HA)的HA2(GLFGAIAGFIENGWEGMIDGWYG)是一种强效的pH响应性融合肽。其两个谷氨酸和天冬氨酸残基的侧链呈阴离子性,使得该肽在生理pH值下呈无规卷曲结构。然而,在酸性内体中,这些侧链的羧基被质子化,负电荷减少,从而肽链形成α-螺旋结构(图2A),并与内体膜融合,使其不稳定。由于呈阴离子性,HA2常与阳离子肽结合用于siRNA的凝聚。例如,HA2已与穿膜肽、九聚精氨酸或阳离子绿色荧光蛋白连接,以将siRNA递送至多种癌细胞。为了增强其融合活性,HA2还被突变为几种衍生物。常见的策略包括增加谷氨酸以提高pH敏感性,并引入色氨酸或亮氨酸等疏水性氨基酸以增强膜融合能力。HA2衍生物如INF7、E5、E5WYG和C6M1已用于质粒DNA和siRNA的递送(表2)。
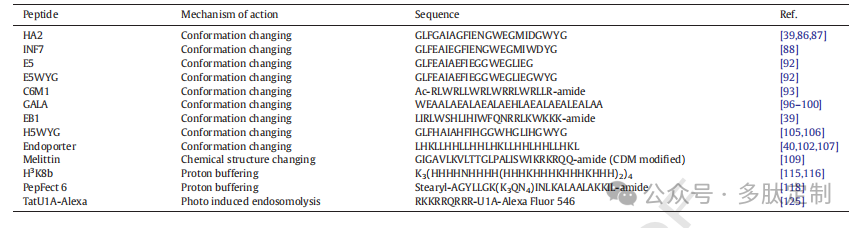
表2:用于 siRNA 传递的内体破坏肽。
受天然HA2融合肽的启发,弗朗西斯·C·索卡(FrancisC.Szoka)的研究小组设计了一种含谷氨酸-丙氨酸-亮氨酸-丙氨酸(EALA)重复序列的人工肽。在这个重复序列中,氨基酸E对pH值敏感,而ALA则提供疏水性。这种肽被命名为“GALA”。在内体中,GALA螺旋折叠成一个由约10个GALAα-螺旋单体组成的跨膜肽孔。作为一种阴离子内溶酶肽,GALA是帮助DNA/阳离子聚合物复合物(通过简单混合)逃逸内体的热门选择。共价连接是另一种常见策略,尽管已知在肽末端进行修饰会降低其pH敏感性和内溶酶活性。然而,多项独立研究均表明,修饰后的GALA脂质体在体外siRNA传递方面比单纯脂质体更有效。
与谷氨酸类似,组氨酸是另一种常用于破坏内体的pH敏感性氨基酸。组氨酸的咪唑基团的pKa值约为6.0,处于内吞途径中pH值变化的范围内(从中性到早期内体的pH6.0-6.5以及晚期内体的pH4.5-5.5)。自然地,组氨酸是调节蛋白质pH依赖性功能的常见成分。例如,人催乳素与其受体的pH依赖性结合活性被认为与结合界面内存在的多个组氨酸有关。利用组氨酸的天然pH敏感性,Lundberg等人将穿膜肽中的两个氨基酸替换为组氨酸,从而创建了一种新的pH敏感性融合肽EB1(LIRLWSHLIHIWFQNRRLKWKKK-酰胺)。这种肽不会破坏细胞膜(因为细胞外的pH值为中性),但在酸性内体中质子化时会形成具有膜溶解性的α-螺旋。同样,组氨酸也被用于控制许多其他融合肽(如LAH4、H5WYG和Endoporter)在pH值变化时的α-螺旋形成。这些肽被广泛用于促进DNA和siRNA递送过程中的内体逃逸。例如,Endoporter似乎是一种效力极高的融合肽。在10%胎牛血清存在的情况下,以1微摩尔浓度的肽,已成功将反义核酸(一种将核苷酸基团连接到吗啉环而非脱氧核糖环上的合成分子)递送至细胞质。请提供需要翻译的原文。同样,肽类、蛋白质、小干扰RNA(siRNA)、反义寡核苷酸以及其他高分子量的货物也已通过内吞途径借助内体转运肽(Endoporter肽)被递送进细胞。
2. 改变化学结构的肽
除了通过pH值触发构象变化来开启和关闭的融合肽之外,还开发了通过暂时掩盖关键残基来破坏内体的肽。细胞进入后,内体的酸性环境有助于通过化学反应去除掩盖部分,从而激活膜破坏功能。羧基二甲基马来酸(CDM)修饰的蜂毒肽是这种策略的杰出代表。CDM是一种马来酸酐,可与肽中的亲核物质(如伯胺)发生反应,这种修饰在酸性环境中可在短短5分钟内被去除。经过CDM修饰后,蜂毒肽上会添加一个羧基。这种阴离子电荷抑制了蜂毒肽的膜破坏活性(图2B)。显微镜研究表明,未修饰的蜂毒肽在浓度为10μg/mL时可在不到10分钟内完全破坏细胞,而CDM修饰的蜂毒肽即使浓度高达400μg/mL也无细胞毒性。DNA质粒与CDM-蜂毒肽的共孵育会导致这两种物质同时在内体中积累,随后在约35分钟内逃逸,从而导致基因表达增强10倍。对于体内靶向应用,通过CDM上的游离羧酸基团将肝细胞靶向的N-乙酰半乳糖胺配体连接到CDM-蜂毒肽上。将这种pH激活肽(命名为NAG-MLP)与靶向凝血因子VII(F7)的肝趋向性胆固醇共轭siRNA(chol-siRNA)简单共注射,可在小鼠和非人灵长类动物中有效敲低F7,且不会改变临床化学生物标志物或诱导细胞因子。
ARC-520也是一种基于NAG-MLP的RNA干扰疗法,正在研发用于治疗慢性乙型肝炎病毒(HBV)感染。它由两种针对HBV基因组高度保守序列的胆固醇偶联siRNA组成,以及促进HBV胆固醇-siRNA从内体逃逸的NAG-MLP。一项包含36名受试者的I期研究显示,ARC-520未检测到明显副作用,仅有一名受试者在最高剂量时出现荨麻疹皮疹。与安慰剂相比,ARC-520即使在高达2毫克/千克的剂量下也似乎是安全且耐受性良好的。一项2a期临床试验表明,单次给药后,ARC-520能显著降低人类体内的表面抗原、e抗原和核心相关抗原,这有力地证明了ARC-520能够使免疫系统得以重建(这是siRNA抑制HBV蛋白的药理学结果)。一项评估其治疗效果一致性的2b期临床研究正在进行中。
3. 质子缓冲肽
内吞体内酸性吸收肽的积累有助于货物分子通过一种被称为质子海绵效应的过程逃逸出内吞体,这种效应源于大量在 pH 值 5 - 6 时具有缓冲能力的弱碱。酸性细胞器中的质子吸收会导致细胞器膜两侧渗透压升高,随后酸性内吞体发生膨胀和/或破裂。
组氨酸的pKa值为6.0,具有出色的质子吸收能力。富含组氨酸的多肽已被证明能将脂质体的DNA转染效率提高100倍以上。还报道了含多个组氨酸的较短线性肽能提高DNA转染效率,而将组氨酸以更高密度掺入的分支肽能进一步提高转染效率。对于siRNA递送,一种8肢肽H3K8b与靶向β-半乳糖苷酶的siRNA复合,并应用于稳定表达β-半乳糖苷酶的小鼠内皮细胞。该分支肽在siRNA浓度为300nM时,能够使β-半乳糖苷酶表达降低80%。将H3K8b与整合素靶向配体(RGD肽)结合,进一步提高了siRNA的递送效率。在携带MDA-MB-435肿瘤细胞的小鼠中,已测试了通过分支肽将抗raf1siRNA系统递送至肿瘤部位。尽管在肾脏中有显著积累,但siRNA在肿瘤中的摄取也很明显,并且在多次尾静脉注射后观察到肿瘤明显缩小。
除了天然氨基酸组氨酸,质子缓冲剂氯喹也可以与肽共价结合,以促进货物从内体中逃逸。PepFect6(PF6)就是按照这种方式设计的(图2C),通过用四个三氟甲基喹啉(氯喹类似物)修饰一个细胞穿透肽(硬脂基-TP10)。与亲本TP-10不同,PF6不会在细胞膜上形成孔洞。相反,它通过内吞作用进入细胞。三氟甲基喹啉分子中和多余的质子,最终通过渗透性膨胀破坏内体隔室。由于这种内体破坏能力,已在包括原代细胞在内的多种细胞类型中实现了强大的RNA干扰。稳定的PF6/siRNA纳米颗粒也适用于全身性siRNA递送。全身注射后的小鼠RNA干扰已实现,且未检测到毒性。
4. 光诱导内溶酶体破裂
除了化学触发的内体裂解外,还可以利用外部刺激(如光)实现内体逃逸。当在递送系统中加入光敏剂时,它们在光激发下会产生活性氧(ROS)。常见的光敏剂,如磺化四苯基卟啉(TPPS2a或TPPS4a)、磺化铝酞菁(AlPcS)和5-(4-羧基苯基)-10,15,20-三苯基-2,3-二羟基氯金(TPC)会产生高活性的单线态氧(1O2),这种单线态氧通过与膜脂质反应会破坏内体膜,从而将siRNA释放到细胞质中(图2D)。请提供需要翻译的原文。例如,阳离子型细胞穿透肽(CPPs)Tat和七聚精氨酸(R7)已与光敏剂AlPcS和TPC共轭,以促进内体逃逸。尽管其机制尚不清楚,但据推测,阳离子型CPPs通过静电相互作用将共轭光敏剂靠近内体膜,在这一过程中发挥着重要作用。
一些传统的荧光染料也按照类似的机制进行了探索。例如,用激光在488纳米波长照射时,富含精氨酸的细胞穿透肽(CPPs)上的荧光素标记物可以从内体中释放出来。使用另一种有机荧光团AlexaFluor633也观察到了类似的内体释放现象。大槻等人探索了使用AlexaFluor546标记的TatU1A肽(TatU1A-Alexa)进行siRNA递送。在光照射后10秒,观察到了TatU1A-Alexa及其货物U1A-siRNA从内体中释放。一旦进入细胞质,U1A-siRNA就能在CHO细胞中诱导eGFP基因沉默,在A431细胞中诱导内源性表皮生长因子受体(EGFR)基因沉默。相反,在未被激光照射的区域未观察到沉默效应。
尽管光化学诱导的内体裂解反应速度快,但实验条件必须严格控制,因为光敏剂和荧光团的光刺激可能会因光照过量而导致细胞死亡。在激光激发R7-TPC和Tat-TMR后观察到了细胞凋亡和坏死损伤。在560纳米光照射TMR-TAT后不久,可见细胞质膜通透性增加、细胞起泡以及细胞萎缩。光化学诱导的内体裂解的另一个潜在限制是体内光传递的困难。与基于光学的成像技术类似,光的穿透深度仅限于几毫米,包括近红外(NIR)光。
参考文献:doi.org/10.1016/j.addr.2016.08.004




















 37
37

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








