一项由多个国际研究团队进行的基因组关联研究(GWAS)的荟萃分析确定了与癫痫相关的26个风险位点和亚型特异性遗传结构。
为了揭示与该疾病相关的变异,来自国际癫痫联盟协会(成立于1909年)的研究人员对复杂癫痫进行了荟萃分析,包括来自三级医疗中心招募的29944名患者和52538名对照者。
研究发现,常见和罕见的遗传变异都会导致轻度和常见的局灶性癫痫(FE)和全身性癫痫,尤其是对于主要由遗传性广泛性癫痫(GGE)构成的全身性癫痫。然而,先前的研究只揭示了其中一部分变异。
研究人员将他们之前已发表的分析与来自Epi25合作和另外四个队列的未发表数据相结合。该成果于2023年8月31日发表在《Nature Genetics》(IF2022=30.8)上,作者指出,新分析包含的样本量是之前的两倍。
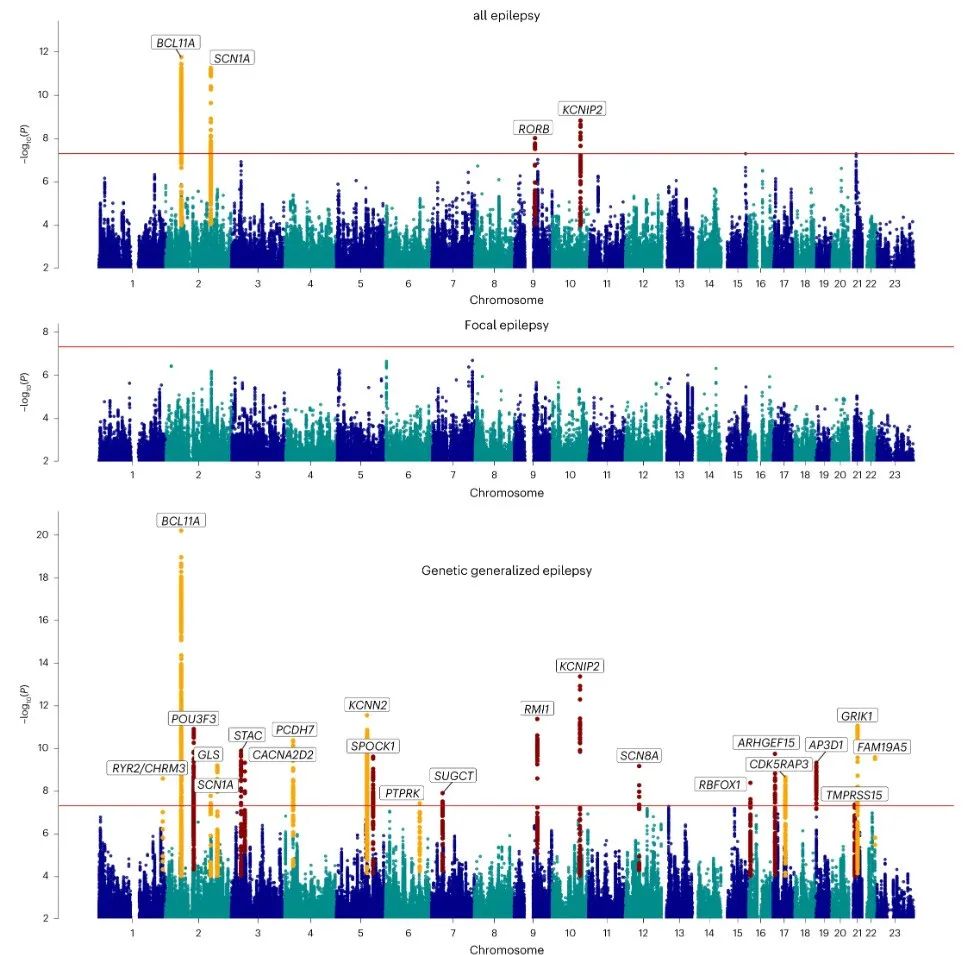
多种族全癫痫(n=29,944)、局限性癫痫(n=16,384)和遗传性全身性癫痫(n=7,407)基因组全球荟萃分析的曼哈顿图,通过有效样本大小加权的固定效应荟萃分析获得。
在post-GWAS的分析中,研究人员使用先前发表的工具(如FUMA和MAGMA)专注于与新发现的风险位点相关的29个基因。其中许多基因都与单基因癫痫相关,包括钙通道基因CACNA2D2,这个基因已经成为十种许可药物的靶标,其中包括两种抗癫痫药物(加巴喷丁(gabapentin )和普瑞巴林(pregabalin))、帕金森病药物沙芬酰胺(safinamide)和非甾体抗炎药塞来昔布(celecoxib)。
对GGE信号的进一步基因集分析涉及大脑和垂体中兴奋性和抑制性神经元的突触过程,表明激素成分对癫痫易感性。兴奋性和抑制性神经元的参与与其他神经系统疾病形成鲜明对比,这些神经系统疾病通常涉及多种细胞类型,如星形胶质细胞、少突胶质细胞或小胶质细胞。
研究人员还利用他们的分析来确定可重新用于癫痫的药物,该评估基于预测的每种药物调节癫痫相关蛋白质的功能和丰度变化的能力。研究结果突出表明,20种已许可用于其他疾病的药物,可能对全身性癫痫产生益处,这些药物需要在未来进行癫痫相关的临床试验。
与此同时,作者在最后的实验中利用了来自几个大规模人口生物库和Decode Genetics的数据,探索了癫痫位点在表型强度较低的队列中的一致性。尽管样本数量几乎翻了一番,但信号并没有显著增加。
值得注意的是,GGE主要受共享遗传变异的影响,而FE受共享遗传变异的影响较小,并且FE的基因组变异不具备显著性。作者认为,局限性癫痫比GGE更加多样化,可能具有更高程度的多基因性,受常见遗传风险变异的影响较小。
作者总结道:“我们的研究揭示了全身性癫痫的神秘生物学以及准确的综合表型的重要性,并可能有助于药物再利用的新治疗方法。”
同时,研究人员也指出了该研究的局限性,生物库中病例的表型主要基于国际疾病分类代码,这可能导致错误分类。

癫痫是一种高度遗传性的疾病,全球有超过5000万人受影响,其中约三分之一对当前治疗方法无效。在这里,我们报告了一项多血统全基因组关联研究,包括29944个病例(分成了三个广泛的癫痫类别和七种癫痫亚型)和52538个对照个体。我们鉴定了26个全基因组显著位点,其中19个是遗传性全身性癫痫(GGE)特异性的。我们确定了与这26个位点相关的29个潜在的致病基因。基于SNP的遗传分析表明,常见变异解释了GGE及其亚型的39.6%到90%的遗传风险。亚型分析结果显示,局灶性癫痫和全身性癫痫之间的遗传结构显著不同。GGE信号的基因集分析暗示了大脑中兴奋性和抑制性神经元的突触过程。优先考虑的候选基因与单基因癫痫基因以及当前抗癫痫药物的靶标存在重叠。最后,我们利用我们的结果来识别可能用于癫痫治疗的替代药物并预测其有效性。
参考文献:
https://www.nature.com/articles/s41588-023-01485-w
阅读原文内容:
https://www.genomeweb.com/genetic-research/gwas-meta-analysis-identifies-26-risk-loci-linked-epilepsy?_ga=2.173200739.1155118450.1693790280-1586280519.1690419342&adobe_mc=MCMID%3D56016949281590676623626787652603614038%7CMCORGID%3D138FFF2554E6E7220A4C98C6%2540AdobeOrg%7CTS%3D1693790284&CSAuthResp=1%3A%3A2712972%3A273%3A24%3Asuccess%3AD73BD9C329E60647B21405171FB69DB0
往期精品(点击图片直达文字对应教程)
























































 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










