小罗碎碎念
今日顶刊:JCO
这篇文章于24-09-11发表于J Clin Oncol,目前IF=42.1,但是注意,这篇文章是一篇观点类文章,而不是我们常规意义上的那种科研型文章。
我在原作者的基础上补充了很多精美插图,并且根据自己的理解和知识积累做了知识扩充。最重要的,再次结合了基金申请的内容去分析问题,直接从实际出发,哈哈。

| 角色 | 姓名 | 单位(英文) | 单位(中文) |
|---|---|---|---|
| 第一作者 | Vincent M. Wagner | The University of Iowa, Department of Obstetrics and Gynecology, Division of Gynecologic Oncology | 爱荷华大学妇产科学系妇科肿瘤科 |
作者:Vincent M. Wagner
回答问题
我首先回答一下文章标题提出的问题——病理AI是否为精准医学的未来?——答案是肯定的。
要想充分挖掘这个问题背后蕴藏的信息,我们首先需要了解一下病理AI具体的研究内容。
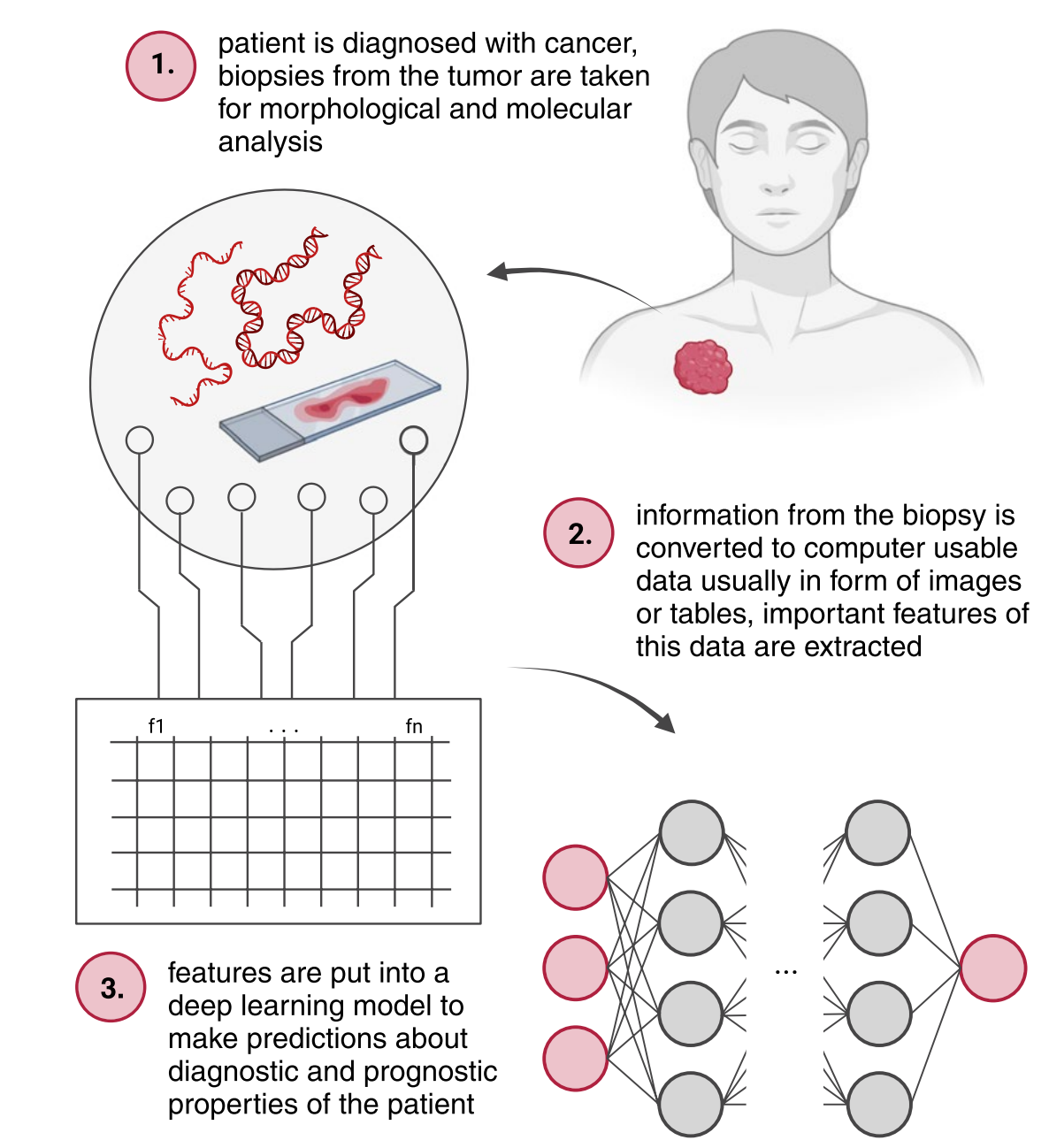
第一步,如果患者确诊癌症了,那么从肿瘤组织中取样,用于进行形态学(morphological)和分子学(molecular)的研究;第二步,是临床负责的制片(即我们说的HE切片),然后用数字扫面仪生成WSI,此时我们就可以从图像中提取重要特征了;第三步,是将我们提取的特征放入深度学习模型中,来进行诊断或者预后的预测。
目前发展趋势
我们判断目前发展趋势的最好的途径,就是看当前领域的发文数量以及基金委的资助趋势。
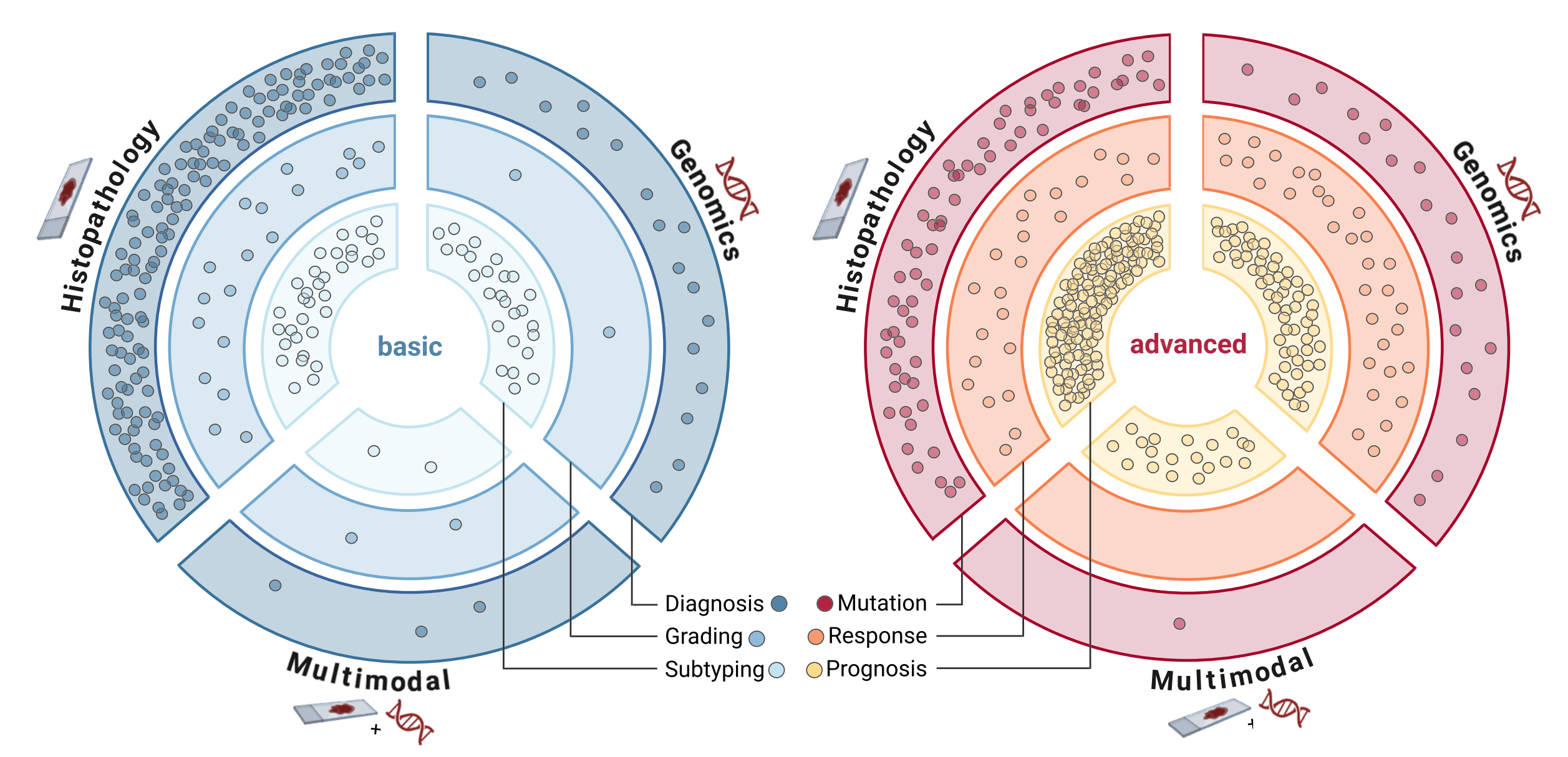
我们先看下面这张图,左边是基础的研究,对应的研究结果是——诊断、分级和亚型分类——这些都是早期的研究喜欢做;右侧这张图则是目前的热点下游任务——突变、响应和预后——其实从名字就可以看出来,多模态一定是未来的必经之路。
聊完了论文,再开看看基金委的资助动态(八字方针)——频繁布局,试点推行。关于基金的申请我写过三篇推文,分别是:
- 北京市自然基金分析:2024年度北京市自然科学基金发布,【医学AI项目】如何申请?
- 国自然基金分析:从国自然立项情况浅谈一下医学AI的未来发展趋势|个人观点·24-08-28
- 国自然重大专项分析:医学AI再度得到国自然重大专项青睐,10个立项机会,4000万经费虚位以待|个人观点·24-09-12

对医学AI感兴趣的,并且目前有申请基金需求的老师,可以看看上面的三篇推文能否给您提供一些帮助。
病理AI在精准医学中的应用现状
自21世纪初伊马替尼用于治疗慢性髓性白血病以来,精准肿瘤学的研究重点一直是通过生物标志物发现肿瘤中的分子靶标,并通过特定的治疗干预进行靶向治疗[1]。
近年来,人工智能(AI)在肿瘤学研究和开发中的指数级增长,预示着精准肿瘤学的下一个发展浪潮[2,3]。深度学习(DL),作为AI的一个子集,可以利用癌症行为、基因组学和组织病理学之间的关系,通过人工神经网络中的数学方程提取数据(如数字组织病理切片)中的抽象和复杂特征与模式[4]。
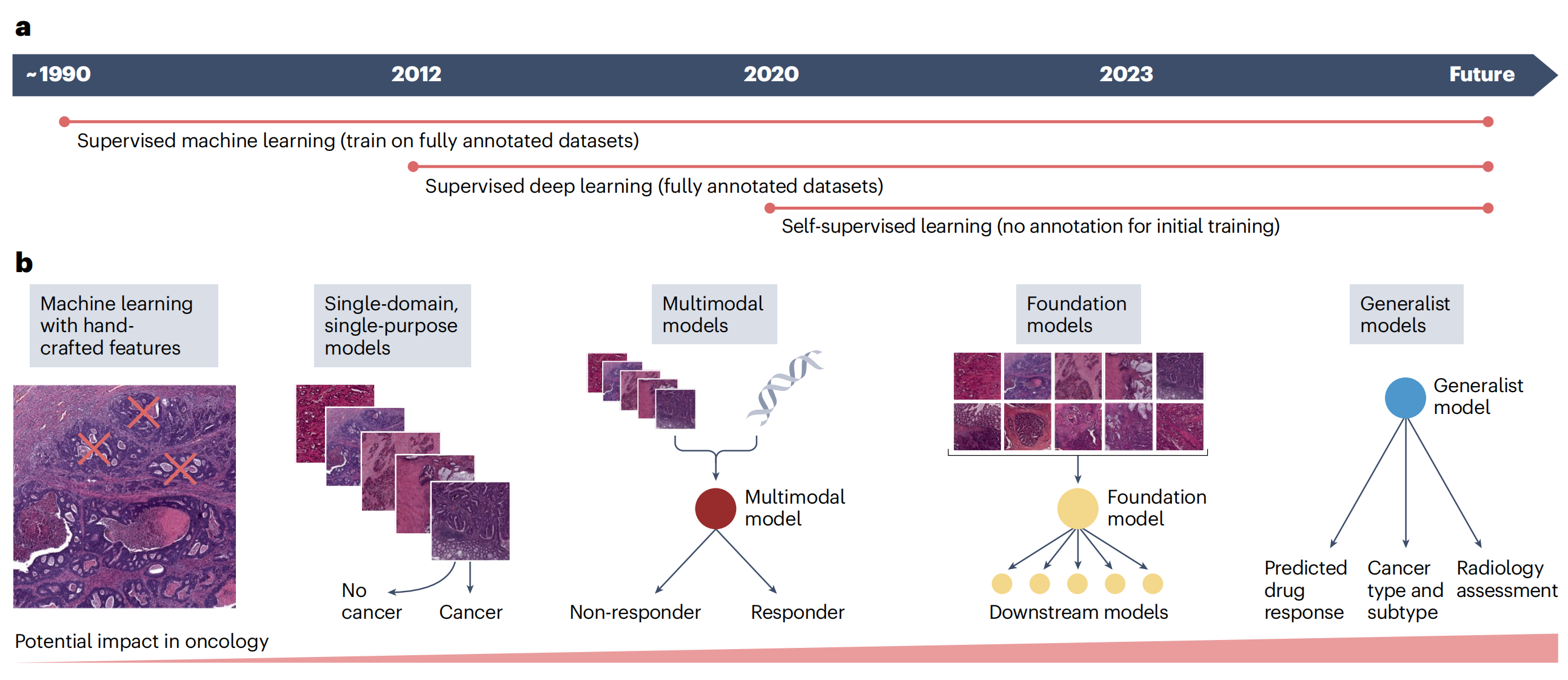
深度学习的多层神经网络能够从相对简单的输入中开发复杂的数据表示,结合大数据集和强大的计算能力,赋予了DL其强大的能力[4]。
乳腺癌是最早使用DL在组织病理学上评估的癌症类型之一,这归功于其已建立的生物标志物驱动治疗[5]。同源重组缺陷(HRD)是乳腺癌和卵巢癌最重要的预测生物标志物之一,HRD使得患者对聚腺苷酸二磷酸核糖聚合酶抑制剂和铂类化疗敏感[6]。HRD主要归因于同源重组通路的异常,尤其是BRCA1和BRCA2基因的突变[6]。目前,HRD通常通过依赖于复杂分子测试的专有伴随诊断试剂盒来确定[6]。
Bergstrom等人开发的DeepHRD算法代表了一种创新的方法,通过AI直接从数字组织病理切片中检测HRD,避免了广泛且昂贵的分子测试[7]。
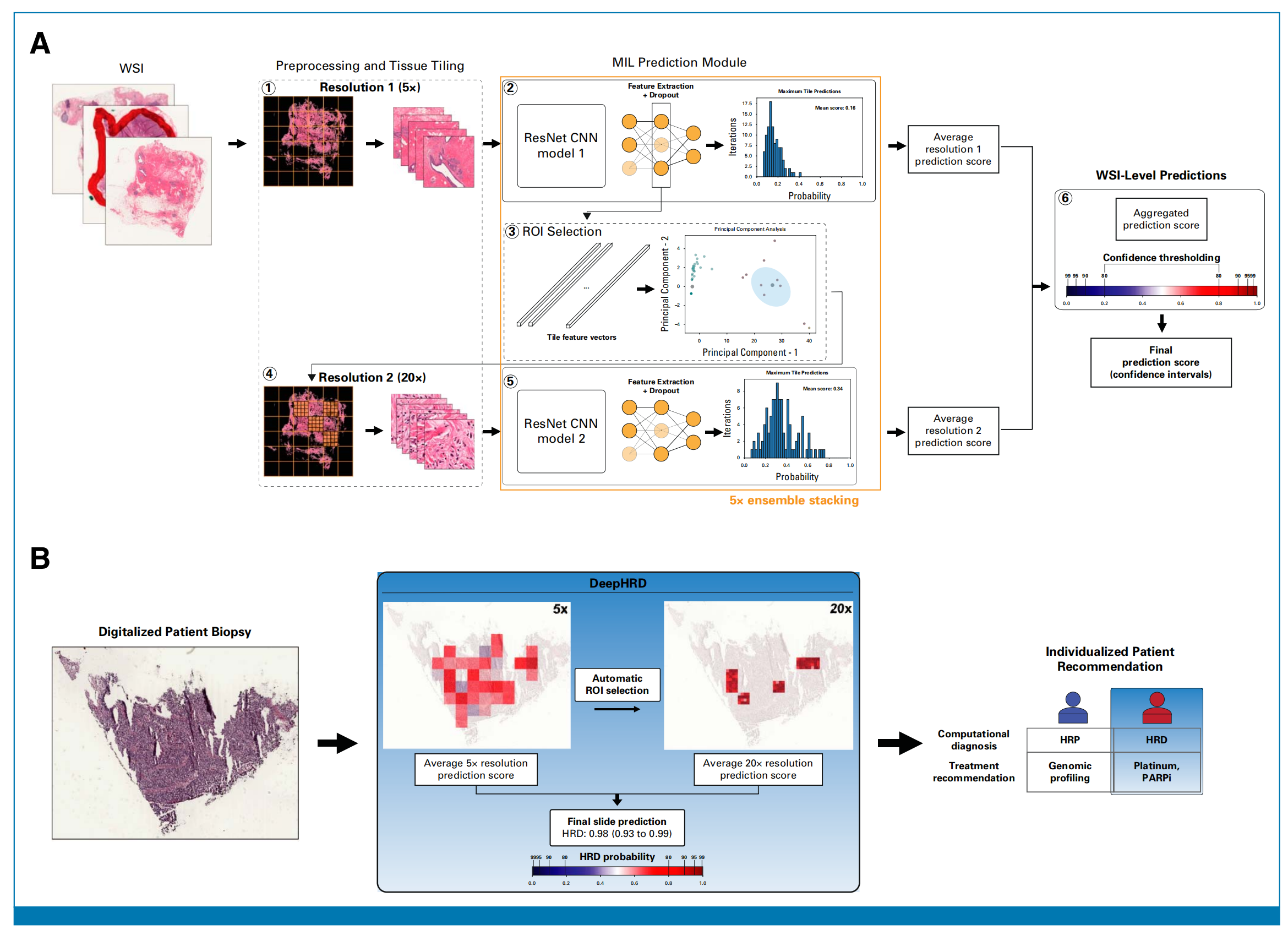
作者使用弱监督卷积神经网络(CNN)和多实例学习(MIL)构建了一个模型,使用苏木精-伊红染色的全切片图像(WSIs)预测HRD和预后[8,9]。CNN通过检测空间特征和模式设计用于视觉/图像应用[8]。
模型将WSIs分割成更小的瓦片进行处理,MIL是一种弱监督DL方法,其中瓦片标签基于WSI标签假设,无需在瓦片级别进行更精确的注释[9]。
作者设计了一个多分辨率工作流程,首先在低倍(5x)放大下评估WSI,然后自动选择一个感兴趣区域在高倍(20x)放大下评估,这模仿了训练有素的病理学家对组织学切片的评估过程。模型使用闪冻(FF)样本和福尔马林固定的石蜡包埋(FFPE)切片进行训练。
尽管之前已有研究使用DL检测HRD[10],但DeepHRD通过建立跨多个独立队列验证的更具泛化性的模型而脱颖而出。
DeepHRD通过评估临床结果进一步展示了其临床实用性。作者使用独立测试组(验证队列中的患者未在训练队列中使用)、平衡训练数据和神经网络内节点的随机丢弃等技术来最小化过拟合。通过比较接收者操作特征曲线下的面积(AUC)适当地评估了模型性能。
DeepHRD能够在FF和FFPE独立队列中实现对HRD的中等准确预测(AUC为0.76-0.81)。他们进一步分析了模型预测预后的能力,发现与传统分子测试相比,DeepHR达能够更精确地预测无进展生存期和治疗反应。重要的是,DeepHRD能够识别出一小部分表现出HRD表型但未被传统分子测试识别的患者。
为了解释DeepHRD算法的内部机制,作者识别并注释了预测HRD的WSI的空间区域,发现这些区域富含坏死、巨噬细胞密度和高密度炎症组织。
综上所述,DeepHRD作为一种创新的DL算法,在精准肿瘤学领域展示了其巨大的潜力,特别是在HRD的检测和预后预测方面。尽管目前仍面临数据集大小、多样性和监管批准等挑战,但其在多个独立队列中的验证结果证明了其临床实用性和泛化能力。
为了成功地将AI整合到临床肿瘤学中,必须解决和克服许多挑战[11]。
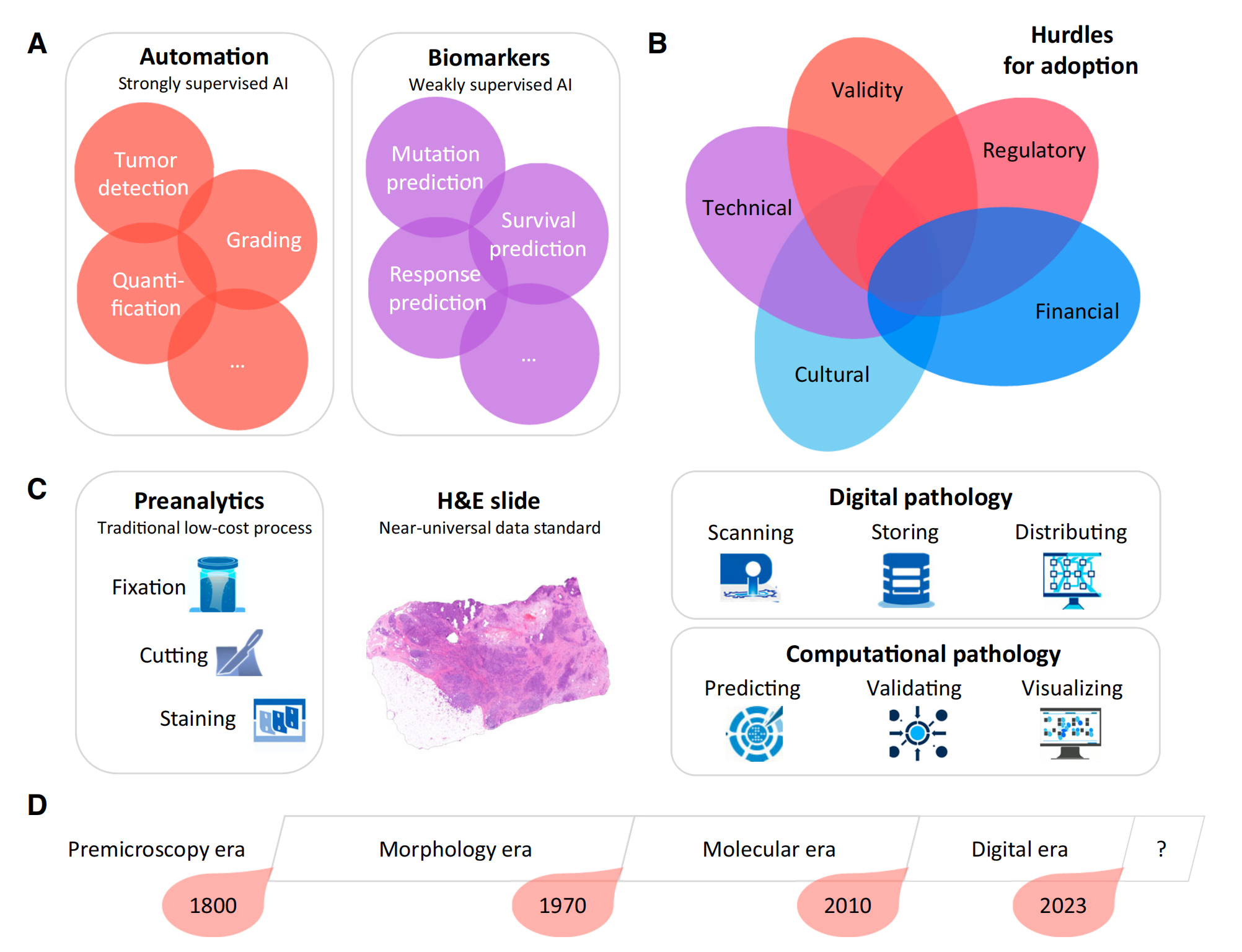
A) 人工智能(AI)在病理学中的关键用例
- 强监督AI:主要用于诊断目的,或者为预后或治疗反应的下游模型生成输入数据。
- 弱监督AI:可以直接产生诊断、预后或预测模型。
B) 组织病理学中AI的挑战
- 如数据的质量和数量、算法的解释性、以及临床实践中的集成问题。
C) AI时代的组织病理学工作流程
- 病理切片的数字化、图像分析、诊断辅助、以及报告生成等步骤。
D) 组织病理学发展简明时间线
- 这部分概述了组织病理学领域的重要发展里程碑,从传统的显微镜观察到现代的AI辅助诊断技术的演变。
为了确保DL模型的泛化性和可重复性,初始训练需要足够数量的高质量、平衡数据。
韩国最近发表的一项研究使用了与Bergstrom等人类似的技术,采用基于多实例学习(MIL)的DL算法和来自癌症基因组图谱(TCGA)的卵巢癌队列,他们能够训练和验证一个模型来预测卵巢癌进展,但与DeepHRD不同,他们的模型与BRCA突变或HRD状态无关[12]。
为了开发不仅准确而且广泛可泛化和可重复的模型,研究人员需要超越单一机构数据和TCGA(已广泛用于模型训练)[2,3]。
大多数已发表的DL研究要么从头开始开发模型,要么从预训练的非医学图像(例如,RESNET 18)开始,然后在数百或数千患者队列上进行微调[2,3]。
相比之下,最先进的DL模型通常使用数百万图像进行训练。
由于患者隐私和数据共享的问题,获得高质量医学数据的大型队列可能很困难[13,14]。
新颖的去中心化AI训练技术,如联邦学习和群体学习,可以帮助克服这些挑战[13,14]。最近开发了在数十万个注释的高质量全切片图像上预训练的组织病理学基础模型,也可以解决这些问题[15,16]。
使用基础模型可以更快地开发准确的癌症或特定任务模型,需要更少的数据和计算资源。
在训练新模型后,需要在未用于训练过程的独立数据上进行验证。
这种验证最好包括跨越现实世界变化的多个大队列[4]。DeepHRD的作者正确指出,他们研究的一个优势是包括了多个独立队列进行验证。然而,这些队列中的每一个都是对相对较少患者的回顾性评估。
再次,获得足够大且多样的验证队列是具有挑战性的。国家和国际合作的临床试验数据可以成为验证队列的丰富来源,并已在前列腺癌中成功实施[17]。
AI算法的最终验证步骤是专门设计的临床试验,以评估模型的准确性和实用性[18]。与传统分子生物标志物类似,这是临床采用前的关键步骤。
新颖AI算法的监管批准可能复杂且具有挑战性。
这是一个快速发展的过程,通常需要行业合作或私人公司的开发才能成功实施[11]。任何新技术都需要临床医生和实践者的接受和采用。
AI代表了癌症护理的范式转变方法,将这些模型纳入常规使用需要时间。成功地将AI整合到临床实践中需要研究人员、临床医生、数据科学家和监管机构之间的跨学科合作。
总之,AI和DL在肿瘤学研究和实践中具有巨大的革命性潜力。像DeepHRD这样的工具的开发展示了这种方法的潜在益处,通过提供精准肿瘤学的下一波浪潮。























 2万+
2万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








