欢迎点击阅读、转发,让更多人看到。
专家视点对于早期诊断来说,对于能够在超低浓度甚至单分子水平上快速检测生物标志物的传感器有着强烈的需求。与其他类型的传感器相比,光学微光纤更便于在早期诊断中用作护理点设备。然而,相对较低的灵敏度严重阻碍了它们的使用。在此,Li等人发展了一种金纳米杂化物(由金三角纳米棱镜和通过静电吸引集成的金纳米粒子组成的混合物)来调节等离子体共振到通信窗口,从而增强了微光纤传感器的倏逝场。实验中,利用了黑磷作为间隔层来支持金纳米杂化物,激发光热效应,优化局部表面等离子体共振增强。随着黑磷负载金纳米杂化物纳米界面的增强,该微光纤在单分子水平上和10-100 nm的浓度范围内检测表皮生长因子受体(一种乳腺癌生物标志物),检测限为6.72 zm。此外,该纳米界面敏化超细光纤能够将癌细胞与正常细胞区分开来并通过细胞光热疗法治疗癌细胞。这项工作为细胞诊断和治疗的整合开辟了一条可能的途径。该成果发表在Science Advances上。


Hongtao Li, Yunyun Huang, Guanhua Hou, Aoxiang Xiao, Pengwei Chen, He Liang, Yugang Huang, Xiaotian Zhao, Lili Liang, Xinhuan Feng, Bai-Ou Guan, Single-molecule detection of biomarker and localized cellular photothermal therapy using an optical microfiber with nanointerface, Science Advances, 5, eaax4659 (2019).
单分子检测已被广泛地探索,因为它增加了对许多基本生物学过程的理解。蛋白质癌症生物标志物存在于血清、组织和体液中,对癌症的预后、诊断和治疗具有重要作用。与早期诊断一样,生物标志物的浓度是超低的,对能够以超高灵敏度甚至单分子水平快速检测生物标志物的传感器有着强烈的需求。在现有的传感方法中,基于折射率的光学传感器具有无标签特性的显著优势。与纳米传感器相比,光学微光纤具有成本低、灵活性好、毫米级长度等优点,更适合作为早期诊断中的护理点器件。然而,皮质醇浓度下相对较低的灵敏度极大地阻碍了其应用。此外,对于长度为毫米、直径为微米的超细光纤,单分子检测似乎很难实现。近年来,研究人员致力于探索提高光纤灵敏度的传感机制。由于基于折射率的微光纤传感器通过光纤的倏逝场检测到分子结合作用引起的近光纤表面的折射率变化,增强倏逝场是提高灵敏度的有效策略,比如,毛细管基光流体光学微光纤和银纳米粒子电磁增强光学微光纤,其检测极限达到6.82×10−17 M。金属纳米结构中的局域表面等离子体共振已被证明能有效地增强倏逝场。然而,共振通常发生在可见光波段,而微光纤传感器的工作波长在通信窗口,因为用于构建传感系统的大多数元件来自光纤通信行业。
01
纳米界面微光纤传感器的设计以单模光纤为原料,通过加热和拉伸工艺制备了直径为7.1 μm、腰长为1.2 mm的石英微光纤锥。微光纤锥度作为一种多模干涉仪,在透射光谱中产生干涉条纹。条纹图来自于基模和高阶模之间的干涉。基模局限于微光纤内部,而高阶模的场分布在微光纤外并与周围介质发生强烈的相互作用。因此,两种模式之间的光程差被周围介质的折射率调制,干涉条纹也随着周围折射率的增大而红移。
图1给出了具有黑磷支持的金纳米混合界面的微光纤传感器的设计。食人鱼水溶液和3-氨基丙基三乙氧基硅烷溶液的连续改性赋予了超细光纤表面正电荷。采用静电吸附的方法,在纳米光纤表面涂覆一层聚甲基丙烯酸甲酯双层膜以保护其不被钝化。图1(B至E)中带有黑磷间隔层(由聚甲基丙烯酸甲酯双层组成)的微光纤表面的X射线光电子能谱、拉曼光谱和原子力显微镜图像表明黑磷间隔基在微光纤上的固化成功。接下来,在1480 nm波长处共振的金纳米杂化物(图1F)被组装在黑磷间隔基上,以形成黑磷支持的金纳米杂化物的等离子纳米界面(图1G和H)。由于金纳米杂化物的散射和吸收作用,当用黑磷支撑的金纳米杂化界面对微光纤进行功能化处理时,会产生约2 dB的额外传输损耗。然后,将单克隆ErbB2抗体固定在纳米界面上,以高亲和力和选择性捕获ErbB2分子。因此,微光纤传感器已准备好用于ErbB2分子检测。如图1I所示,单分子结合可以通过透射光谱的逐步移动来表示。此外,该传感器还可以将乳腺癌细胞(如MCF-7细胞)与正常细胞区分开来并通过与细胞表面ErbB2的相互作用将其捕获。MCF-7细胞在微光纤表面的捕获增加了表面折射率并在透射光谱中表现为红移,如图1J所示。此外,纳米界面的光热效应可在来自微光纤的近红外辐射下杀死微光纤表面的MCF-7细胞。图1K说明了传感的光学设置。总液体体积约为4毫升。
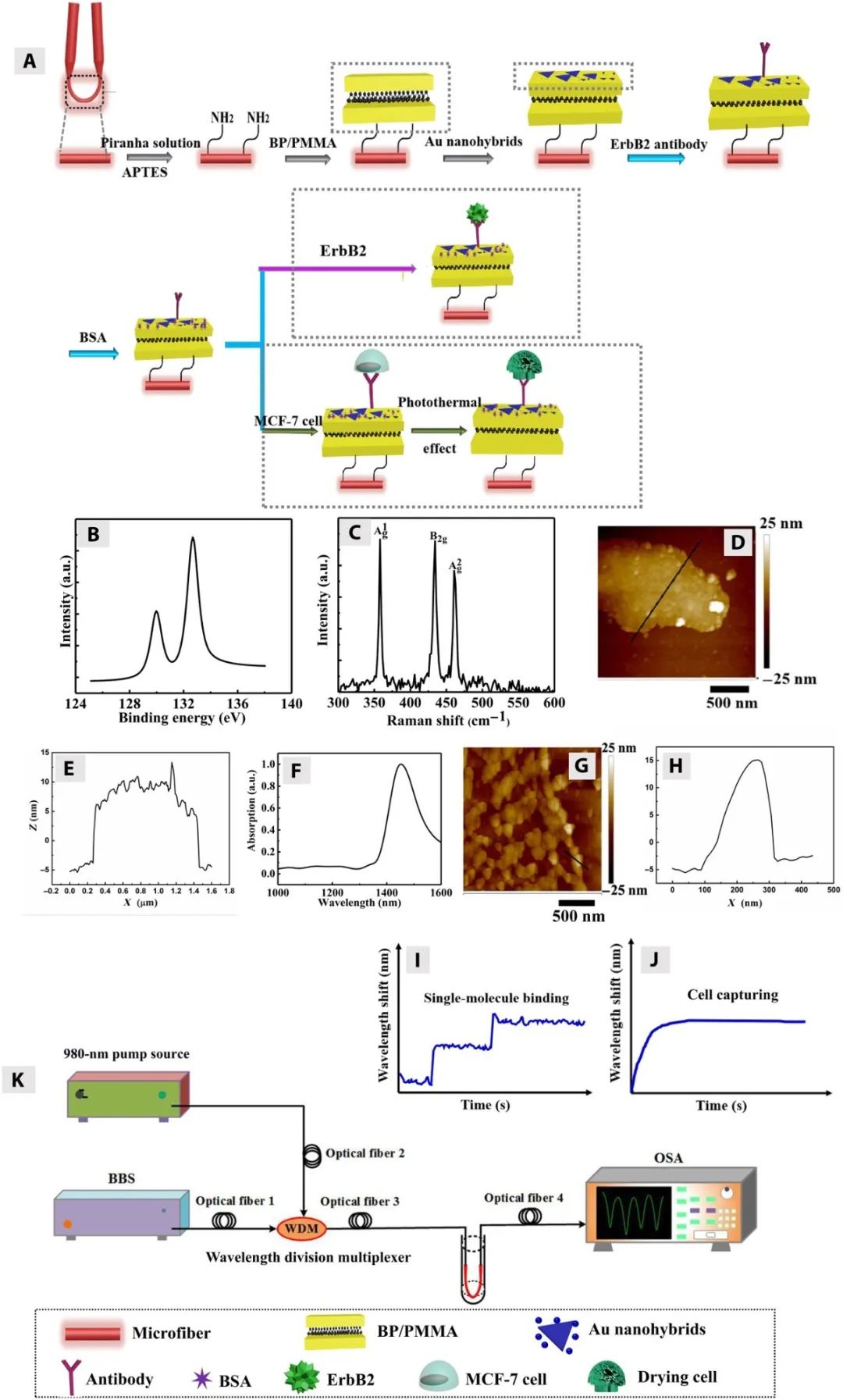
图1 微光纤传感器的制备。(A)微光纤生物传感器的功能化方案。(B)黑磷间隔层的X射线光电子能谱。(C) 带有黑磷间隔层的微光纤的拉曼光谱。(D和E)带有黑磷间隔层的超细光纤表面的原子力显微镜图像[由聚甲基丙烯酸甲酯双层组成]。(F) 金纳米杂化物的消光光谱。(G和H)用原子力显微镜研究了具有黑磷支撑的金纳米杂化界面的微光纤表面。(I)单分子ErbB2结合引起的透射光谱阶跃位移示意图。(J)MCF-7细胞结合引起的透射光谱波长偏移示意图。(K) 光学装置方案。
图2展示了一个制备好的微光纤传感器和两个控制传感器的ErbB2传感能力。控制传感器I是一种微光纤,带有ErbB2抗体,固定在纳米界面上,仅由金纳米杂化物组成,不含黑磷纳米片。控制传感器II是一种将ErbB2抗体直接固定在二氧化硅表面的微光纤。制备的传感器、控制传感器I和控制传感器II是从相同的超细光纤中获得的。区别在于它们有不同的接口修改。传感前,传感器在磷酸盐缓冲盐水溶液中浸泡3小时,以稳定和避免磷酸盐缓冲盐水溶液中离子的非特异性粘附干扰传感过程。之后,评估微光纤在磷酸盐缓冲盐水溶液中的稳定性。当ErbB2浓度从10 zM增加到100 nM时,使用制备的传感器观察到透射倾角波长的规则红移,如图2A所示。该传感器的线性浓度范围从10 zM到100 nM,灵敏度为1.45 nm/logM(图2d)。磷酸盐缓冲盐水溶液中ErbB2浓度传感器的检测极限(信噪比,≥3)约为6.72 zM,比先前报道的先进技术低三个多数量级。
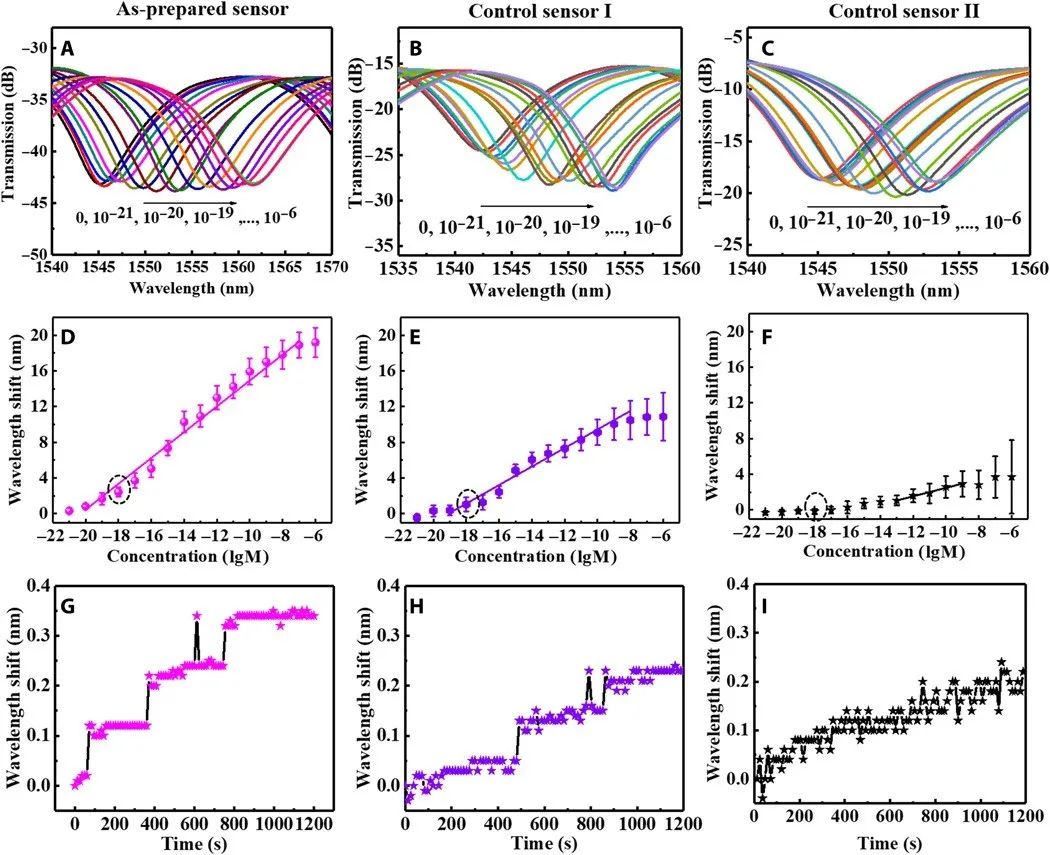
图2 ErbB2传感。(A到C)在不同浓度的ErbB2下测量了制备的传感器和控制微光纤的透射光谱。(D到F)传感器和控制微光纤的波长偏移与ErbB2浓度的关系。(G到I)三个传感器在1 aM浓度下对ErbB2的光学响应。(A、D和G为制备好的传感器;B、E和H为在仅由金纳米杂化物构成的纳米界面上具有抗体的超细光纤;C、F和I,具有抗体但没有任何界面的微光纤。)
对于控制传感器,带有ErbB2抗体的微光纤固定在纳米界面上,仅由不含黑磷纳米片的金纳米杂化物组成,线性浓度范围为100 zM至10 nM,灵敏度为1.04 nM/logM,检测极限为104 zM(图2B和E)而直接固定在二氧化硅表面的ErbB2抗体微光纤传感器的浓度范围为10 pm~1 nm,灵敏度为0.47 nm/logM,检测极限为196 fM(图2C和F)。此外,在图2(G到I)中给出了在1 aM的ErbB2浓度下随时间的波长偏移。ErbB2单分子与抗体之间的结合事件被制备的微光纤传感器识别为0.1 nm的阶跃位移(图2G)。此外,该事件可被仅由金纳米杂化物组成的纳米界面的控制微光纤识别为0.08 nm的阶跃位移(图2H)而没有任何界面的控制微光纤无法识别该事件(图2I)。因此,黑磷支持的金纳米杂化界面和不含黑磷纳米片的金纳米杂化界面提高了传感器的灵敏度。此外,黑磷支持的金纳米杂化界面实现了最有效的灵敏度提高。
为了证实阶跃位移是由ErbB2分子的结合事件引起的,将两种尺寸和稳定性相似的已制备超细光纤(两种超细光纤均用黑磷支撑的金纳米杂化界面和ErbB2抗体功能化)固定在40 ml磷酸盐缓冲盐水溶液中。每根超细光纤都由一个宽带光源照射,宽带光源由四个发光二极管通过波分复用构建,从而提供1250至1650 nm的大发射带宽,其透射光谱由光学光谱分析仪监测,如图3A所示。这里,两个制备的微光纤分别表示为传感微光纤和控制微光纤。对于传感微光纤,当浸入磷酸盐缓冲盐水溶液中时,只记录到背景噪声,如图3B所示。接下来,在制备好的超细光纤一侧向溶液中添加4 ml 磷酸盐缓冲盐水溶液。同样,在接下来的2小时内只记录到背景噪声,如图3C所示。然后,在不搅拌的情况下,将4 ml的10 aM ErbB2溶液注入传感微光纤的侧面。在46分钟和86分钟,传感微光纤分别记录了0.1 nM的阶跃位移。对于对照超细光纤,当浸泡在磷酸盐缓冲盐水溶液中并向溶液中加入4 mL磷酸盐缓冲盐水溶液时,只记录到背景噪声(图3E和F)。当在传感微光纤一侧注入4 ml的10 aM ErbB2溶液时,控制微光纤仍然记录到背景噪声(图3G),因为注入的ErbB2溶液在2小时内无法在静止条件下扩散到其上。此外,在不搅拌的情况下将4 ml 10 aM ErbB2溶液注入对照微光纤一侧,之后,对照微光纤记录到~0.1 nm的明显阶跃位移。这与图3(E到G)中捕捉到的噪声完全不同。因此,证实了ErbB2分子与微光纤表面的结合引起了透射光谱~0.1 nm的阶跃位移。因此,制备的传感器在单分子水平上实现了生物标记物的检测。
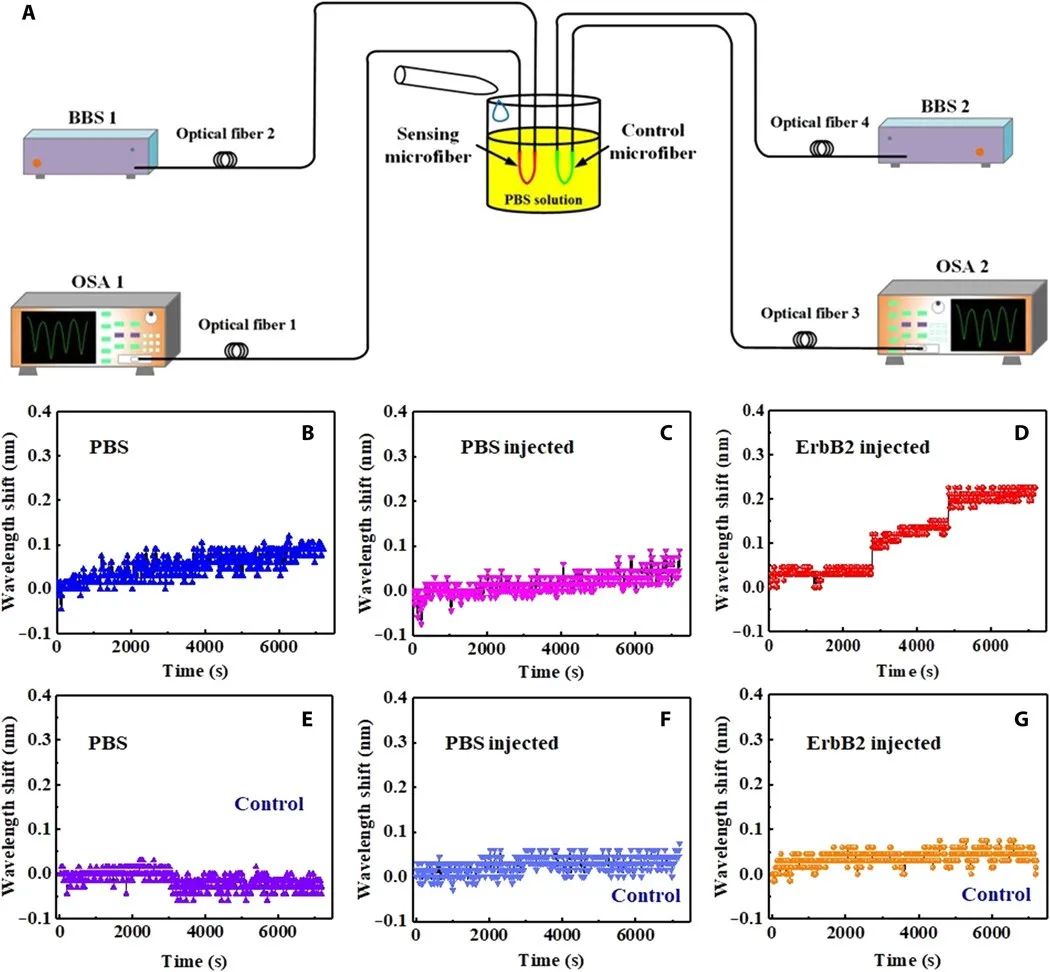
图3 两种微光纤的实验。(A) 结合事件确认实验的光学装置。(B到G)注入不同溶液后两个微光纤记录的波长偏移。(B到D,即制备好的微光纤;E到G,控制微光纤。)
02
传感器的特异性特异性是肿瘤生物标志物传感器的一个重要考虑因素。为了评价功能化光学微光纤传感器的特异性,在磷酸盐缓冲盐水溶液中用相同浓度的其他蛋白质生物标志物牛血清白蛋白和免疫球蛋白G代替ErbB2,在其他步骤和条件不变的情况下,进行相同的检测程序。图4(A和B)显示了牛血清白蛋白和免疫球蛋白G溶液中的光学响应。这些控制蛋白没有引起可检测到的稳定反应:在波长上有一些约0.1 nm的阶跃位移,但很快就会下降。这表明干扰分子到达了传感器表面,但由于缺乏结合作用而很快下降。这与ErbB2分子结合引起的稳定阶跃位移不同。这些结果表明,所制备的传感器可以将ErbB2分子与其他大小相近的蛋白质分子区分开来,这种选择性为原位细胞监测铺平了道路。
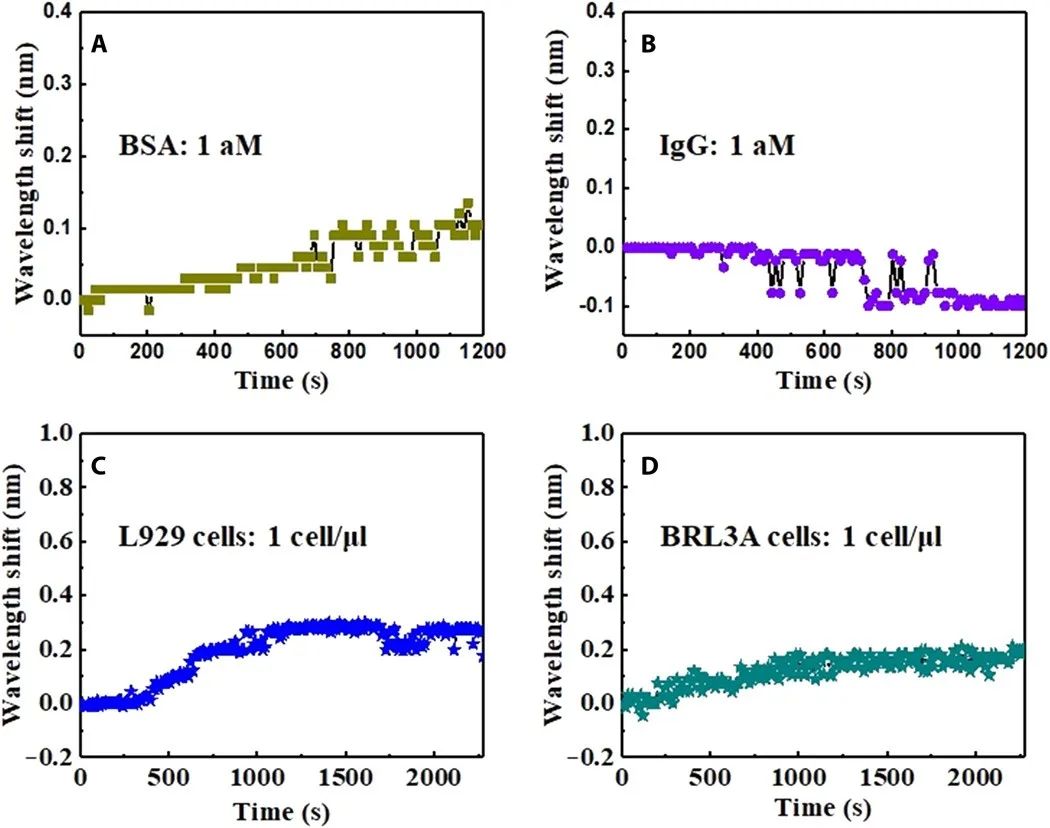
图4 制备的特异性传感器。光学制备的传感器对干扰蛋白质和细胞的反应。(A) 牛血清白蛋白溶液浓度为1 aM。(B)免疫球蛋白G溶液,浓度为1 aM。(C) L929细胞,浓度为1 cell/μl。(D)BRL3A细胞,浓度为1 cell/μl。
接下来,为了将乳腺癌细胞与正常细胞区分开来,对正常细胞的光反应进行了估计,如图4C和D所示。L929细胞(小鼠成光纤细胞)和BRL3A细胞(正常大鼠肝细胞)是用于对照实验的标准正常细胞系。这种微光纤通过结合细胞表面的生物标志物来捕捉细胞。基于这一机制,正常细胞的光反应相对较低,可以忽略,因为正常细胞中ErbB2的表达水平远低于癌细胞。
03
细胞捕获和细胞光热疗法实验中,评估了所制备的传感器在超低浓度下捕获和检测乳腺癌细胞的能力,如图5A所示。以MCF-7细胞(浓度为1 cell/μl)作为乳腺癌细胞系。与正常细胞的类噪声反应(图4C和D)不同,对癌细胞的反应出现显著的红移并且在30分钟内趋于稳定,这表明在这种超低浓度下,癌细胞是通过细胞表面的ErbB2生物标记物与微光纤表面的抗体结合而捕获的。图5B和C中的光学显微镜图像显示了MCF-7细胞捕获前后的微光纤表面。然后,将波长为980 nm的泵浦激光器耦合到微光纤中,以激发纳米界面的光热效应。黑磷支撑的金纳米界面通过倏逝场吸收980 nm的泵浦光,产生热量并对癌细胞进行热处理。图5D到F显示了泵浦光开启后不同时间微光纤表面癌细胞的形态。泵浦光刺激5400 s后,癌细胞被破坏,如图5F所示。微光纤锥度对温度也很敏感,因此,纳米界面的光热效应引起了透射倾角波长的偏移,从中可以估计光热效应引起的温度变化大小。从倾斜波长偏移可以看出,在泵浦光的刺激下,温度逐渐升高。泵浦光开启1200 s后,倾斜波长偏移-1.65 nm,趋于稳定。黑磷支持的金纳米界面-功能化超细光纤锥的温度敏感性为-0.09 nm/°C,由此可以估计温度已升高了18 °C。被困在微光纤表面的癌细胞吸收了纳米界面产生的热量,当热量积累到一定程度时,细胞被破坏。因此,所制备的超细光纤能够在超低密度下将癌细胞与正常细胞区分开来并通过纳米界面的光热效应捕获并杀死癌细胞。癌细胞检出限应低于1 cell/μl。随着靶细胞浓度的增加,传感器捕获和杀死的癌细胞数量将增加。因此,这种超细光纤在细胞靶向光热治疗中具有潜在的应用前景。
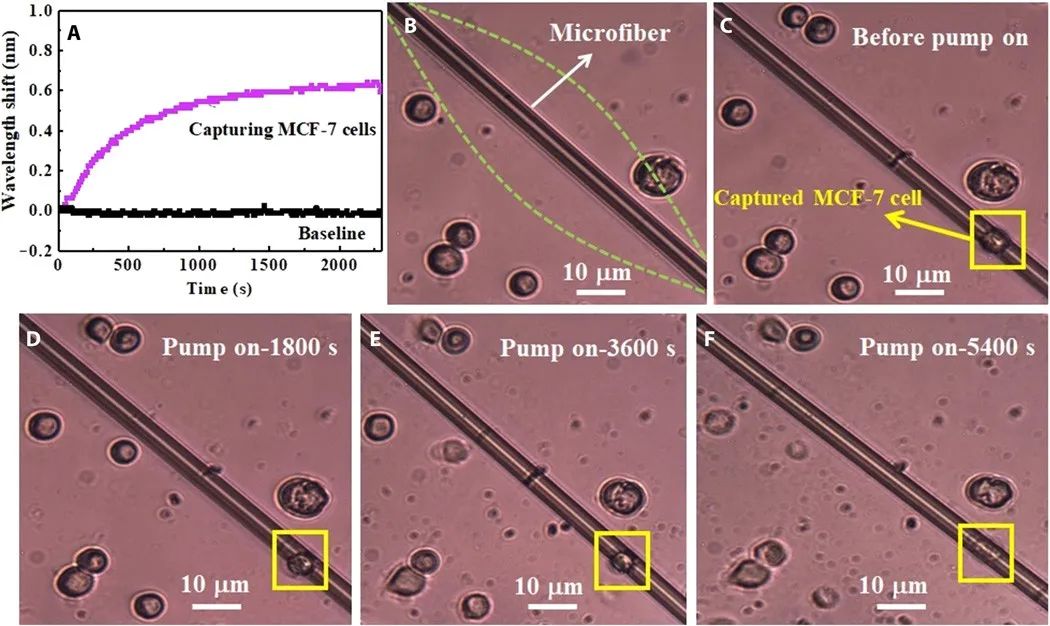
图5 细胞捕捉和细胞光热疗法。(A)在1 cell/μl密度下微光纤对MCF-7细胞的响应波长偏移(泵关闭;基线,无MCF-7细胞的细胞培养液)。(B到F)显微光纤表面的光学显微镜图像,捕捉到MCF-7细胞并通过光热效应杀死它。
04
展望
ErbB2生物标志物的单分子检测、癌细胞捕获和细胞光热治疗都发生在光学微光纤的倏逝场中。HE12模式呈现出一个大的分数功率引导到微光纤的外部。利用等离子体纳米界面增强局域倏逝场。金纳米杂化物和黑磷间隔基的表面形貌通过原子力显微镜和高分辨率透射电子显微镜进行表征(图1D、E、G和H)。带有黑磷间隔层的超细光纤表面的原子力显微镜图像(图1D和E)表明黑磷纳米片的厚度约为5 nm。直径为150 nm、厚度为20 nm的单层金纳米杂化物均匀地组装在黑磷间隔层上。根据纳米界面的形貌,采用时域有限差分法对1550 nm波长处的超细光纤表面进行了近场强度映射。由于黑磷间隔基的调谐效应,由黑磷间隔基支撑的金纳米杂化物的局部电场增加了36倍(A位点)。因此,黑磷负载的金纳米杂化物的能量增强可以达到1296倍。作为一种波长编码的传感器,微光纤监测由生物标志物结合引起的光谱位移。此外,表面的单分子结合事件可以被视为点状畸变。
传感器的波长偏移与结合位置处的倏逝场强度成比例。当ErbB2分子结合发生在纳米界面时,诱导的波长偏移(~0.1 nm)比没有纳米界面的情况下大1296倍。因此,具有纳米界面的微光纤在单分子水平上实现了ErbB2检测,而没有界面的微光纤则无法实现。此外,具有黑磷支撑的金纳米杂化界面的微光纤通过倏逝场进行光热治疗。它只允许在微光纤表面捕获的细胞上进行治疗,但不会伤害那些没有捕捉到的细胞。由于制备好的超细光纤只捕获靶癌细胞,而不影响正常细胞,因此,它具有靶向光热治疗的潜力。
总之,利用等离子纳米界面功能化光学微光纤在单分子水平上检测蛋白质癌症生物标志物和细胞光热治疗,这种微光纤可以在13个数量级的浓度范围内(10 zM到100 nm)感知生物标志物。该传感器对ErbB2浓度的检测限达到6.72 zM,比之前报道的先进技术低三个多数量级。在此基础上,微光纤被成功地用于区分癌细胞和正常细胞并通过细胞光热疗法治疗癌细胞。毫米尺寸的超细光纤代表了一种潜在的设备,适用于早期护理点诊断并增加了便利性。此外,这项工作为细胞诊断和治疗的整合提供了可能的途径。
END
 黄赟赟
,暨南大学
光子技术研究院副研究员。研究方向是光纤传感、生物光子学、光纤敏感材料。
E-mail: yingyueabc@126.com
黄赟赟
,暨南大学
光子技术研究院副研究员。研究方向是光纤传感、生物光子学、光纤敏感材料。
E-mail: yingyueabc@126.com
 关柏鸥
,暨南大学
光子技术研究院教授。研究方向是光纤器件、光纤传感技术、生物光子学、微波光子学。
E-mail: tguanbo@jnu.edu.cn
关柏鸥
,暨南大学
光子技术研究院教授。研究方向是光纤器件、光纤传感技术、生物光子学、微波光子学。
E-mail: tguanbo@jnu.edu.cn





扫码关注我们
 戳
戳




















 1792
1792











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








