摘要:人工智能 (AI) 正在迅速改变医疗保健,其在癫痫领域的应用在过去十年中呈指数级增长。将 AI 整合到癫痫管理中有望彻底改变该复杂疾病的诊断和治疗。然而,将 AI 转换为神经学临床实践尚未取得成功,这强调了需要考虑迄今为止的进展并评估 AI 的挑战和局限性。在这篇综述中,我们概述了使用各种数据模式开发的癫痫 AI 应用:神经影像、脑电图、电子健康记录、医疗设备和多模态数据整合。对于每种模式,我们都考虑了潜在的用途,包括癫痫发作检测和预测、癫痫发作定位、癫痫起始区定位以及对手术或神经刺激干预的评估,并回顾了迄今为止开发的 AI 工具的性能。我们还讨论了必须解决的方法论考虑因素和挑战,以成功地将 AI 整合到临床实践中。我们的目标是概述该领域的当前状态,并为未来利用 AI 改善癫痫管理提供指导。
1. 引言
人工智能 (AI) 正在迅速改变医疗保健领域,其在癫痫领域的应用在过去十年中呈指数级增长。将AI 集成到癫痫管理中有望彻底改变这种复杂疾病的诊断和治疗。然而,将 AI 转化为神经学临床实践尚未取得成功,这强调了需要考虑迄今为止取得的进展并评估 AI 的挑战和局限性。在这篇综述中,我们概述了使用各种数据模式开发的癫痫 AI 应用:神经影像、脑电图、电子健康记录、医疗设备和多模态数据集成。对于每种模式,我们考虑了潜在的用途,包括癫痫发作的检测和预测、癫痫发作的定位、癫痫发作起始区 (SOZ) 的定位以及对手术或神经刺激干预的评估,并回顾了迄今为止开发的 AI 工具的性能。我们还讨论了必须解决的方法论考虑因素和挑战,以成功地将 AI 集成到临床实践中。我们的目标是概述该领域的当前状态,并为未来利用 AI 改善癫痫管理提供指导。
患有癫痫的人通过医疗保健系统的过程会产生大量关于其疾病的信息。在第一次就诊时,患者的病史会进入电子病历中,他们可能会进行头皮脑电图 (EEG) 和脑部 MRI,以评估电生理和结构脑异常。在评估初步结果后,该个体很可能会接受抗癫痫药物试验。对于三分之二患有癫痫的人来说,他们的状况会对抗癫痫药物产生反应,但三分之一的人会继续出现无法控制的发作1。对于这些个体,手术或神经调节方法是实现癫痫发作自由的主要途径,这些方法需要大量评估才能确定癫痫发作起源的脑区,即癫痫发作起始区 (SOZ)。这个过程包括在癫痫监测单元进行的 I 期评估,在该评估期间,在控制环境中撤药,并使用头皮 EEG 和视频监测来检测和定位癫痫发作。在这个阶段,还可能进行高级神经影像学检查,如正电子发射断层扫描 (PET) 和基于任务的功能性磁共振成像 (fMRI)。获得关于癫痫发作侧化和大致定位的信息后,这些信息可以用于 II 期评估,即颅内脑电图 (iEEG),在该评估中,在可疑的 SOZ 中植入电极,并重复 I 期中使用的方法。iEEG 数据提供了最终证据,用于确定手术方案,例如消融、切除或植入神经调节装置。
这个旅程的每个阶段以及每个工具的使用(图 1)都会生成数据,AI 可以利用这些数据。然而,有效地将 AI 工具转化为临床实践需要医生了解 AI 的基本概念(图 2)、正在开发中的工具以及它们的使用方式。在这篇综述中,我们提供了关于 AI 在癫痫中当前发展的全面概述,这对于将这些工具有效转化为临床实践至关重要。我们介绍了机器学习和深度学习方法,这些方法结合了癫痫患者医疗保健旅程中使用的每个工具的数据,从电子病历到 iEEG 和神经影像。大多数此类应用专注于单个模态,但尽可能多地描述了跨模态信息结合的方法。此外,虽然我们描述了涉及目前用于临床实践的工具的应用(例如,结构 MRI、PET 和 iEEG),但我们还描述了涉及目前尚未在临床中使用但有可能在集成时提供帮助的模态的应用(例如,弥散加权成像、静息态 fMRI 和可穿戴设备)。最后,我们描述了解决方案,以解决必须解决的某些最大局限性,以成功地将 AI 集成到癫痫的临床管理中。我们的目标是概述该领域的当前状态,并为未来利用 AI 改善癫痫管理提供指导。
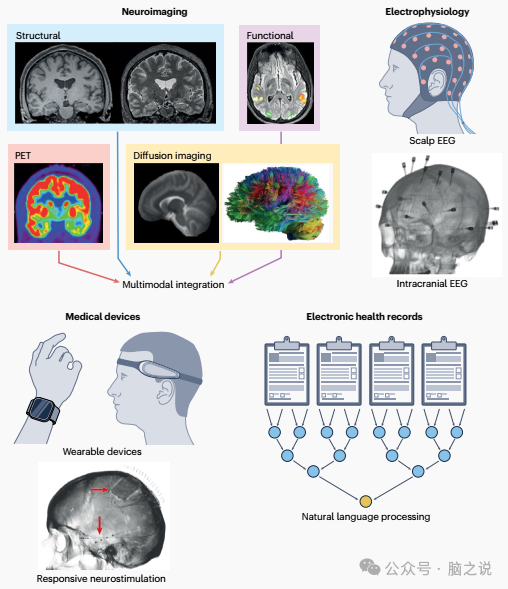
图1 主要用于癫痫中的 AI 数据模态。
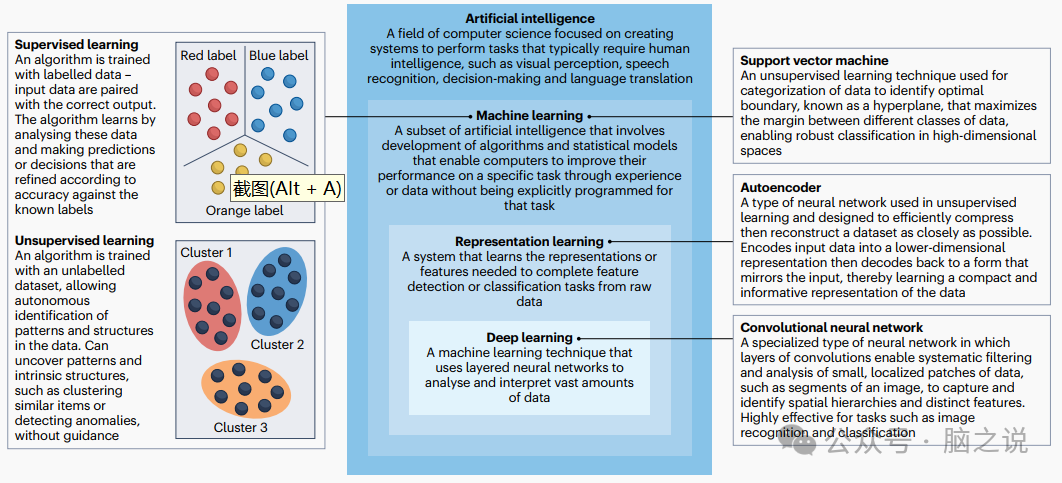
图2 人工智能术语概述。
2. 神经影像
多模态成像在癫痫管理的整个疾病轨迹中发挥着关键作用,从初始诊断到难治性癫痫的术前评估。在术前评估中,结构和功能成像对于定位致痫区至关重要,并有助于移除、切除或神经调节。鉴于其临床效用,神经影像自然成为众多癫痫 AI 研究的焦点。在本节中,我们将回顾神经影像中 AI 应用的当前状态。
2.1 结构神经影像
结构神经影像,特别是结构 MRI,包括 T1 加权成像、T2 加权成像和液体衰减反转恢复 (FLAIR) 成像,是癫痫患者术前评估中最常见的神经影像学方法。这些方法可以直接可视化潜在的癫痫病因的结构异常,例如局灶性皮质发育不良 (FCD)、海马萎缩或脑肿瘤。结构 MRI 对临床管理的直接影响使其成为基于 AI 的病变检测算法的明确候选者。
大多数针对癫痫病变检测的 AI 研究都集中在 FCD 的检测上,因为这种病变是颞叶外癫痫中最常见的,适当的手术治疗通常可以实现无发作。早期方法包括使用线性判别分析分类器和逻辑回归分类器从 T1 加权图像中检测皮质形态特征,以识别在组织学上为阳性但在 MRI 上为阴性的人;也就是说,脑 MRI 没有发现可见的结构异常。检测 FCD 的其他方法涉及使用灰-白质交界处的图像强度特征和来自自动编码器创建的高维特征,这些特征在监督学习和非监督学习范例中使用支持向量分类器进行分析。使用这些方法,MRI 阳性人群的 FCD 敏感性为100%,非监督学习方法提高了 MRI 阴性但组织学上为FCD 阳性人群的敏感性。基于规范建模的皮质异常检测方法也已开发,在 MRI 阳性和 MRI 阴性 FCD II 型人群的混合队列中实现了 0.96 的 AUC 值。
这些研究集中在成人群体,其中 FCD 在癫痫患者中的比例比儿童群体中要小。使用单层神经网络分析图像强度(来自FLAIR 和 T1 加权图像)和皮质形态特征,在儿童群体中检测 FCD 的敏感性为 73%。这项研究中确定的特征成为其他 FCD 检测研究的基石,并最终导致了多中心癫痫病变检测项目的创建,这是一个国际合作项目,它测试、验证和细化了原始 FCD 检测算法,涉及数百名参与者和机构。在基于多中心数据集的另项工作中,开发了一种双卷积神经网络方法,其中直接从 T1 加权图像和 FLAIR 图像中提取3D 图像块,消除了需要特征制作的需求,经过 leave-one-site-out 交叉验证后,敏感性达到 93%。
这些国际、多机构合作是确保癫痫管理中 AI 算法可推广性的努力的好例子,取得的进展使得 FCD 检测算法有望在接下来的 5-10 年内被纳入临床应用。
AI 也可以通过检测结构异常来帮助诊断癫痫。这种方法最常用于颞叶癫痫 (TLE),在这种疾病中,海马体等中线颞叶结构中的结构改变有助于将癫痫患者与健康对照组区分开来。使用支持向量分类器进行区域体积测量或从海马体分割中提取形状和放射组学特征,可以实现 TLE 和健康对照组的分类,其受试者工作特征曲线下面积 (AUC) 大于 0.8。此外,使用结合海马体体积和基于强度的特征的支持向量分类器,在 MRI 阴性人群中实现了 96% 的病变检测率。
基于图像分类的卷积神经网络也被用于从 2D 冠状灰质图中检测 TLE。在这种方法中,冠状成像切片被用作卷积神经网络的直接输入,最小化了特征选择的必要性。在一个 MRI 阳性或 MRI 阴性 TLE 的人群中,卷积神经网络实现了 0.87 的 AUC。类似地,使用轴向灰质图训练卷积神经网络以区分 TLE、阿尔茨海默病和健康对照组,即使一半的队列 MRI 阴性 TLE,也实现了 91% 的检测率。
类似的策略也用于 MRI 阴性癫痫患者的 SOZ 定位。在这个背景下,使用支持向量分类器分析海马体体积测量和 FLAIR 强度数据,可以实现 82% 的定位精度,而使用仅包含 MRI 阴性 TLE 中颞叶结构的FLAIR 强度数据支持向量分类器,可以实现 76% 的定位精度。此外,使用仅包含结构脑体积数据和支持向量分类器的算法,当使用光谱聚类进行特征选择时,在 MRI 阴性癫痫患者中实现了 94% 的定位精度。
其他模型也被用于以高精度进行定位。例如,使用随机森林分类器对强度和结构特征进行分类,在 MRI 阴性癫痫患者中实现了 AUC 为 0.84 的定位,而使用结合杏仁核、丘脑和海马体体积的逻辑回归分类器,实现了 92% 的定位精度。
这些研究的局限性在于,所使用的算法是在单一队列中开发和测试的。在另项研究








 最低0.47元/天 解锁文章
最低0.47元/天 解锁文章

















 45
45

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








