第三章 氨基酸 (但是好像氨基酸部分少了很多视频~)
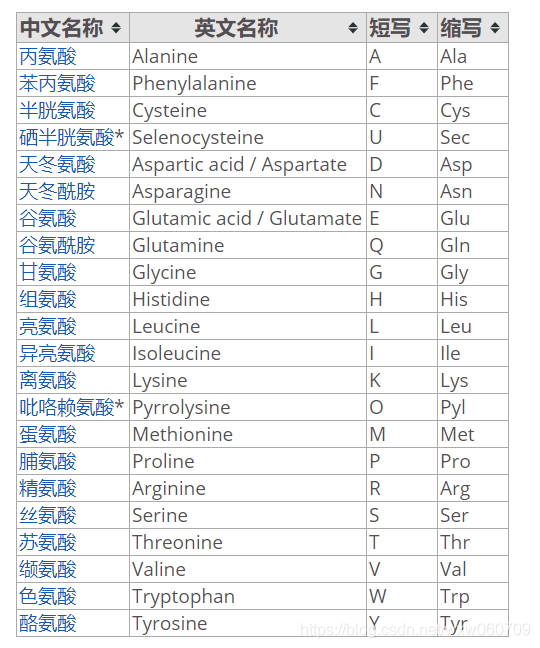
4.1.1 氨基酸(1)
- 蛋白质氨基酸:蛋白质中常见的20种氨基酸,称蛋白质氨基酸、基本氨基酸、标准氨基酸或编码氨基酸。
- 稀有的蛋白质氨基酸:蛋白质组成中,除上述20种常见氨基酸外,从少数蛋白质中还分离出一些稀有氨基酸,它们都是相应常见氨基酸的衍生物。如4-羟脯氨酸、5-羟赖氨酸。
- 非蛋白质氨基酸:生物体内呈游离或结合态的氨基酸。
- 根据水解程度:完全水解(氨基酸混合物)、不完全水解(大小不等的肽和氨基酸)
- 根据水解方法:
- 酸水解:多数氨基酸稳定,不引起 消旋作用;Trp(色氨酸)完全被破坏,羟基氨基酸部分分解,Gln(谷氨酰胺)和Asn(天冬酰胺)的酰胺基被水解下来。
- 碱水解:Trp稳定;多数氨基酸被不同程度破坏,且产生消旋现象,Arg(精氨酸)脱氨。
- 酶水解:不产生消旋作用,也不破坏氨基酸,但需多种酶协同作用。
4.1.2 氨基酸(2)
- 硒代半胱氨酸(Sec),第21种基本氨基酸。
- 氨基酸的物理性质
- 溶解性:溶解于水,特别是稀酸稀碱溶液,不溶于乙醚、氯仿等有机溶液。
- 熔点:均大于200摄氏度,也就是说氨基酸都是固态,这说明了氨基酸与氨基酸之间的结合力很强,是离子键,即氨基酸是以离子状态存在的,而不是以中性分子存在的。

- 当氨基酸溶液在某一定pH值时,使某特定氨基酸分子上所带正负电荷相等,称为两性离子,在电场中既不向阳极也不向阴极移动,此时溶液的pH值即为该氨基酸的等电点(isoelectric point)。
4.1.3 氨基酸(3)
- 氨基酸的甲醛滴定:甲醛与氨基酸的氨基作用形成羟甲基衍生物。
- 氨基酸光学活性和光谱性质
- 旋光性:除甘氨酸外,所有天然α-氨基酸都有不对称碳原子,因此所有天然氨基酸都具有旋光性。
- 紫外吸收光谱:20中基本氨基酸中,Trp、Tyr(酪氨酸)和Phe(苯丙氨酸)的R基团中含有苯环共轭双键系统,在紫外光显示特征的吸收谱带,最大光吸收(Imax)分别为280、275和257nm。
- 氨基酸的化学反应
- 与α-氨基的反应
- α-羧基的反应
- α-氨基和α-羧基间的成肽键反应
- R基团的反应






















 1409
1409











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








