摘要
CD39可能作为膀胱癌(BC)潜在治疗靶点。抑制CD39能够抑制肿瘤生长和延长生存时间。通过单细胞测序发现CD39抑制介导了肿瘤微环境的改变。

背景
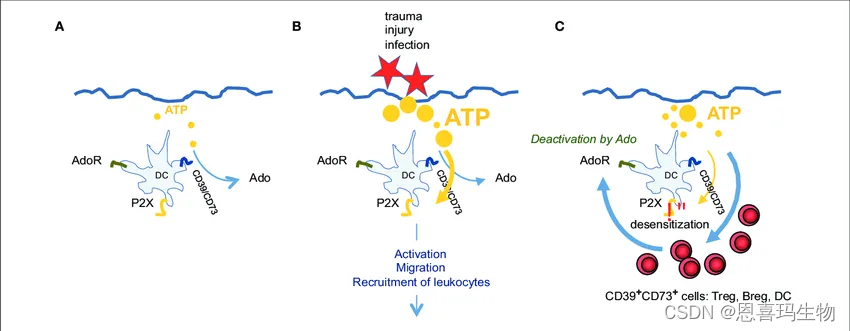
CD39是膜外三磷酸腺苷二磷酸水解酶-1,由ENTPD1编码。
功能:CD39与胞外ATP(extracellular ATP,eATP)结合,并将其水解为AMP;另一种胞外核酸酶CD73则会将AMP水解为腺苷(adenosine,ADO)。在ATP-ADO通路中,CD39是eATP水解的限速酶,而CD73是AMP水解的限速酶。
理论上,在ATP-ADO通路中抑制CD39具有双重抗肿瘤免疫效果:①通过抑制ATP的水解,提高TME中有促炎和促细胞增殖作用的ATP水平;②通过抑制下游产物ADO的累积,逆转ADO受体直接介导的免疫抑制作用及长期建立的免疫抑制性TME
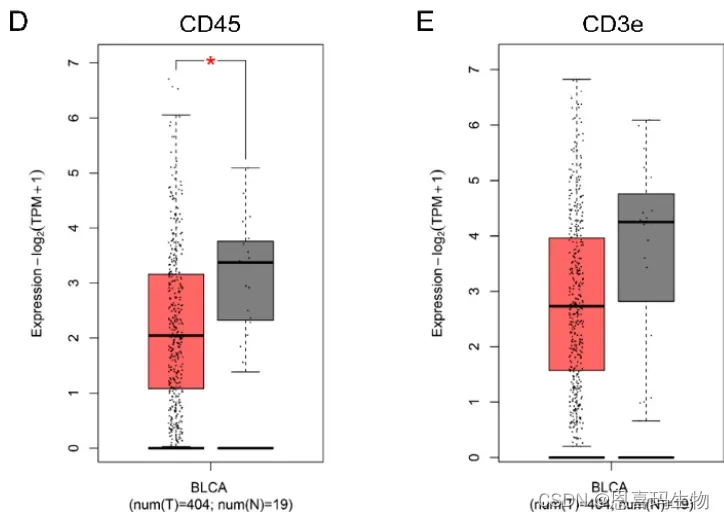
CD39在BC中过表达,主要定位于肿瘤间质区
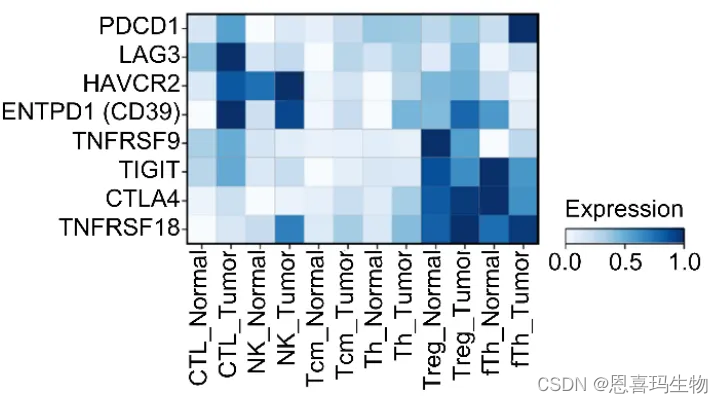
从单细胞测序数据发现(8 tumor、3 paratumor),多个免疫检查点基因在肿瘤驱动的免疫细胞中表达
从TCGA-BCLA数据发现,这些免疫检查点中CD39与预后相关,所以就筛出了focus gene?
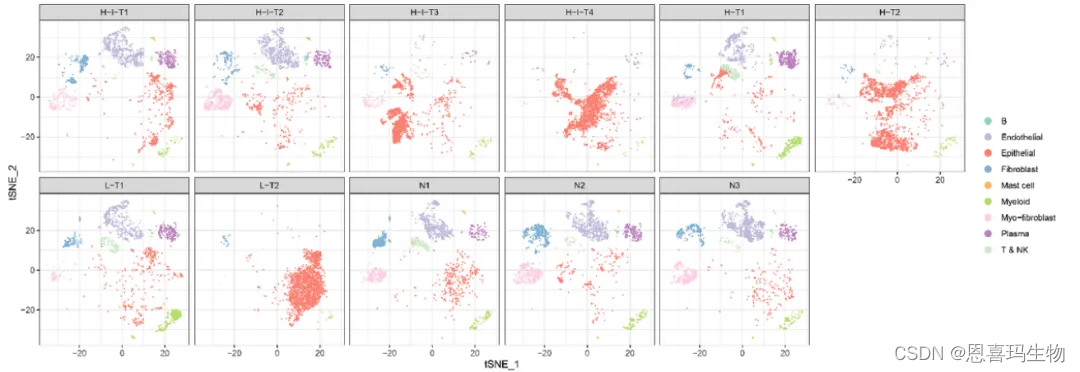
从11个样本中随机选2000个细胞,从tsne看出癌旁有更多免疫细胞
TCGA-BCLA也说明癌旁有更多免疫细胞
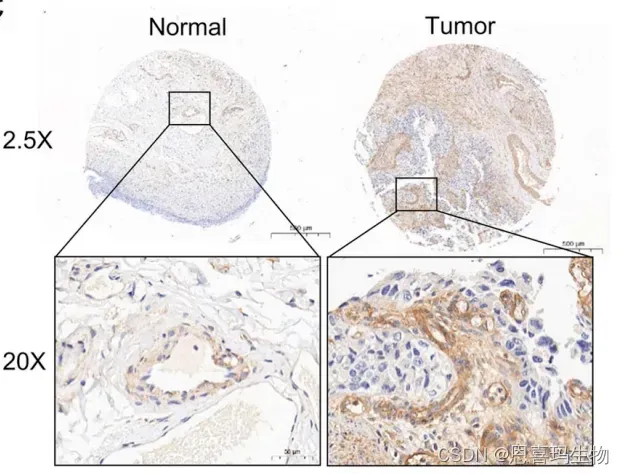
免疫组化说明CD39在BC中高表达
CD39表达增加导致T细胞耗竭和ICB应答率降低
之前的研究表明T细胞表面表达CD39说明T细胞功能障碍。
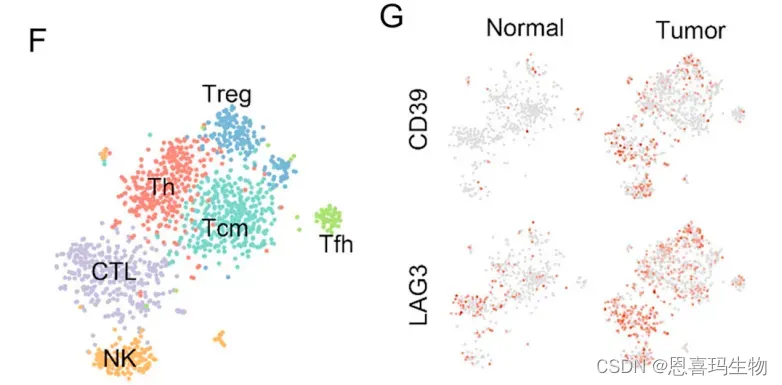
通过单细胞测序数据可以看到肿瘤细胞中T、NK细胞都高表达CD39和LAG3(T耗竭marker)
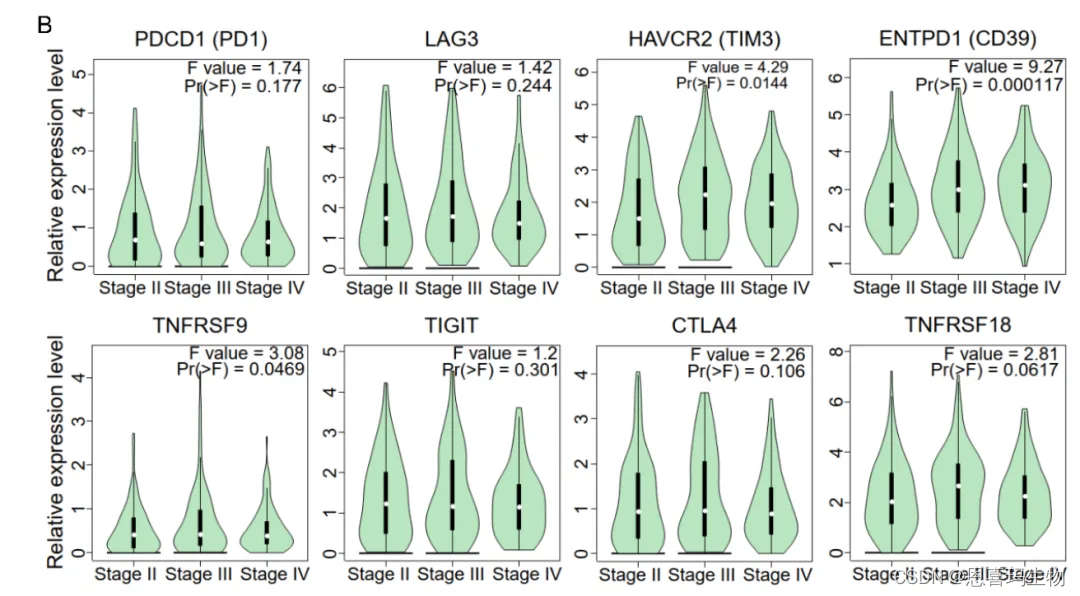
TCGA-BLCA队列中验证了CD39与T细胞耗竭signature正相关关系。
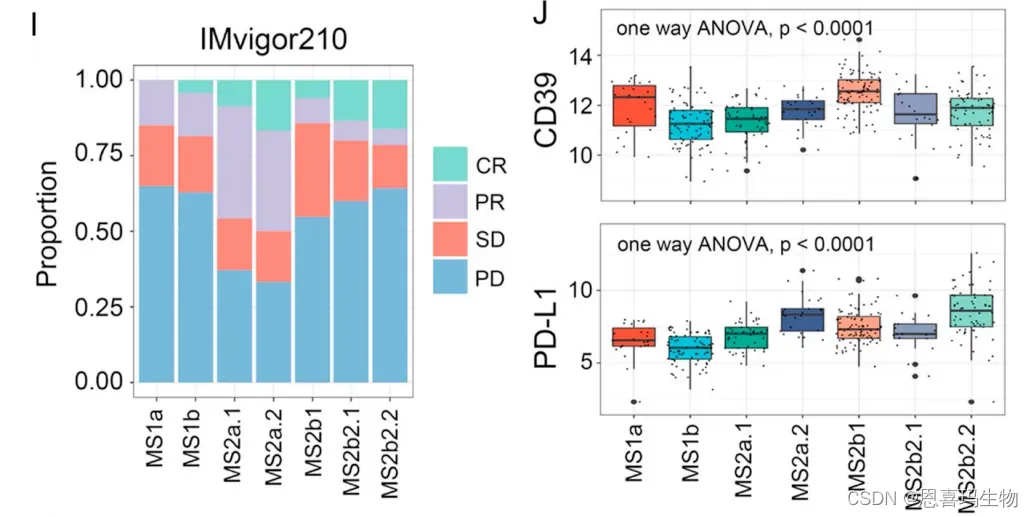
免疫治疗队列,1a和2b1亚型有最高的CD39和最差的reponse,因此CD39阻碍了免疫治疗。
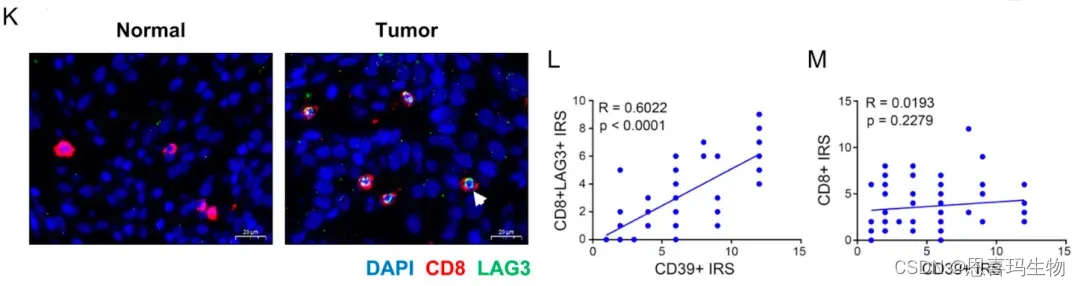
图K说明在蛋白水平上tumor有更多T细胞,图LM说明CD39与CD8+ T细胞比例相关而与数量无关。
CD39i在体内抑制BC的进展
CD39i能够减小小鼠的肿瘤,增加生存时间;
流式结果说明,CD39i后CD45+、CD4+、CD8+细胞增加;
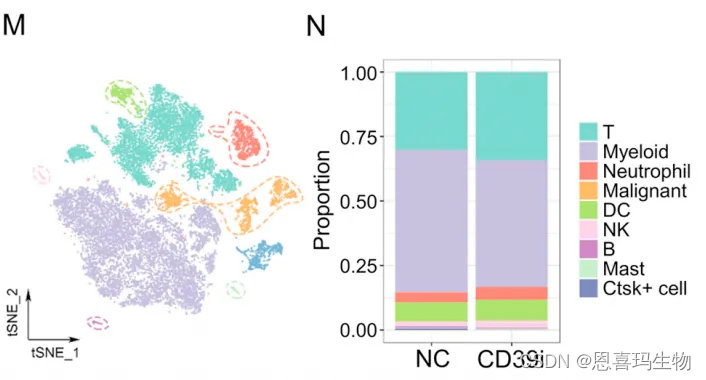
CD45+细胞的单细胞测序结果(MN)表明没有大的差异,只有T细胞比例稍微增加,作者解释说结合流式结果表明,CD39i增加T细胞比例,把肿瘤变得更“hot”
CD39i促进cDC1增加
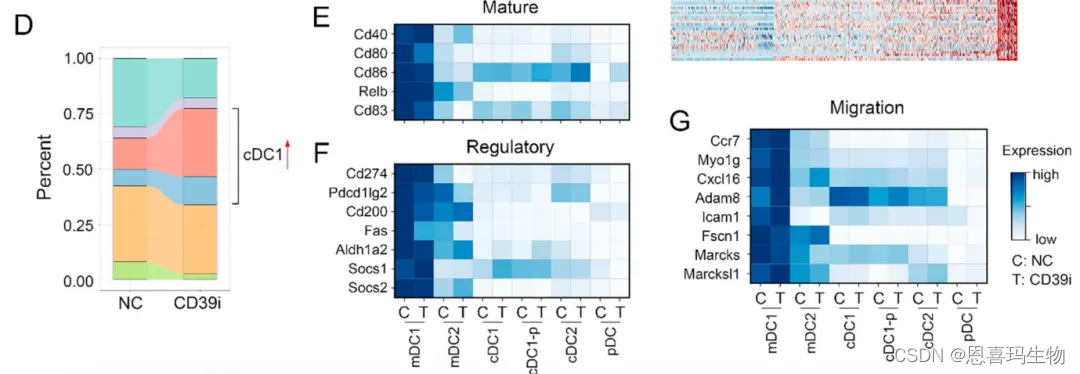
把DC细胞分6群migratory DC2 (mDC2)、migratory DC1−CD80 +(mDC1−CD80 + )、cDC1、cDC1-proliferating (cDC1-p)、conventional type 2 dendritic cells (cDC2)、plasmacytoid DC (pDC)
CD39i使cDC1和cDC1-p比例增加(图D),但是功能没变化(图EFG),这说明CD39i只是增加cDC1比例,不影响其功能。
CD39i激活CD8 + T细胞,促进T细胞扩增
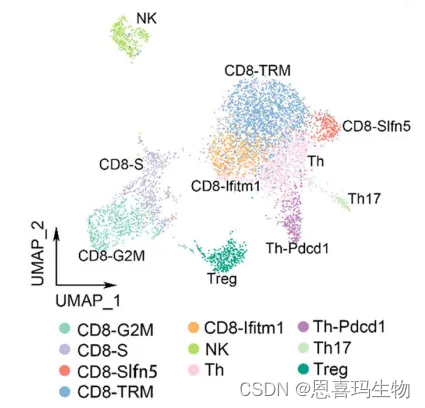
淋巴细胞分为10群,包括CD8-G2M, CD8-S,CD8-Slfn5, CD8-TRM, CD8-Ififitm1, NK, Th, CD4-Pdcd1, Th17, and Treg
CD39i治疗后cycling CD8 + T cells (CD8-G2M and CD8-S)增加、NK增加、Treg减少
流式结果表明CD39i增加CD27+ CD11b+和CD27-CD11b+ NK 细胞比例,但是减少 CD27-CD11b- and CD27 + CD11b- NK 细胞比例,这表明主要增加了成熟NK细胞;但是
Granzyme B + NK细胞比例未增加,这表明Granzyme B + NK细胞细胞增加的原因是NK细胞数量的增加而不是依赖单个细胞Granzyme B的表达。
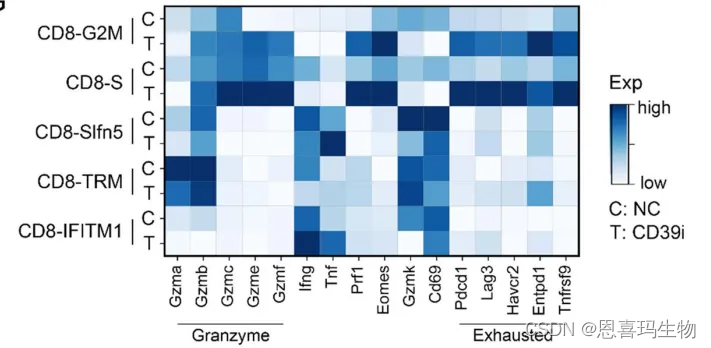
对CD8 + T细胞亚群功能分析,CD39i治疗后,
杀伤marker表达增加eEomes、Prf1、granzymes ;
resident markers (Gzmk and Cd69)下调;
共抑制和共激活免疫检查点在CD8+ T细胞中都缺失(除了cycling 细胞);
以上结果表明,CD39i治疗增加了CTLs的量但是其还受负调控机制抑制。
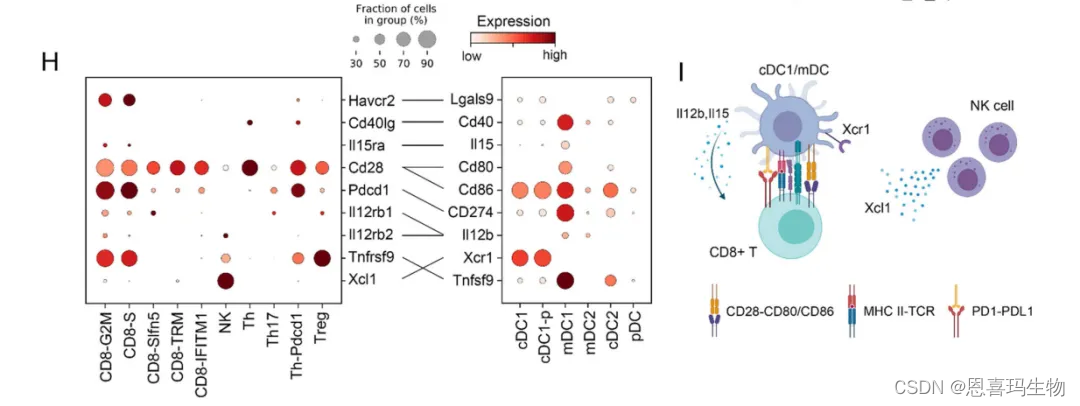
cDC细胞,尤其是cCD1细胞对CTL细胞有重要调控作用。因此用CellPhoneDB 对NK、cCD1、T细胞做细胞通讯分析。
cDC1 and mDC1 通过 Il15, Il12b, Cd80, and Cd86与 Il15ra, Il12rb1/2, and Cd28 互作增强cycling CD8 + T 细胞抗肿瘤作用。NK细胞与cDC1通过Xcl1通讯,Xcl1使cDC1进入肿瘤,CD39i通过增加肿瘤中NK细胞数量从而增加该过程。cDC1和 mDC1通过表达 CD274 (Pd-l1), Lgals9, and Tnfsf9抑制免疫。
以上结果表明,CD39i 治疗增加NK细胞浸润,释放Xcl1从而招募cDC1,cDC1通过Il15, Il12b, Cd80 ,Cd86激活cycling CD8 + T细胞,同时也被免疫检查点抑制。
去除NK细胞可以逆转CD39i的抗肿瘤作用
转基因小鼠去除NK细胞。流式结果表明CD39i 治疗增加cDC1、XCR1 + cDC1浸润细胞比例、Xcl1蛋白水平,但是去除NK细胞的转基因小鼠中没有这些变化,说明NK细胞很重要...
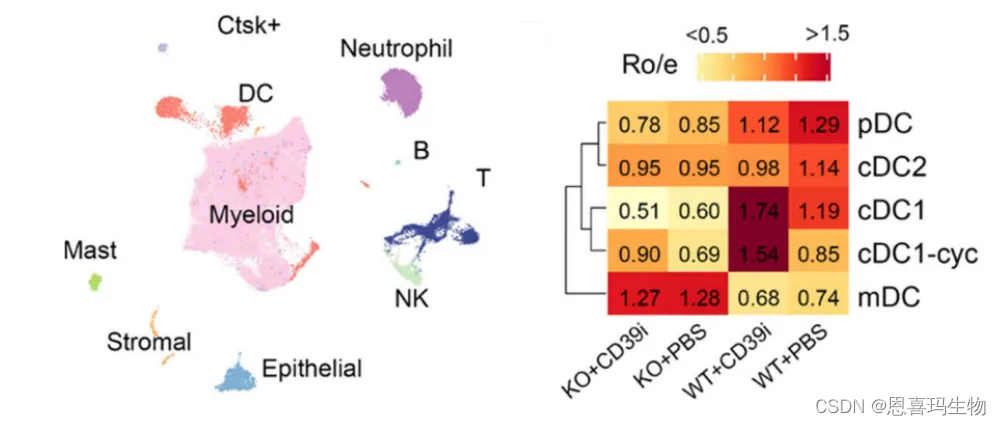
cDC1缺失导致CD39i治疗失败,且有更高的肿瘤负担
转基因小鼠去除cDC1细胞。
去除cDC1细胞的转基因小鼠在CD39i治疗后肿瘤大小无缩减。
单细胞测序结果表明,KO与WT小鼠相比在CD39i治疗后cDC1无增加(描述的不够准确,大概这个意思)。
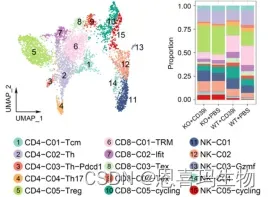
淋巴系分为15群,WT中CD39治疗后proliferating CD8 + T细胞、NK细胞增加,Treg 减少。
KO中CD39i虽然增加NK量,但是CD8+功能缺失,这表明CD39i是通过NK/cDC1间接激活T细胞。
基于CD39i的联合治疗
虽然CD39i激活CTL,但是还受到免疫检查点抑制剂的负调节,因此考虑与ICB联合治疗。
但是,CD39i+ICB效果不好,作者解释说可能两种治疗针对同一群细胞,因此作用抵消。
CD39i+顺铂效果好,可能的原因是顺铂导致细胞死亡释放ATP、而CD39i抑制细胞外ATP降解,因此可能增强了免疫效应。
Reference
https://www.frontiersin.org/articles/10.3389/fimmu.2018.02581/full
https://static-content.springer.com/esm/art%3A10.1038%2Fs41467-022-34495-z/MediaObjects/41467_2022_34495_MOESM1_ESM.pdf
https://baijiahao.baidu.com/s?id=1699883718969749836&wfr=spider&for=pc





















 264
264

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








