大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
N6-甲基腺苷(N6-methyladenosine, m6A)是真核生物mRNA中最丰富的化学修饰,在基因表达调控中发挥着重要作用,包括转录调控和转录后调控。m6A是一种可逆修饰,分别由甲基转移酶(writer)、去甲基化酶(eraser)和m6A结合蛋白(reader)进行添加、去除和识别。
m6A检测技术的发展是研究m6A功能的基础。薄层色谱(TLC)、斑点印迹(dot-blots)以及液相色谱-串联质谱(LC-MS/MS)是广泛用于检测RNA m6A整体水平变化的方法。然而这些方法无法分析m6A在转录组水平上的分布,也无法识别特定基因中的m6A位点。以下内容将介绍关于高通量m6A测序技术和单基因m6A位点的检测方法。
高通量m6A测序技术
尽管对于DNA化学修饰有许多检测方法,但开发用于RNA m6A测序方法还是存在一些困难。首先,RNA不能直接扩增,必须首先逆转录成cDNA。但m6A结构不影响正常碱基配对,m6A位点信息可能在逆转录过程中丢失。其次,尽管m6A是真核mRNA中含量最丰富的修饰,但其绝对含量非常低,并且在细胞中仍有大量的核糖体RNA(rRNA)和转运RNA(tRNA)干扰。因此,需要通过高度特异性的方法在复杂系统中富集m6A RNA。目前已经开发出多种m6A的高通量测序技术,促进了RNA修饰的功能研究。
(1)抗体依赖性m6A测序方法
MeRIP-seq/m6A-seq 是最早使用m6A抗体开发的高通量测序技术。该技术通过mRNA片段化成100-200个核苷酸(nt),然后与m6A抗体孵育,洗脱的RNA用于构建文库和测序。甲基化区域在免疫沉淀RNA相对于input RNA的转录覆盖率称为peaks(图1A)。MeRIP-seq/m6A-seq 生成了约200个nt分辨率的m6A信息。MeRIP-seq/m6A-seq操作简单,所有试剂均已商品化;因此,它一直是m6A测序的首选方法。
2021年有研究团队开发了一种升级版的MeRIP-seq/m6A-seq方法,称为m6A-seq2。m6A-seq2不是一次对一个样本进行m6A免疫沉淀(m6A-IP),而是对合并RNA样本进行m6A-IP。带有条形码的RNA接头被连接到不同样本的片段化RNA上,然后在合并样本上执行单个抗m6A-IP,然后根据条形码序列分配原始样本的reads(图1A)。m6A-seq2所有m6A-IP都在单管中进行,可以减少技术变异性、样本起始量和文库制备成本。此外,考虑到不同样本之间对固定数量抗体的竞争,m6A-seq2可能能够实现不同样本之间m6A整体水平的比较。
m6A单碱基分辨率交联和免疫沉淀方法(m6A-CLIP/miCLIP)可以成功生成单碱基分辨率的m6A位点信息。该方法片段化的RNA与m6A抗体孵育,然后RNA-抗体复合物通过254 nm UV光交联,通过蛋白酶消化得到的氨基酸残基抑制逆转录中的碱基配对,导致在m6A位点附近发生片段化或突变,最终以单碱基分辨率获得m6A位点信息(图1A)。抗体和RNA的结合效率以及交联效率将对最终的测序结果产生重大影响。此外,交联主要发生在抗体的芳香族氨基酸和RNA的嘧啶碱基之间。因此,m6A-CLIP/miCLIP不是直接鉴定单m6A位点,而是从相邻嘧啶位点突变中进行推断;无法准确定位多个相邻腺苷中的m6A,且很难对群集m6A分布进行分析。

图1:高通量m6A测序技术
- 基于抗体的m6A测序方法示意图:MeRIP-seq/m6A-seq、m6A-seq2和m6A-CLIP/miCLIP。
- 抗体非依赖性m6A测序方法示意图:m6A SEAL-seq、m6A SAC-seq、Nanopore Direct RNA-seq和GLORI-seq。
(2)抗体非依赖性测序技术
基于抗体的m6A高通量测序技术存在明显的缺点:m6A抗体质量不易控制,使用不同制造商的抗体获得结果差异较大。此外,抗体的高价格和测序所需的大量RNA也阻碍其大规模应用。为了克服这些局限,科研人员也提出了多种抗体非依赖性m6A高通量测序方法。
FTO辅助的m6A选择性化学标记方法(m6A-SEAL-seq)利用去甲基化酶FT的特性,在体外对m6A进行标记。FTO用于将m6A氧化为中间产物hm6A,hm6A进一步与二硫苏糖醇(DTT)转化为稳定的N6-二硫代硫醇甲基腺苷(dm6A)。然后用生物素标记dm6A以富集含有原始m6A的RNA片段。对富集的RNA进行测序以获得m6A位点信息(图1B)。m6A-SEAL-seq所需初始RNA量很低,FTO具有很强大的去甲基化活性,几乎没有序列选择性。m6A-SEAL-seq的缺点是操作步骤多、耗时长、分辨率与MeRIP-seq相似。
选择性丙烯基化学标记测序(m6A-SAC-seq)可以直接标记m6A,覆盖几乎所有m6A经典motif,并以单碱基分辨率定量分析捕获的m6A位点。该方法使用特定酶将烯丙基化学基团添加到m6A中,形成a6m6A,经I2处理后进行环化。在逆转录过程中,环化的a6m6A被逆转录酶读为突变。基于突变位点检测转录组中的m6A位点,并通过标准曲线转换突变率来获得m6A含量的准确信息(图1B)。m6A-SAC-seq可广泛应用于各种生物学背景,并在基础生物学研究和临床应用中具有良好前景。m6A-SAC-seq的主要局限在于反应基于酶,因此可能具有序列偏好。
纳米孔直接RNA测序(Nanopore Direct RNA-seq)是另一种能够以单碱基分辨率鉴定m6A修饰的测序技术。当RNA通过纳米孔时,通过纳米孔表面的电场强度鉴定RNA序列。RNA修饰导致强度水平变化,因此可以通过以单碱基分辨率计算确定修饰碱基(图1B)。尽管Nanopore Direct RNA-seq能够在单碱基水平上鉴定m6A修饰,但仍存在一些缺点,如成本高、准确性低、对RNA质量和初始量要求较高。
乙二醛和亚硝酸盐介导的未甲基化腺苷脱氨酶测序(GLORI-seq)是最近报道的技术;它能够高效且无偏倚检测单碱基m6A位点,并绝对定量m6A修饰水平。GLORI技术使用乙二醛和亚硝酸盐的催化系统高效地将未甲基化腺苷脱氨形成肌苷(A到I,>98%)。肌苷在逆转录过程中与胞嘧啶匹配,随后在测序过程中被读为鸟苷(G),产生A-to-G转化。而m6A保持不变,在测序后仍被读为A。因此,GLORI通过检测测序reads中A的比例,实现了对单碱基m6A的绝对定量(图1B)。
单基因m6A位点的检测
尽管高通量测序技术能够快速获得数千个m6A位点数据,但由于测序过程中的偏倚或技术原理上的缺陷,它们仍然会产生假阳性或假阴性结果。因此,有必要开发检测单基因m6A位点的方法。
MeRIP-qRT-PCR已被广泛用于验证高通量测序鉴定的m6A peaks。mRNA或总RNA被片段化为100-200nt,随后用m6A抗体进行免疫沉淀,富集的RNA通过常规qRT-PCR进行定量(图2)。尽管MeRIP-qRT-PCR简单实用,但它不能提供单碱基分辨率,并且依赖于m6A抗体的特异性。
基于单碱基延伸和连接的qPCR扩增方法(SELECT)利用m6A抑制DNA聚合酶和连接酶的特性,方便快速地检测特定位点的m6A修饰及程度。SELECT使用DNA聚合酶和连接酶连接靶位点的两个互补DNA引物。在这个过程中,m6A首先干扰上游引物的延伸,然后阻碍下游引物的连接。尽管m6A不会100%抑制每一步,但通过两步反应可以大幅减少最终产物量。最终,通过qRT-PCR分析目标位点和对照组的阈值循环(Ct)的差异,可以检测目标位点的m6A修饰和甲基化程度(图2)。SELECT操作简便,所有实验都可以在一个反应系统中完成,无需额外的纯化步骤。但SELECT需要引入对照组并生成标准曲线以完成检测和定量分析。
位点特异性切割和放射性标记,随后通过连接辅助提取和TLC(SCARLET)可以以单碱基分辨率定量检测RNA中的修饰位点,这目前是RNA修饰的“金标准”。因为RNase H会消化RNA/DNA杂交体中的RNA,但不消化RNA/2-O-甲基化DNA杂交体中的RNA,使用RNase H暴露于预定义的m6A位点进行放射性标记。使用DNA连接酶将32P标记的RNA片段连接到116个核苷酸的单链DNA寡核苷酸上。然后用RNase T1/A处理样品以消化所有RNA,而32P标记的预定义m6A位点保持不变。经过凝胶纯化和核酸酶P1消化后,通过TLC确定m6A修饰状态(图2)。SCARLET技术的应用受到其复杂步骤、长实验时间和使用放射性试剂的限制。
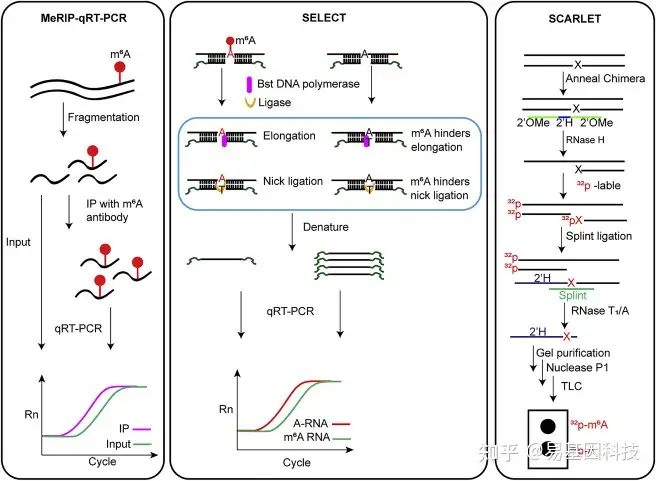
图2:单基因m6A位点检测方法
位点特异性m6A检测方法示意图:MeRIP-qRT-PCR、SELECT和SCARLET。
总结而言,目前已经开发出的不同层面m6A修饰检测方法主要有:
1)整体水平检测:TLC、Dot-blot和LC-MS/MS;
2)转录组范围内m6A修饰高通量检测(图1):
-
- 基于特异性抗体的测序技术(MeRIP-seq/m6A-seq、m6A-seq2、m6A-CLIP/miCLIP);
- 非抗体依赖的测序技术(m6A-SEAL-seq、m6A-SAC-Seq、Nanopore Direct RNA Seq、GLORI-Seq);
3)单基因m6A位点检测技术:MeRIP-qRT-PCR、SELECT、SCARLET(图2)。
以上方法有不同的应用场景,科研老师们可以根据自己的科研需求选择适合的检测方法。
关于易基因RNA m6A甲基化测序(MeRIP-seq)技术
易基因MeRIP-seq技术利用m6A特异性抗体富集发生m6A修饰的RNA片段(包括mRNA、lncRNA等rRNA去除所有RNA),结合高通量测序,可以对RNA上的m6A修饰进行定位与定量,总RNA起始量可降低至10μg,最低仅需1μg总RNA。广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症发生与发展、药物应答等研究领域;可应用于动物、植物、细胞及组织的m6A检测。
大样本量m6A-QTL性状关联分析,传统MeRIP单个样品价格高,通常难以承担。易基因开发建立MeRIP-seq2技术,显著提成IP平行性,实现不同样本间相对定量,降低检测成本。
易基因提供适用于不同科研需求的MeRIP技术:
- m6A甲基化-常量mRNA 甲基化测序(MeRIP-seq)
- m6A甲基化-常量mRNA +lncRNA甲基化测序(lnc-MeRIP-seq)
- m6A甲基化-微量mRNA +lncRNA甲基化测序(Micro-lnc-MeRIP-seq)
- 高通量m6A甲基化-常量mRNA甲基化测序(MeRIP-seq2)
技术优势:
- 起始量低:样本起始量可降低至10-20μg,最低仅需1μg总RNA;
- 转录组范围内:可以同时检测mRNA和lncRNA;
- 样本要求:可用于动物、植物、细胞及组织的m6A检测;
- 重复性高:IP富集重复性高,最大化降低抗体富集偏差;
- 应用范围广:广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症的发生与发展、药物应答等研究领域。
研究方向:
m6A甲基化目前主要运用在分子机制的理论性研究
- 疾病发生发展:肿瘤、代谢疾病(如肥胖/糖尿病)、神经和精神疾病(如阿尔兹海默症/抑郁症)、炎症…
- 发育和分化:早期胚胎发育、个体/组织/器官生长发育、干细胞分化与命运决定、衰老
- 环境暴露与响应:污染、抗逆、生活方式
关于m6A甲基化研究思路
(1)整体把握m6A甲基化图谱特征:m6A peak数量变化、m6A修饰基因数量变化、单个基因m6A peak数量分析、m6A peak在基因元件上的分布、m6A peak的motif分析、m6A peak修饰基因的功能分析
(2)筛选具体差异m6A peak和基因:差异m6A peak鉴定、非时序数据的分析策略、时序数据的分析策略、差异m6A修饰基因的功能分析、差异m6A修饰基因的PPI分析、候选基因的m6A修饰可视化展示
(3)m6A甲基化组学&转录组学关联分析:Meta genes整体关联、DMG-DEG对应关联、m6A修饰目标基因的筛选策略
(4)进一步验证或后期试验

易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化)和表观转录组学(m6A、m5C、m1A、m7G)、染色质结构与功能组学技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900.

参考文献:
Tang J, Chen S, Jia G. Detection, regulation, and functions of RNA N6-methyladenosine modification in plants. Plant Commun. 2023 May 8;4(3):100546. pii: S2590-3462(23)00044-5. doi: 10.1016/j.xplc.2023.100546. PubMed PMID: 36627844.
相关阅读:
1. 项目文章|MeRIP-seq揭示m6A修饰在肺动脉高压(PAH)发病机制中的潜在作用和新治疗靶点
2. 项目集锦 | 易基因近期m6A甲基化(MeRIP-seq)研究成果
3. 项目文章 | 90天见刊,易基因m6A RNA甲基化(MeRIP)+转录组组学研究
4. 干货系列:m6A RNA甲基化研究的前期探索性实验思路
5. 干货系列:高通量测序后的下游实验验证方法——m6A RNA甲基化篇
7. 干货:m6A RNA甲基化MeRIP-seq测序分析实验全流程解析
8. 独家分享:m6A peak鉴定经典点软件exomPeak原理解析




























 6745
6745

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








