随着科技的飞速发展,电子实验记录本已经成为研发企业不可或缺的工具。然而,在使用电子记录本系统的过程中,合规性却是一个不容忽视的问题。今天,我们就一起来探讨一下大家比较关心的电子实验记录本的合规性。
如何判断电子实验记录本是否合规呢?
是需要FDA发什么许可认证吗?
电子记录有没有相关政策的支撑呢?
和GMP有什么关系吗?
CSV验证又是什么意思?
……
一、电子实验记录本的合规性概念
首先,我们需要明确一个概念,合规性是什么?简单来说,就是企业的运营和管理活动符合相关法律法规、行业规范以及企业内部制度的要求。对于电子实验记录本而言,合规性主要体现在数据的真实性、完整性和可追溯性上。
二、电子实验记录的政策法规支撑
国际法规与标准
别急,我们先来解释第一个问题,电子实验记录的政策法规支撑有哪些?1997年,美国药监局(FDA)颁布了联邦法规21章第11条(21 CFR Part 11),这条法规主要规定了电子记录和电子签名的标准,确保FDA认为电子记录、电子签名和在电子记录上的手签名是可信赖的、可靠的,并且通常等同于纸制记录和在纸上的手写签名,这条法规也被公认为是电子记录领域最权威的法规之一。

以下为法规中的部分相关信息
电子记录的要求
1、电子记录需满足FDA对于数据完整性、可靠性和安全性的要求,确保其可以被验证且未经篡改。
2、用于电子记录的计算机系统(包括硬件和软件)应得到适当的维护和控制,以确保其持续符合FDA的要求。
3、电子记录的管理应确保数据在整个生命周期内都保持其原始性和可追溯性。
电子签名的要求
1、电子签名应能唯一地标识签署人的身份,并表明签署人对电子记录内容的认可。
2、电子签名应使用安全、可靠的技术来创建和验证,以防止伪造或篡改。
3、与电子签名相关的所有操作(如创建、验证、存储等)都应按照FDA的规定进行,并保留相关的审计追踪信息。
实施细节
1、对于需要提交给FDA的电子记录,需满足特定的文件格式和技术要求,以便FDA能够有效地接收和审核这些记录。
2、在电子记录的创建、验证、存储和备份等过程中,应遵循相关的标准和最佳实践,以确保数据的完整性和可靠性。
3、对于使用电子记录和电子签名的组织,应建立相应的政策和程序来确保这些记录的合规性和可追溯性。
在法规的支持下,一些大型的跨国药企,自2000年起就陆续开始上线了电子实验记录本系统,节省实验记录时间、节省知识资产损失、提升效率、数据利用率增加等成了药企们对ELN系统的良好反馈。
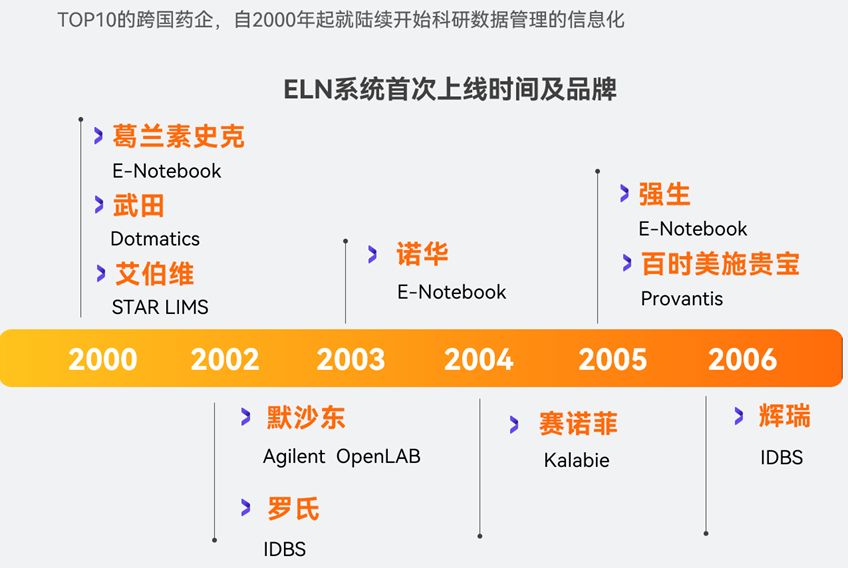
除了美国FDA的21 CFR Part 11,国际药品生产和质量管理组织(ISPE)的GAMP5指南中也强调了系统的验证、数据完整性和安全性等方面的要求。此外,ISO等机构也颁布了相关文件,具体可见下图。

国内法规与标准
随着电子实验记录本在我国的发展,NMPA国家药监局近年来也陆续出台了关于电子记录的相关文件,如2017年7月颁布的《药品非临床研究质量管理规范》,这是我国第一次针对非临床药品研发阶段的电子记录数据的合规性,进行了明确的定义和规范,奠定了电子实验记录本的法律基础,对科学家们关注的原始数据、计算机化系统、电子数据、电子签名、稽查轨迹,同行评议进行了明确的定义和解释。

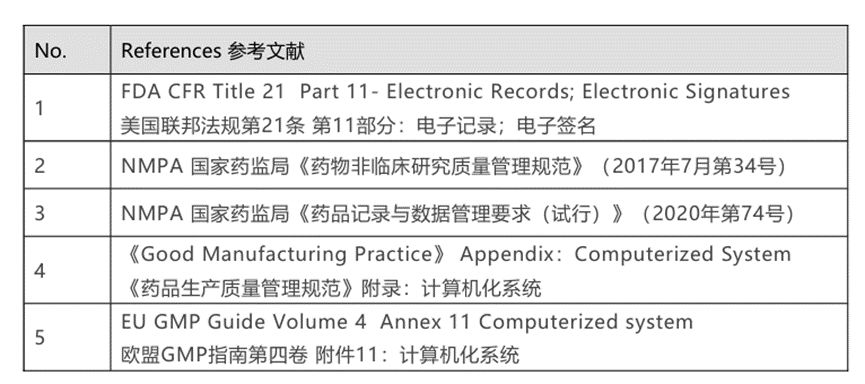
也就是说,不论国际还是国内,电子记录的合规性都得到了法律层面的政策支持,在GMP(药品生产质量管理规范)中也有对计算机化系统相关的合规要求,主要参考法规如下图所示。
说完了电子实验记录宏观层面的合规性,再聊聊对于企业个体来说,如何确认自己企业的电子实验记录本系统的合规性呢?常听到的CSV验证是什么意思?
三、 企业如何确认ELN系统的合规性
软件层面,选择合规的软件系统
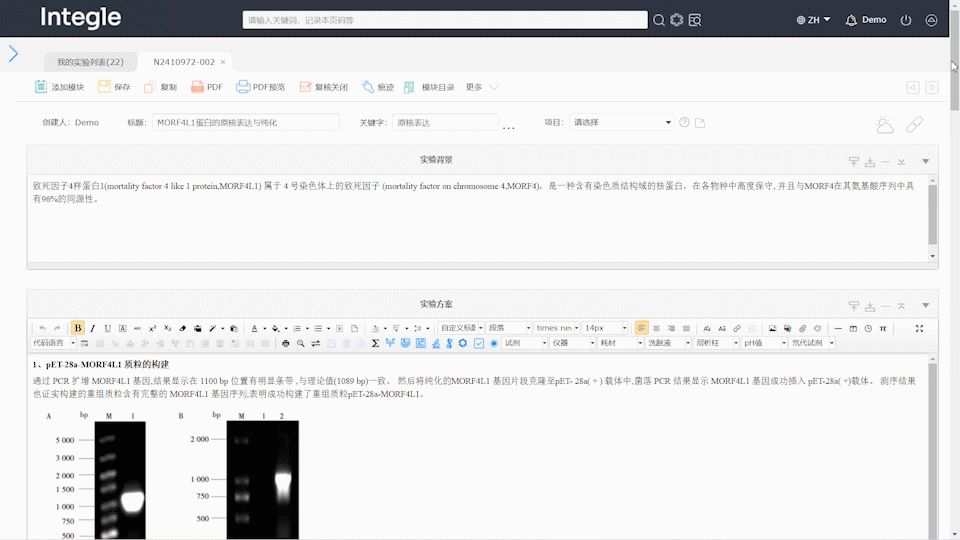
选择经过认证、符合相关法规要求的电子实验记录本软件。软件功能上要支持修改留痕、复核签名(生成数字证书)、监控日志(登录日志、数据库备份日志、分享日志、操作日志)、精确到个人的权限等。例如,InELN电子实验记录本在设计之初就参考了FDA 21 CFR Part11 和 NMPA相关要求,提供了每6秒自动记录保存的功能,可以提供非常详细的全过程痕迹跟踪能力,记录数据均可阅读并支持导出Word、PDF等可以导出打印,支持结构式搜索,便于审计核查。
管理层面,指定明确的SOP流程
某研发企业在使用电子实验记录本时,选择了合规的软件系统,但由于对数据管理制度执行不严格,导致部分实验数据被篡改和丢失。在后续的合规审查中,这些问题被一一暴露出来,导致该企业未能通过审查。这不仅给企业带来了经济损失,更重要的是损害了企业的声誉和信誉。因此,我们建议,在选择了合规的软件系统上,企业还应做到以下几点:
(1)制定明确的数据管理制度:明确数据的采集、存储、使用、备份和销毁等各个环节的流程和责任人,保证实验记录的及时性。
(2)加强权限管理:确保只有授权人员才能访问和修改实验数据,防止数据泄露和篡改。
(3)定期审计和检查:对电子实验记录本进行定期审计和检查,确保数据的真实性和完整性。
(4)培训和意识提升:加强员工对合规性的培训和意识提升,确保每个人都能自觉遵守相关规定。
认证层面,尽早完成CSV验证
计算机化系统验证(Computerized Systems Validation,简称CSV)的目的是确保计算机化系统的稳定性、可靠性和合规性。值得一提的是,计算机化系统不止是软件和硬件,还包括了操作流程,连接的设备仪器和操作环境。GAMP5指南中对于实验室内的计算机系统的分类标准如下:对于不同分类的计算机系统提出了不同的验证要求。
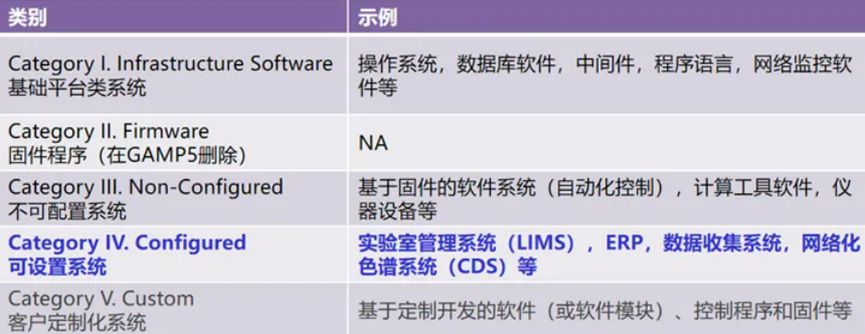
图片来源:知乎
在进行计算机化系统验证活动时,除了确保开发设计的系统要符合法规、行业指南外,还要符合公司内部的规程要求。进行计算机化系统验证后,不仅使数据完整性和可靠性得到保障,还可以进行风险管理和问题预防,CSV验证是实现GMP中关于计算机化系统合规性要求的关键步骤。
四、经验借鉴
最后,给大家提供一个可借鉴的小经验:参考行业内与自己业务相似企业的成功案例。例如一品红药业,上线ELN系统后经历多次官方审计没有收到过缺陷项,也被审计老师询问过实验记录的即时性和审计追踪的有效性,公司通过使用含有痕迹功能的InELN电子实验记录本加上设计了“4h内完成实验记录”的内部SOP,加上做了系统的CSV验证,成功通过了每次的现场核查。
结语
以上就是关于电子实验记录本的合规性的内容啦,希望对大家有帮助哦!
让研发有数据、有智慧、有未来
























 1309
1309

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








