
2024年5月,中国农科院李慧慧团队绘制泌盐植物互花米草高质量基因组,揭示其耐盐分子机理,在Plant Biotechnology Journal在线发表了题为“The Spartina alterniflora genome sequence provides insights into the salt tolerance mechanisms of exo-recretohalophytes”的研究论文,揭示了互花米草耐盐的分子机制,为植物耐盐遗传改良提供了新的基因资源。
研究背景:
高盐度造成显著的环境胁迫,极大地阻碍了植物生长和发育,预计全球约20%的陆生植物将受到严重影响。然而,盐生植物对这些盐碱生境表现出了显著的适应性,表现出一系列的生存策略来应对胁迫。这些策略包括维持离子平衡和利用盐分泌机制,这对它们在此类条件下的生存至关重要。互花米草(Spartina alterniflora)是禾本科(Poaceae)的一种外生盐生植物,能够在海滨良好生长,但其耐盐适应的基因组基础仍不清楚。互花米草在非生物胁迫耐受性的分子机制、进化遗传学、比较基因组学等方面的研究普遍滞后,因此在利用相关基因进行作物改良方面的研究也普遍滞后,主要是由于缺乏高质量的参考基因组序列。在这里,研究报告了一个高质量的,染色体规模的互花米草基因组,通过基因组学、转录组学和代谢组学的综合分析,初步确定了通过离子转运蛋白和盐过度敏感(SOS)途径基因的扩增,导致特定功能和显著高的表达水平。此外研究还发现了谷胱甘肽代谢的盐诱导效应,互花米草(Alterniflora)的耐盐性也有一定的贡献。
技术路线:

研究结果:
1.测序和组装互花米草基因组
为了获得高质量的互花米草基因组测序,首先通过K-mer频率估计其基因组大小为1.57Gb,杂合性率为0.53%(表S1)。通过流式细胞术进行的后续分析显示,其大小约为1.70 Gb。荧光原位杂交(FISH)显示染色体数目为62条(图S2),倍性分析显示互花米草是一种异源四倍体(AABB)(图S3)。然后,通过整合PacBio HiFi测序、Hi-C分析和RNA测序,对互花米草进行了鉴定。PacBio HiFi测序生成了总计83.10 Gb的测序数据,平均覆盖深度约为509(表S2),Hi-C测序生成了265.94 Gb(约1609)的读数(表S3),总装配长度为1.58Gb,包括101个重叠群(N50 = 46.74Mb)和45个支架(N50 = 58.84Mb;表1)。此外,使用LACHESIS的Hi-C辅助组装了1.58 Gb的序列锚定到31条假染色体上(图1)。这种基于Hi-C的装配体代表了互花米草基因组,每条染色体的长度范围在35.19和76.39Mb之间(表S4)。然后将染色体从最长到最短进行组织,并相应编号,其中假染色体Chr 01最长。Hi-C接触矩阵中染色体之间的相互作用程度较低,表明基因组组装中无明显错误(图S4)。色葡萄互花米草基因组的鸟苷-胞嘧啶(GC)含量为44.92%(表1),重复百分比为53.05%(图S5)。

表1
为了确定基因组组装的完整性,随后确定了互花米草的遗传多样性为97.5%(单一:24.6%;重复:72.9%;片段:1.7%;缺失:0.8%; n = 3236)(表S5)。通过与已发表的S.互花米草基因组,研究发现组装的互花米草基因组的BUSCO和Contig N50的质量均高于文献值(BUSCO:95.83%,Contig N50:18.80 Mb)。通过使用长末端重复序列(LTR)组装指数(LAI = 13.46)评估LTR完整性的额外验证表明,组装的互花米草基因组具有足够高的质量作为参考基因组。

图1
2.基因组注释
对于基因注释,研究人员整合了从头的结果,基于同源性的预测与基于转录组学的方法以产生一组82811个高置信度的蛋白质编码基因。蛋白质编码基因的平均长度在S.互花米草基因组为3990 bp,平均跨越5.3个外显子(表S6)。然后使用5个功能注释数据库对预测基因进行注释(表S7),在蛋白质数据库中识别出77 520(93.61%)个具有已知同源性的注释基因(图S6)。除蛋白质编码基因外,73.64%的互花米草基因组包含重复序列,61.10%的基因组包含转座因子(TE),更具体地,长末端重复(LTR)-反转录转座子(RT)约占基因组的58.59%(表S8)。其中,Gypsy含量最高,占33.41%;其次为Copia,占13.4%;这些LTR-RT大多位于着丝粒和着丝粒周围区域。除了蛋白质编码基因和重复元件外,基因组还包含3419个核糖体RNA(rRNA)、292个微小RNA(miRNAs)、1022个转移RNA(tRNA)、227个小核RNA(snRNAs)和5202个小核仁RNA(snoRNAs)(表S9)。31条染色体的基因组特征如图1所示。
3.WGD对互花米草对盐碱环境的适应
WGD在许多植物物种的进化中多次发生,通常被认为是产生额外遗传物质的主要进化力量,可增加植物的适应性可塑性,最终促进物种多样化和功能创新。为了研究WGD的可能性,通过比较互花米草、海雀稗、粳稻,后两个被用作参考,因为它们与互花米草及其相对简单的基因组结构(图2a)。为了推断基因组内的基因共线性,在互花米草基因组使用相同的标准,检测到了288和386个来自P.vaginatum和Z.japonica基因组,分别含有3912和10528对共线性基因对。
最大的同源块在互花米草的基因组中含有1387个基因对,位于第5和第6染色体上,而在海雀稗和粳稻分别有221对和592对基因对。这些结果表明互花米草基因组中同源基因对数明显多于另外两种植物的基因组。结果表明,互花米草可能发生一个或多个WGD事件。互花米草共线性分析共鉴定出1605个同源片段,结果表明,互花米草和海雀稗的基因组序列有2098个同源区,共包含83736个共线性基因对。因此,这些结果只是揭示了互花米草和另外两个参照基因组。
为进一步研究调查潜在的WGD是否可能导致互花米草对盐环境的适应,研究人员进一步鉴定了互花米草和11种其它植物物种的耐盐相关基因家族和转录因子和基因组的功能注释,分析表明,与其他作物和盐生植物相比,互花米草具有更高丰度的盐胁迫相关基因和TF(图2b和表S10)。对盐胁迫响应钾离子通道基因(Kv-like、KUP/HAK/KT、KEA、HKT)、互花米草(alterniflora)中这些基因所占的比例显著高于其它物种除了K.obovata(图2b)(0.1393%)。在基因组内,与11种其他物种相比,互花米草的KUP/HAK/KT和HKT的比例显著更高(图S7 A)。此外,S.与几个其他物种相比,互花米草显示出通常更高比例的盐胁迫相关TF,包括NAC、bZIP、WRKY、AP 2、ERF和MYB(图S7 B和表S10)。特别是互花米草的AP 2 TF含量(0.10%)高于除玉米外的大多数物种,MYB TF含量(0.51%)高于大多数其他物种。这些结果支持WGD事件有助于其适应盐水环境的可能性。
然后,我们计算了基因组内和基因组之间的每个共线基因对的同义取代分歧(Ks)。在P.vaginatum和Z.japonica的Ks分布旁系同源物分别在~0.60和~0.29的Ks值处仅显示一个峰。与此相反,在互花米草中,一个峰在Ks ~ 0.067处,另一个在Ks ~0.206处(图2c),这意味着可能发生了至少两个WGD事件。随后的MCMC树和化石校准的分析,估算出S.alterniflora和Z.japonica(图2a)。
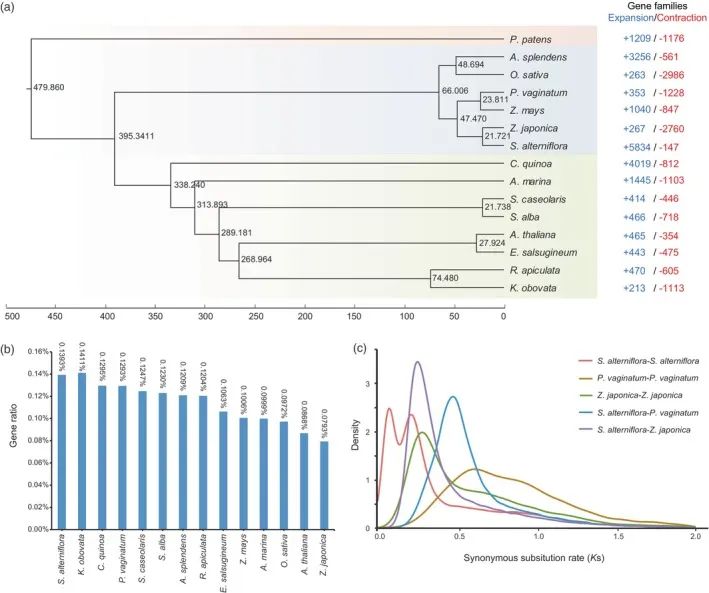
图2
4.互花米草的基因组学特征与更强的耐盐性相关
CAFE分析表明,在互花米草基因组中(图2a),包括3335个显著扩增的和45个显著收缩的,当与其他13个物种中的这些相比时(P值<0.01),扩展的基因家族的GO分析富含术语如“离子转运”、“跨膜转运”、“对盐胁迫的响应”、“对氧化胁迫的响应”、“钾离子转运”和“对渗透胁迫的响应”(图3a)。扩展基因家族的比较GO分析互花米草和其他13种植物的结果表明,只有互花米草与盐胁迫相关的生物过程的互花米草富集(图3a)。
研究表明,离子转运蛋白有助于植物的耐盐性,这与我们的结果非常一致,显示KUP/HAK/KT和HKT家族成员的扩增(图S8和S9)。此外,我们还观察到APETALA 2/ERF、expansins(包括EXPA和EXPB)、蛋白磷酸酶2Cs(PP 2Cs)、SNF 1调节的蛋白激酶2s(SnRK 2s)和WD 40家族在S.互花米草(图3b和图S10- S12)。同样,在互花米草中的TTG 1蛋白,代表了在其他盐适应物种中保守的TTG 1蛋白的扩展集合(图3c)。
为了探讨与耐盐性相关的基因组特征,在互花米草中,研究发现了正选择基因(PSG),互花米草基因组(表S11)。这1384个PSG的GO分析显示了术语“对应激的反应”和“离子转运”的富集(图3d和表S12),而互花米草和上述盐生植物物种的比较表明,这两个术语在这些物种中不能检测到或富集程度很差(图3d)。
利用Orthofinder软件进行聚类分析,共确定了14个物种共有的7294个基因家族,其中1614个为互花米草特异性基因家族(对应7443个基因)(图3e)。对于生物学过程术语“对刺激的响应”、“对胁迫的响应”、“对水的响应”和“对盐胁迫的响应”,互花米草特异性基因显示富集(图3f),进一步说明基因扩增可增强对盐胁迫的适应。互花米草特异性基因约占所有蛋白编码基因的8.99%,其中50%属于TE家族。研究发现,在TE家族中,编码双链特异性核酸内切酶(DDE)超家族DDE_Tnp_4的基因所占的比例较高。全基因组比较分析表明,DDE_Tnp_4基因在互花米草(171)和C.昆诺阿藜(177),与其它盐适应物种(表S13)相比,在拟南芥(11)中具有明显较少的家族成员。值得注意的是,在白骨壤(Avicennia marina)、秋茄(Kandelia obovata)、桐花树(Aegiceras corniculatum)、盐芥(Eutrema salsugineum)和厚藤(Pellaea vaginata),在171个DDE_Tnp_4成员中,有38个是互花米草DDE_Tnp_4基因与其他植物的DDE_Tnp_4基因不存在共线性关系。
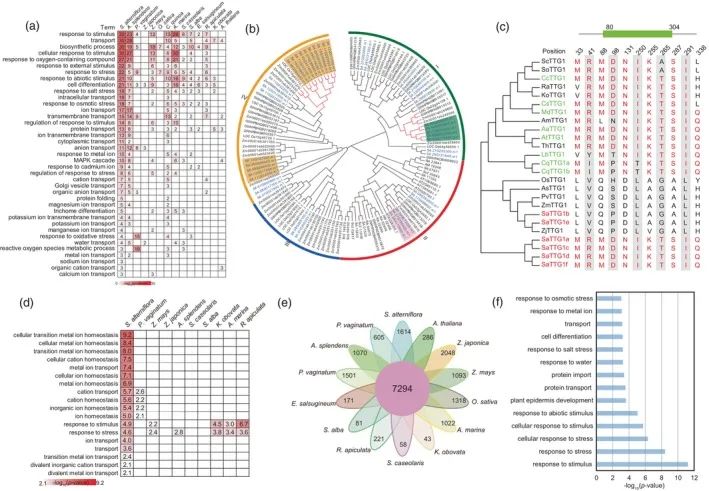
图3
5.转录组分析揭示的全基因组盐响应
为了筛选与互花米草对盐胁迫的响应,用从暴露于0、300或600 mM NaCl 48小时的整个幼苗提取的RNA进行RNA-seq分析。结果表明,用300或600 mM NaCl分别处理互花米草幼苗,这两个处理之间有2543个幼苗数据重叠。GO分析显示,这些上调的DEG富集在离子相关的生物学过程中,包括“离子结合”和“跨膜转运蛋白活性”(图4a)。相反,3451和10980 DEGs在300或600 mM NaCl处理下下调,其中2204个是两种策略共有的。这些下调的DEG的GO分析显示与光合作用相关的过程中的富集,包括“对光刺激的响应”、“叶绿素代谢过程”和“叶绿素生物合成过程”(图4b)。
上调DEG的KEGG分析显示,与“脂肪酸代谢”、“MAPK信号转导”、“自噬”和“植物激素信号转导”相关的途径富集(图4c)。由于脂肪酸(FA)为植物发育提供能量,但也产生大量的副产物活性氧(ROS),对植物细胞造成潜在的氧化损伤,因此,研究解释了在盐胁迫的互花米草通过清除活性氧促进植物耐盐性的可能机制此外,已知自噬通过根皮层细胞的中央液泡中的Na+螯合参与植物对盐胁迫的抗性。在互花米草基因组,34在盐胁迫后显著上调,表明盐胁迫可诱导自噬,并且在盐环境条件下自噬由不同的信号途径调节(表S14)。
脱落酸(ABA)是一种植物激素,其作为发育信号和作为环境刺激如盐的整合物。研究进一步分析了富含"植物激素信号转导"的DEG,发现了18个蛋白磷酸酶2C(PP2C)和5个丝氨酸/苏氨酸蛋白激酶2(SnRK2s),它们属于ABA信号通路;以及15个TF,包括7个碱性亮氨酸拉链(bZIPs)、6个JAZs和2个APETALA2s(AP2s)(图4d)。在ABA依赖性信号传导途径中,SnRK2成员作为信号传导的枢纽发挥作用,形成ABA-PYR(吡嗪抗性)-PP2C-SnRK2信号传导途径,以启动TF的磷酸化。已证明ABA-PYR-PP2C-SnRK2-bZIP信号通路在盐胁迫应答中发挥作用。在这些在盐胁迫中上调的bZIP中,顺式作用元件的分析显示,6个包含ABA响应元件(ABRE;具有ACGT核心基序),位于其启动子的2kb内(图4e),表明bZIP TF在ABA-PYR-PP2C-SnRK2途径的下游发挥作用,以增强互花米草对盐碱环境的适应性。此外,两个AP2(水稻ABI4的同源物)和六个JAZ基因也在盐胁迫下上调(图4d),并且它们在其启动子的2kb内也含有ABRE(图4e),这表明它们也可能在ABA途径的下游发挥功能。
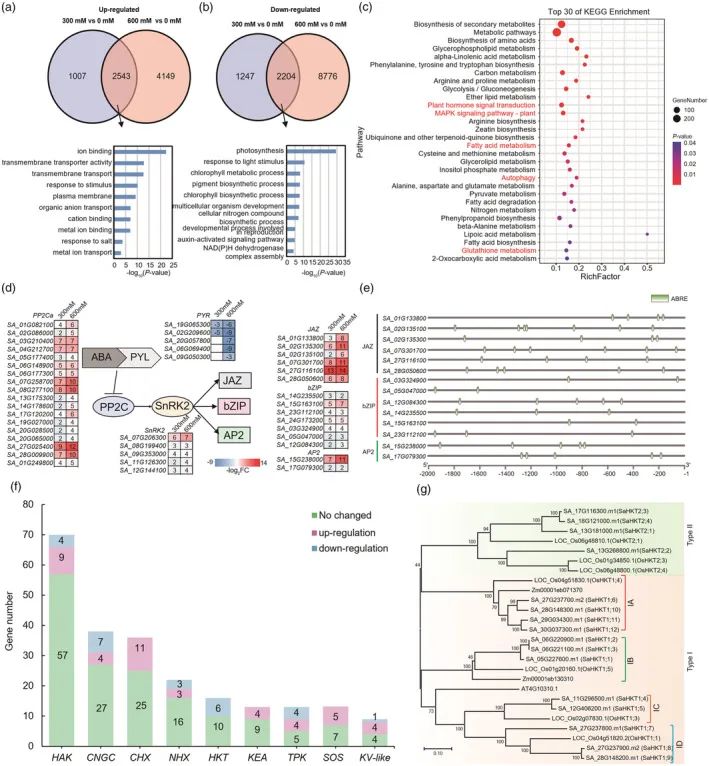
图4
6.互花米草对盐胁迫的响应
在植物中,离子转运蛋白对于维持离子内稳态和对环境刺激(如高盐)的响应至关重要。因此,研究了可能参与盐胁迫耐受性的离子转运蛋白基因。在盐处理的幼苗中,共有69个DEG被注释为离子转运蛋白表达上调(图4f和表S14),包括5个盐过度敏感基因(SOS)、11个环核苷酸门控通道(CNGC)、11个阳离子H+交换剂(CHX)、8个双孔K+通道(TPKs)、6个Na+/H+交换剂(NHX)、6个HKT、4个KEA,5个Kv和13个KUP/HAK/KT。其中,CHX、KEA和SOS只受到上调,而HKT则全部受到下调。
HKT通道在植物的Na+和K+摄取以及Na+-K+内稳态中起作用是很好确定的。因此,我们比较了互花米草基因组(下文称为SaHKT)与水稻、玉米和拟南芥中那些。系统发育分析表明,互花米草可以分为两个分支(I型和II型),这与以前的研究一致,基于它们的保守功能域,研究发现来自互花米草可进一步分为IA、IB、IC或ID组(图4g),每组从稻或玉米中的1个成员扩展到3-4个成员。其中4个IA成员与OsHKT 1;4聚在一起,而3个IA成员与OsHKT 1;1分组(图4g)。值得注意的是,3个Id型SaHKT位于27号染色体(SaHKT 1;7和SaHKT 1;8)和28号染色体(SaHKT 1;9)上,其中SaHKT 1;8和SaHKT 1;9基因对可能由片段重复事件形成。它们的表达谱的比较显示,这对SaHKT在盐胁迫下表现出相似的差异表达模式,它们都在转录中增加(表S14)。SaHKT 1;8是一种K+偏好性转运蛋白,尽管在此之前已知该家族中只有II型HKT表现出强的K+亲和力。相反,SaHKT 1;9仅显示Na+流出能力。
为了研究这些盐响应性SaHKT是否具有不同的调控机制,研究使用每个基因起始密码子上游的2-kb序列进行了成对和局部比对。该分析揭示了SaHKT 1;8和SaHKT 1;9上游的1.3 kb保守区(图S13),该保守区在所有其他SaHKT的2 kb上游区中不存在。在该保守区域中预测调控元件揭示了一个胁迫应答元件(STRE,CCCCT/AGGGG)基序。由于STRE-mediated的转录激活已经显示出赋予对各种应激的耐受性,推测这两种SaHKT可能受各自的STRE调控,从而调节盐胁迫下互花植物。此外,在我们先前的工作中进行的酵母中的互补测定显示I型成员SA_06G220900.m1(SaHKT 1;2)和SA_06G221100.m1(SaHKT 1;3)能够在低K+浓度下互补K+转运蛋白缺陷型酵母菌株R5421。
在以前的研究中,我们鉴定了SaHKT 2;4作为一种能够补充钾缺陷突变体并响应盐胁迫的基因。亚细胞定位显示SaHKT 2;4在血浆中表达(图5a)。为了评估其在盐胁迫抗性中的作用,研究人员在拟南芥中过表达SaHKT 2;4并选择两个转基因系用于进一步检查(图S14)。值得注意的是,在盐胁迫条件下,与野生型(WT)植物相比,转基因植物表现出上级盐耐受性(图5 b)。硝基蓝四唑(NBT)和3,30-二氨基联苯胺(DAB)染色测定证明,与转基因植物相比,WT植物受到盐胁迫的影响更严重,产生更高水平的活性氧物质(ROS)如O2和H2O2(图5c)。离子含量的分析显示,在盐胁迫下,转基因植物在叶中保持较低的Na+水平和较高的K+水平,导致Na+/K+比率降低(图5e-g)。此外,转基因植物在盐胁迫处理后表现出更高的叶绿素含量、过氧化物酶(POD)和过氧化氢酶(CAT)活性以及脯氨酸含量,同时表现出更低的丙二醛(MDA)含量(图5 h-l)。表达分析进一步表明,与盐胁迫下的WT植物相比,盐胁迫响应基因,包括AtPP 2CA、AtRD 29 A、AtRD 29 B、AtNCED 3、AtCAT和AtS 0 S1,在转基因株系中上调(图S15)。这些结果表明,在拟南芥中过量表达SaHKT 2;4增强盐胁迫抗性,并促进参与盐胁迫反应的基因的表达。
SOS途径由Na+/H+逆向转运蛋白(NHx)SOS1、CBL相互作用蛋白激酶(CIPK)SOS2和类钙调神经磷酸酶(CBL)家族蛋白SOS3组成,对通过调节Na+排斥来维持细胞离子稳态至关重要。我们在互花链霉菌基因组中共鉴定出14个NHXs、72个CIPKs和28个CBL,它们的成员都多于其他物种中各自的科。系统进化分析表明,互花链霉菌的NHx、CIPK和Cbl基因经过扩增(图S16和S17),鉴定出4个SOS1基因,包括SA_07G128500.m1(SaSOS1a)、SA_09G217800.m1(SaSOS1b)、SA_13G072600.m1(SaSOS1c)和SA_14G075200.m1(SaSOS1d);4个SOS2基因SA_05G305800.m1(SaSOS2a)、SA_06G271800.m1(SaSOS2b)、SA_13G230000.m1(SaSOS2c)和SA_14G231200.m1(SaSOS2d);4个SOS3基因,分别为SA_01G250900.m1(SaSOS3a)、SA_02G250600.m1(SaSOS3b)、SA_19G025440.m1(SaSOS3c)和SA_20G029900.m1(SaSOS3d)。与其他植物的比较表明,互花米草的每一个SOS基因的拷贝数都高于所检测的其他物种,代表了13个重复对(图S18)。对其表达模式的分析表明,SaSOS1d、SaSOS2c、SaSOS2d、SaSOS3a、SaSOS3b和SaSOS3d都在盐胁迫下上调(表S14),这表明在盐胁迫反应中,只有互花草才有功能作用,而其他物种的拷贝数较低。
在植物中,复制的基因通常会进化到失去原有功能或获得新功能,从而增强其适应性。先前的研究表明,各种非生物胁迫可能会对多样化的表达模式和扩大的反应施加正选择压力,以保留基因组中的重复基因。在本研究中,发现SOS重复对在盐胁迫下表现出不同的表达水平。例如,SaSOS 1c在盐胁迫下不表达,而其同源物SaSOS 1c、SaSOS 1d在盐胁迫下高表达。进一步分析表明,SaSOS 1d具有三个STRE顺式元件,而SaSOS 1c启动子区仅包含一个(图S19和S20)。
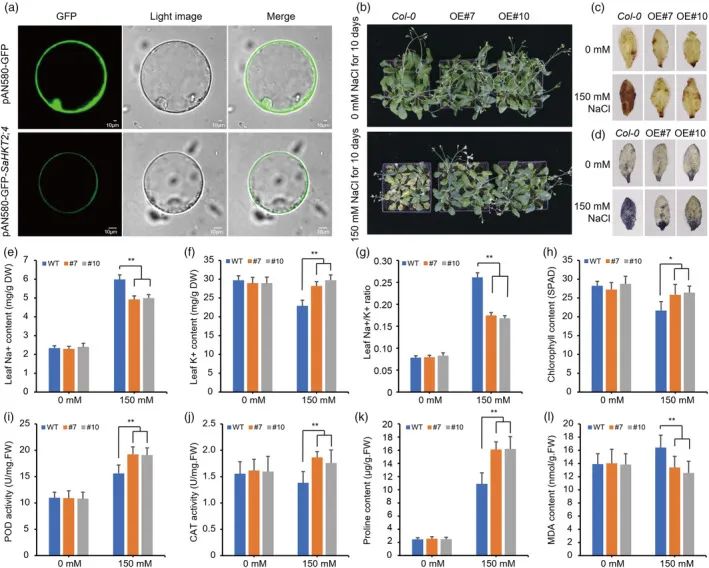
图5
7.互花米草中代谢产物谱和差异代谢途径对盐胁迫的响应
为了更深入地了解研究互花米草对盐环境的适应性,进行了全面的代谢组学和转录组学分析。代谢物组学分析表明,与未处理的样品相比,用300 mM或600 mM NaCl处理互花米草幼苗48 h的结果(图6a),包括脂质和脂质样分子(210)、苯丙素类和聚酮化合物(170)、有机杂环化合物(91)、有机酸和衍生物(88)、有机氧化合物(77)、苯并咪唑(68)和其他代谢物(77)。其中,142种为相对于未处理对照的差异丰度代谢物(DAM)(图6 b和表S15)。为了评估盐胁迫下DEG和DAM之间的相关性,对转录组和代谢组数据进行相关性分析,利用KEGG途径分析来鉴定重叠富集的途径。该分析旨在阐明互花米草的耐盐机制KEGG分析显示,这些DAM在色氨酸代谢、谷胱甘肽代谢、氨酰-tRNA生物合成和玉米素生物合成中高度富集(图6c)。
谷胱甘肽(GSH; c-谷氨酰-半胱氨酰-甘氨酸),一种低分子量硫醇,是参与植物抗氧化防御的主要代谢物之一。注意到谷胱甘肽代谢途径在上调的DEG和DAM中高度富集(图4c和6c),回顾转录组学数据,以检查参与谷胱甘肽代谢的DEG(图6d)。GSH生物合成途径涉及从氨基酸开始的两个ATP依赖性步骤,其中第一个步骤是由L-谷氨酸和L-半胱氨酸在c-谷氨酰半胱氨酸合成酶(c-ECS,EC www.example.com; GSH1)的催化下形成c-谷氨酰半胱氨酸,而第二个步骤涉及由谷胱甘肽合成酶(GSH-S,EC 6.3.2.2; GSH2)催化的甘氨酸和c-谷氨酰半胱氨酸的缩合。结果表明,在盐胁迫下,互花米草GSH-S的表达上调,而GSH-S的表达下调。GSH是谷胱甘肽过氧化物酶(GPX)和谷胱甘肽-S-转移酶(GST)反应的底物。结果表明,GPX在600 mM NaCl处理下表达上调,6个GST在NaCl处理下表达上调,9个GST在NaCl处理下表达下调。此外,研究发现6种植物螯合素合酶(PCS),其催化螯合肽的合成,在盐胁迫条件下上调表达,其中20个PCS基因在盐胁迫下表达下调。研究选择了5个在300 mM和600 mM NaCl浓度下均上调的基因用于进一步研究,包括1个c-ECS(SA_02G264000)、3个GST(SA_04G150100、SA_05G096400和SA_18G100200)和1个PCS基因(SA_03G330800),这些与谷胱甘肽代谢相关的基因受盐胁迫的高度调控。
在用300mM和600mM NaCl处理后,在两种比较(300mM对0mM和600mM对0mM)中鉴定了属于43个家族的435个转录因子(TF)的共同组。这些差异表达的TF主要编码MYB、ERF、NAC和WRKY TF(图S21和表S16),表明它们可能参与了拟南芥的耐盐响应。随后,为了探索谷胱甘肽代谢基因与TF之间得关系,研究进行了共表达聚类分析,将其分为8个簇(图S22)。该分析揭示了谷胱甘肽代谢基因与TF之间的密切关联。研究进一步分析了一个c-ECS的上游2000 bp的启动子结合位点,(SA_02G264000),3个GST(SA_04G150100、SA_05G096400和SA_18G100200)和一个PCS基因(SA_03G330800),结果显示在这五个谷胱甘肽代谢基因的上游启动子中有许多TF的结合位点(图6 e),bZIP、WRKY、MYB和bHLH TF的结合位点特别富集。使用log 2(倍数变化)>1和FPKM >5的标准,将焦点缩小到属于bZIP、WRKY、MYB和bHLH家族的七个TF。定量实时PCR(qRT-PCR)证实,这七个TF基因的转录水平随着盐浓度的增加而显著增加(图6 f),表明它们积极参与了互花米草对盐胁迫的反应。
讨论与结论
盐胁迫严重地影响植物生长和生物量生产,并且众所周知高盐度诱导植物中的生理和生化变化。在以前的研究人员进行的基因组研究中,他们提供了新的表型和基因组证据来证明互花米草在其引入的范围内迅速适应可变的环境条件。互花米草(Alterniflora)是禾本科(Poaceae)的一种外生殖盐生植物,能在高盐环境中生存,这就提出了一个问题:互花米草是如何适应和生存在高盐环境中的,而这是大多数其他植物所不可能做到的,先前的研究对此问题没有给出满意的解释。为了阐明海盘车适应和耐受高盐胁迫的机制。互花米草测序并组装了一个高质量的S.互花植物。通过整合基因组学、转录组学、代谢组学和比较基因组学分析,研究发现一组物种特异性的、显著扩展的和正选择的基因赋予了互花米草具有耐盐性,其耐盐性强于其他盐生植物。此外,这些分析还鉴定了几个离子转运蛋白基因,包括HKT和SOS,它们对S.互花米草以及盐响应性谷胱甘肽代谢。以上结果表明,S.互花米草可能已经进化出一些关键特征,这些特征可以作为作物遗传改良的重要资源。
综上所述,本研究构建了一个互花米草高质量的通过结合PacBio HiFi,Hi-C和转录组学分析的基因组,为互花米草的遗传研究,可以促进各种性状的遗传作图,特别是耐盐性,基因组结构、基因注释和基因表达的详细信息也可以指导具有改良耐盐性的作物的分子育种。
高颜值免费 SCI 在线绘图(点击图片直达)
最全植物基因组数据库IMP (点击图片直达)
往期精品(点击图片直达文字对应教程)























































 1万+
1万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








