小罗碎碎念
这一期分享的文章稍微早一点,已经发表三年了,是昨天分享的文章中引用的一篇参考文献。

本期推荐的文章是《Computed tomography-based radiomic model predicts radiological response following stereotactic body radiation therapy in early-stage non-small-cell lung cancer and pulmonary oligo-metastases》,作者是 Ben Man Fei Cheung 等人,发表在《Radiat Oncol J》2021年第39卷第4期上。
文章概述
本研究旨在确定接受立体定向放射治疗 (SBRT) 治疗的早期非小细胞肺癌 (NSCLC) 或肺寡转移患者治疗反应的预测因子,并开发机器学习模型来预测对 SBRT 的放射学反应。
该分析包括 69 名接受胸部 SBRT 治疗的患者,并使用从 CT 图像中提取的影像组学特征来开发支持向量机 (SVM) 模型。
主要发现包括偏度和均方根作为对 SBRT 反应的影像组学预测因子,SVM 模型的准确率为 74.8%。完全缓解(CR)、部分缓解(PR)和无反应预测的曲线下面积分别为0.86、0.946和0.857。该研究得出的结论是,治疗前 CT 扫描的影像组学分析可以成为预测肿瘤对 SBRT 反应的宝贵工具。
要点速览
- 影像组学模型从成像中提取肿瘤的几何和纹理特征,以预测临床结果
- 研究重点是早期NSCLC和SBRT治疗的肺寡转移
- 使用
PyRadiomics从CT图像中提取110个影像组学特征 偏度和均方根被确定为对 SBRT 反应的预测因子- SVM 机器学习模型的准确率达到 74.8%
- CR、PR 和无应答者预测的曲线下面积分别为 0.86、0.946 和 0.857
一、绪论
胸廓立体定向体部放疗(SBRT)被应用于多种情况,包括早期和转移性肺癌,以及其他肿瘤的胸腔寡转移灶,与常规放疗相比,它可以提供更好的局部控制效果[1-3]。然而,近期的一些经验报告显示,胸腔SBRT后的病理完全反应(CR)率约为60%,低于之前的估计[4]。此外,尽管SBRT的毒性特征通常较好,但它并非没有副作用,包括肺炎、气道、血管和胸壁并发症[5,6]。因此,预测对胸腔SBRT有反应的患者,可以合理选择患者,优化风险/效益比。
多项研究已经开发了预测早期和寡转移癌症患者接受胸腔SBRT后临床结果的模型。这些研究主要基于临床或传统放射学参数。例如,在早期原发性肺癌中,肿瘤大小被发现是一个强烈的反应预测因子[7]。Tanadini-Lang等人[8]开发了一个预测寡转移癌症患者接受SBRT后两年总生存率的列线图。该列线图根据原发肿瘤、Karnofsky指数、原发肿瘤控制情况、转移灶数量和肿瘤直径预测生存率,符合指数为0.73。研究发现,如表现状态、原发肿瘤部位、转移灶大小和数量等因素在预后中起着重要作用。例如,转移性非小细胞肺癌(NSCLC)或黑色素瘤的预后比其他组织学类型差[8]。另一方面,转移灶较小、孤立性转移灶和良好的表现状态与较好的预后相关[9]。
尽管有了显著的进步,但为了准确告知治疗决策,还需要进一步提高预测性能。除了临床特征,复杂的放射学特征被认为具有预后价值。随着放射组学的出现,可以使用数学算法从计算机断层扫描(CT)、磁共振成像(MRI)或正电子发射断层扫描(PET)图像中提取肿瘤的文本特征。提取的特征允许全面描述病变的放射学外观,识别肉眼看不见的特征。放射组学特征可能捕获与肿瘤侵袭性、异质性、转移倾向和对治疗的反应相关的综合肿瘤特征集[10]。
随着SBRT在早期NSCLC和胸腔寡转移灶中的应用增加,基于放射组学特征的增强预测模型可以帮助区分治疗反应性和非反应性肿瘤。此外,这样的模型可以开发为普遍适用,无论肿瘤组织学类型、原发部位或分期如何。因此,我们计划进行这项分析,以识别可以预测SBRT后放射学反应的预测性普遍放射组学特征。我们还提出了一个基于放射组学特征的机器学习模型,以预测SBRT后的放射学反应,无论组织学、原发部位和分期如何。
二、材料与方法
2-1:患者筛选
本研究回顾性分析了2008年1月至2018年12月间接受使用主动呼吸控制(ABC)技术的胸廓SBRT的患者。研究获得了香港大学/医院管理局香港西区(HKU/HA HKW)机构审查委员会(编号:UW 16-522)的批准。
纳入标准
- I期非小细胞肺癌(即美国联合委员会分期T1-2N0M0)
- 肺寡转移瘤
- 其原发肿瘤已手术切除
- 肺部转移灶少于5个,并且全身控制稳定。
排除标准
无法耐受ABC技术所需的屏气,以及Timmerman等人[11]定义的禁飞区内的胸廓肿瘤或与纵隔/胸壁结构重叠的肿瘤。
选择上述标准是为了避免使放射组学文本特征解释不准确的混淆因素,如过度转移的肿瘤、接受替代SBRT剂量方案的肿瘤和与其他结构重叠的肿瘤。
共有69名患者被招募。所有患者接受了相当于BED10>100 Gy的45-60 Gy,分3-5次在隔天进行。
患者的临床参数总结
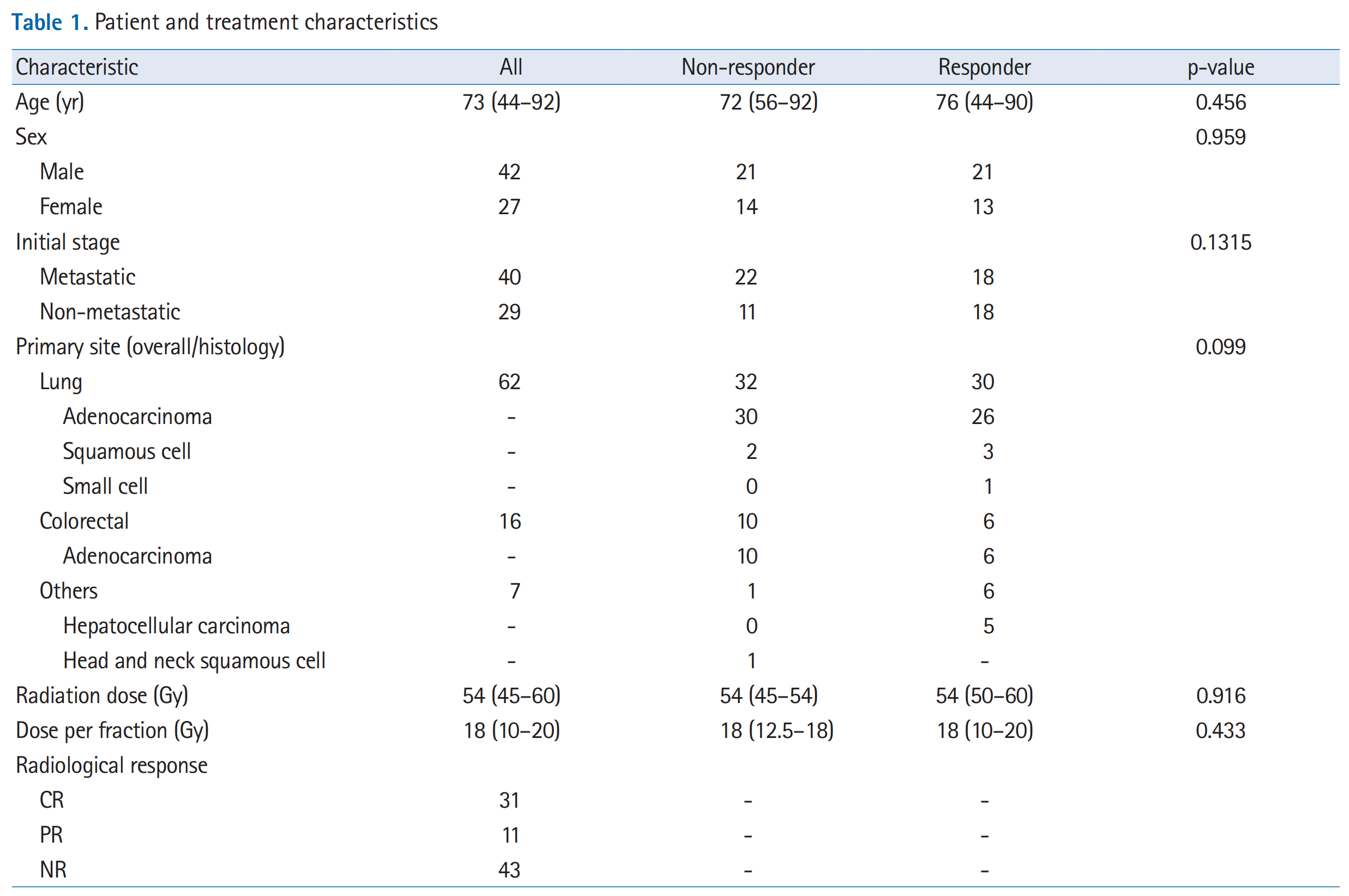
表1 “Patient and treatment characteristics” 提供了参与研究的患者和治疗特征的详细统计数据。
以下是对表中内容的分析:
-
患者年龄(Age):
- 所有患者的中位年龄为73岁,年龄范围从44岁到92岁。
-
性别(Sex):
- 42名男性和27名女性患者。
-
初始阶段(Initial stage):
- 40名患者为转移性疾病,29名患者为非转移性疾病。
-
原发肿瘤部位和组织类型(Primary site and histology):
- 62个肿瘤位于肺部,其中大部分(30个)为腺癌,还有少数为鳞状细胞癌(2个)、小细胞癌(1个)。
- 14个肿瘤为胸外转移瘤,其中10个为腺癌。
-
放射治疗剂量(Radiation dose):
- 所有患者接受的放射治疗剂量范围为45至60 Gy。
-
每次分割剂量(Dose per fraction):
- 分割剂量范围为10至20 Gy。
-
放射学反应(Radiological response):
- 31个肿瘤达到了完全反应(CR),11个肿瘤达到了部分反应(PR),43个肿瘤未达到反应(NR)。
表中还包含了统计学上对响应者和非响应者之间差异的检验结果(p-value),例如性别(Sex)、初始阶段(Initial stage)、原发肿瘤部位和组织类型(Primary site and histology)、放射治疗剂量(Radiation dose)和每次分割剂量(Dose per fraction)等特征在响应者和非响应者之间没有显著差异(p-value > 0.05),表明这些特征与治疗反应之间没有统计学上的显著关联。
这些数据对于理解患者的基线特征和它们与治疗反应之间的关系非常重要。此外,这些信息还可以帮助未来的研究者设计更精确的临床试验,并可能有助于开发个性化的治疗策略。
患者的呼吸通过使用改良呼吸计和闭锁阀的ABC技术进行主动控制。在预定义的肺容积下关闭两个阀门,呼吸在辐射束开启时保持在20秒的确定和稳定扩张。然后允许患者自由呼吸,直到下一个ABC周期。CT模拟使用3毫米的切片厚度进行。
治疗计划使用Eclipse放射治疗计划系统(Varian Medical Systems,Palo Alto,CA,USA)进行。使用宽度为1,600,水平为-600的肺窗描绘大体肿瘤体积(GTV)。计划靶体积(PTV)定义为GTV加5毫米边缘。在PTV的80%-90%等剂量水平上,每份处方10-20 Gy,总计45-60 Gy,分3-5次在2周内完成。处方剂量必须覆盖PTV的95%,PTV的99%接受>90%的处方剂量。每 次分割前和治疗中心与CT图像上的肿瘤中心进行比较,以验证治疗等中心。
2-2:结局评估
研究的主要结局是
局部放射学反应
- 放射学完全缓解(CR)
- 部分缓解(PR)
- 稳定疾病(SD)
- 进展性疾病(PD)
其他结局
- 局部区域失败
- 远处转移
- 总生存期(生存时间从初次照射时开始计算)
在我们三级机构中,所有患者在第一年每隔3个月,从第二年开始每隔6个月进行一次常规胸部CT增强扫描。此外,可以根据临床医生的判断进行PET/CT扫描。
肿瘤反应由独立的高级放射科医生根据实体肿瘤反应评估标准(RECIST)1.1版和Green’s标准进行评估[12]。将SBRT后稳定或进展性疾病的患者分为非应答者,而CR和PR的患者分为应答者。整个随访期间,每个反应类别都使用整个随访期间达到的最佳反应进行分析。
PTV内的疾病进展定义为局部复发。局部区域复发定义为肺部和/或区域淋巴结的复发。远处转移是根据诊断时的阶段具体定义的。对于早期肺癌,它定义为远处器官或淋巴结的病变发展。对于转移性恶性肿瘤,它定义为在SBRT之前疾病原始范围之外的新转移的发展。患者定期至少每3个月进行一次审查,并在新的随访成像可用时也进行审查。
2-3:放射组学和统计分析
使用3D-Slicer软件对勾画的CT进行了分析。CT的体素间距被标准化为1毫米×1毫米×1毫米。对图像应用了25 HU(亨斯菲尔德单位)的 bin 宽度以进行放射组学特征提取。
使用PyRadiomics模块提取了GTV的110个放射组学特征,包括形状、统计和文本特征(补充表S1)。
随后使用MATLAB R2020a(MathWorks Inc.,Natick,MA,USA)中开发的内部软件对这些特征进行了分析
为了确定预测非应答者的特征,计算了每个放射组学特征的受试者操作特征(ROC)曲线,以区分非应答者(SD和PD)和应答者(PR和CR)。计算了每个ROC曲线下的面积(AUC)。使用z检验对AUC值的显著性进行了评估,并通过Bonferroni调整对多重测试进行了调整[14]。还进行了Cox回归分析,以阐明影响总生存期的临床因素。
根据TRIPOD声明,使用支持向量机(SVM)模型根据提取的放射组学特征预测治疗反应。该模型的目的是将患者的放射学反应分类为三个类别,即非应答者(PD和SD)、PR和CR。
在本研究中,NR患者的数量超过了PR和CR患者。由于反应分组不平衡,使用了自适应合成采样方法(ADASYN)对少数类别(PR和CR)进行上采样,以提高模型性能。
知识点补充:自适应合成采样方法
自适应合成采样方法(ADASYN,Adaptive Synthetic Sampling Approach)是一种用于处理不平衡数据集的统计技术,特别是在少数类别的样本数量相对较少时。在机器学习和数据挖掘领域,ADASYN用于增强或平衡数据集中的少数类别,以便更准确地训练模型并提高对少数类别的预测能力。
以下是ADASYN方法的关键特点和步骤:
-
问题识别:
- 确定数据集中哪些类别是少数类别(即样本数量较少的类别),哪些是多数类别。
-
合成数据生成:
- ADASYN通过合成新样本来增加少数类别的数量。这些合成样本不是简单地复制现有样本,而是通过某种方式生成的,以保持原有数据的统计特性。
-
适应性(Adaptiveness):
- 该方法的“自适应”特性意味着合成样本的过程会考虑到数据集中的局部密度。ADASYN倾向于在数据密度较低的区域生成更多的样本,以此来填补数据空间中的空白。
-
合成样本的生成:
- 通常,合成样本是通过从现有少数类别样本中随机选择一个样本,然后根据该样本的邻域生成新样本来进行的。这个过程可以通过多种方式实现,例如使用核密度估计或其他统计技术。
-
保持数据分布:
- ADASYN旨在生成与原始少数类别数据相似分布的合成样本,而不是改变数据的原始分布。
-
模型训练与验证:
- 使用经过ADASYN处理后的数据集来训练机器学习模型,并通过交叉验证等方法来评估模型的性能。
ADASYN的应用可以帮助提高模型对于少数类别的识别能力,尤其是在数据不平衡的情况下。在医学研究、欺诈检测、罕见事件预测等领域,ADASYN和其他过采样技术是非常重要的工具。
在文章中,ADASYN用于处理放射组学特征和治疗反应之间的不平衡数据集,以便更准确地训练支持向量机(SVM)模型来预测立体定向体放射治疗(SBRT)的放射学反应。通过增加响应者(CR和PR)的样本数量,ADASYN帮助模型更好地学习并区分不同的治疗反应类别。
在训练SVM模型时,包括了所有提取的放射组学特征,而没有进行先前的选择,以防止偏差。没有包括临床参数,以评估模型仅基于放射组学特征预测反应的能力。
在这项研究中,使用了高斯SVM,并采用了逐一分类技术和套索正则化。在训练过程中,使用贝叶斯优化优化了超参数,如box约束水平和核尺度。选择最佳表现模型的超参数。由于放射组学特征高度相关且有时冗余,因此采用了套索正则化。
知识点补充:套索正则化
套索正则化(Lasso regularization),在统计学和机器学习中,是一种用于防止模型过拟合的技术,它通过在损失函数中添加一个正则化项来实现。这个正则化项是模型系数的绝对值之和。Lasso正则化在处理具有大量特征的数据集时特别有用,因为它可以减少不重要的特征系数,甚至将它们压缩至零。
以下是套索正则化的详细解释:
-
损失函数(Loss Function):
- 在机器学习中,损失函数衡量的是模型预测值与实际值之间的差异。模型训练的目标是最小化损失函数。
-
正则化项(Regularization Term):
- 正则化是损失函数之外额外添加的一个项,目的是惩罚大的模型系数。在Lasso正则化中,这个正则化项是模型系数的绝对值之和。
-
Lasso正则化表达式:
-
Lasso正则化的公式通常写作:
Ω ( f ) = λ ∑ ∣ w i ∣ \Omega(f) = \lambda \sum |w_i| Ω(f)=λ∑∣wi∣ -
其中 $\Omega(f) 是正则化项, 是正则化项, 是正则化项, w i w_i wi 是模型的系数, 是模型的系数, 是模型的系数,\lambda$ 是正则化参数(也称为惩罚系数),控制正则化项的强度。
-
-
系数压缩:
- 当 λ \lambda λ增大时,正则化项的权重增加,这会促使模型系数 ( w i w_i wi ) 减小。如果 w i w_i wi 的绝对值被压缩至零,那么相应的特征在模型中的作用就被完全排除了。
-
特征选择(Feature Selection):
- Lasso正则化可以作为一种特征选择方法,因为它能够将不重要的特征系数压缩至零,从而实现特征的自动选择。
-
模型复杂度控制:
- Lasso正则化有助于控制模型的复杂度,减少过拟合的风险,特别是在面对特征数量多于样本数量的情况时。
-
优化算法:
- 包含Lasso正则化的模型通常需要特殊的优化算法来求解,因为正则化项是非光滑的。
-
与岭正则化(Ridge Regularization)的区别:
- 与Lasso不同,岭正则化采用系数的平方和作为正则化项,它倾向于让所有系数均匀地小,而不是将它们压缩至零。
在机器学习模型中,如支持向量机(SVM)或其他算法,Lasso正则化可以提高模型的泛化能力,尤其是在面对高维数据时。在医学、金融和生物信息学等领域,Lasso正则化因其特征选择能力而被广泛应用。在上文提到的研究中,Lasso正则化被用于优化SVM模型,以提高对立体定向体放射治疗(SBRT)反应的预测准确性。
在训练过程中,计算了不同特征的权重系数。因此,重要性较高的特征对最终模型的贡献较大,而冗余和噪声特征对最终模型的影响较小。为了避免SVM模型的过拟合,限制了模型对外部数据集的泛化能力,因此使用了10折交叉验证进行内部验证。使用 bootstrap 重采样1,000次构建了ROC曲线。使用AUC来评估模型性能。
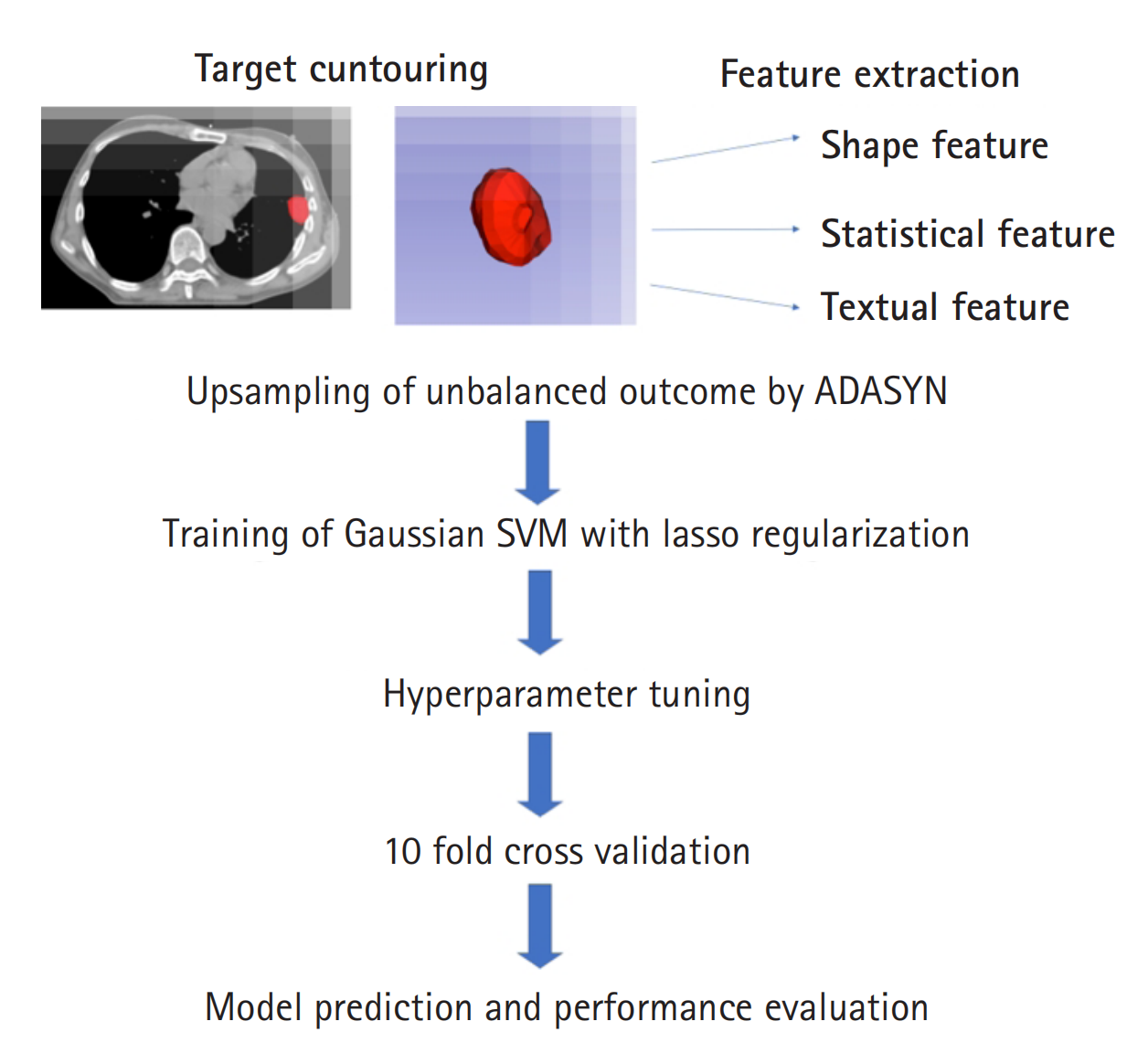
模型训练的示意图在图1中呈现
图1描述了当前研究中放射组学工作流程的各个步骤。
以下是对图中描述的流程的分析:
-
肿瘤轮廓提取(Target contouring):
- 首先,使用CT图像对肿瘤进行轮廓提取,定义出肿瘤的边界,这是后续放射组学特征提取的基础。
-
放射组学特征提取(Feature extraction):
- 利用
PyRadiomics模块从已轮廓化的肿瘤中提取放射组学特征。这些特征包括形状(Shape)、统计(Statistical)和纹理(Textural)特征。
- 利用
-
数据不平衡处理(Upsampling of under-represented population):
- 由于完全反应(CR)和部分反应(PR)的患者数量较少,使用自适应合成采样方法(ADASYN)对这些少数类别进行
上采样,以平衡数据集。
- 由于完全反应(CR)和部分反应(PR)的患者数量较少,使用自适应合成采样方法(ADASYN)对这些少数类别进行
-
机器学习模型训练(Training of Gaussian SVM):
- 使用支持向量机(SVM)作为机器学习模型,特别是采用高斯核函数的SVM。模型训练时采用
Lasso正则化来防止过拟合。
- 使用支持向量机(SVM)作为机器学习模型,特别是采用高斯核函数的SVM。模型训练时采用
-
超参数优化(Hyperparameter tuning):
- 通过
贝叶斯优化(Bayesian optimization)方法来调整和选择模型的最佳超参数,如正则化参数、核函数的尺度等。
- 通过
-
内部验证(Internal validation):
- 为了评估模型的泛化能力,采用
10折交叉验证(10-fold cross-validation)的方法对模型进行内部验证。
- 为了评估模型的泛化能力,采用
-
模型性能评估(Performance evaluation):
- 在交叉验证的基础上,使用接收者操作特征曲线(ROC)和其他统计方法来评估模型的性能。
-
结果预测(Prediction generation):
- 使用训练好的SVM模型对新数据进行预测,生成对肿瘤放射学反应的预测结果。
整个流程展示了从数据预处理到特征提取、模型训练与优化、内部验证,最终到性能评估和结果预测的完整过程。这种系统化的方法有助于开发出准确、可靠的放射组学模型,以预测肿瘤对SBRT的反应。
使用统计软件包SPSS 25.0(IBM,Armonk,NY,USA)进行统计分析。使用t检验对连续变量进行显著性检验,使用卡方检验对分类变量进行显著性检验。使用对数秩检验进行单变量分析。p值小于0.05被认为具有统计学意义。
三、结果
3-1:临床特征
总共招募了69名患者,这些患者从2008年到2018年间接受了胸廓立体定向体部放疗(SBRT)。中位年龄为73岁(范围,44至92岁)。其中42名患者为男性,27名患者为女性。在69名患者中,55名患者有肺部原发肿瘤,而14名患者有来自其他肿瘤的胸腔寡转移灶。对于55名有肺部原发肿瘤的患者,29名患者患有非转移性肺癌,而26名患者患有转移性肺癌。总的来说,40名患者患有转移性疾病,而29名患者患有非转移性疾病。
由于一些患者接受了多个照射肿瘤的治疗,总共分析了85个病变,其中:
- 31个达到完全缓解(CR)
- 11个达到部分缓解(PR)
- 43个肿瘤为非应答者(NR)。
由于85个病变中有43个为非应答者,因此客观缓解率低于之前的研究报道[11]。
大多数非胸腔恶性肿瘤起源于结直肠(16个肿瘤)。其他非胸腔疾病包括肝细胞癌、头颈癌和食管癌。在组织学上,大多数肿瘤由腺癌组成(72个肿瘤),其余为鳞状细胞癌(n = 7)、肝细胞癌(n = 5)和小细胞癌(n = 1)。
- 中位随访时间为50.5个月(范围,1至132个月)。
- SBRT后的中位总生存期为32个月(范围,1至132个月;置信区间[CI],24.72–39.28)。
- 中位局部失败无生存期(LFS)为31个月(范围,1至132个月;CI,23.6–38.4)。
- 中位局部区域失败无生存期(LRFS)为22个月(范围,1至132个月;CI,14.46–29.54)。
- 3年的局部控制率为87.15%,而5年的局部控制率为80.12%。
- 中位远处转移无生存期(DMFS)为18个月(范围,1至132个月;CI,10.46–25.54)。
对于非小细胞肺癌(NSCLC)患者,总生存期为38个月(范围,1至132个月;CI,29.7–46.3),LFS为37个月(范围,1至132个月;CI,29.3–45.9),LRFS为36个月(范围,1至132个月;CI,28.1–45.2),DMFS为35个月(范围,1至132个月;CI,27.1–44.2)。
进一步将患者细分为转移性肺癌和非转移性肺癌。
对于转移性肺癌患者
OS为45个月(范围,9至116个月;CI,33–65),LFS为36个月(范围,9至116个月;CI,29–62),LRFS为36个月(范围,9至116个月;CI,29–62),DMFS为36个月(范围,9至116个月;CI,29–62)。
对于非转移性肺癌患者
OS为33个月(范围,1至132个月;CI,35–62),LFS为33个月(范围,1至132个月;CI,35–62),LRFS为33个月(范围,1至132个月;CI,35–62),DMFS为33个月(范围,1至132个月;CI,35–62)。
对于非NSCLC患者,OS为48个月(范围,13至116个月;CI,32.6–67.3),LFS为36个月(范围,9至116个月;CI,27.8–63.7),LRFS为36个月(范围,9至116个月;CI,27.8–63.7),DMFS为30个月(范围,13至116个月;CI,14.4–45.6)。
对于SBRT的应答者和非应答者,中位总生存期分别为47个月(范围,9至132个月;CI,36.3–57.3)和33个月(范围,1至93个月;CI,23.93–42.07),显示出应答者相对于非应答者有改善生存的趋势(p = 0.059)。
多变量Cox回归分析确认了应答者相对于非应答者有改善总生存的趋势(p = 0.062)。对于其他临床特征,没有发现与总生存显著相关的证据(表2)。
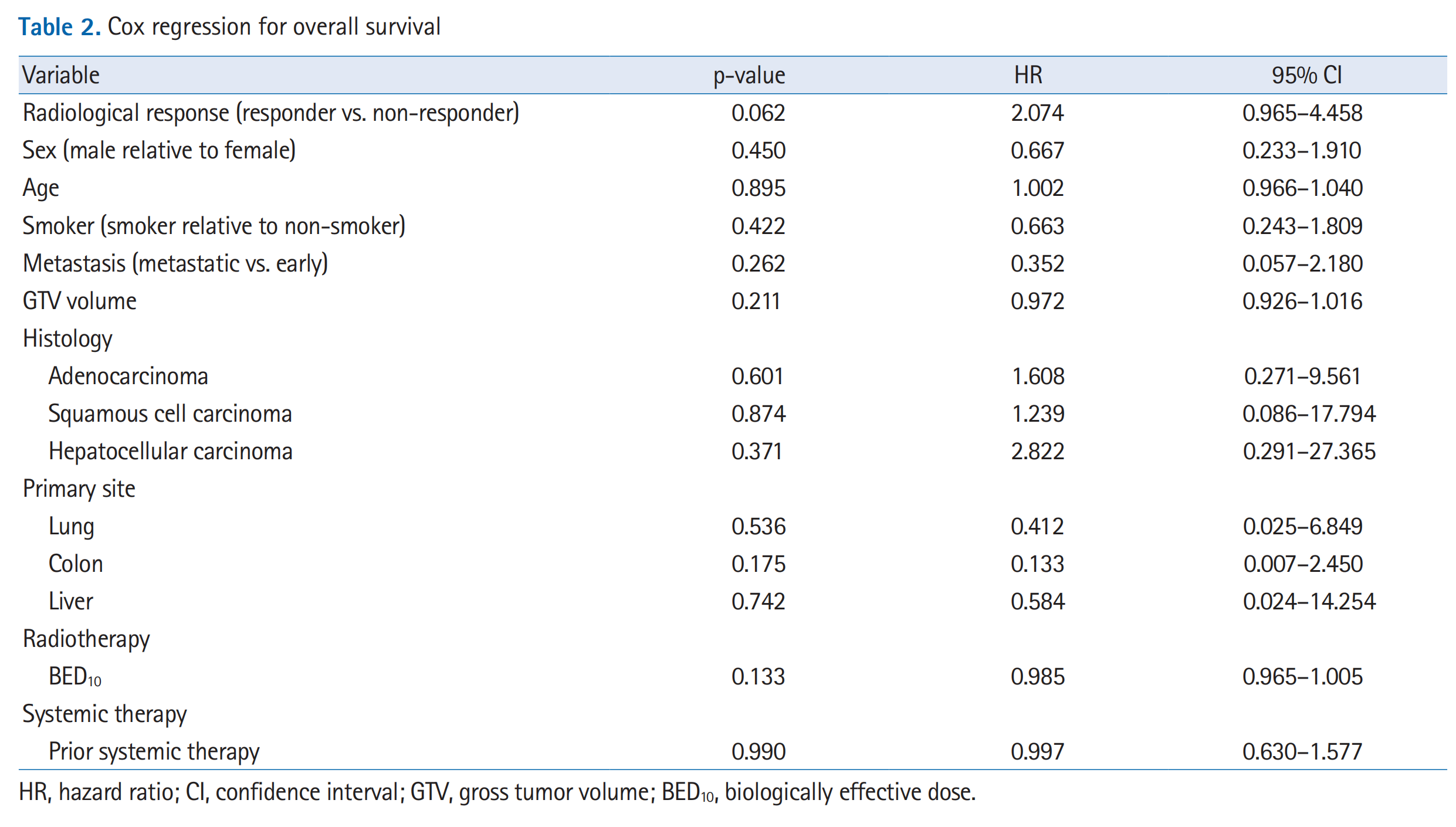
表2 “Cox regression for overall survival” 展示了使用Cox比例风险模型分析不同变量对于整体生存率(Overall Survival, OS)的影响。Cox回归是一种统计技术,用于评估多个协变量对生存时间的影响。
以下是对表中内容的分析:
-
变量(Variable):
- 列出了影响整体生存率的候选变量。
-
p-value:
- 显示了每个变量在Cox回归模型中的统计显著性。p值小于0.05(通常用0.05作为阈值)通常被认为是统计学上显著的。
-
风险比(Hazard Ratio, HR):
- 风险比是Cox回归模型中估计的参数,用于衡量每个变量对生存时间的影响。HR值大于1表示与参考组相比,该变量与更高的风险(即更短的生存时间)相关;HR值小于1表示与更低的风险相关。
-
95%置信区间(95% Confidence Interval, CI):
- 给出了HR的95%置信区间,表示如果多次重复研究,95%的结果会落在这个区间内。如果置信区间包含1,则该变量的效应可能没有统计学上的显著性。
在表2中,研究者特别关注了以下几个变量:
- 放射学反应(Radiological response):将放射学反应者(CR和PR)与非反应者(NR)进行了比较。p值为0.062,接近0.05,表明放射学反应可能与整体生存率有显著相关性。
其他变量,如性别(Sex)、年龄(Age)、吸烟状况(Smoker)、转移状态(Metastasis)、肿瘤体积(GTV volume)、组织学类型(Histology)、原发肿瘤部位(Primary site)、生物学等效剂量(Radiotherapy BED10)、以及先前系统治疗(Systemic therapy)等,它们的p值均大于0.05,表明在这项研究中,这些变量与整体生存率没有统计学上的显著关联。
值得注意的是,由于样本量较小,一些可能影响生存率的变量可能没有显示出统计学上的显著性。此外,Cox回归模型的解释需要考虑所有变量的多重比较问题,通常使用如Bonferroni校正等方法来调整p值。
表2的结果对于临床决策具有重要意义,因为它提供了关于哪些因素可能对NSCLC患者接受SBRT后的整体生存率有影响的证据。
3-2:放射组学特征
首先,我们通过单变量分析确定可以预测SBRT反应的放射组学特征。肿瘤被分为非应答者(SD和PD)和应答者(CR和PR)。构建ROC曲线以预测肿瘤反应。
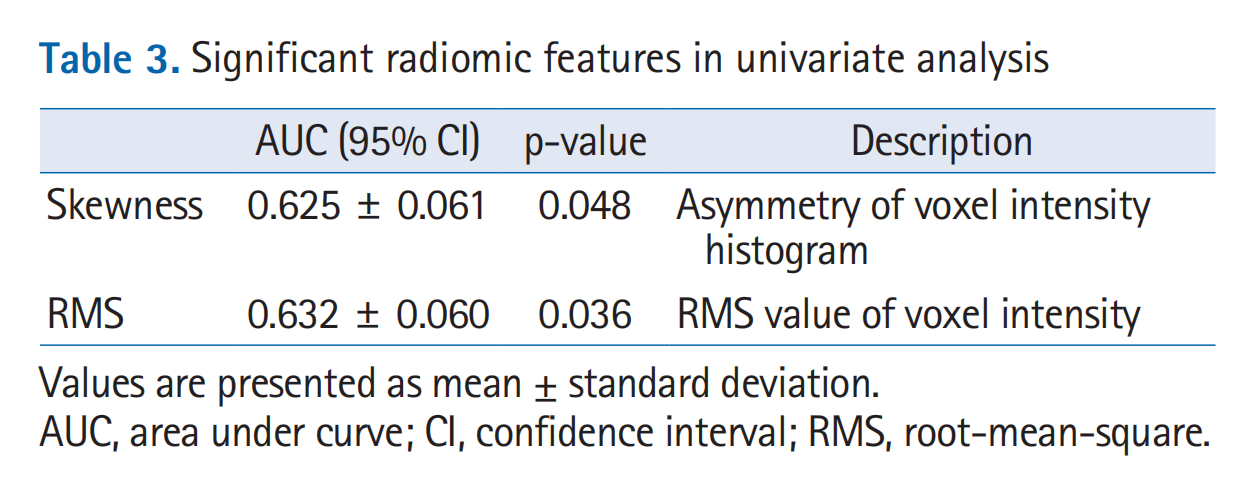
在110个放射组学特征中,偏度和均方根(RMS)被确定为SBRT非应答的统计学显著标志(AUC,0.619–0.629;p < 0.05)(表3)。
这两个特征都是一阶统计特征,描述了体素强度的统计分布。偏度是描述感兴趣区域内体素强度偏斜分布的统计特征。正偏度表示在体素强度直方图上,均值右侧延伸出一条长尾巴。RMS指的是感兴趣区域内体素强度的均方根(表3)。所有临床参数均无法预测治疗反应(p > 0.05)。
表3 “Significant radiomic features in univariate analysis” 展示了在单变量分析中具有统计学意义的放射组学特征。这些特征是从110个提取的放射组学特征中筛选出来的,它们与立体定向体放射治疗(SBRT)的非响应者(NR)有关。
以下是对表中内容的分析:
-
AUC (Area Under Curve):
- AUC是指接收者操作特征曲线(ROC Curve)下的面积,用于衡量特征对于分类问题区分能力的统计量。AUC值的范围是0到1,值越大,表示该特征的区分能力越好。在表3中,AUC值用于评估每个放射组学特征在区分响应者和非响应者时的表现。
-
p-value:
- p值用于检验统计假设,即该特征与治疗响应之间没有关联的零假设。p值小于0.05通常表示该特征与治疗响应之间存在统计学上的显著关联。
-
特征描述(Description):
- 表中列出了每个显著特征的描述,说明了它们代表的影像组学特征类型。
在表3中,特别提到了以下两个显著的放射组学特征:
-
Skewness:
- AUC值为0.625,p值为0.048,表示偏度(Skewness)是预测SBRT非响应者的统计学显著特征。偏度是描述感兴趣区域内体素强度分布不对称性的统计特征。
-
RMS (Root-Mean-Square):
- AUC值为0.632,p值为0.036,表示均方根(RMS)也是预测SBRT非响应者的统计学显著特征。RMS指的是感兴趣区域内体素强度的均方根值。
这些特征的统计学显著性表明,它们可能与肿瘤对SBRT的反应有关。在放射组学分析中,这样的特征可以用于开发预测模型,以帮助临床医生更好地选择可能对治疗有反应的患者。此外,这些特征可能还与肿瘤的生物学特性有关,因此它们也可能为理解肿瘤的生物机制提供线索。
值得注意的是,尽管这些特征在单变量分析中显示出显著性,但为了提高预测的准确性,通常需要使用多变量分析,如支持向量机(SVM)等机器学习技术,来考虑多个特征之间的相互作用。
3-3:多变量机器学习模型
由于单个放射组学参数的预测准确性不理想,当代的多变量机器学习模型可能能够提高预测准确性。使用ADASYN对少数类别(PR和CR)进行上采样后,SVM模型采用一对一技术对NR、PR和CR进行分类。
图3展示了使用支持向量机(SVM)模型预测放射学反应的接收者操作特征(ROC)曲线,分别为完全反应(Complete Response, CR)、部分反应(Partial Response, PR)和非反应者(Non-responders, NR)。
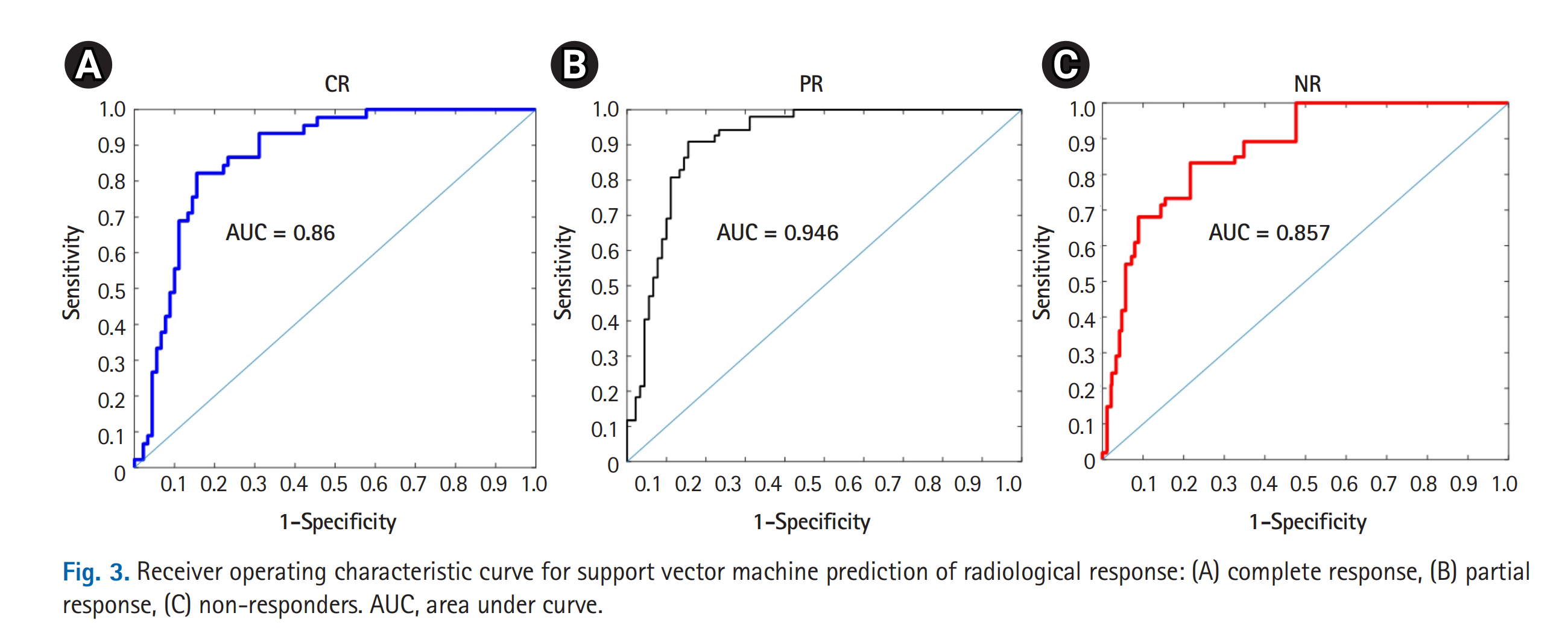
以下是对图中内容的分析:
- ROC曲线:
- ROC曲线是一个用于评估分类模型性能的图形工具,它将真正例率(True Positive Rate, TPR,也称为敏感度或召回率)绘制在y轴上,将假正例率(False Positive Rate, FPR)绘制在x轴上。
- F1分数
- CR:0.71
- PR:0.84
- NR:0.72
- AUC
- CR:0.86(95% CI,0.794–0.921;p < 0.05)
- PR:0.946(95% CI,0.873–0.978;p < 0.05)
- NR:0.857(95% CI,0.789–0.915;p < 0.05)
- AUC解释:
- AUC值的范围是0到1。AUC值越高,表示模型的预测性能越好。一般来说,AUC值大于0.9表示模型的预测性能非常好,AUC值在0.7到0.9之间表示模型的预测性能良好,而AUC值低于0.7则表示模型的预测性能一般。
- 模型选择:
- 在实际应用中,可能需要根据临床需求选择一个最佳的决策阈值,这通常是通过在敏感度和特异度之间寻找一个平衡点来实现的。
图3的ROC曲线和相应的AUC值表明,所训练的SVM模型在预测SBRT治疗反应方面具有较高的准确性和可靠性。这些结果对于临床决策支持系统和个性化治疗计划的制定具有重要意义。
四、讨论与总结
4-1:使用放射组学改善SBRT的预后预测
随着精准医学的发展,肿瘤学中的预后预测模型变得更加精确。大多数肿瘤在基因表达、相关间质和血管方面高度异质,这对预后有着深远的影响[16]。这种异质性不仅存在于个体间,也存在于同一患者不同病变之间以及同一病变不同区域之间,尤其是在转移性肿瘤中[17]。因此,临床特征可能无法完全捕捉肿瘤的异质性。
放射组学的出现部分克服了这一局限,因为它可以提取临床上无法检测到的特征,以捕捉肿瘤内部的异质性和跨肿瘤的异质性[10]。因此,人们努力利用放射组学进行预后预测。Huynh等人[18]表明,放射组学特征可以预测早期肺癌患者SBRT后的总生存期和远处转移。随后,构建了多目标模型(如随机森林)以改善早期肺癌的预后预测[19]。
除了肺癌,放射组学驱动的模型已被应用于各种其他恶性肿瘤,如结直肠癌、前列腺癌和乳腺癌[20-22]。对于各种原发部位的治疗结果和并发症都进行了准确的预测[23-25]。具体到SBRT,临床结果如总生存期、远处转移或并发症(如肺炎)已通过放射组学建模[26,27]。它还被应用于其他成像模式,如PET/CT或MRI[28]。
SBRT通常用于早期肺癌的治愈性治疗,并且越来越多地用于有寡进展性或寡转移性疾病的转移性肺癌患者,允许获得高局部控制率[29]。这种方法可以与常规放疗相比获得更好的局部控制[30,31]。然而,Pallma等人[4]的病理系列显示,SBRT后早期非小细胞肺癌的pCR率为60%,低于之前的假设。在不太有利的组织学或更先进的疾病中,局部控制率可能较低[32]。手术治疗与SBRT的选择由临床医生自行决定,应基于患者的特征、并发症和临床经验,最好在多学科团队的背景下进行[33]。
因此,SBRT前治疗结果的预测在选择最佳治疗方式方面具有实际意义。最近的放射组学模型允许准确预测早期NSCLC患者SBRT后的总生存期、DMFS和无进展生存期[18,34]。
本研究包括早期和转移性疾病以及不同原发部位和病理的患者,旨在识别不依赖于原发部位和病理的胸部SBRT的放射组学反应的通用放射学标记。
值得注意的是,尽管包括转移性和非转移性恶性肿瘤,放射学应答者相对于非应答者有改善生存的趋势。因此,放射学应答可能是胸部SBRT的重要预后标志,可以反映对总生存期的影响。因此,在给予SBRT之前预测放射学应答可能对治疗决策具有重要意义。
4-2:预测放射组学特征
据我们所知,这是第一个包括接受SBRT治疗的原发性肺癌和来自胸外疾病的肺转移瘤患者的病例研究。
偏度和均方根(RMS)被确定为放射学非应答者的预测因子。有趣的是,这两个特征在之前关于常规胸腔放疗的放射组学研究中也被识别出来。Coroller等人[35]发现,包括偏度和RMS在内的七个特征与早期肺癌化疗-放疗后病理学大体残留疾病显著相关。这些发现得到了Chong等人[36]的证实,他们表明偏度在肺癌腺癌化疗-放疗后病理学非应答者中具有预测价值。考虑到其他原发肿瘤,偏度也被发现与结直肠癌患者的较差预后相关[37]。
随着时间的推移,偏度的变化也被发现是有信息的;治疗后偏度的长期降低被证明可以预测肺癌腺癌更好的总生存期[38]。在多个放射组学研究中,尤其是在多个肿瘤部位和治疗模式下,偏度的增加被发现与较差的预后相关,这表明偏度可能是普遍存在的负放射组学预后因素。可能的生物学机制在后续部分进一步讨论。
尽管关于RMS预后含义的数据较少,但最近有研究表明,较低的RMS与肺癌患者的较差生存期相关[39]。
尽管本研究纳入的病例数较小,但与之前的放射组学研究一致。此外,这些发现也在使用不同成像和分析协议的不同研究中得到证实[35,36,39]。这表明偏度和RMS可能是具有普遍性的重要不良放射组学预后因素。
4-3:放射组学特征的生物学基础:放射基因组学
越来越多的努力被投入到揭示放射组学特征背后的生物学基础,因为生物学的改变可能具有特定的放射学表现。多个放射基因组学研究已经发现放射组学特征与基因表达之间的关联,突显了生物学与放射学之间的可能联系[40]。
几项研究指出,偏度与肺癌和其他肿瘤类型的放疗反应较差和放射抵抗有关[34,41,42]。过去的研究已经确定了放射学偏度与肿瘤生物学之间的可能相关性。正偏度被发现与非小细胞肺癌(NSCLC)中的KRAS突变相关[43]。事实上,KRAS突变的肺癌以其预后差和治疗抵抗为特征,这在结直肠癌中也得到了证实[44,45]。由于KRAS突变在多种恶性肿瘤中常见,因此在本研究中观察到的正偏度肿瘤的较差预后可能至少部分是由KRAS突变驱动的[46]。KRAS突变导致预后不良的机制可能包括诱导类似癌症干细胞的表型,从而导致放射抵抗[47]。这可能是本研究中正偏度患者对SBRT反应减弱的可能解释。
低FOXF2表达是一个新发现的NSCLC的不良预后因素[48]。FOXF2抑制肿瘤细胞在体外的增殖、迁移和侵袭,并显示出增强转移[49]。Perez-Morales等人[39]证明,肺癌肿瘤的RMS水平与FOXF2表达相关。因此,可能放射学的RMS水平反映了肿瘤中潜在的FOXF2表达。
此类证据加强了肿瘤放射组学特征可能反映相关潜在生物学过程的概念,这些过程最终影响疾病的预后和放射敏感性。
4-4:放射组学中机器学习的应用
肿瘤的纹理分析允许通过多种统计表示来代表肿瘤内部的异质性。因此,数据集通常是高维的。
在本研究中,对85个分析病变评估了110个放射组学特征。通过单变量模型进行假设检验将需要进行多次统计测试。这可能导致更高的第一类错误,因此需要进行Bonferroni调整。
此外,一个特定的放射组学特征可能不足以实现良好的分类性能。例如,偏度和RMS的AUC仅为0.625和0.632。最优决策边界可能位于更高维度的空间中,更适合于多变量建模。支持向量机(SVM)允许决策边界位于高维空间中的超平面内,因此分类性能将显著提高[50]。SVM搜索一个可以最大化分离感兴趣结果的超平面。多项研究已经证明了SVM在预测放射治疗后临床结果(如肺炎或总生存期)的高维临床数据集分类方面的能力[51,52]。在本研究中,我们证明了SVM在预测SBRT后肿瘤反应方面具有高度准确性。
本研究的临床结果不平衡,因为CR(n = 31)和PR(n = 11)的患者数量少于NR(n = 43)。尽管数据集不平衡,我们仍然能够识别出两个预测NR的放射组学特征,这与之前的研究一致。在数据不平衡的类别中,算法通常会牺牲少数类别的预测准确性以实现更高的整体准确性[53]。因此,在构建SVM模型时,使用ADASYN将PR和CR上采样以匹配NR类。这种方法保留了上采样类的统计分布,同时增加了统计功效[53]。之前放射组学研究中使用合成少数过采样技术(SMOTE)的类似方法已被证明有利于整体分类性能[19]。
机器学习模型在放射组学和精准医学领域的应用具有巨大的潜力。机器学习允许在多维模型中考虑多个因素,这在精准医学时代非常有用。放射组学和机器学习在临床实践中的应用需要准确和可重复的模型。由于SBRT的放射学反应可能直接影响生存,放射组学模型的预测能力可以指导选择可能对SBRT有反应的肿瘤,并为更具放射抵抗性的肿瘤选择替代疗法。因此,优化专门模型可以使放射组学在临床决策过程中得到引入。
4-5:局限性
这里我们展示了一个旨在阐明未来确认的预后放射组学特征的假设生成研究。尽管这是一种提供额外预后信息的有前途的技术,但这项研究具有几个局限性。这是一项回顾性研究,纳入了一个小而异质的患者群体,这可能限制了其普遍性。由于是回顾性进行的,某些因素可能没有得到充分控制。正如之前所述,每个类别(CR、PR和NR)的结果是不平衡的。尽管ADASYN可以从统计上补偿不平衡,但真实的数据点仍然更受青睐。
此外,我们承认NSCLC和非肺部肿瘤的患者比例也是不平衡的(55比14)。然而,在肿瘤水平上,有62个NSCLC病变和23个非肺部肿瘤。不平衡的程度也通过ADASYN在一定程度上减少。
计划和治疗变异性也限制了这项研究。在计划CT期间过度的肿瘤运动可能会限制特征提取的准确性。通过仅招募使用ABC技术的患者来减少肿瘤运动来解决这个问题。还应该注意,研究中有几种分割方案被使用,这可能导致肿瘤反应的差异。
本研究对患者进行了严格的筛选,排除了中央肿瘤患者和不能耐受ABC的患者。这提高了模型的准确性,但同时也限制了其在“现实世界”临床实践中的应用。
我们承认不同机构使用不同的成像协议和扫描仪。此外,使用对比剂或注射时间也可能在机构间有所不同。已经显示,使用对比剂可能会影响某些放射组学特征[54]。本研究采用了非对比CT胸腔,而其他研究采用了对比剂计划CT。这可能限制了放射组学模型的普遍性和共享。因此,放射组学模型的应用可能限于单一机构,而不包括多机构数据。也缺乏普遍的特征提取协议和特征集,这阻碍了跨研究的比较。这可以通过跨不同数据集的数据共享和交叉验证来克服,希望这将在未来产生更具普遍性的模型。
4-6:结论
本研究提供了一个概念证明,即放射组学特征可以预测SBRT的反应,而不管肿瘤的组织学类型、原发部位和初始分期如何。我们还证明,偏度和均方根(RMS)是潜在的普遍不良预测因子,与多项之前的放射组学研究一致。
此外,还显示了放射学应答的肿瘤有改善总生存的趋势。这验证了放射学应答作为总生存预后因素的作用。定义普遍的放射组学预测特征的临床意义需要进行额外的前瞻性分析。需要进一步的研究来揭示放射组学特征和治疗反应性的生物学基础。
多变量模型,如支持向量机(SVM),可以提高分类性能,允许准确预测结果。使用此类模型的放射组学分析可能会用于治疗选择。数据共享和统一的特征提取和处理程序备受期待,以在未来产生更稳健的模型。























 2315
2315

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








