小罗碎碎念
本期分享的文献是“AI-Based Risk Score from Tumour-Infiltrating Lymphocyte Predicts Locoregional-Free Survival in Nasopharyngeal Carcinoma”,翻译一下,即——基于肿瘤浸润淋巴细胞的人工智能风险评分预测鼻咽癌的无局部生存率。

本文讨论了一项研究,该研究旨在从**肿瘤浸润淋巴细胞(TILs)中开发基于人工智能的风险评分,以预测鼻咽癌(NPC)的无局部生存期。该研究从H&E染色的鼻咽癌切片中收集全切片图像(WSI),并使用深度学习算法检测图像中的肿瘤核和淋巴细胞核**。
TIL被量化为12个评分,并**在TIL上训练随机生存森林模型,以生成风险评分**。结果显示,在局部复发病例中,与血浆 Epstein-Barr 病毒 DNA 拷贝相比,基于 AI 的风险评分具有很强的预后价值。研究表明,新型数字标记物可能有助于鼻咽癌的治疗决策。
要点总结
- 鼻咽癌是一种源自鼻咽上皮细胞的罕见恶性肿瘤。
- 10%到50%的鼻咽癌病例在初治后会出现局部复发。
- 目前鼻咽癌的预后指标,如**分期和血浆 Epstein-Barr 病毒 DNA,对局部复发并不敏感**。
- 肿瘤浸润淋巴细胞(TIL)与更好的鼻咽癌临床预后相关。
- 该研究从TILs中开发了一种基于人工智能的风险评分,用于**预测鼻咽癌患者的无局部复发生存率**。
- 人工智能算法在全切片图像中检测肿瘤核和淋巴细胞核,并将TIL量化为12个评分。
- 在局部复发病例中,与血浆Epstein-Barr病毒DNA拷贝相比,基于人工智能的风险评分显示出很强的预后价值。
- 新型数字标记物可能有助于鼻咽癌的治疗决策。
一、引言
鼻咽癌(NPC)是一种罕见恶性肿瘤,起源于鼻咽部上皮细胞,在鼻腔内的**罗斯穆勒窝(Fossa of Rosenmuller)这一咽部隐窝中最为常见。该肿瘤位置的特殊性使得其可以通过多种途径扩散[1-3]。鼻咽癌的病因涉及环境因素、遗传因素和感染Epstein-Barr病毒(EBV)[4-6]。NPC的主要治疗方法是放射治疗(RT),在晚期病例中,可辅以同步化疗、诱导化疗或辅助化疗**[7,8]。临床上,晚期鼻咽癌通常被划分为局部晚期鼻咽癌(LA NPC),包括根据国际癌症联合会/美国癌症联合会(UICC/AJCC)临床分期标准(第8版)的III期(T3N0-2M0,T0-2N2M0)和IVa期(T4或N3M0)。
远处转移是治疗失败的主要原因。然而,在初步治疗5年后,10%至50%的病例会发生局部区域复发[9,10]。这可能导致进一步复发或身体其他部位转移的风险增加。早期发现和治疗局部区域复发可以防止肿瘤进一步扩散,改善NPC的预后[11]。
TNM分期系统是目前决定NPC患者治疗决策和预后的主要因素。然而,尽管处于相同分期的NPC患者接受了相似的治疗,他们的结果可能会有所不同[12]。NPC患者血浆中循环游离EBV DNA的水平已被证明是一个重要的预后标志物,并有助于确定适当的治疗[13,14]。然而,EBV DNA对局部区域复发的敏感性不如对远处转移的敏感性[15]。有研究表明,多达40%的局部复发与血浆EBV DNA的增加无关[16]。
NPC的一个特点是肿瘤浸润淋巴细胞(TILs)的存在[17]。越来越多的研究关注TILs在各种类型的癌症(包括NPC)中的潜在预后价值[18]。在多种恶性肿瘤中,TILs在肿瘤微环境中的存在与较好的临床结果相关。在NPC中,TILs与肿瘤进展的关系一直是许多研究的主题。有几项研究报告了TILs密度与NPC患者有利临床结果之间的正相关关系。特别是,TILs的存在与改善总生存期、无病生存期和远处转移生存期相关[19-22]。这些发现表明,TILs可能在宿主对NPC的免疫应答中发挥关键作用,并可能作为该疾病的预后生物标志物。尽管如此,为了消除主观性和观察者内部变异性,必须就TILs的定义和计数达成共识[23]。
与其他癌症类似,NPC的诊断和预后涉及一个多方面的方法。这包括症状检查、体格检查、内窥镜检查、高级成像(MRI、CT、PET)和血液检测。为了进一步验证肿瘤的存在并完善诊断,进行病理学检测。这包括仔细检查组织样本以确认肿瘤的存在及其分级。同时,放射学评估用于癌症分期,有助于确定疾病的程度和严重性。这些诊断努力的累积是一个耗时且劳动密集型的过程,持续超过一周的时间。
人工智能(AI)和计算病理学在癌症治疗中有两个主要目标:自动化临床工作流程的某些部分,并利用同一工作流程中的数据获得新的见解[24]。
AI和计算病理学在包括NPC在内的癌症的诊断和预后中的应用正在开始取得令人鼓舞的结果[25-27]。例如,AI算法在检测内窥镜图像中的鼻咽肿块方面已被证明优于人类观察者[28]。在NPC诊断中使用全切片图像(WSIs)的另一个例子中,AI算法已显示出优于初级和中级病理学家[29]。AI在NPC预后任务中展示了其潜力,通过利用各种数据模态,如临床病理学数据、磁共振成像(MRI)、正电子发射断层扫描(PET)和WSIs,实现了高准确性[30-33]。

与其他数据模态如MRI和PET相比,WSIs提供了对细胞和组织结构的全面视角。然而,据我们所知,目前还没有研究探讨AI在NPC WSIs中对TILs的详细量化。
本研究的目标是使用基于AI生成的风险评分将局部晚期鼻咽癌患者分为高风险和低风险组。本研究探讨AI和计算病理学在开发基于数字TILs的NPC(数字NPC-TILs)预后评分方面的潜力,以评估局部区域无复发生存(LRFS)。除了LRFS,我们还研究了远处转移无生存(DMFS)、区域无复发生存(RRFS)和无进展生存(PFS)。
通过采用AI和计算病理学,我们的方法提供了从广泛使用的H&E染色的组织学图像中客观评估TILs的能力。我们进行了详细的分析,并展示了我们的新型数字TIL评分在LRFS以及其他生存终点方面具有预后价值。我们的研究提供了关于TILs、肿瘤微环境和NPC患者生存之间相关性的见解。所提出的方法在NPC治疗决策方面具有潜力。
二、材料和方法
2-1:数据收集
从中山大学肿瘤中心收集了**396张完整的全切片图像(WSIs),这些图像来源于378例鼻咽癌(NPC)患者的苏木精和伊红(H&E)染色切片。所有WSIs都是使用Aperio扫描仪以40倍放大率和0.255微米每像素**(mpp)的分辨率扫描的。
在总共378例病例中,有11例只有WSIs,没有伴随的临床信息,包括生存终点。因此,最终的数据集包含367例病例,共有385张WSIs。对于具有多个WSIs的病例,特征被聚合为平均值。从中山大学肿瘤中心伦理委员会获得了批准(B2023-381-01)。
临床数据包括年龄、性别、原发肿瘤(T)、区域淋巴结(N)、分期组和血浆EBV DNA数据。本研究不包括M(远处转移),因为我们的重点是预测局部复发性NPC患者的预后,不包括那些转移到其他器官的患者。
此外,TNM分期状态是在患者出现早期症状的阶段获得的,因此尚未发生转移。与之前的研究[34]一样,血浆EBV DNA水平在治疗前通过针对EBV基因组的BAMHI-W区域的定量聚合酶链反应进行量化。结果以血浆每毫升EBV基因组拷贝的浓度报告。队列中的所有患者都接受了化疗和放疗。
2-2:临床病理特征
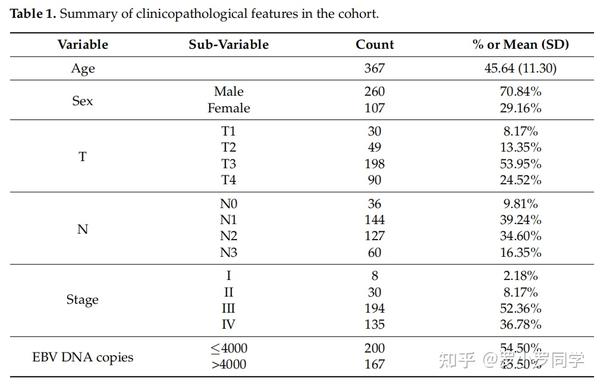
本队列的中位随访时间为36个月,范围从1个月到79个月。生存数据通过将最大观察时间限制在60个月(5年)来进行右删失处理。所有患者的平均年龄为45岁,其中70.84%为男性。LRFS、DMFS、PFS和RRFS的事件百分比分别为5%、12%、17%和2%。
为了进行预后分析,我们**使用4000拷贝/mL作为阈值将患者分为高EBV DNA组和低EBV DNA组**(低:≤4000拷贝/mL,高:>4000拷贝/mL)。这个阈值的选择与最新的权威研究[35,36]保持一致。队列中包括167例高EBV DNA拷贝病例和200例低EBV DNA拷贝病例。
队列中的TNM分期是根据国际癌症联合会(UICC)和美国癌症联合会(AJCC)**第八版分期系统**进行的。根据TNM分期系统,大多数患者处于第3阶段(见表1)。
2-3:肿瘤细胞核检测与聚类
该文的整体分析流程,如下图所示。

图1
主要包括四个主要步骤:
- 肿瘤细胞核检测与聚类
- 数字TIL量化
- 风险评分计算
- 生存分析
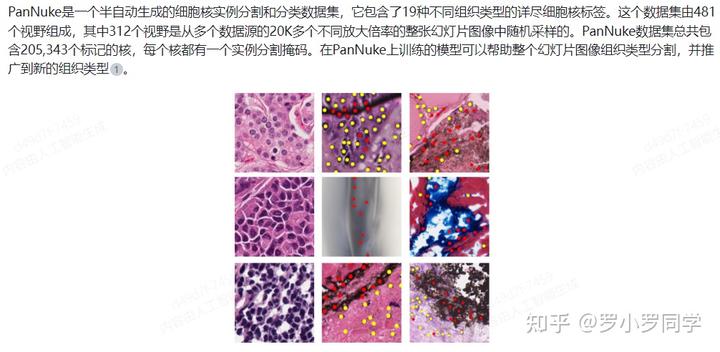
我们**使用HoverNet模型[37]在40倍放大率的WSIs中检测、分割和分类细胞核,该模型是使用PanNuke数据集**[38]进行训练的。
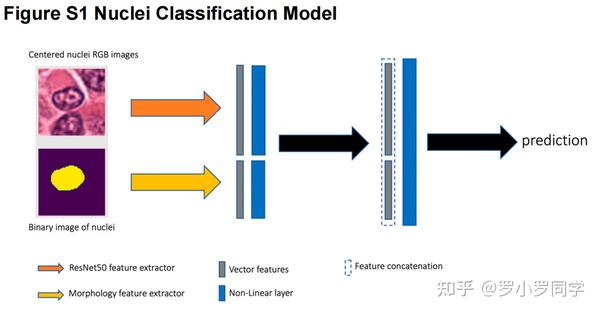
为了纠正细胞核的误分类,我们训练了一个深度学习模型,我们称之为**MorphResNet,它融合了残差神经网络(ResNet[39])的深度特征和细胞核的形态学特征。我们使用了来自ResNet50倒数第二层的特征,该层是在ImageNet[40]数据集上预训练的。我们选择ResNet模型是因为其广泛的应用,它不仅节省了计算成本和时间,而且在不降低预测能力的情况下保持了性能[41,42]。形态学特征包括偏心率、凸包面积、轮廓面积、等效直径、主轴长度、次轴长度、周长、坚实度、方向、半径和边界框面积**。完整的模型架构可以在补充文件Figure S1中找到。
为了构建细胞核数据集,我们将PanNuke和MoNuSAC[43]的数据合并,创建了细胞核数据集。

我们从MoNuSAC中选择性地包括了标记为“上皮”和“炎症”的数据。数据集中的每个细胞核图像都被提取并居中到64×64像素的大小,对于位于图像边缘附近的图像,我们添加了额外的填充。最终数据集中的细胞核图像总数为219,934。我们**使用Macenko[44]方法增强数据,以确保模型在图像染色变化上的泛化能力。数据按照80-10-10的比例分为训练、验证和测试集。我们使用Adam优化器对模型的所有层进行50轮训练**。模型在测试集上达到了0.921的准确率和0.919的F1分数。模型的性能还通过定性的方式进行了评估,并得到了参与研究的医疗人员的认可。
我们**根据细胞核的密度使用基于密度的空间聚类应用与噪声(DBSCAN)算法[45]进行肿瘤细胞核的聚类。此外,肿瘤簇扩大了60像素或15微米,形成了一个更大的区域的新簇。我们在DBSCAN中设置最大距离为200,最小样本数量为10。所有参数都是经验确定的。这些参数使我们能够避免簇之间的重叠**。最初的簇被称为内部肿瘤簇(在肿瘤簇中间),而扩展的区域被指定为外部肿瘤簇。
2-4:数字TILs与肿瘤形态学
多项研究表明,肿瘤微环境(TME)与癌症生存率相关。TME包括肿瘤区域周围的间质细胞,如成纤维细胞、内皮细胞和免疫细胞(淋巴细胞)。在**本研究中,我们的重点是肿瘤和淋巴区域及其与生存率的关系。我们基于H&E图像中的细胞核制定了数字化的TIL评分。肿瘤簇内外的所有淋巴细胞核都被定义为肿瘤浸润淋巴细胞**(TILs)。
我们将位于内部肿瘤簇中的肿瘤细胞和TILs称为**内肿瘤肿瘤细胞和内肿瘤TILs。相比之下,位于外部肿瘤簇中的肿瘤和TIL细胞核被定义为间质肿瘤细胞和间质TIL**。
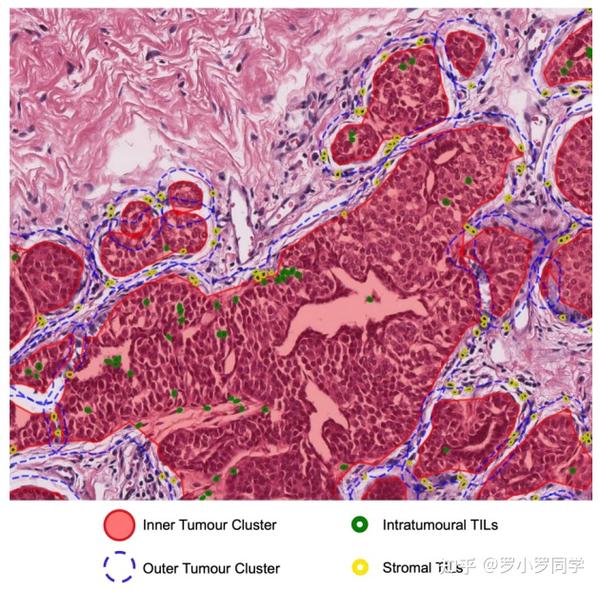
图2
这两种类型的肿瘤细胞核和TIL在图1中有所展示。通过测量肿瘤细胞核和TIL的数量及其相应簇的面积,我们生成了12个数字TIL特征。我们称这组特征为**数字NPC-TILs**。数字NPC-TIL特征及其公式的完整列表可以在表S1中看到。

此外,我们还研究了NPC生存率中的肿瘤形态学。我们**从簇区域内的肿瘤细胞核计算了9个形态学特征。簇扩大区域内的肿瘤细胞核不计入形态学特征测量。接下来,我们计算每位患者的形态学特征的均值,并用于下游分析**。本研究中使用的形态学特征的完整列表可以在表S9中看到。
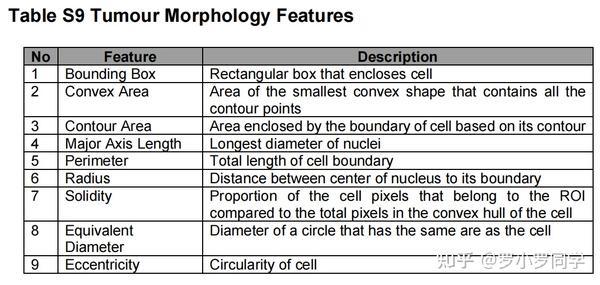
1、Bounding Box
在医学影像分析领域,Bounding Box(最小上界矩形框)常用于包围和标识图像中的特定区域,例如肿瘤区域。这种技术**通常用于图像分割和分类任务**,特别是在深度学习模型训练中。
具体来说,Bounding Box可以被视为一种简化的图像分割方法,它通过**定义一个最小的矩形框来包围图像中的一个对象或者区域**。这种方法简单易用,计算量小,因此在实际应用中被广泛采用。
在肿瘤形态学特征的研究中,Bounding Box同样发挥了重要作用。通过对肿瘤区域的Bounding Box进行标注,可以帮助医生或者算法更好地识别和定位肿瘤,从而更准确地进行病理分析和治疗方案制定。 例如,在脑肿瘤的检测中,研究者们会使用Bounding Box来确定肿瘤区域,然后通过灰度阈值和基于低通的形态学操作将肿瘤区域转化为3D肿瘤掩模。
此外,Bounding Box也可以用于评估模型的性能。例如,在MoNuSAC数据集中,参与者需要提交测试图像的PNG格式文件,然后使用聚合杰卡德指数(Aggregated Jaccard Index,简称AJI)计算细胞核分割的准确性。在这种情况下,Bounding Box可以帮助确定每个细胞核的位置和大小,从而帮助计算AJI。
2、Convex Area
在医学影像分析中,Convex Area是指凸包面积,它是通过将所有点连接起来形成的最小凸多边形的面积。在肿瘤形态学特征的研究中,Convex Area常常被用作衡量肿瘤的一种重要参数。
具体来说,Convex Area可以通过以下步骤计算:首先,将肿瘤区域的边界点提取出来;然后,使用这些边界点作为输入,生成一个最小上界凸多边形;最后,计算这个凸多边形的面积,即为Convex Area。
Convex Area的大小可以反映肿瘤的体积和形状。一般来说,如果肿瘤的Convex Area越大,那么肿瘤的体积也就越大。同时,Convex Area还可以反映出肿瘤的形状,比如,如果肿瘤的形状越接近圆形,那么其Convex Area就越小。
3、Contour Area
在医学影像分析中,Contour Area指的是图像轮廓的面积。这是一种常见的测量图像形状的方法,尤其在肿瘤形态学特征的研究中。
具体来说,Contour Area可以通过以下步骤计算:首先,从图像中提取出肿瘤区域的边界点;然后,将这些边界点按照顺序排列,形成一个封闭的轮廓;最后,计算这个轮廓的面积,即为Contour Area。
Contour Area的大小可以反映肿瘤的体积和形状。一般来说,如果肿瘤的Contour Area越大,那么肿瘤的体积也就越大。同时,Contour Area也可以反映出肿瘤的形状,比如,如果肿瘤的形状越接近圆形,那么其Contour Area就越小。
4、Major Axis Length
在医学影像分析中,Major Axis Length(最大轴长度)是一种重要的形态学特征,用于**描述肿瘤或其他结构的长轴尺寸**。
具体来说,Major Axis Length可以通过以下步骤计算:首先,从图像中提取出肿瘤区域;然后,找到这个区域的最大主轴,也就是沿着最长距离的方向;最后,计算这个最大主轴的长度,即为Major Axis Length。
Major Axis Length的大小可以反映肿瘤的体积和形状。一般来说,如果肿瘤的Major Axis Length越大,那么肿瘤的体积也就越大。同时,Major Axis Length也可以反映出肿瘤的形状,比如,如果肿瘤的形状越接近圆形,那么其Major Axis Length就越小。
2-5:生存分析
在本研究的生存分析中,我们**将局部区域无复发生存(LRFS)确定为主要终点,并额外考察了远处转移无生存(DMFS)、区域无复发生存(RRFS)和无进展生存(PFS)等终点。在研究期最后一天未发生事件的病人被标记为删失事件。整个流程,从细胞核检测和分类到数字TIL评分和统计分析,均使用了Python 3.7**编程语言。
本研究旨在开发具有NPC预后价值的数字化人工智能生物标志物。我们**在生存分析中使用了四组特征**:
- 数字TIL评分
- 临床病理学数据(年龄、性别、TNM分期和EBV DNA水平)
- 肿瘤细胞核形态学
- 数字NPC-TIL评分与肿瘤细胞核形态学的组合
我们使用**三折交叉验证在每个特征集上训练了随机生存森林(RSF)模型。进行了网格搜索以确定RSF的最优参数。为了从模型中评估风险评分预测,我们使用了PySurvival [47] Python包中的concordance_index函数来计算Harrell的C指数(一致性指数)[46]。C指数评估了预测生存结果与实际生存结果之间一致性的概率**[48]。
随后,我们**评估了RSF模型中风险评分的预后价值,以将患者分层为低风险和高风险组。风险评分等于或低于截止值的病人被视为低风险,反之亦然。截止值在发现集中确定,并使用Cutoff Finder [49]进行计算**。我们在验证集中使用Kaplan-Meier(KM)曲线分析和log-rank检验来评估NPC预后中提出的生物标志物。
此外,我们进行了单变量和多变量分析,以评估风险因素与生存结果之间的关系,使用了Cox比例风险(Cox PH)模型。我们**使用了lifelines Python包中的危害比(HR)、C指数、95%置信区间(CI)和p值来评估Cox PH模型**。所有统计分析均采用双尾检验,p值小于0.05被认为具有统计学意义。

为了进行预后价值评估以及单变量和多变量分析,我们将数据分为了发现集和验证集。验证集被设置为数据的30%,并根据相应终点的事件对数据进行分层。
三、讨论
本研究针对鼻咽癌(NPC)的肿瘤微环境(TME)中的免疫特征在预后中的作用进行了深入探讨。当前,TNM分期系统及其临床数据的局限性促使人们越来越关注TME的免疫特征在NPC预后中的重要性。尽管在其他类型的癌症中,TME的免疫特征(如TILs)显示出有前景的结果,但在NPC中的研究文献却相对匮乏。此外,大多数免疫特征的主观评估容易受到观察者间和观察者内变异性影响。
为了解决这个问题,本研究提出了一种基于人工智能和计算机视觉的新方法,用于**自动评分NPC中H&E全切片图像(WSIs)的TILs**。我们开发了12个数字TIL特征,并将它们组合成一个单一的NPC-TIL评分。分析表明,这一评分是NPC在局部区域无复发生存(LRFS)和其他生存结果中的独立预后因素。
本研究在三个位置捕获了TIL信息:内部肿瘤簇(肿瘤簇中间)、外部肿瘤簇(肿瘤簇扩大区域)以及两者都有。每个位置包括四组数字NPC TILs。从内部肿瘤簇提取的TILs被标记为“内肿瘤”,因为它们描述了高密度肿瘤区域内的淋巴细胞。此外,从外部肿瘤簇提取的TILs被标记为“间质”,因为它们位于肿瘤簇周围。
第一组数字NPC TILs提供了淋巴细胞数量与肿瘤细胞数量的分布,命名为TIL比例、内肿瘤TIL比例和间质TIL比例。第二组提供了淋巴细胞数量与肿瘤细胞总占据面积之间的关系,命名为TIL密度肿瘤、内肿瘤TIL密度肿瘤和间质TIL密度肿瘤。最后,第四组深入探讨了空间方面,考虑了淋巴细胞细胞覆盖的总面积与肿瘤细胞总面积的关系,命名为TIL面积比例、内肿瘤TIL面积比例和间质TIL面积比例。在三个不同位置采用这四组特征集,不仅增强了我们量化TILs数量的能力,还增强了我们对其在肿瘤微环境内复杂相互作用中的空间分布和密度的理解。
已知EBV DNA是NPC远处转移的重要生物标志物。然而,这个标志物对远处转移的敏感性高于局部区域复发的敏感性。在Cox-PH建模的单变量和多变量分析中,我们显示数字NPC-TIL评分是NPC LRFS的一个强有力预后因素。通过使用这一风险评分对局部区域复发的NPC患者进行低风险和高风险分层,得到了统计学上显著的结果(p < 0.001)。
本研究的目标是通过从组织学图像中基于人工智能的风险评分,对局部晚期鼻咽癌患者进行高风险和低风险组的分层。对于低风险鼻咽癌患者,可以实施“降级”治疗策略,以提高其生活质量。同时,对于高风险局部晚期鼻咽癌病例,可以考虑额外的治疗措施,如诱导化疗后使用卡培他滨的维持治疗或结合全程免疫治疗。
本研究探索了数字NPC-TIL评分在LRFS中的NPC预后。如图4所示,良好预后者的数字NPC-TIL评分显著高于预后不良者。
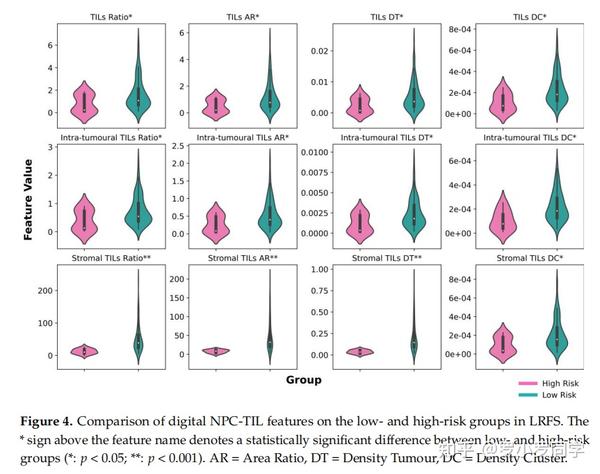
我们的肿瘤细胞核形态学分析表明,数字NPC-TIL评分可以捕获局部复发病例中的核异常。在预后不良的病例中,肿瘤细胞核倾向于有更大的尺寸和更多的不规则形状。已知**肿瘤核异常是许多肿瘤的标志性特征**。
通过检查RSF模型的模型可解释性,我们发现**TIL密度簇是数字NPC-TILs中最重要的特征,在所有生存终点的重要性最高**。这一特征捕捉了肿瘤簇内部和周围的TIL数量信息,指向肿瘤微环境内的免疫反应,并确认TILs的存在和数量对NPC患者预后有影响。
四、结论
本研究介绍了一种新颖的人工智能方法,该方法利用常规的H&E组织学图像,并为鼻咽癌(NPC)预后开发了一套新颖的数字TIL特征。
据我们所知,这是首个研究自动化H&E图像中NPC的TIL评分,并展示出潜在的预后标志物,这些标志物可以帮助评估患者治疗的研究。该研究为NPC预后中潜在的数字免疫标志物提供了重要见解。数字NPC-TIL评分可能潜在地被用来协助治疗决策,并在局部复发的情况下改善患者结果。尽管本研究中关于数字TILs的发现很有前景,但我们的样本仅来源于单一队列。
此外,缺乏关于生活方式和合并症等重要因素的信息也是另一个限制。在多中心队列上进行大规模验证是本研究结果能够在临床实践中实施之前所需的。

























 3104
3104

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








