小罗碎碎念
本期推文主题——人工智能在肿瘤
新辅助治疗领域中的研究进展。

这一期推文谋划已久,最早可以追溯到五一假期。五一的时候,我第一站去的就是北大。当时和北医的一个师兄(博士)聊天,主要聊的就是新辅助治疗+AI这一部分的内容。
后来聊着聊着,就聊到未来的人生规划,以及科研道路上的一些趣事。说到这里,还要感谢那位师兄,正是与他的那次交流,我才萌生了写文献日推系列推文的想法。
回到正题,考虑到有些老师/同学对于接下来涉及的部分概念可能不熟悉,这里小罗先简单的做一个解释。
何为“新辅助治疗”
肿瘤的新辅助治疗(Neoadjuvant Therapy)是指在对恶性肿瘤进行局部治疗(如手术或放疗)之前给予的全身性治疗。
这种治疗方式的目的是为了减小肿瘤的体积,降低肿瘤的分期,提高手术切除的完整性和成功率,以及减少术后复发的风险。
新辅助治疗的具体形式包括化疗、激素治疗、免疫治疗或靶向治疗等,具体取决于肿瘤的类型、位置、分期以及患者的整体状况。既然我们要研究新辅助治疗,那么就证明这种方式必然有它的好处。
所以,我们在正式开始本期的推文之前,还需要了解一下新辅助治疗有什么好处/优点:
- 降期:通过新辅助治疗,可以减小肿瘤的大小,使其更容易被手术切除,甚至在某些情况下,可以使原本无法手术的肿瘤变为可手术。
- 提高R0切除率:R0切除是指手术切除了所有可见的肿瘤组织。新辅助治疗可以提高达到R0切除的机会,这对于提高生存率和减少复发非常重要。
- 病理反应评估:新辅助治疗后的肿瘤组织可以在手术中被切除并进行分析,这有助于评估治疗的效果,并为后续的治疗决策提供信息。
- 早期系统治疗:对于某些肿瘤,新辅助治疗可以提前开始全身性治疗,从而可能提高治疗效果。
- 筛选有效治疗:通过观察新辅助治疗期间肿瘤的反应,可以初步判断某种治疗对特定患者是否有效,从而避免无效治疗带来的副作用和资源浪费。
- 降低微转移风险:新辅助治疗可能有助于消灭潜在的微转移灶,即那些尚未在影像学上显现但可能已经存在于体内的癌细胞。
新辅助治疗的决策通常涉及多学科团队(MDT)的讨论,包括肿瘤科医生、外科医生、放射科医生和其他相关专业人员。他们会综合考虑肿瘤的特点、患者的整体状况和治疗目标,为患者制定最佳的治疗方案。
交流群
欢迎大家来到【医学AI】交流群,本群设立的初衷是提供交流平台,方便大家后续课题合作。
目前群内成员已达三位数,大部分来自全国百强医院/前50院校。此外,小罗也借助自媒体,与华盛顿大学、北大、北航、华科、北科、南方医等院校的课题组建立了联系,欢迎更多的人加入我们的队伍!!
由于近期入群推销人员较多,已开启入群验证,扫码添加我的联系方式,备注姓名-单位-科室/专业,即可邀您入群。
一、AI评估接受“非小细胞肺癌”新辅助治疗患者的病理反应

文献概述
这篇文章是关于使用人工智能(AI)辅助的数字病理学来评估新辅助Atezolizumab治疗
非小细胞肺癌(NSCLC)患者的病理反应。
背景:
病理反应(PathR)是通过组织病理学评估切除的标本来评估新辅助治疗的早期临床终点,可能与长期结果相关。数字病理学可以提高PathR评估的效率和精确度。
LCMC3研究:
评估了新辅助Atezolizumab在可切除NSCLC患者中的使用,并报告了20%的主要病理反应(MPR)率。
方法:
研究使用基于指南的视觉技术确定原发性肿瘤切除标本中的PathR,并开发了一个卷积神经网络(CNN)模型,使用相同的标准在全切片图像上数字化测量活肿瘤的百分比。
评估了由47位地方病理学家和3位中心病理学家进行的活肿瘤百分比的视觉确定之间的一致性。
结果:
视觉确定活肿瘤百分比的一致性具有较高的相关性(ICC=0.87)。数字化评估的活肿瘤百分比与视觉评估有良好的相关性(Pearson r=0.73)。数字化评估的MPR在预测视觉评估的MPR上表现出色,并与更长的无病生存期(DFS)和总生存期(OS)相关。
结论:
AI辅助的数字病理学在新辅助NSCLC临床试验中的病理评估中显示出前景。在临床环境中开发AI方法可能有助于病理医生在临床操作中,包括常规PathR评估,并最终支持改善患者护理和长期结果。
文章强调了AI在病理学中的应用潜力,并展示了在NSCLC新辅助治疗中评估病理反应的准确性和效率。研究结果支持AI技术在临床试验和日常临床实践中的应用,可能会改善患者的治疗和预后。
知识点补充
主要病理反应
主要病理反应(Major Pathologic Response,MPR)是肿瘤治疗反应评估的一个术语,特别是在新辅助治疗(neoadjuvant therapy)的背景下使用。
-
定义:MPR通常定义为在新辅助治疗后,手术切除的肿瘤组织中活肿瘤细胞的比例显著减少。具体而言,MPR通常指在切除的肿瘤组织中,活肿瘤细胞的比例低于10%。
-
重要性:MPR是评估新辅助治疗效果的一个重要指标。新辅助治疗是在手术前给予的治疗,目的是缩小肿瘤、降低分期或控制微转移,以期改善手术结果和患者预后。
-
临床意义:MPR的存在可能与患者更好的预后相关,包括更长的
无病生存期(Disease-Free Survival,DFS)和总生存期(Overall Survival,OS)。因此,MPR可以作为治疗效果的一个预测因素。 -
评估方法:MPR的评估通常在手术切除肿瘤后进行,通过病理学家对切除的肿瘤组织进行显微镜下的检查来确定活肿瘤细胞的比例。
-
数字化评估:随着数字病理学和人工智能技术的发展,现在可以通过数字化手段评估MPR,即利用计算机算法分析全切片图像(Whole Slide Images,WSI)来定量评估活肿瘤组织的比例。
-
研究与临床试验:MPR是许多新辅助治疗临床试验的主要终点之一,用于评估新药物或治疗方案的有效性。
-
治疗决策:MPR的结果可能会影响后续治疗决策。例如,如果MPR评估显示肿瘤对新辅助治疗反应良好,可能会继续或调整当前治疗方案;如果反应不佳,则可能考虑更换治疗方法。
-
标准化:为了确保MPR评估的一致性和可比性,医疗界正在努力制定统一的评估标准和指南。
在上文提到的LCMC3研究中,研究者使用基于AI的数字病理学方法来评估MPR,并发现数字化评估的MPR与通过传统显微镜检查评估的MPR具有很高的一致性,并且与患者的长期生存结果相关。
这表明AI技术在病理学评估中的应用潜力,可能在未来成为常规的临床工具。
“Tumor Bed”(肿瘤床)
“Tumor Bed”(肿瘤床)是病理学中的一个术语,指的是肿瘤被切除后在组织中留下的空间或区域。
-
定义:肿瘤床是指原发肿瘤被手术切除后,在原发肿瘤生长位置留下的区域。这个区域可能包含残留的肿瘤细胞、炎症细胞、纤维化组织、坏死组织或其他由于肿瘤存在而改变的组织。
-
病理学重要性:在肿瘤切除后,病理学家会对切除的组织进行详细的显微镜下检查,以评估肿瘤的类型、分级、侵犯范围以及是否有癌细胞残留在肿瘤床内。这些信息对于评估患者的预后和指导后续治疗非常重要。
-
肿瘤床评估:在病理学中,评估肿瘤床通常涉及识别和量化肿瘤周围的组织变化,包括肿瘤周围的反应性改变、炎症反应、纤维化以及可能的肿瘤残留。这些评估有助于确定病理反应,例如
病理完全缓解(pCR)或主要病理反应(MPR)。 -
与肿瘤的关系:肿瘤床不仅包括原发肿瘤的区域,还可能包括肿瘤侵犯的周围组织。在肿瘤切除后,肿瘤床的组织学特征可以反映肿瘤的生物学行为和对治疗的反应。
-
治疗和预后:肿瘤床的评估对于确定肿瘤是否完全切除、是否有微卫星病变以及是否有局部复发的风险至关重要。此外,肿瘤床中的组织学特征可能与患者的预后和生存率有关。
-
数字病理学的应用:在数字病理学中,如上文提到的研究,使用深度学习算法来自动识别和量化肿瘤床,可以提高病理评估的效率和准确性。这些算法可以帮助病理学家更准确地评估肿瘤床的特征,包括识别活肿瘤组织、坏死和肿瘤相关基质。
随着数字病理学和人工智能技术的发展,对肿瘤床的评估变得更加精确和高效。
重点关注
Figure 1 展示了用于数字化病理反应评估的机器学习算法的开发过程。
以下是对图1各部分的分析:
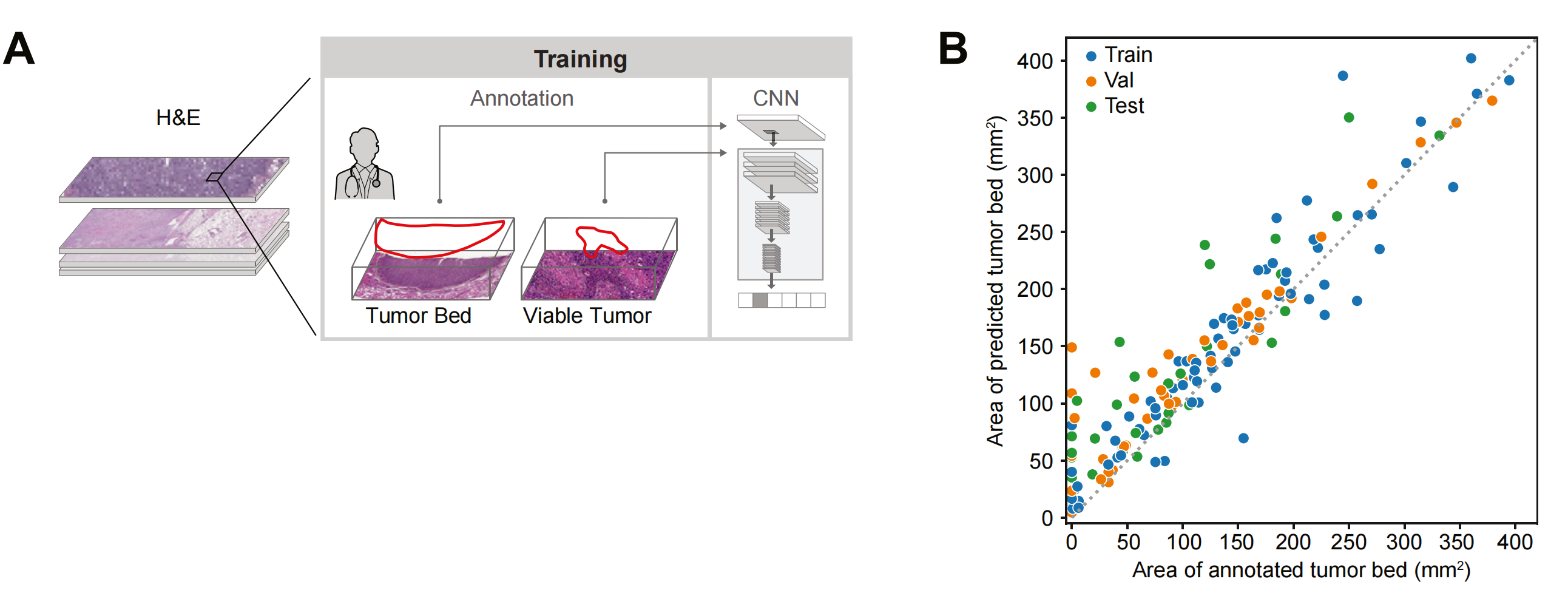
A部分:
- 描述了三个独立的深度卷积神经网络(CNN)的使用,这些网络利用病理学家的注释来对每个H&E(苏木精-伊红)染色的全切片图像(WSI)进行分类。
- 这些CNN被训练来识别和分类不同的组织类型,包括:
- 人工制品模型(Artifact Model):区分切片背景和图像模糊、组织褶皱或撕裂、组织压碎等人工制品。
- 组织模型(Tissue Model):在可用的组织区域内,将像素分类为活肿瘤组织、肿瘤相关基质(包括与肿瘤相关的所有非癌细胞组织,如纤维化或其他结构性肿瘤组分)、坏死组织或其他组织。
- 肿瘤床模型(Tumor Bed Model):在可用的组织区域内,将像素分类为肿瘤床或非肿瘤床。
- 图中还展示了一个示意图,说明了肿瘤床和肿瘤组织的注释。
B部分:
Figure 1(B) 展示了预测的肿瘤床面积与注释的肿瘤床面积之间的比较。
-
数据表示:每个点代表一个全切片图像(WSI),这是从患者肿瘤切除样本中获取的一张完整的组织切片图像。
-
颜色编码:点的颜色表示模型开发过程中使用的数据集,颜色编码有助于区分不同阶段的数据点。
-
比较方法:图表使用散点图来展示每张WSI的预测值与实际注释值之间的关系。理想情况下,如果模型预测完全准确,所有的点将会落在图表的对角线上,即预测值等于注释值。
-
模型准确性:通过观察点的分布,可以评估模型的准确性。如果点集中在对角线附近,这表明模型的预测与病理学家的注释非常接近,模型表现出较高的准确性。
-
一致性评估:图表还可以揭示模型预测的一致性。如果点广泛分布在图表的各个区域,这可能表明模型在不同数据集上的表现存在差异,或者模型在某些类型的肿瘤或组织上的表现不如其他类型的准确。
-
数据集影响:颜色编码可以帮助识别特定数据集是否存在偏差或特定类型的样本是否更难以预测。例如,如果某个数据集的点明显偏离对角线,这可能表明该数据集需要进一步的模型调整或更多的训练数据。
-
统计分析:除了视觉评估外,还会应用统计方法来量化预测准确性,如计算皮尔逊相关系数、均方误差(MSE)或决定系数(R²)。这些统计指标可以提供模型预测能力的量化评估。
-
模型改进:根据图表的分析结果,研究者可以识别模型的弱点,并针对性地改进模型。例如,如果发现模型在预测某些特定类型的肿瘤床面积时存在偏差,可以增加这些类型的样本在训练集中的比例,或调整模型参数以提高性能。
-
临床意义:最终,这种比较的结果对于临床应用至关重要。准确的肿瘤床预测有助于病理学家更好地评估肿瘤切除后的病理反应,从而可能影响患者的治疗决策和预后评估。
Figure 1(B) 通过直观地展示模型预测与实际注释之间的一致性,为评估AI模型在病理学诊断中的有效性提供了一个重要的工具。
C部分:
- 展示了一个代表性的测试集切片,其中包括人工制品、肿瘤床和组织模型的叠加图,这些叠加图展示了模型的预测结果。
- 这些叠加图有助于直观地理解模型是如何在实际的病理切片图像上进行分类和预测的。
整体而言,Figure 1 强调了深度学习模型在数字化病理评估中的开发和应用,展示了模型如何通过学习和识别病理学家的注释来提高病理反应评估的效率和准确性。
通过这种方式,AI技术有助于实现病理评估的自动化和标准化,从而可能改善临床试验的执行和结果的解读。
二、多组学预测“食管癌”对新辅助放化疗(NCRT)反应的生物标志物

文献概述
这篇文章讨论了在预测
食管癌对新辅助放化疗(NCRT)反应的生物标志物发现中采用多组学方法的多维视角。
新辅助放化疗后进行手术已成为可手术的局部晚期食管癌的标准治疗策略。
文章强调了需要改进的生物标志物来预测食管癌对化疗和放疗的反应,并概述了基于多组学数据的新型预测生物标志物的发现,包括基因组/转录组测序和蛋白质组/代谢组质谱。
多组学数据的应用已经改善了我们对食管癌NCRT敏感性/抗药性机制的理解,并且人工智能(AI)的显著发展为癌症研究提供了新的方向。整合多组学数据显著推进了我们对疾病的认知,并促进了从不同维度水平预测治疗反应的有价值生物标志物的识别。
文章还总结了当前在预测NCRT反应方面使用多组学技术的研究现状,并讨论了这些多组学平台的当前限制、挑战和未来展望,以帮助实验设计和临床使用,进行更综合的分析。
重点关注
人工智能(AI)在基于多组学数据的食管癌患者治疗选择中的新兴作用。
-
多组学数据整合:AI可以处理和分析来自不同组学层面(如基因组、转录组、蛋白质组、代谢组和放射组)的大量数据。这些数据提供了关于肿瘤生物学和对治疗反应的全面信息。
-
生物标志物发现:AI算法,特别是机器学习和深度学习,能够从复杂的多组学数据集中识别出与治疗反应相关的生物标志物。这些标志物可能包括基因变异、表达模式、蛋白质和代谢物的变化。
-
个性化治疗策略:通过分析患者的多组学数据,AI可以帮助医生为每个患者定制个性化的治疗计划。这可能包括选择最合适的药物、治疗方案和治疗时间。
-
预测模型:AI可以构建预测模型来预测患者对特定治疗的反应。这些模型可能会考虑多种因素,如基因表达水平、蛋白质活性和代谢途径的变化。
-
临床决策支持:AI系统可以作为临床决策支持工具,帮助医生在治疗选择上做出更明智的决策。这可能涉及到对患者治疗反应的预测、风险评估和治疗结果的预测。
-
持续监测和调整:AI还可以用于治疗过程中的持续监测,根据患者的反应和治疗结果实时调整治疗计划。
-
提高治疗效率:通过精确识别最有可能从特定治疗中受益的患者,AI有助于提高治疗效率,减少不必要的副作用,并提高患者的生存率和生活质量。
总之,Fig. 1强调了AI在分析多组学数据、发现生物标志物、个性化治疗计划和提高临床决策质量方面的潜力。随着AI技术的不断进步,其在食管癌治疗选择中的作用将越来越重要。
三、多染色AI模型,预测“结直肠癌”患者的预后与治疗反应

文献概述
研究团队开发并评估了一种基于多染色深度学习模型(MSDLM)的人工智能(AI)系统,用于确定结直肠癌(CRC)患者的AImmunoscore(AIS)。
这项技术通过分析超过1000名结直肠癌患者的样本,展示了其在预测患者预后和治疗反应方面的高能力,并且表现优于其他临床、分子和基于免疫细胞的参数。
文章详细描述了结直肠癌(CRC)的背景,强调了肿瘤免疫微环境(TIME)中免疫细胞的亚型、密度和位置对临床结果的预测价值。尽管免疫评分(Immunoscore, IS)已被引入用于衡量肿瘤中心和边缘的CD3阳性和CD8阳性T淋巴细胞密度,但其在临床常规使用中的普及仍面临挑战。
研究团队建立了一个深度学习模型,该模型利用多种免疫组化图像来预测CRC患者的生存和治疗反应。MSDLM在预测无复发生存期(RFS)方面的表现优于基于单一免疫细胞群体图像数据的单染色深度学习模型(SSDLMs)。
通过结合MSDLMs,研究者计算了AIS,它是一个独立且显著的预后因素,并且优于其他临床、分子和免疫基础参数。此外,AIS还显示出在预测直肠癌患者对新辅助疗法反应方面的潜力。
研究还使用了可解释AI(xAI)方法来确认MSDLM的决策是基于已知的抗肿瘤免疫原则。研究结果表明,通过深度学习模型可以对来自不同免疫细胞的IHC染色图像进行分类,从而将CRC患者分为“复发”和“无复发”组。此外,研究还探讨了MSDLM在预测直肠癌患者对新辅助放化疗反应方面的应用。
文章最后讨论了TIME评估在CRC临床管理中的潜在影响,指出尽管评估TIME被认为会显著改变CRC和其他肿瘤的临床管理,但迄今为止,细胞免疫景观的表征尚未纳入常规诊断。研究团队提出的MSDLM和AIS可能为CRC的预后和预测提供有价值的工具,有助于改善CRC的临床管理。
重点关注
参与研究的预后队列的临床特征和CONSORT图
CONSORT图是一种常用于临床试验的图表,用于清晰地展示研究的流程和参与者的分布。
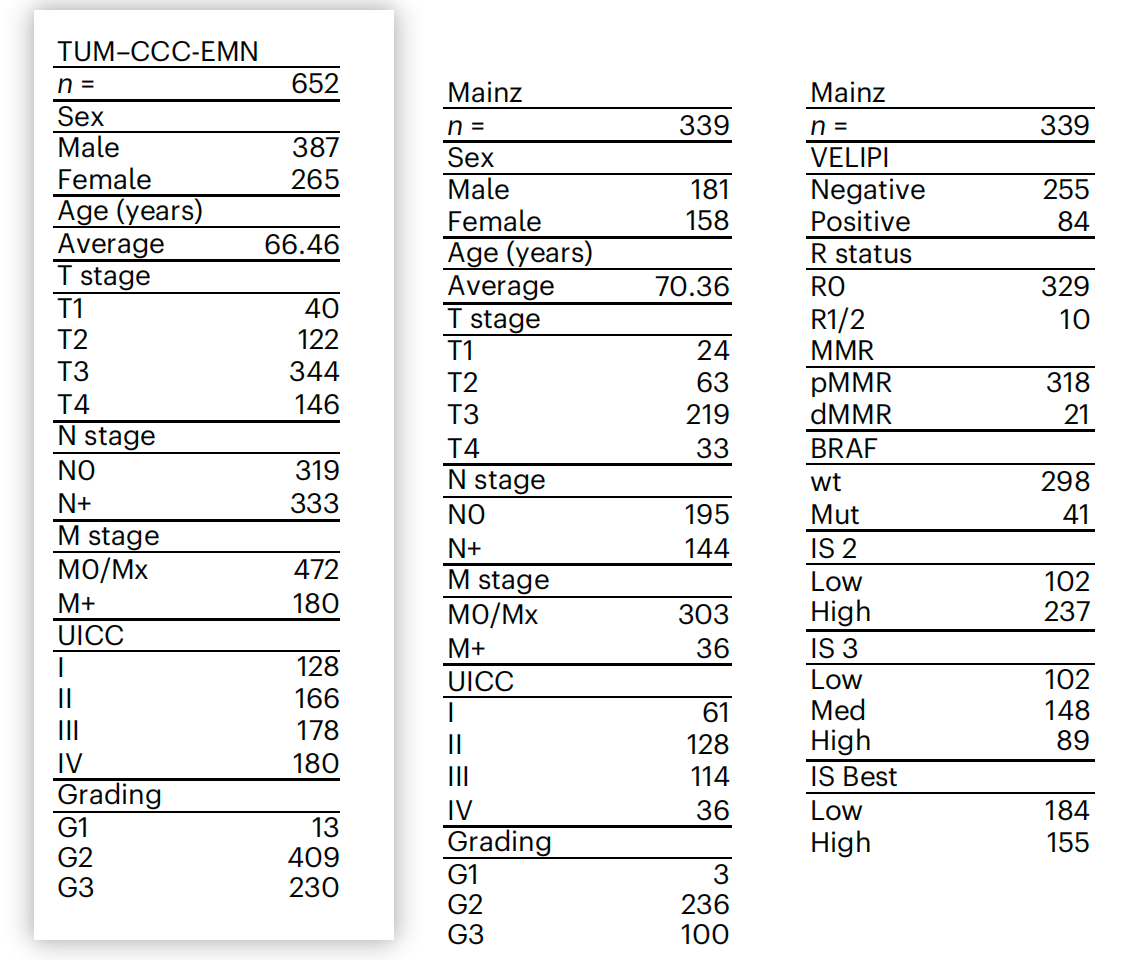
-
临床特征(Clinical characteristics):
-
表格列出了两个主要的临床队列:来自Mainz的队列和TUM–CCC-EMN(埃尔兰根大学医院 - 欧洲纽伦堡大都会区综合癌症中心)的队列。
-
每个队列的性别、年龄、肿瘤分期(T stage)、淋巴结状态(N stage)、远处转移状态(M stage)、UICC分期、分级(Grading)、BRAF突变状态(Mut)、错配修复(MMR)状态(dMMR代表缺陷,pMMR代表正常)等信息。
-
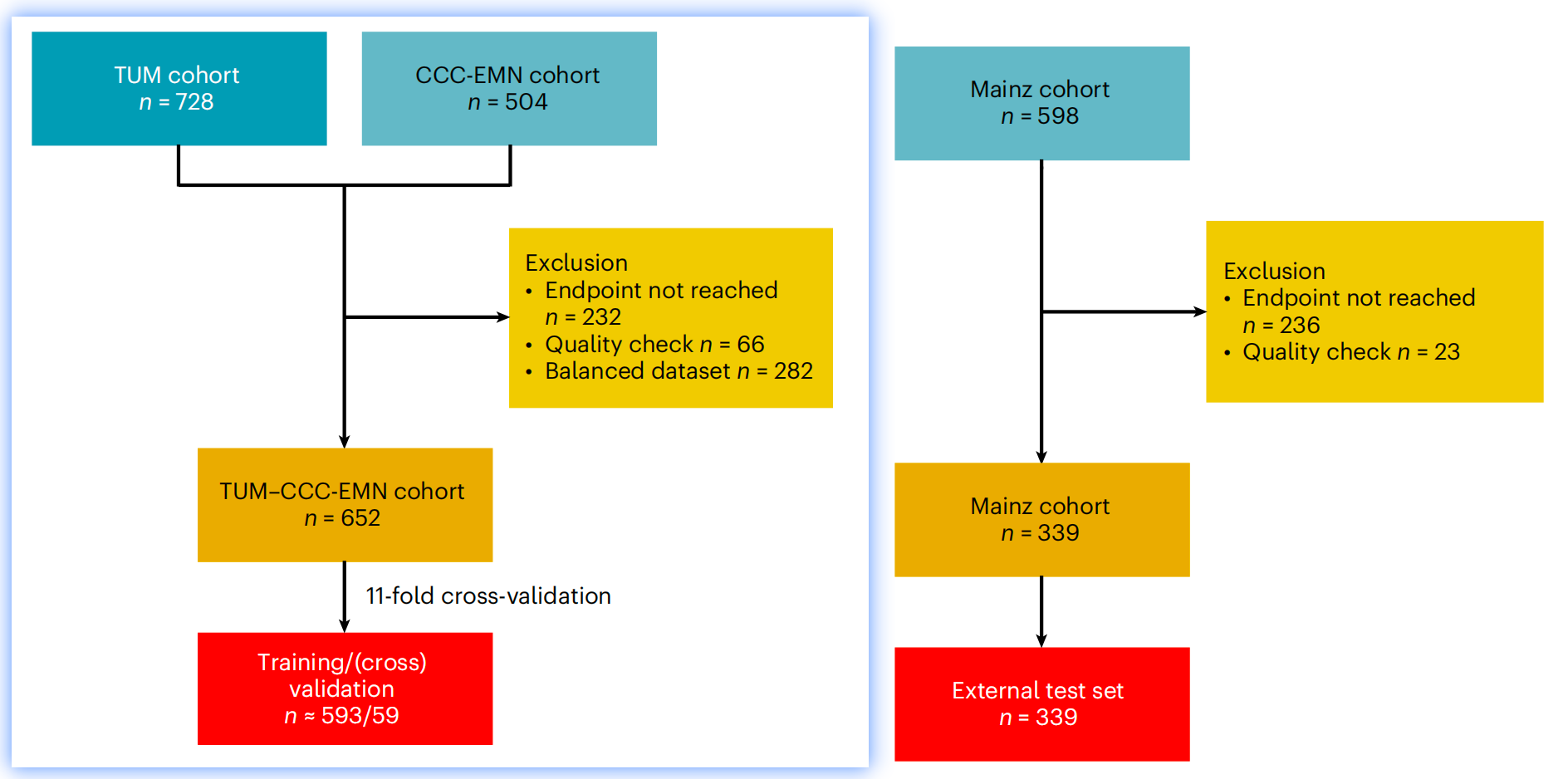
- CONSORT图:
- CONSORT图通常用于展示研究参与者的纳入和排除流程。在这项研究中,图展示了以下信息:
- 初始纳入的患者总数。
- 因未达到终点(例如,3年内未复发或复发)而排除的患者数量。
- 质量检查排除的患者数量。
- 最终用于训练、验证和测试的数据集的患者数量。
- CONSORT图通常用于展示研究参与者的纳入和排除流程。在这项研究中,图展示了以下信息:
Fig. 1 是研究方法部分的重要组成部分,它帮助读者理解研究的参与者是如何被选择和分类的,以及每个队列的临床特征是如何分布的。这对于评估研究结果的普适性和可靠性至关重要。
四、机器学习+病理+临床信息,预测“三阴性乳腺癌”患者对新辅助治疗的组织学反应

文献概述
文章主要研究了
三阴性乳腺癌(Triple-negative breast cancer, TNBC)的新辅助治疗(neoadjuvant chemotherapy, NACT)效果的预测问题。
TNBC是一种预后较差、治疗选择有限的罕见癌症,其特点是高转移潜力和治疗反应的异质性。
研究团队利用机器学习(ML)技术,结合全切片图像(whole-slide images, WSIs)和临床信息,开发了一种在诊断时预测早期TNBC患者对NACT组织学反应的方法。
为了克服小规模研究的偏差,同时尊重数据隐私,研究采用了多中心的TNBC研究,使用联邦学习(federated learning, FL)技术,确保患者数据在医院防火墙后得到安全保护。
研究结果表明,基于WSIs的局部ML模型能够预测NACT的反应,而通过FL的协作训练可以进一步提高模型性能,达到与使用耗时的专家注释训练的ML模型相当的水平。
该ML模型具有可解释性,并且对特定的组织学模式敏感。这项概念验证研究将FL应用于真实世界数据集,为未来使用前所未有的大型数据集发现生物标志物铺平了道路。
文章还讨论了如何通过FL模型提高对NACT反应的预测能力,并在两个外部验证队列上测试了模型的稳健性。
此外,研究者还应用了可解释性方法来分析最佳的联邦学习深度学习模型,并讨论了几个与TNBC中NACT反应相关的新潜在生物标志物。
总体而言,这项研究展示了在保护数据隐私的同时,如何利用分散在不同医院的数据来提高对罕见疾病治疗效果预测的准确性,并为未来的生物标志物发现和个性化医疗提供了新的可能性。
重点关注
Fig. 1展示了三阴性乳腺癌(TNBC)的治疗路径和医院间的协作联邦学习(FL)研究的概览。
这个图分为两个主要部分:
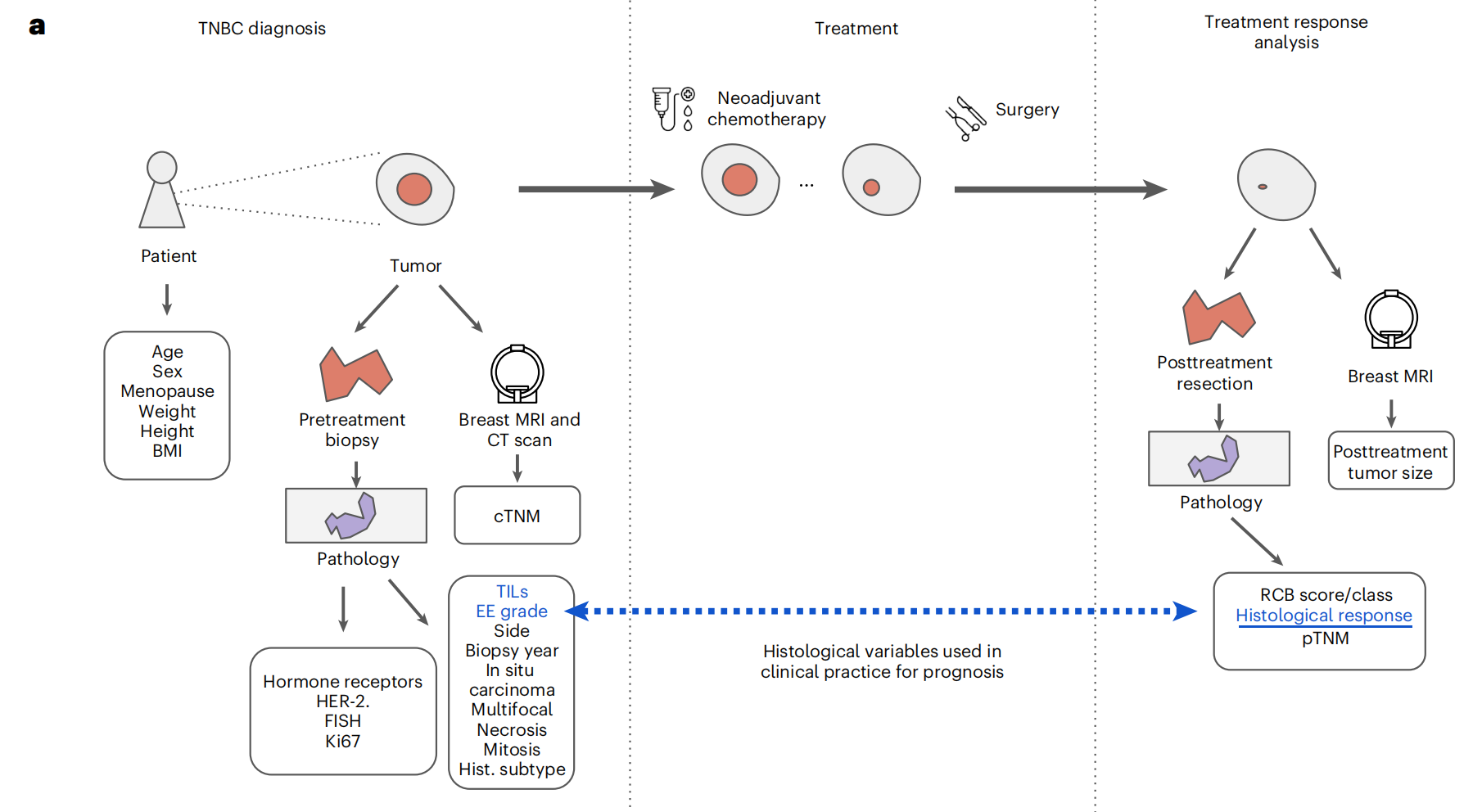
a. TNBC治疗路径:
- 诊断:TNBC的诊断始于对原发肿瘤的活检和随后的组织病理学分析,以及乳房MRI和CT扫描。这些检查帮助获取描述诊断时患者状态的人口统计学、临床和组织病理学变量。
- 治疗:治疗包括新辅助化疗(NACT)后进行手术。NACT的目的是缩小肿瘤,为手术创造条件。
- 治疗反应分析:使用另一次乳房MRI和组织学分析来评估治疗反应,这有助于得出治疗后的TNM评分、残留癌负荷(RCB)评分,最终确定组织学反应。预测组织学反应的标准临床实践主要依赖于治疗前肿瘤的EE组织学等级和肿瘤浸润性淋巴细胞(TILs)的评估。
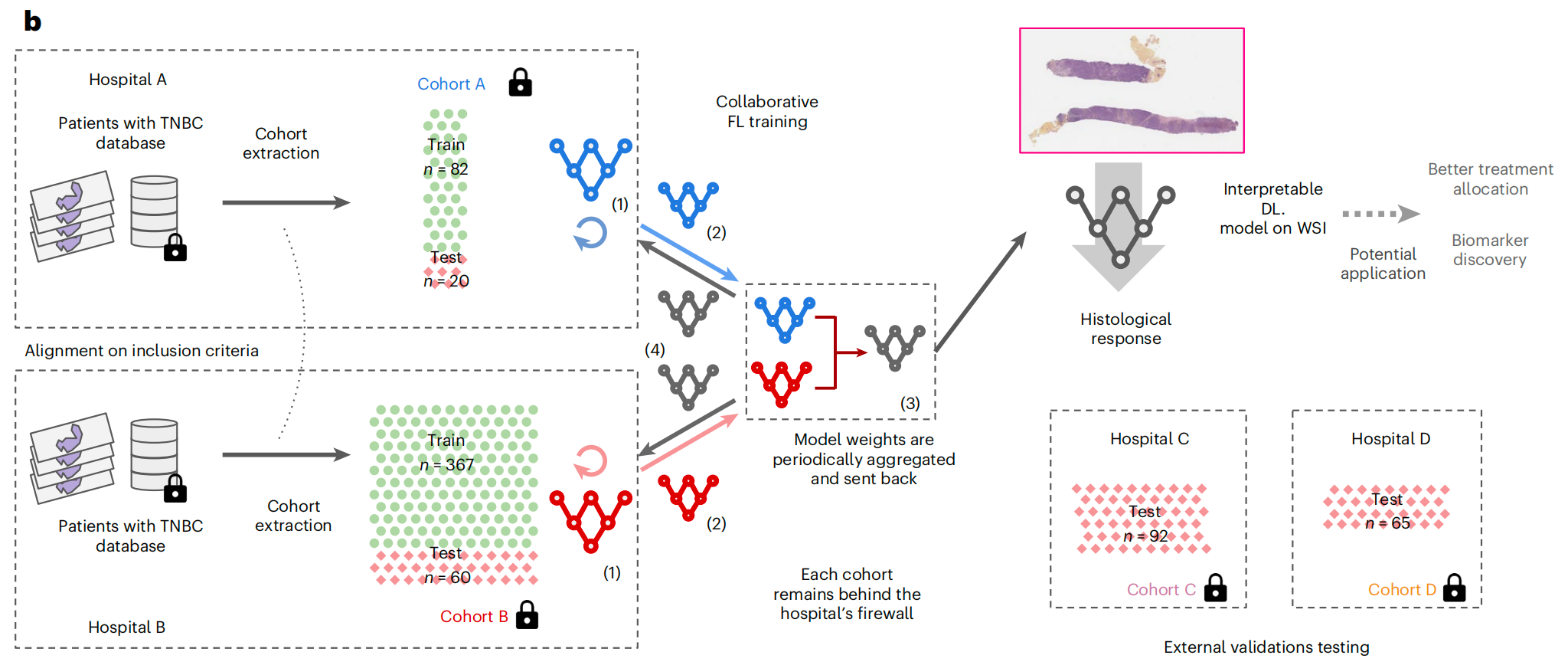
b. 协作FL研究概述:
- 队列提取:从两个不同的医院中提取了两个队列A(n=102)和B(n=427),它们有相似的纳入标准和格式,包括a部分描述的临床变量以及治疗前活检的全切片图像(WSI)。
- DL模型训练:使用协作FL的方式训练了一个深度学习(DL)模型,同时保持数据在各自医院的防火墙之后,目的是基于WSI预测组织学反应。在协作FL中,模型首先在本地训练,然后发送到聚合节点,在那里进行平均,并将得到的共识模型发送回工作节点,这个过程在多个轮次中迭代进行。
- 模型测试与应用:训练完成的模型能够从WSI预测NACT反应,并且设计上是可解释的。该模型随后从FL网络中提取出来,并在两个外部验证队列C(n=92)和D(n=65)上进行测试。这个概念验证的潜在未来应用包括改善治疗分配和生物标志物的发现。
图1强调了FL在医学研究中的应用潜力,尤其是在处理跨多个中心的敏感数据时,能够在不共享原始数据的情况下,通过协作训练提高模型的预测能力。这对于罕见疾病如TNBC的研究尤其重要,因为它允许研究者利用更大规模的数据集来训练高质量的ML模型。
五、“肺癌”患者在接受新辅助疗法后的病理反应与生存率之间的关系

文献概述
研究主要探讨了肺癌患者在接受新辅助疗法(包括免疫疗法和化疗)后的病理反应与生存率之间的关系。
研究发现,新辅助免疫疗法加上化疗可以提高无事件生存期(EFS)和病理完全缓解(pCR,即在原发肿瘤和淋巴结中没有残留的活性肿瘤)。
研究还提出了一种评估病理反应的新方法,即使用泛肿瘤评分系统来量化残余活性肿瘤(RVT)的比例,并发现这种评分系统能够预测EFS。
研究在名为CheckMate 816的随机、III期临床试验中进行,评估了新辅助nivolumab(一种抗PD-1药物)联合化疗在可切除肺癌患者中的疗效。
研究发现,无论淋巴结是否受累,0% RVT-PT(原发肿瘤中的残余活性肿瘤为0%)与>0% RVT-PT相比,EFS都有所提高。此外,研究还发现病理反应的深度(%RVT-PT)与EFS结果相关,且结合原发肿瘤和淋巴结的病理反应有助于区分不同的预后结果。
文章还讨论了病理反应评估与放射学反应和循环肿瘤DNA清除率的比较,并指出病理反应在预测EFS方面更为准确。
研究结果支持将病理反应作为新兴的生存替代指标,并呼吁对肺癌和其他肿瘤类型中%RVT的全谱进行进一步评估。
总的来说,这项研究强调了病理反应评估在肺癌新辅助治疗中的重要性,并为未来的临床试验设计和治疗决策提供了科学依据。
重点关注
新辅助疗法治疗肺癌后
病理完全缓解(pCR)和残余活性肿瘤(RVT)百分比与无事件生存期(EFS)之间的关系。
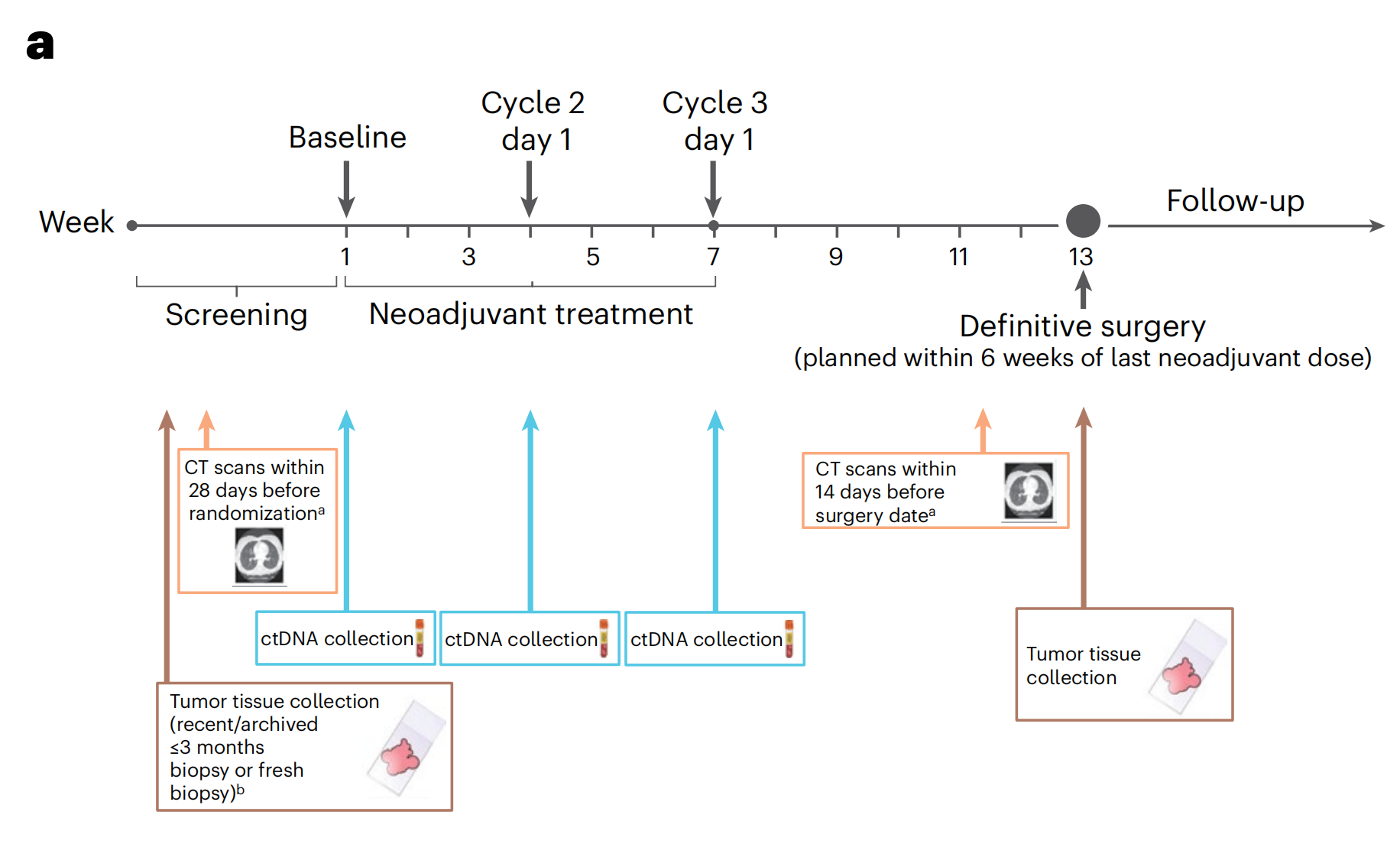
a. CheckMate 816 试验样本收集时间线:这张图展示了生物标志物研究中样本的收集时间点,包括放射影像学成像(橙色)、循环肿瘤DNA(ctDNA,蓝色)和肿瘤组织(棕色)。
b 中的示意图和代表性显微照片详细展示了免疫相关病理反应标准(irPRC)的评分系统。
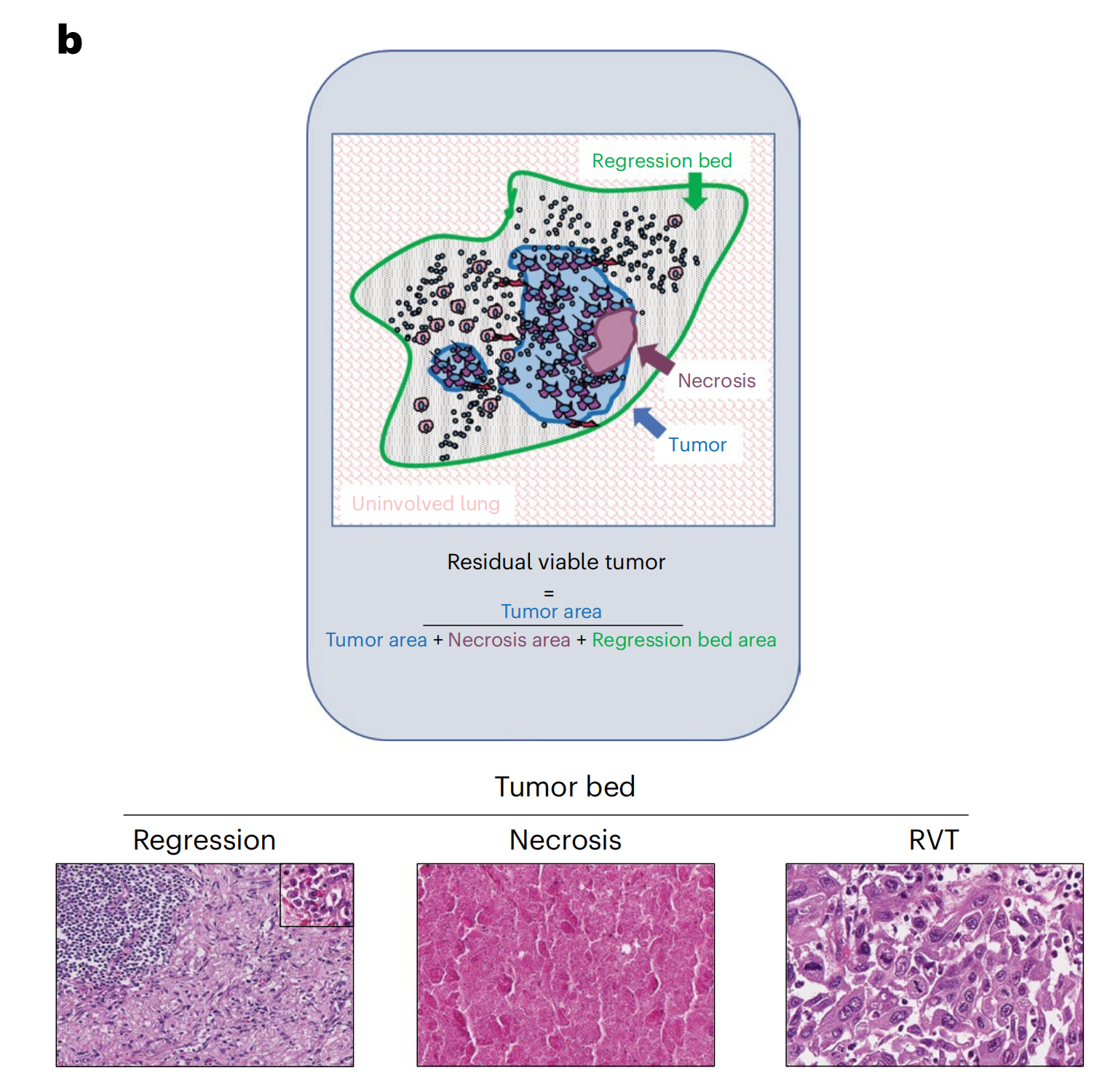
- irPRC评分示意图:这部分提供了irPRC评分的视觉表示,帮助理解评分系统是如何根据组织学特征来评估肿瘤对治疗的反应。
- 组织学成分:显微照片展示了评分系统中包含的不同组织学成分,这些成分包括:
- 纤维化区域:这是肿瘤组织被替换后留下的瘢痕组织,表明肿瘤曾经存在过。
- 新生血管化:新形成的血管,通常在肿瘤组织被清除后出现,是组织修复和再生的标志。
- 肿瘤浸润性淋巴细胞(TIL):这些是侵入肿瘤组织的免疫细胞,它们的出现表明免疫系统正在对肿瘤发起攻击。
- 三级淋巴结构(TLS):显微照片中的TLS位于左上角,这是一种特殊的淋巴细胞聚集,通常与免疫反应有关,可能在肿瘤微环境中促进免疫细胞的相互作用。
- 浆细胞群:插图突出显示了在回归区域常见的浆细胞集合。浆细胞是免疫系统的一部分,它们产生抗体,有助于对抗肿瘤。
- 回归区域:显微照片特别展示了回归区域,这是肿瘤组织被免疫反应或其他治疗效应清除的地方。回归区域通常伴随着上述的组织学变化。
- 评分目的:irPRC评分系统旨在量化肿瘤对新辅助免疫疗法的反应,通过评估肿瘤组织的残留活性、坏死和回归的程度来预测患者的预后。
- 临床意义:通过这种评分系统,病理学家可以更准确地评估肿瘤对治疗的反应,为临床医生提供关于患者预后和进一步治疗决策的重要信息。
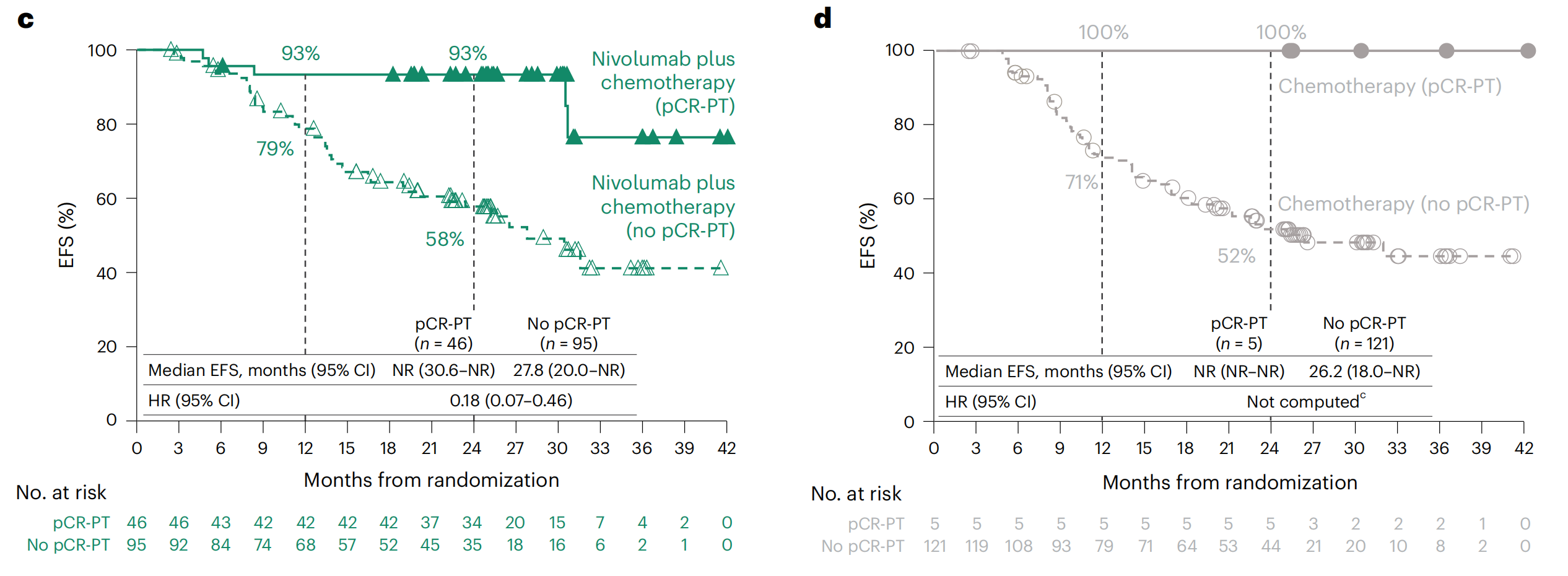
c. 和 d. pCR状态的EFS Kaplan-Meier曲线:c 部分显示了接受nivolumab加化疗治疗组的患者的EFS Kaplan-Meier曲线,而 d 部分显示了仅接受化疗治疗组的患者的EFS Kaplan-Meier曲线。这些曲线根据原发肿瘤(PT)的pCR状态来划分患者群体。
e. %RVT的ROC曲线分析:这部分展示了接受nivolumab加化疗治疗的可评估病理患者群体中,2年EFS率与原发肿瘤中RVT百分比的ROC曲线分析。ROC曲线用于评估连续变量预测结果的准确性,曲线下面积(AUC)为0.74,表明%RVT是一个预测2年EFS的有用指标。
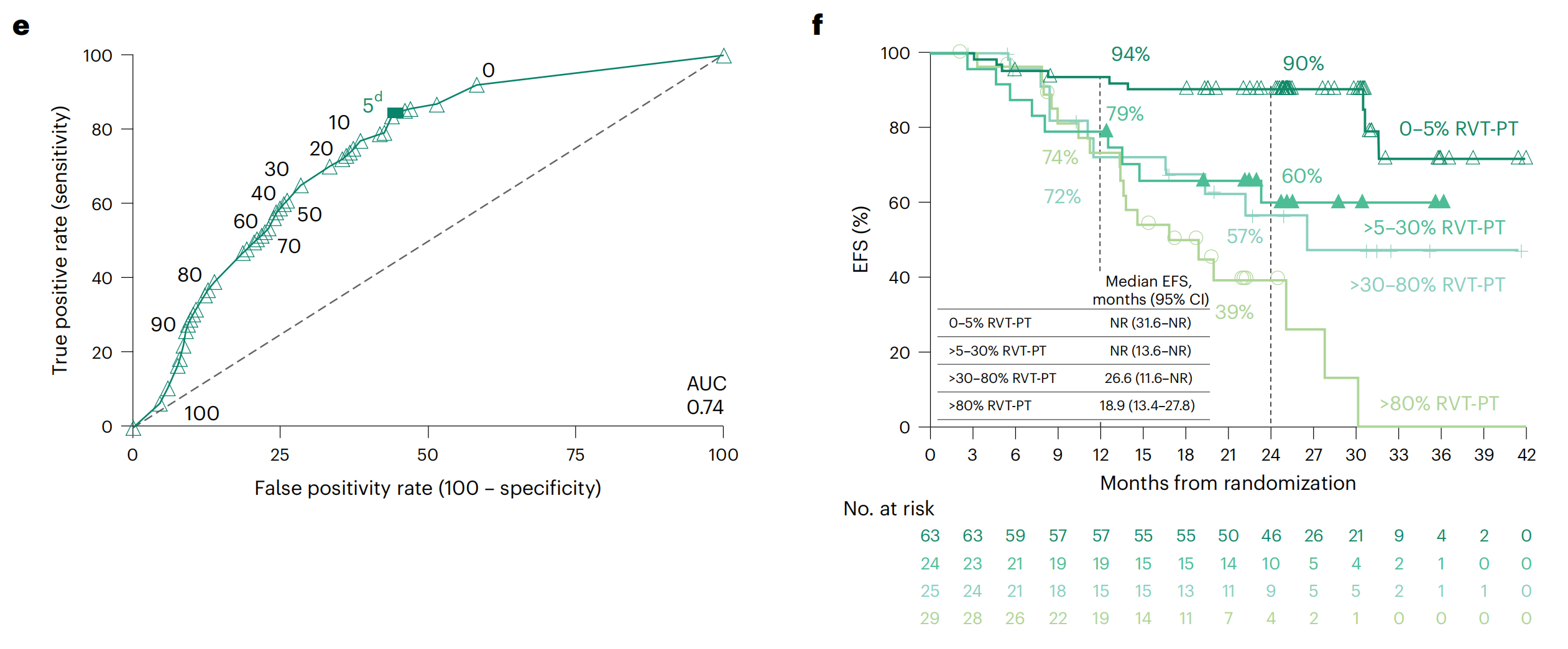
f. %RVT分类的EFS Kaplan-Meier曲线:这部分展示了根据原发肿瘤中RVT的不同百分比类别,接受nivolumab加化疗治疗的可评估病理患者群体的EFS Kaplan-Meier曲线。不同的RVT百分比范围(0-5%,>5-30%,>30-80%,>80%)与2年EFS率有明显差异。
其他注释:
- 使用了RECIST 1.1标准来评估肿瘤的放射学反应。
- 对于可手术的纵隔淋巴结进行了采样,所有可疑的纵隔淋巴结如果可以通过内窥镜超声(EBUS)、纵隔镜检查或胸腔镜手术到达,则需要进行病理确认。
- 由于只有5名患者达到了化疗组的pCR-PT,因此没有计算该组的风险比(HR)。
- 图中的实心方块表示最佳截止值,这是所有可能的截止值中真正例率和假正例率之差。
数据库锁定日期为2021年10月20日,nivolumab加化疗组和化疗组的最短随访时间为21个月,中位随访时间为29.5个月。
注意:CT代表计算机断层扫描,EBUS代表内窥镜超声,NR代表未达到,TIL代表肿瘤浸润性淋巴细胞,TLS代表三级淋巴结构。
六、放射基因组学模型,预测高级别浆液性卵巢癌患者对新辅助化疗的反应

文献概述
这篇文章是关于一种新型的集成放射基因组学模型(Integrated Radiogenomics models),用于预测高级别浆液性卵巢癌(High grade serous ovarian carcinoma, HGSOC)患者对新辅助化疗(Neoadjuvant chemotherapy, NACT)的反应。
HGSOC 是一种高度异质性的疾病,通常在晚期、转移性状态下被发现,其复杂性是预测NACT反应和理解反应关键决定因素的主要障碍。
研究者提出了一个框架,通过整合基线临床数据、基于血液的生物标志物以及从所有原发和转移性病变中提取的放射组学生物标志物来预测HGSOC患者对NACT的反应。
他们使用了一种集成机器学习模型,该模型被训练用来预测总疾病体积的变化,并在诊断时获取数据(n = 72)的基础上进行训练。
该模型在内部保留队列(n = 20)和独立外部患者队列(n = 42)中进行了验证。在外部队列中,与临床模型相比,集成放射组学模型将预测误差降低了8%,在RECIST 1.1分类上达到了0.78的AUC,而临床模型的AUC为0.47。
研究结果强调了在治疗反应的整合模型中包含放射组学数据的价值,并提供了开发新的基于生物标志物的NACT临床试验的方法。
研究还发现,放射组学特征与临床和生物学特征相关联,并且某些全局生物标志物(如分期、CA-125或ctDNA)的信息也可以通过多病变放射组学特征来捕获,这些特征量化了疾病的范围、传播、异质性和背景。
研究者设计了一个名为IRON(Integrated Radiogenomics for Ovarian Neoadjuvant therapy)的集成放射基因组机器学习框架,该框架是一个包含三个机器学习管道的稳健集成体,每个管道都包括一个分类器(弹性网、支持向量回归或随机森林),前面是共线性减少和特征选择步骤。
最后,研究指出,尽管该研究提供了放射基因组数据整合的概念验证,以描述和预测HGSOC患者对NACT的反应,但需要在更大的队列中验证这些结论,并在未来的模型中纳入更多的分子分析和计算病理学,以提高模型性能并详细解释反应背后的主要驱动因素。
重点关注
研究的结构和训练队列的主要特征。
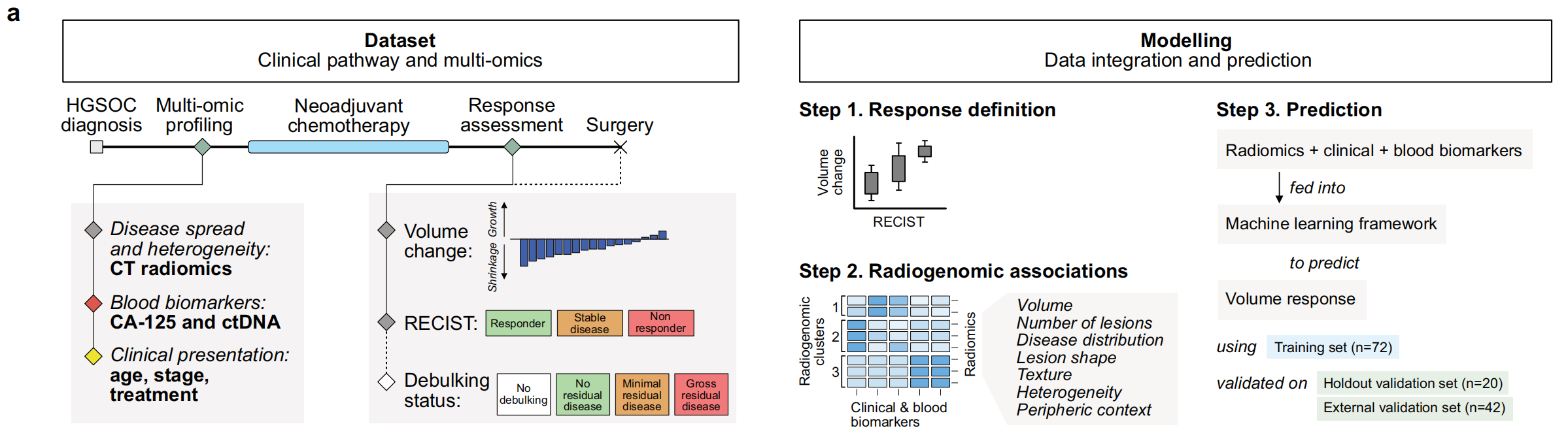
a. 关键时间点和数据集变量:左侧展示了数据集中的关键时间点和变量,右侧展示了建模策略的步骤。补充图S1提供了额外信息。这表明研究设计包括多个阶段,从患者入组到治疗反应评估。
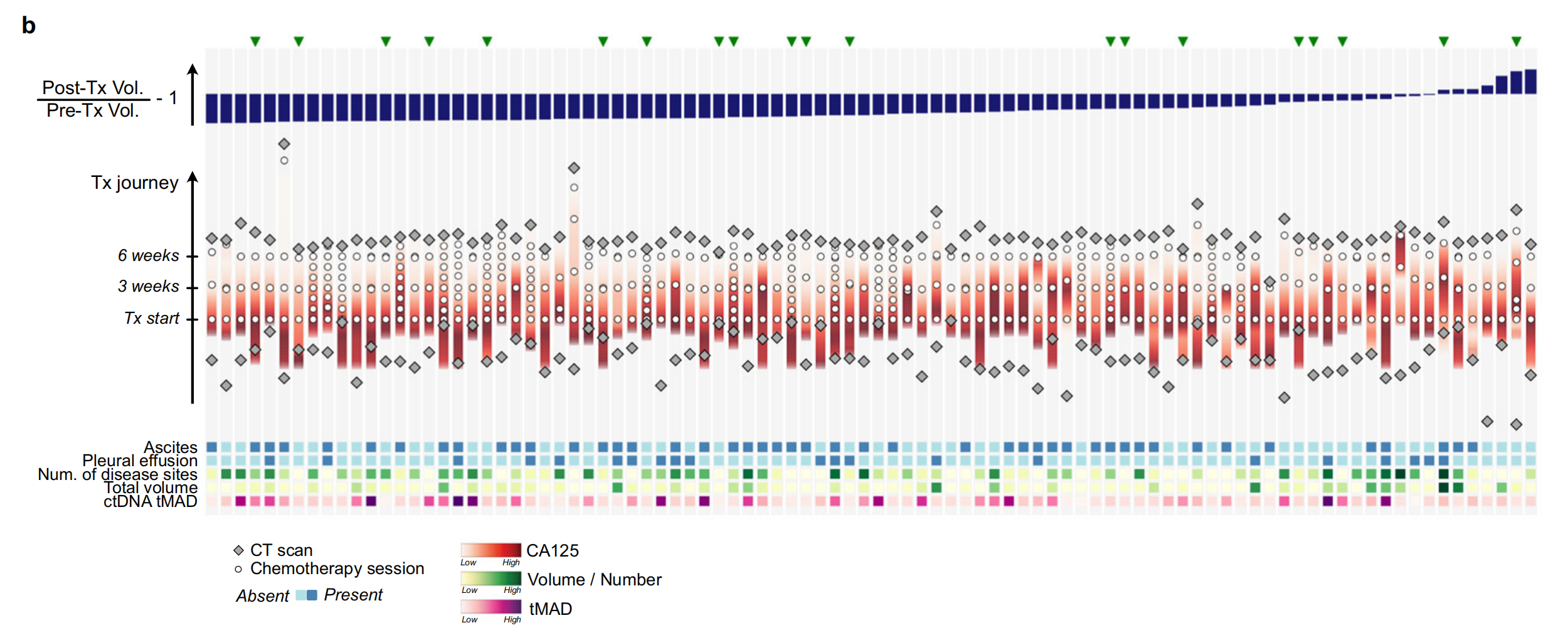
b. NeOV队列的治疗过程:展示了92名患者在接受NACT后的体积肿瘤反应排序。在保留验证集中随机选择的患者用绿色三角形表示。治疗过程从底部向上垂直排列,与第一个化疗周期的时间对齐。底部的热图显示了基线时获得的额外生物标志物。这显示了不同患者对治疗的不同反应和治疗的个体化路径。
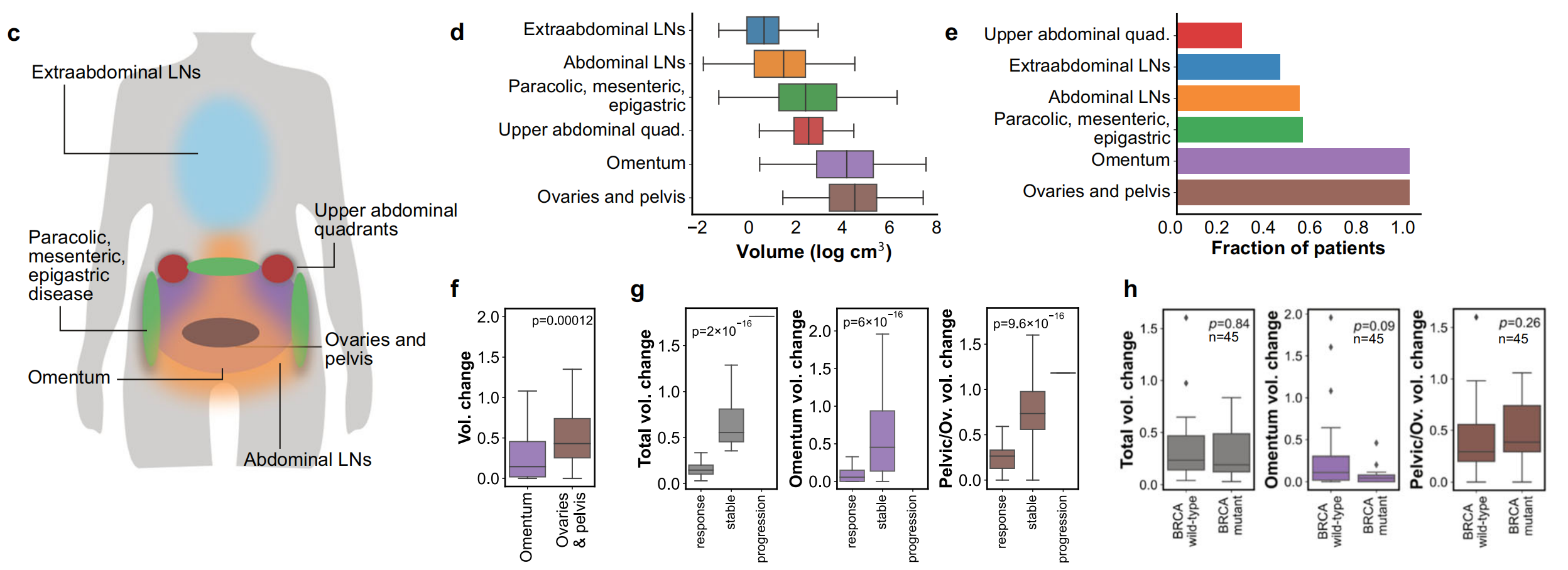
c. HGSOC的原发和转移病灶部位:展示了高级别浆液性卵巢癌中原发和转移病变的常见部位。
d. 训练队列中肿瘤体积的分布:展示了训练队列中不同部位肿瘤体积的分布情况。
e. 肿瘤部位的分布:展示了训练队列中每个患者的肿瘤部位分布。
f. 大网膜和盆腔/卵巢病变的体积变化:展示了训练队列中所有患者大网膜和盆腔/卵巢病变的体积变化。使用双侧Mann-Whitney U检验获得p值,以评估统计学差异。
g. 按RECIST 1.1反应状态分层的总体积和部位特异性体积变化:为训练队列展示了根据RECIST 1.1标准分层的总体积和部位特异性体积变化。使用双尾点双系列相关系数获得p值。
h. 按BRCA突变状态分层的总体积和部位特异性体积变化:这部分数据仅限于训练队列中已知BRCA突变状态的45名患者。使用双侧Mann-Whitney U检验获得p值。
图1中的箱线图表示了数据的四分位数范围,中位数用线表示。异常值用圆圈表示,并通过四分位距规则识别。























 992
992











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








