小罗碎碎念
今日推文主题:人工智能在病理组学和影像组学中的最新研究进展
今天早上爬起来写Nat Med发表的那篇子宫内膜癌的文献精析,写的我整个人都emo了,比昨天写那篇卵巢癌的Nat Commun吃力太多了,看来还是需要加强锻炼。
眼看着就到十点了,下午还要去酒店当会议工作人员,没有办法,只得停下来,把今天的文献速递写了。今天的第二篇文献又是一篇关于子宫内膜癌的研究,小罗在早上那篇Nat Med的阴影下,顶着生理不适强行写完了这期推文,且看且珍惜,哈哈。

一、用于增强诊断准确性和效率的病理AI协作框架


文献概述
文章介绍了一个名为
nuclei.io的数字病理框架,该框架结合了主动学习和实时的人机交互反馈,用于快速创建多样化的数据集和模型。
研究通过两项交叉用户研究验证了该框架的有效性,这些研究利用了AI与病理学家之间的协作,包括在子宫内膜活检中识别浆细胞以及在淋巴结中检测结直肠癌转移。在两项研究中,nuclei.io都显著提高了诊断性能。
文章详细讨论了人工智能(AI)和机器学习(ML)算法在数字病理学中取得的显著成就,这些成就包括细胞或组织分割、图像分类、患者预后预测以及淋巴结转移识别等。尽管AI在某些定义明确的任务中可能在准确性方面超越病理学家,但在临床设置中部署病理AI算法面临挑战,这些挑战包括现有的法规和临床实践、伦理问题(如模型透明度和患者安全)以及医疗责任等。
研究着重于如何通过人机协作来提升手术病理学中的诊断准确性和效率。例如,先前的研究调查了深度学习辅助检测乳腺癌淋巴结转移对六位病理学家的影响,发现AI可以减少每张切片的审查时间。另一项研究描述了对80例肝癌亚型分类的ML辅助可以提高诊断能力,特别是对于那些具有明确经验水平的病理学家。最近的研究建议使用ML可以减少寻找乳腺癌淋巴结转移的筛查时间。
文章还介绍了nuclei.io框架的四个阶段:
- 数字扫描和WSI细胞核分割
- 使用可解释特征和深度学习特征的单细胞核级特征提取
- 病理学家与系统交互提供实时反馈的主动学习阶段
- 最终的模型微调和推荐
此外,文章还讨论了如何通过实时人机交互数字病理框架解决数据限制的挑战,并强调了主动学习与人类反馈结合的重要性。
研究设计包括两项独立的用户研究,每项研究都有不同的目标。
- 第一项研究评估了专家训练的ML模型,重点是在子宫内膜活检中识别浆细胞。
- 第二项研究评估了个性化的ML模型,重点是检测结直肠癌转移到淋巴结的情况。
研究结果表明,个性化的ML模型可以提高对孤立肿瘤细胞的检测灵敏度,并在不同情况下显著提高了时间效率。
文章最后讨论了AI/ML在医疗领域的部署限制,以及如何通过nuclei.io框架来实现AI与病理学家的协作,从而提高数字病理学的准确性和效率。作者认为,将病理学家的专业知识与AI/ML算法相结合,可以显著提高手术病理学家的评估质量、速度和信心,最终有助于改善临床工作流程和患者护理。
重点关注
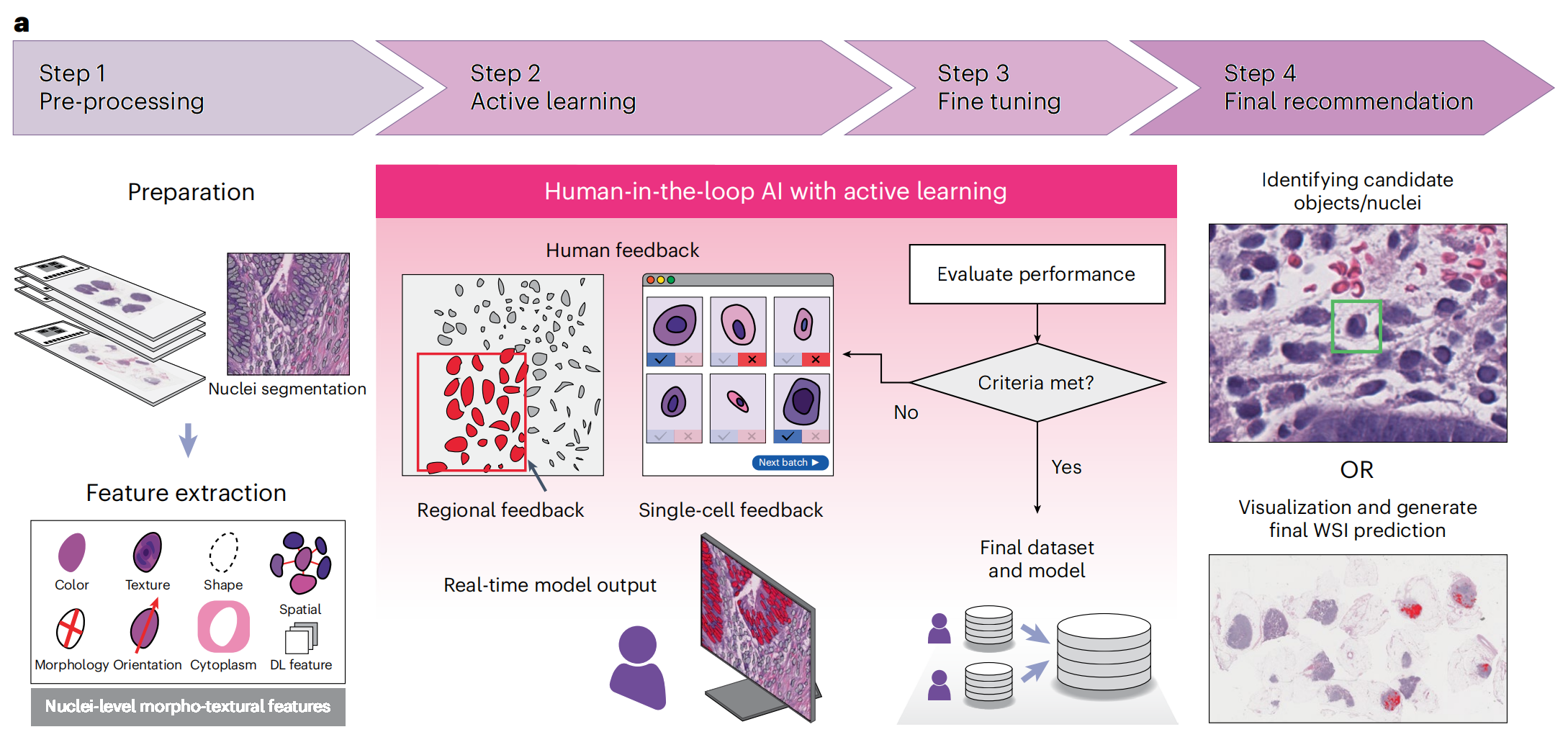
在文章中,Fig. 1 提供了对nuclei.io框架和研究设计的概览。
a. Human-in-the-loop active learning for digital pathology from WSI pre-processing to the final recommendation.
- 这部分展示了一个流程图,描述了从全切片图像(Whole Slide Image, WSI)的预处理到最终推荐的人机交互式主动学习过程。
- 流程包括以下步骤:
- 预处理(Pre-processing):WSI 扫描并进行细胞核分割。
- 特征提取(Feature extraction):提取细胞核的形态和纹理特征。
- 主动学习(Active learning):利用病理学家的反馈进行模型训练和数据标注。
- 微调(Fine-tuning):根据反馈优化模型。
- 最终推荐(Final recommendation):生成最终的诊断建议。
- 这个过程强调了实时反馈和模型迭代的重要性,以提高诊断的准确性。
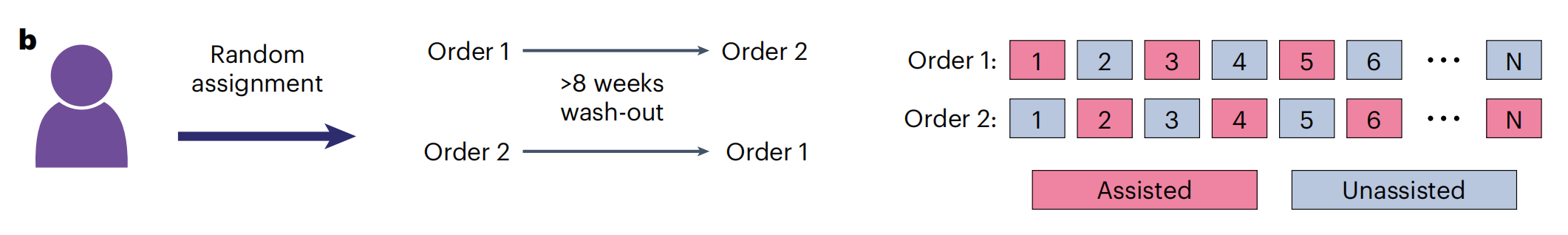
b. Crossover study design.
- 这部分描述了交叉研究设计,其中病理学家在辅助(Assisted)和非辅助(Unassisted)模式之间交替进行切片评估。
- 研究设计了两个顺序(Order 1和Order 2),每个顺序都包含了辅助和非辅助模式,但顺序不同。
- 这种设计允许比较两种模式对病理学家诊断性能的影响,并评估AI辅助的潜在好处。
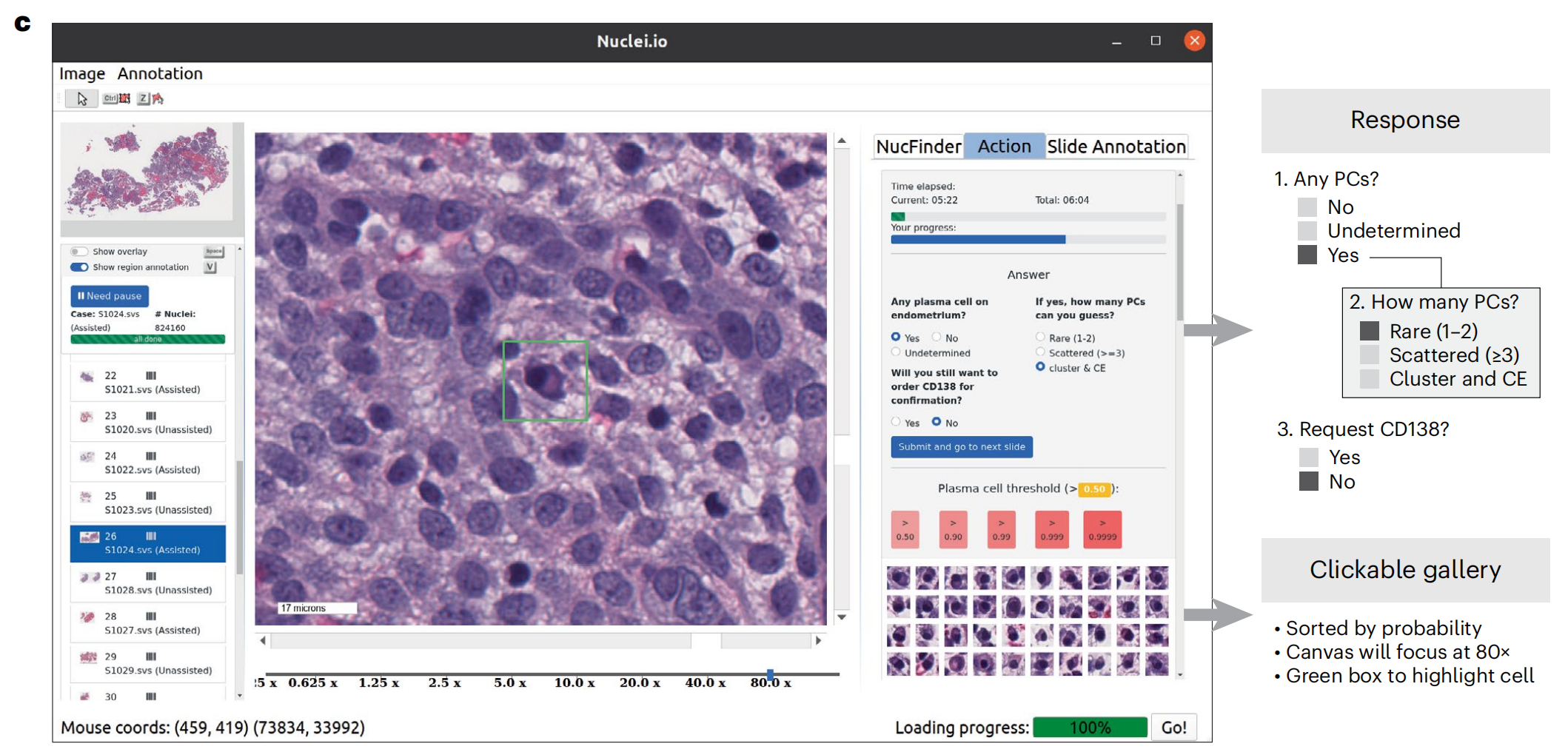
c. Screenshot of the nuclei.io interface used for PC identification.
- 这部分提供了nuclei.io界面的截图,展示了如何用于浆细胞(Plasma Cells, PCs)的识别。
- 界面显示了潜在的PCs,用绿色框标记,并且有一个侧边栏,列出了按概率排序的候选细胞。
- 每个候选细胞都可以点击,并导航到80倍放大的目标位置,供病理学家审查。
整体而言,Fig. 1 强调了nuclei.io框架的核心特点:结合AI算法和病理学家的专业判断,通过实时反馈和模型迭代,提高病理诊断的效率和准确性。该框架旨在通过人机协作,优化AI在临床病理诊断中的应用。
二、人工智能(AI)进行组织病理学图像分析,识别和区分子宫内膜癌(EC)的分子亚型


文献概述
这篇文章是一项关于使用人工智能(AI)进行组织病理学图像分析的研究,目的是识别和区分
子宫内膜癌(EC)的分子亚型。
研究团队运用AI技术对368名患者的组织病理学图像进行了分析,并在两个独立的验证队列中进一步验证了结果,这两个队列分别包含290名和614名来自其他中心的患者。
研究发现,通过AI分析能够区分p53异常(p53abn)和无特定分子特征(NSMP)的EC亚型,并且识别出一个NSMP EC患者亚群,这些患者的无进展生存期和疾病特异性生存率显著较差,被称为“p53abn样NSMP”。
研究还通过浅层全基因组测序发现,与普通NSMP相比,“p53abn样NSMP”群体的基因拷贝数异常负担更高,表明这一群体在生物学上与其他NSMP EC不同。该研究证明了AI在检测预后不同且传统分子或病理标准难以识别的EC亚群方面的强大能力,从而改进了基于图像的肿瘤分类。
此外,研究还指出,传统的临床病理参数在分类EC和指导治疗方面的可重复性不佳,特别是在高级别肿瘤中。AI的应用为识别具有侵袭性疾病的EC患者提供了新的工具,这些患者可能被过度治疗或未得到可能降低复发风险的适当治疗。研究结果表明,AI方法在区分p53abn和NSMP EC亚型方面具有较高的准确性和可靠性,并且可以推广到不同中心收集的数据集。
研究使用了多种深度学习模型以提高分类的准确性和鲁棒性,包括
- VarMIL
- Vanilla
- IDaRS
- HistogramBased
- Attention-based
- VLAD
- CLAM-MB
- CLAM-SB
- TransMIL
通过生存分析,研究还评估了不同亚群的疾病特异性生存期(DSS)和无进展生存期(PFS)。研究结果对于改善EC的诊断和治疗具有重要的临床意义,并且可以指导未来的临床试验和生物标志物的研究。
重点关注
图1展示了基于AI的组织病理学图像分析的工作流程,具体步骤如下:
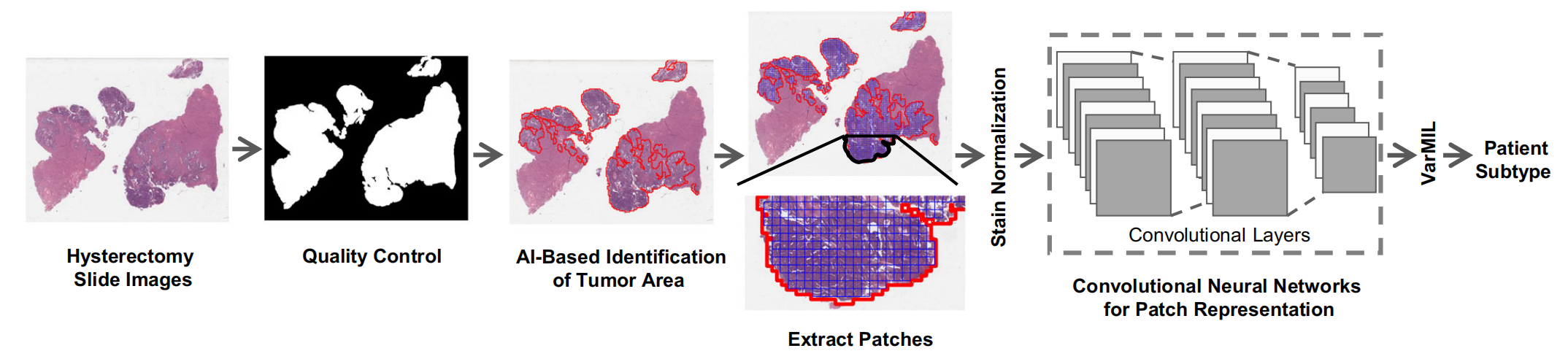
-
质量控制:首先使用名为HistoQC【81】的质量控制框架来生成一个掩膜,该掩膜仅包含组织区域,并去除图像中的伪影或异常。
-
肿瘤区域识别:接着,训练一个AI模型来识别组织病理学切片中的肿瘤区域。这个模型能够识别出哪些区域是肿瘤组织。
-
图像分割:识别出的肿瘤区域的图像被进一步分割成较小的块(patches),这些小块通常是512×512像素的大小。
-
颜色标准化:为了消除不同染色协议带来的颜色变化,对这些小块进行标准化处理,以确保颜色的一致性。
-
深度学习特征提取:将标准化后的图像小块输入到深度学习模型中,以提取每个小块的特征表示。这一步骤是深度卷积神经网络(CNN)发挥作用的地方,它能够学习图像块中与肿瘤分类相关的特征。
-
多实例学习模型预测:最后,使用基于多实例学习(Multiple Instance Learning, MIL)的模型VarMIL来预测患者的亚型。VarMIL模型能够综合考虑所有小块的特征,并对整个图像进行分类,从而预测患者的肿瘤亚型。
整个流程是一个从原始的组织病理学图像到肿瘤亚型预测的自动化过程,涉及到图像处理、深度学习和机器学习等多个步骤,旨在提高肿瘤分类的准确性和效率。
三、多组学分析肝细胞癌,揭示其代谢重编程的特征并探索其在精准治疗中的应用潜力


文献概述
这篇文章是一项关于肝细胞癌(HCC)的研究。
研究团队通过多组学的方法对HCC进行了深入分析,以揭示其代谢重编程的特征,并探索了这些特征在精准医疗中的应用潜力。
- 研究背景:肝细胞癌是全球癌症死亡的第二大原因,具有高度的异质性,导致有效治疗选择有限。
- 研究方法:通过结合转录组学、代谢组学和脂质组学的全面分析,识别了HCC中与葡萄糖代谢、脂质氧化降解和新合成脂质途径相关的显著变化。
- 研究结果:脂质组学分析揭示了HCC样本中甘油脂、磷脂酰胆碱(PC)和鞘脂(SL)衍生物的异常变化。利用机器学习技术,研究者识别出与脂质代谢相关的基因,这些基因作为不同病因HCC的共同生物标志物。研究还发现,靶向饱和脂肪酸磷脂酰胆碱(SFA-PC)和长链鞘脂生物合成途径,特别是通过抑制酶Lysophosphatidylcholine Acyltransferase 1 (LPCAT1)和Ceramide Synthase 5 (CERS5),可能是HCC治疗的潜在策略。此外,数据还揭示了CERS5在促进肿瘤进展中的致癌作用,特别是通过脂质自噬。
- 结论:研究阐明了HCC中脂质代谢的代谢重编程特征,识别了预后标志物和治疗靶点,并强调了代谢相关靶点在HCC治疗干预中的潜力。
注意,这是跨国合作——研究由多个中国和奥地利的研究机构共同完成,得到了中国国家自然科学基金、山东省自然科学基金等多个基金项目的支持。(有能力的老师/同学也整一个,至少能撑撑门面,哈哈。玩笑归玩笑,话说回来,这样合作是有好处的,可以提升模型的泛化性)
四、基于人工智能(AI)的转录组学特征标记,开发并验证个性化胰腺导管腺癌(PDAC)患者的辅助化疗方案


文献概述
这项研究,旨在开发和验证一种基于人工智能(AI)的转录组学特征标记,以个性化胰腺导管腺癌(PDAC)患者的辅助化疗方案。
研究团队使用了来自临床前模型的PDAC数据集,这些数据集包含了mFOLFIRINOX(mFFX)化疗方案成分的化疗反应概况。
通过独立成分分析、最小绝对收缩和选择算子-随机森林方法,研究者们鉴定出与化疗反应相关的特定基因转录本,并开发了三个转录组AI签名。这些AI签名与之前开发的吉西他滨签名结合,通过整合肿瘤微环境中的转录组特征,最终形成了Pancreas-View工具,该工具在PRODIGE24/CCTG PA6试验的343名患者队列中进行了临床验证。
研究结果显示,被预测对所使用药物敏感的患者(n=164;47.8%)比其他患者有更长的无病生存期(DFS)。特别是,接受mFFX治疗的mFFX敏感组的中位DFS为50.0个月,而接受吉西他滨治疗的吉西他滨敏感组的中位DFS为33.7个月。相比之下,化疗方案与签名预测不匹配的患者(n=86;25.1%)或对所有药物都有抗药性的患者(n=93;27.1%)的DFS更短,分别为10.6个月和10.8个月。
研究结论指出,这项研究展示了一种基于转录组的工具,该工具使用临床前模型和机器学习来准确预测对mFFX和吉西他滨的敏感性。Pancreas-View工具整合了四个药物签名,以协助做出更明智的治疗决策。这些签名能够准确识别高反应患者,预示着改善的无病生存和癌症特异性生存。临床验证涉及343名患者的队列,证实了这种方法的有效性。结合了来自临床前模型和机器学习的预测因子的转录组签名,提供了一种合理的治疗策略。
五、在炎症环境下,非干细胞系如何成为肠道肿瘤发生的另一种起源

以下是文章中第一作者和通讯作者的相关信息,以表格形式列出:

文献概述
这篇文章探讨了在炎症环境下,非干细胞系如何成为肠道肿瘤发生的另一种起源。
传统上认为结肠癌起源于干细胞,但炎症作为结肠癌的一个关键风险因素,已被证明能抑制肠道的干性。
研究者使用小鼠Paneth细胞作为模型,评估了在炎症环境下,分化的细胞系触发肿瘤形成的能力。研究发现,在炎症条件下,Paneth细胞特异性的Apc基因突变导致肠道肿瘤的形成,这些肿瘤不仅与患有炎症性肠病的患者中的肿瘤相似,也与更多的人类散发性结肠癌相似。这可能是因为西式饮食习惯带来的炎症后果,这是结肠癌的主要风险因素之一。
研究结果表明,在散发性结肠癌的相当一部分案例中,癌症的起源位于分泌细胞系,而不是干细胞。此外,研究者还发现,在Apc/Kras基因突变的小鼠Paneth细胞中,即使在没有炎症刺激的情况下,肿瘤的多样性也显著增加,并且这些细胞获得了干细胞标记,同时保留了一些分泌特征。研究还观察到WNT、MYC、Hedgehog和G2M检查点信号通路在这些细胞中上调。
这项研究提供了一种新的视角,即在炎症或其他因素(如西式饮食习惯)的影响下,分泌细胞可能会经历去分化过程,从而成为癌症发生的新起源。这可能对结肠癌的预防和治疗具有重要意义。
研究还发现,西式饮食触发的炎症反应导致Paneth细胞去分化,并且这种去分化过程与肿瘤发生有关。研究者通过单细胞RNA测序(scRNA-seq)分析和谱系追踪,揭示了Paneth细胞在遗传靶向或炎症刺激下如何获得不同的细胞特征。此外,研究还表明,人类散发性结肠癌中有一部分可能起源于非干细胞,这与小鼠模型中观察到的Paneth细胞的肿瘤发生过程相似。
总的来说,这篇文章提出了一个颠覆传统观念的新理论,即在特定环境下,已经分化的细胞也可能成为癌症的起源,这对于我们理解癌症的发生机制以及开发新的治疗策略具有重要意义。
观点梳理——西式饮食触发的炎症反应导致Paneth细胞去分化,并且这种去分化过程与肿瘤发生有关
西式饮食通常指的是高脂肪、高糖、高热量的饮食模式,这种饮食习惯与多种慢性疾病有关,包括肥胖、糖尿病和心血管疾病。此外,西式饮食还与慢性炎症状态有关,这种状态有时被称为“metaflammation”,即由代谢失调引起的炎症。
在文章中,研究者探讨了西式饮食如何可能通过触发炎症反应,导致Paneth细胞去分化,并与肿瘤发生有关。
-
西式饮食引发炎症:西式饮食中的高脂肪和高糖成分可能改变肠道微生物群的组成,导致肠道屏障功能下降,从而允许有害物质进入血液循环,引发系统性炎症反应。
-
Paneth细胞的作用:Paneth细胞是位于小肠底部的分泌细胞,它们分泌抗菌肽以保护肠道免受病原体侵害。在正常情况下,Paneth细胞是终末分化的细胞,不参与细胞增殖。
-
去分化过程:在炎症环境下,Paneth细胞可能失去其正常的分泌功能,并开始表达干细胞标志物,如Lgr5。这种去分化过程使得Paneth细胞获得了类似干细胞的特性,包括自我更新和多向分化潜能。
-
肿瘤发生的关联:去分化的Paneth细胞可能更容易受到遗传突变的影响,这些突变可能进一步促进肿瘤的形成。例如,文章中提到在Paneth细胞中特异性地敲除Apc基因会导致小鼠肠道肿瘤的形成。
-
炎症与肿瘤微环境:西式饮食引起的炎症还可能导致肿瘤微环境的改变,比如增加免疫细胞和肿瘤相关成纤维细胞的浸润,这些改变为肿瘤细胞提供了有利的生长条件。
-
基因表达的变化:西式饮食可能通过影响Paneth细胞的基因表达,激活与细胞周期、增殖和干细胞特性相关的信号通路,如WNT、MYC和Hedgehog信号通路。
-
表观遗传修饰:西式饮食可能还通过改变Paneth细胞的表观遗传状态,如DNA甲基化和染色质可及性,促进了去分化过程。
综上所述,西式饮食通过引发炎症反应,可能促进Paneth细胞的去分化,获得干细胞特性,并在遗传和/或环境因素的作用下,增加了肿瘤发生的风险。这项研究强调了饮食因素在肠道健康和癌症发生中的潜在作用,并为未来的癌症预防和治疗提供了新的视角。
重点关注
Fig. 1 展示了在炎症环境和Apc基因丢失的情况下,Paneth细胞(PCs)如何成为肠道肿瘤起源的细胞。
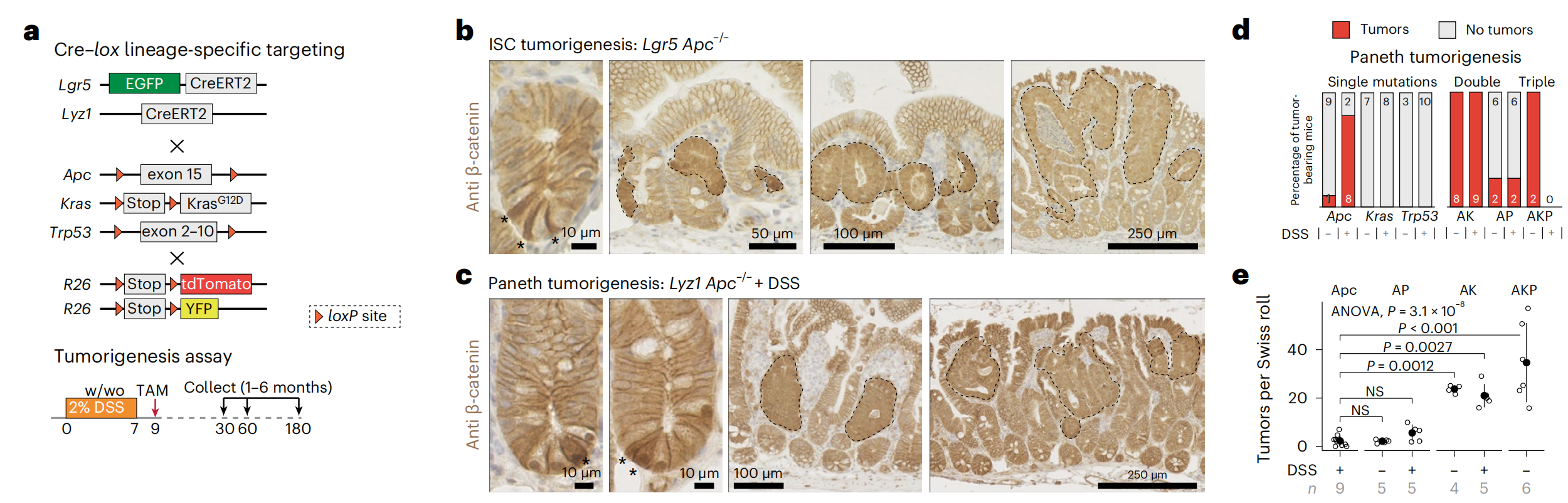
a. Cre-lox策略:描述了在Lgr5+肠道干细胞(ISCs)和Lyz1+ Paneth细胞中针对Apc、Kras和Trp53基因的特定突变。图中"w/wo"表示有无DSS(硫酸葡聚糖钠,一种诱导肠道炎症的物质)的存在。
b, c. β-Catenin免疫组化(IHC)分析:展示了由Lgr5+ ISCs (b) 和PCs © 发起的肠道肿瘤。星号标出了Lgr5+ ISCs和PCs中β-Catenin在细胞质和核中的积累增强;虚线表示肿瘤灶和腺瘤。
d, e. 肿瘤多发性计算:根据携带肿瘤的小鼠数量 (d) 以及基于Swiss roll计数的每个基因型的肿瘤数量 (e) 来计算肿瘤多发性。有无DSS存在的情况下都进行了计算。误差线表示标准差(s.d.)。P值表示通过单因素方差分析(ANOVA)和Tukey的事后检验进行的组间比较。
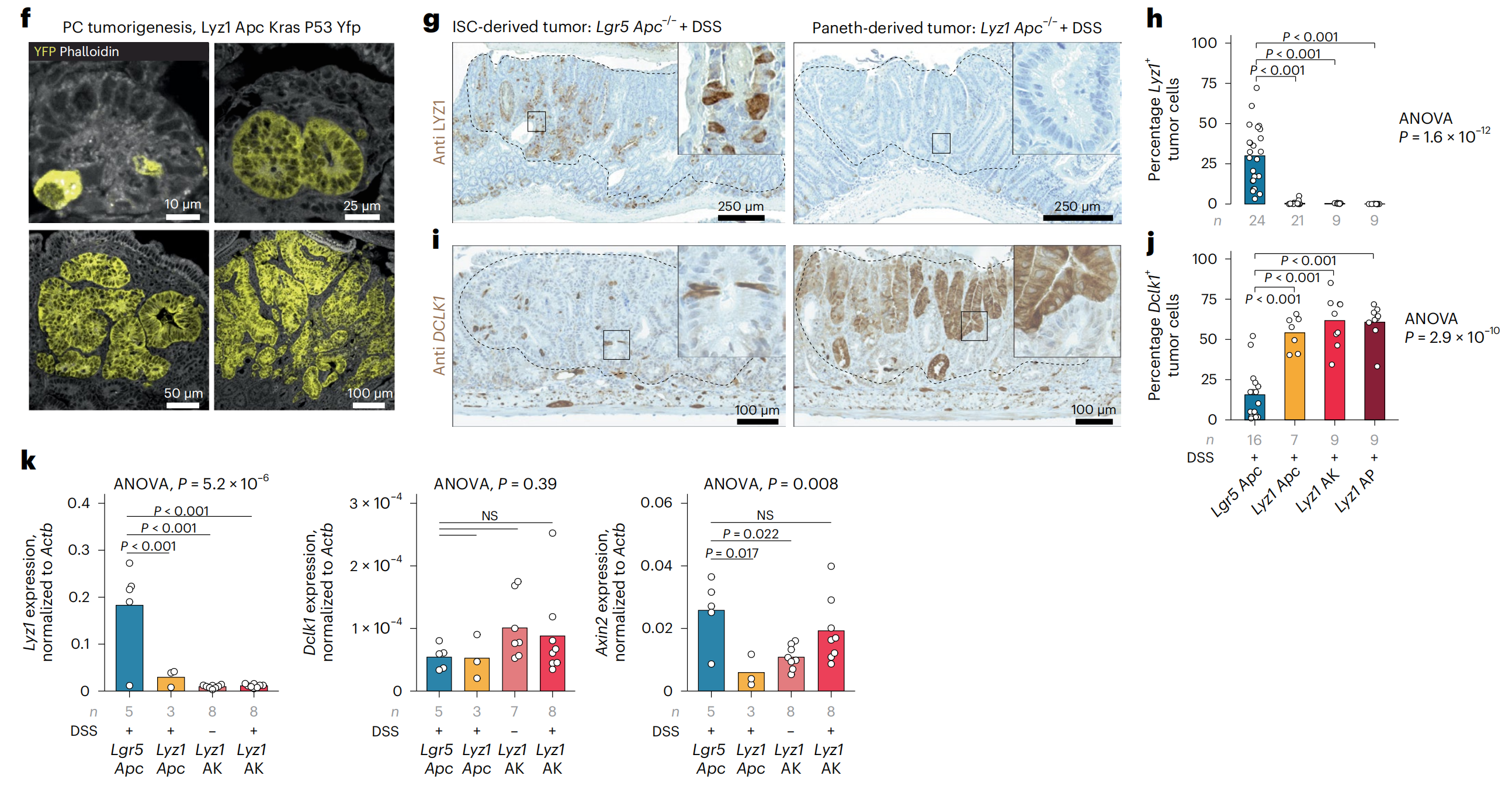
f. 谱系追踪分析:使用黄色荧光蛋白(YFP)标记的PCs,在肿瘤启动和进展的不同阶段进行追踪分析。
g-j. LYZ1和DCLK1的IHC分析:对Lgr5+ ISC衍生的(左侧)和PC衍生的(右侧)腺瘤进行了LYZ1 (g) 和DCLK1 (i) 的IHC分析,并量化了Lyz1+ (h) 和Dclk1+ (j) 肿瘤细胞的数量。P值通过单因素方差分析和Tukey的事后检验表示组间比较。
k. 定量PCR表达分析:对不同腺瘤基因型的Lyz1、Dclk1和Axin2进行了定量PCR表达分析。P值代表单因素方差分析和Tukey的事后检验的组间比较结果。
从这个图可以得出的关键信息是,在炎症环境下,特别是当Apc基因在Paneth细胞中丢失时,这些细胞能够形成与炎症性肠病(IBD)患者相似的肠道肿瘤,并且这些肿瘤在形态和基因表达上与Lgr5+ ISCs起源的肿瘤有显著差异。
此外,通过IHC和定量PCR分析,研究者们能够进一步确认肿瘤细胞的起源,并探究了不同肿瘤起源细胞的分子特征。
六、使用冠状动脉计算机断层扫描(CTA)来预测急性冠脉综合征(ACS)的可能性

文献概述
这篇文章是一篇社论,讨论了使用冠状动脉计算机断层扫描(CTA)来预测急性冠脉综合征(ACS)的可能性。
-
冠状动脉CTA的重要性:CTA是评估低至中等预测试概率患者慢性冠脉综合征的首要影像工具,因其出色的阴性预测值而被广泛使用。
-
CTA提供的额外信息:除了检测冠状动脉阻塞性疾病的存在与否,CTA还能提供其他有价值的信息,如高风险斑块特征的评估、心脏室腔和大血管的尺寸、心脏瓣膜的钙化情况,以及心外脂肪组织的数量和衰减。
-
AI在CTA中的应用:Koo等人在EMERALD-II研究中发现,使用人工智能(AI)进行冠状动脉斑块的定量评估和血液动力学分析,可以提高对急性冠脉综合征的预测能力,超越了传统的狭窄严重程度评估和高风险斑块特征的检测。
-
AI算法的组成:AI算法包括壁剪切应力、轴向斑块应力、分数流量储备和心肌血流等血液动力学特征,以及整体斑块负担、非钙化斑块负担和低衰减斑块负担的定量特征。
-
AI预测模型的效果:通过层次聚类和选择每个聚类中的最佳特征,这5个AI特征在添加到包含狭窄严重度和高风险斑块特征的模型中时,能够提高对随后急性冠脉综合征的预测能力,达到了0.84的接收者操作特征曲线下面积。
-
冠状动脉粥样硬化的评估:在评估个体的心血管风险中起着关键作用,冠状动脉钙化是评估心血管疾病风险的最佳测试。
-
AI在提高诊断信息方面的作用:AI方法可以提供超出目前临床常规评估的CT成像的诊断信息,甚至可能检测到人眼未注意到的模式。
-
治疗策略的需求:一旦检测到心血管疾病风险的增加特征,就需要治疗策略来调节它们。强化降脂治疗已知可以改变整体冠状动脉斑块负担以及高风险斑块特征。
-
研究的局限性:当前模型没有包括对已建立的心血管风险因素(如高血压、血脂水平、吸烟状态和糖尿病)的调节,因为这些因素没有包含在研究中。此外,由于患者是从经验丰富的高容量中心招募的,10%的CT检查因图像质量不佳而被排除,这限制了AI算法的应用。
-
未来研究的需求:需要在更大的队列中进行进一步分析,包括非冠状动脉措施,如心外脂肪组织和心周脂肪衰减,以评估AI算法在冠状动脉CTA后预测不良心血管事件的全部潜力。
文章最后指出,除了对阻塞性冠状动脉疾病的信息外,冠状动脉CTA还提供了可以精确预测未来急性冠脉综合征风险的见解。























 736
736

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








