小罗碎碎念
本期推文主题
今天选择的这篇精析文章年代有点久远,但是很经典,IF也不低(23分)。对于刚入门病理AI的同学来说,是一篇值得仔细研读的文献。
最新发表的文献动不动就上多组学多模态,各种大模型往上堆,有的时候一遍看下来都不知道作者在讲什么。所以,不妨先花一点时间,看看最早一批研究是如何开展的,循序渐进,这样底子更扎实。
我是罗小罗同学,下期推文见!!
文献概述
这篇文章是关于一项原创性研究,标题为《Artificial intelligence-guided tissue analysis combined with immune infiltrate assessment predicts stage III colon cancer outcomes in PETACC08 study》,由 Cynthia Reichling 等人撰写,发表在《Gut》期刊2020年第69卷上。
研究的主要目的是探讨使用人工智能(AI)工具辅助组织分析和免疫细胞浸润评估,以预测III期结肠癌患者的预后。

| 角色 | 姓名 | 单位(中文翻译) |
|---|---|---|
| 第一作者 | Cynthia Reichling | 法国第戎博若莱医疗中心消化病和肿瘤科 |
| 通讯作者 | François Ghiringhelli | 法国第戎弗朗索瓦·莱克莱尔中心医学肿瘤科 |
研究团队开发了一种软件,能够在CD3和CD8染色的切片上检测结肠肿瘤、健康粘膜、基质和免疫细胞。
通过自动量化肿瘤核心(Tc)和侵袭边缘(IM)中的淋巴细胞密度和面积,结合LASSO算法,研究者们发现了与患者预后相关的肿瘤细胞内的数字参数(DgMate)。研究结果表明,在1018名患者的数据集中,较差的无复发生存期(RFS)与高IM基质面积和高DgMate相关。CD3+ Tc、CD3+ IM和CD8+ Tc的高密度与较长的RFS显著相关。方差分析显示,CD3+ Tc的预值与经典的CD3/CD8免疫评分相似。
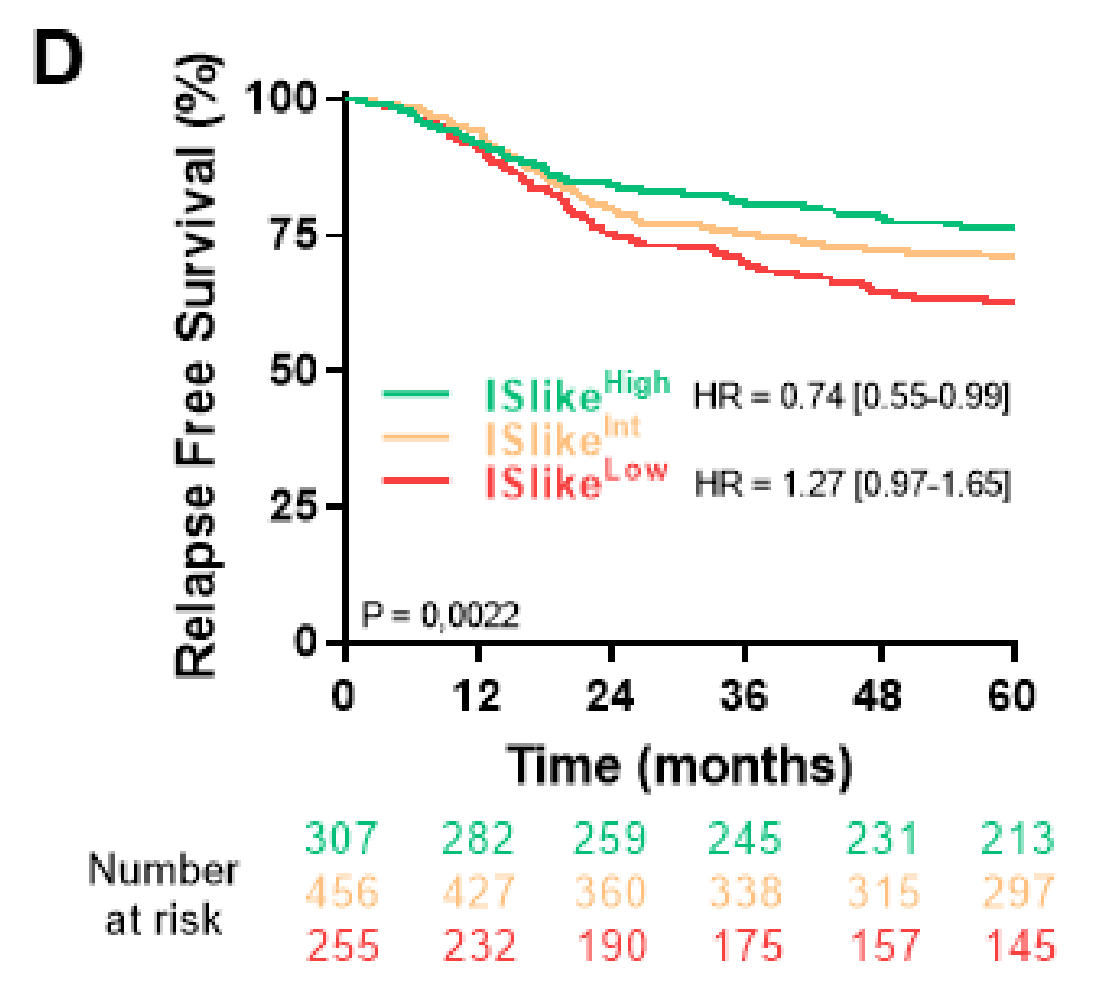
研究还发现,将IM基质面积、DgMate和CD3结合的“DgMunes”在评估患者预后时,比免疫评分表现得更好,并且在Cox多变量分析后与患者预后独立相关。基于DgMunes和临床变量的预测列线图能够识别复发风险低于10%的患者群体和复发风险为50%的患者群体。
文章的结论指出,人工智能有潜力通过协助病理学家更好地定义III期结肠癌患者的预后,从而改善患者护理。研究还讨论了在临床实践中应用这些发现的潜在影响,包括在结直肠癌预后中考虑肿瘤基质和肿瘤细胞固有变量,以及使用单一标准CD3病理切片的改进方法。
此外,文章还提到了该研究的一些限制,例如分析的后 hoc 设计和一些亚组中患者数量有限,可能限制了结论的普适性。研究还需要在前瞻性试验中使用不同的数据集来验证软件的可重复性,并在不经常接受化疗的II期肿瘤患者中进行类似研究以测试数据的适用性。
一、引言
近年来,转移性结肠癌(CC)的管理因新的解剖学、分子生物学和免疫学数据的可用性而发生了显著变化。然而,在局限性肿瘤中,辅助治疗仅依赖于根据肿瘤、淋巴结和转移(TNM)分类定义的病理分期。这种分类存在一定局限性,因为同一分期的患者预后可能存在显著差异。确实,在III期患者中,5年无复发生存率(RFS)介于44%至83%之间。
肿瘤原位免疫微环境对确定患者预后也变得重要。
在大多数实体瘤中,高T细胞浸润与肿瘤扩散风险降低和生存率提高相关。这一相关性在CC中得到良好证实,同样也适用于黑色素瘤、卵巢癌、乳腺癌、前列腺癌和肺癌。
在CC中,Jérôme Galon等人提出了免疫评分(Immunoscore)概念,研究肿瘤核心(TC)和侵袭边缘(IM)中CD3和CD8的肿瘤浸润情况。
免疫评分较TNM分期能更精确地定义患者预后。这种浸润与CC中肿瘤扩散风险降低和生存率提高相关。最近的一项大型多中心前瞻性研究通过集中方法进行免疫评分分析,能够将I-III期CC患者分为高、中、低免疫评分三组,5年内复发率分别为8%、19%和32%。
除了免疫评分分析,许多研究强调了肿瘤浸润淋巴细胞在结直肠癌(CRC)中的预后作用。然而,Luigi Laghi等人发现,CD3浸润仅在II期肿瘤中具有预后意义。
关于III期CRC,文献中存在矛盾数据。Laghi等人显示,CD3浸润不能独立用于预测患者临床结局,而Sinicrope和Pagès在两项不同的针对FOLFOX方案辅助化疗的临床试验中表明,CD3+密度可以独立预测III期CC患者的结局。
此外,非免疫因素也与局限性CC的结局相关。例如,肿瘤定位已知具有预后影响,因为在转移性环境中,右侧CC患者的预后较差。
**肿瘤分子特征,如RAS状态、错配修复状态和共识分子亚型,也可用于确定预后。**人工智能(AI)可用于分析虚拟显微镜图像,并准确确定预后和肿瘤分子特征。
在此,作者假设可以开发一款AI软件,在单个肿瘤切片上同时分析免疫浸润和肿瘤相关预后参数。作者进一步假设,由AI生成的肿瘤相关变量分析或肿瘤相关与免疫变量的结合分析可能优于免疫评分分析。
二、方法
2-1:患者
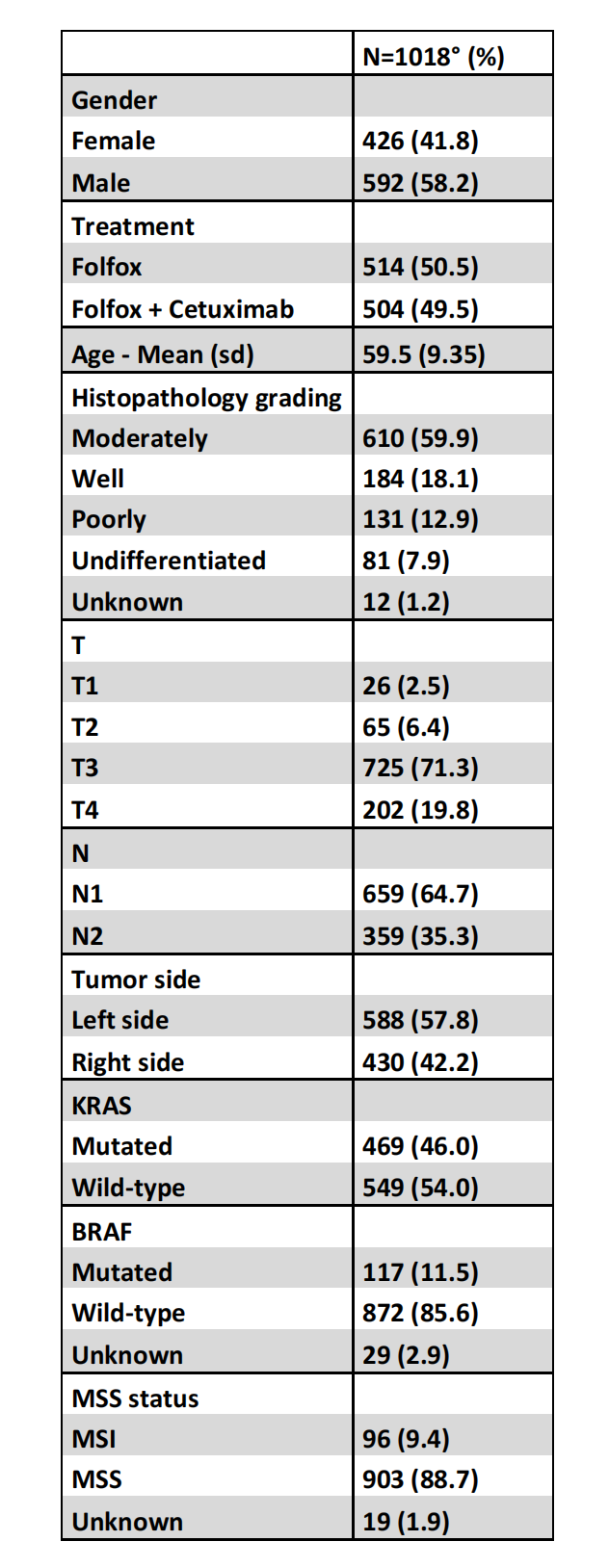
本研究中的患者来自PETACC8队列,这是一项欧洲III期临床试验,研究III期CC患者接受12周期FOLFOX-4或cetuximab联合FOLFOX-4的辅助治疗【27】。
所有2559名患者最初于2005年12月22日至2009年11月5日被纳入。微卫星稳定(MSS)状态、K-RAS、N-RAS和BRAF突变状态按照先前描述的方法进行确定【25】【28】。
入组患者已签署知情同意书,同意进行转化研究。由于当地病理学家无法提供切片或缺乏用于辅助研究的书面知情同意,本研究仅纳入了PETACC08队列中的1018名患者。没有肿瘤的切片患者也被排除在研究之外。
2-2:CD3和CD8染色
PETACC08样本的CD3染色在Emile教授的实验室进行。切片按照先前描述的方法进行染色【29】,使用Bond-Max Fr4.0(Leica Biosystem)和CD3初级抗体(克隆F7.2.38,Agilent)。
对于CD8染色,从Fédération Francophone de Cancérologie Digestive获取福尔马林固定石蜡包埋的切片。
切片使用抗CD8初级抗体(克隆C8/144B,Agilent)和Bond III设备(Leica Biosystem)进行染色。一旦复染并永久装片,切片使用Nanozoomer HT2.0(Hammamatsu)在×20放大倍数下数字化,以生成ndpi格式的全切片成像(WSI)文件。
三、人工智能软件生成
3-1:组织库生成步骤
所有WSI文件通过QuPath软件30的脚本使用超像素策略自动分割。这种方法将组织分割成数千部分。然后,从每个小片中自动计算并提取127个参数(颜色、饱和度、亮度、纹理等)。每个小片的坐标被导出以确定后续的位置。
接下来,两名病理学家手动标注WSI为不同的类别,即健康(粘膜)、肿瘤、间质、免疫细胞、坏死和空隙。根据定义,肿瘤间质包括基底膜、成纤维细胞、细胞外基质、免疫细胞和血管,31但作者要求病理学家排除免疫细胞,并将该区域标记为“间质区域”。
作者还要求病理学家选择富含淋巴细胞的间质区域,作者将这些区域标记为“免疫区域”。坏死组织和没有组织的小片被归类为“其他”以进行进一步分析。
这项工作在不同组织类型的80张切片上完成。两名病理学家之间的差异在联合会议中由双方重新评估。
3-2:分类模型建立步骤
从这一训练组织库中,作者构建了一个随机森林32分类模型。为了区分不同的组织学类型,作者使用VSURF算法33选择了最能区分上述不同组织类别的变量。
然后,使用所选变量为每个组织学分化组构建训练模型。对于组织学分化未知的患者,作者使用了元训练,重新组合所有可用的训练数据。
用于分类WSI小片的模型是基于PETACC8数据库中组织学分化的可用数据选择的。这个模型被称为ColoClass。
3-3:肿瘤核心(TC)和侵袭边缘估计
通过将分类模型识别为肿瘤细胞的相邻小片合并,得到TC。
一旦通过肿瘤小片的聚类估计了TC,就会自动绘制一个额外边界,距离为300µm。这个额外边界与TC之间的区域是侵袭边缘(IM),在先前的研究中选择为距离肿瘤边界大于500µm的组织距离。34 35
作者对CD3的不同IM距离(200, 300, 400和500µm)进行了测试,发现300, 400和500µm得到了相似的结果,变量之间强烈相关且具有相似的预后价值,然后作者决定选择300µm IM的样本集以缩短计算时间。
3-4:CD3和CD8检测步骤
在测量并导出所有WSI小片的数据后,运行脚本以检测WSI上的任何细胞并导出坐标。因此,使用QuPath检测脚本,将每个标记(即CD3或CD8)的阳性细胞与阴性细胞区分开来。
通过收集细胞和小片的坐标,作者能够确定每个细胞的准确位置以及它所属的类别(即健康、肿瘤、免疫或间质)。通过三次扫描几张CD3切片,生成多个.ndpi文件,测试该方法的可重复性。
一名独立的生物信息学家然后使用作者的QuPath和R脚本处理每个文件,并检查与免疫和间质信息相关的DGMate(DiGital tuMor pArameTErs)参数和后续得分。
DGMuneS的变异系数约为5%。确定了两位病理学家对CD3的半定量评估之间的一致性(约为90%和89%),并执行了QuPath检测脚本。
3-5:分类模型验证步骤
为了验证提出的分类模型,作者从训练数据集之外随机选择了53张切片。这些切片经过相同的处理(即分割、数字参数测量、坐标提取)。
作者要求两名病理学家使用QuPath对WSI上的某些小片进行分类,并在联合会议中重新评估他们之间的差异。然后,将标注的小片导出并在ColoClass中处理。
所有数据、R代码和用于QuPath的Groovy脚本可在GitHub(https://github.com/Klopfe)上获得。
在线补充文件中提供了教程。
四、统计分析
4-1:生存分析
通过Cox比例风险模型对无复发生存期(RFS)的不同变量的预后价值进行了测试,RFS定义为首次复发或任何原因死亡的时间。
使用Kaplan-Meier方法估计生存概率,并使用对数秩和检验评估生存曲线。RFS期超过5年的患者被视为截尾。
4-2:DGMate评分构建
使用QuPath30测量每个软件分割小片的127个参数。作者计算了每张切片上每个肿瘤小片参数的平均值,每张切片得到127个参数。
然后,使用glmnet R包36执行LASSO算法,以选择与RFS相关的变量。DGMate评分是通过LASSO程序选择的变量在发现队列上构建的Cox模型的线性预测器。
4-3:发现队列和验证队列
为了验证DGMate评分作为预后变量的有效性,作者通过随机抽样将队列分为两个不同的组,将70%的患者放入发现队列,30%的患者放入验证队列。两组在每一个临床变量上都是可比的。
4-4:免疫评分的复现
根据先前描述的方法8,生成了类似免疫评分的得分。作者计算了CD3 IM、CD3 TC、CD8 IM和CD8 TC变量的百分位数,然后计算了这四个变量平均百分位数作为每位患者的得分。
设计了一个三分类免疫评分系统,得分在0到0.25、0.25到0.7和>0.7的患者分别被归类为低、中、高免疫评分。
还设计了一个两分类免疫评分系统,得分在0到0.25和>0.25的患者分别被归类为低和高免疫评分。
4-5:Cox模型预测准确性
为了评估不同模型的预测准确性并能够比较它们的性能,作者使用了1000次自助重采样,并计算了每次自助抽样的预测准确性(AUC)。
当模型是嵌套的时,使用似然比检验比较模型性能。
4-6:列线图构建
作者使用列线图表示多变量Cox模型,结合DGMuneS评分、N分期、T分期、分化程度和RAS状态来构建一个评分。然后,这个评分被用来将患者分为三个不同的类别。
评分截断值如下:得分最高的20%的患者被归类为“高”,得分最低的20%被归类为“低”,其余的为“中”。
这一选择是作者决定建立一个与整体人群生存模式相似的中等组所驱动的。
4-7:软件和可用数据
使用R v3.3.3进行统计分析。
图形使用GraphPad 7.03制作。
五、结果
5-1:生成用于分类结肠癌病理切片组织结构的AI软件
使用开放源代码的QuPath软件,作者基于Megapixel策略进行了组织分割,该策略根据相似性(称为tile)重新组合像素,使用来自不同组织学类型的80张切片的训练集。总共使用了27466个小片来建立这个组织库。
从这个训练组织库中,作者建立了一个随机森林分类模型,称为ColoClass。为了验证作者的分类模型,作者随机选择了54张额外的切片,这些切片由两名病理学家进行分类。然后,导出并处理了这些切片上的注释tile。
总共处理了26659个小片,病理学家与ColoClass分类之间的符合率约为85%(22652个小片)。对于可比的数据集,两名病理学家之间的符合率为87%。在独立于组织学分化类型的情况下,也观察到了类似的结果(在线补充表S1)。
使用QuPath自动检测阳性的T细胞(CD3或CD8),并将其自动归类到分类区域。汇总这些信息,软件能够自动确定每张切片上对应于特定组织的区域,以及每种组织中的CD3和CD8细胞浸润情况。
5-2:组织分析的预后作用
作者在PETACC8队列中测试了每个变量对RFS的预后作用,包括1220名患者(流程图,在线补充图1)。
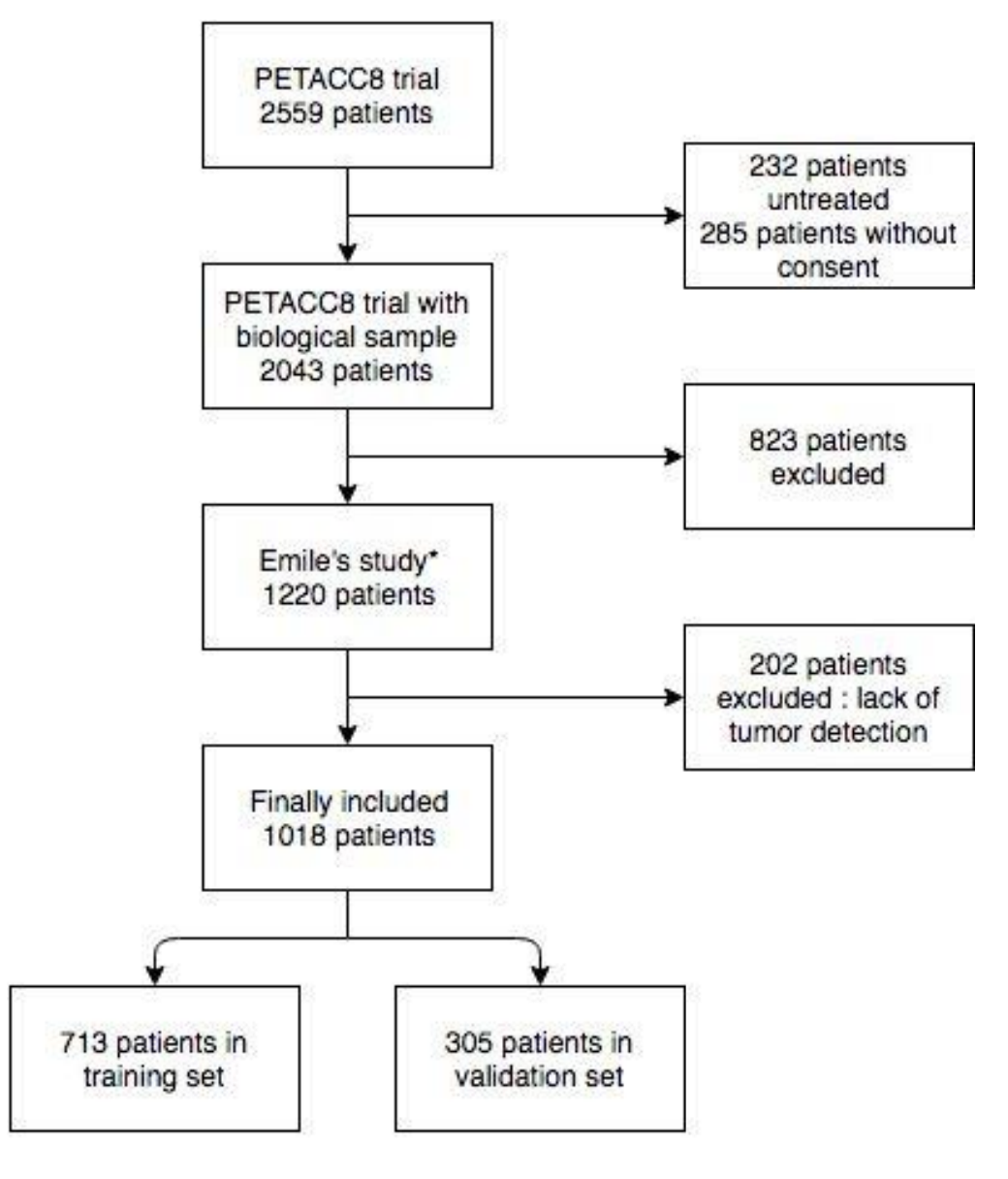
在质量控制后,一些患者(n=202; 16.5%)被排除,主要是因为切片上未检测到肿瘤。患者特征在线补充表S2中展示。
作者测试了软件确定的每个区域与RFS的关系(图2A)。
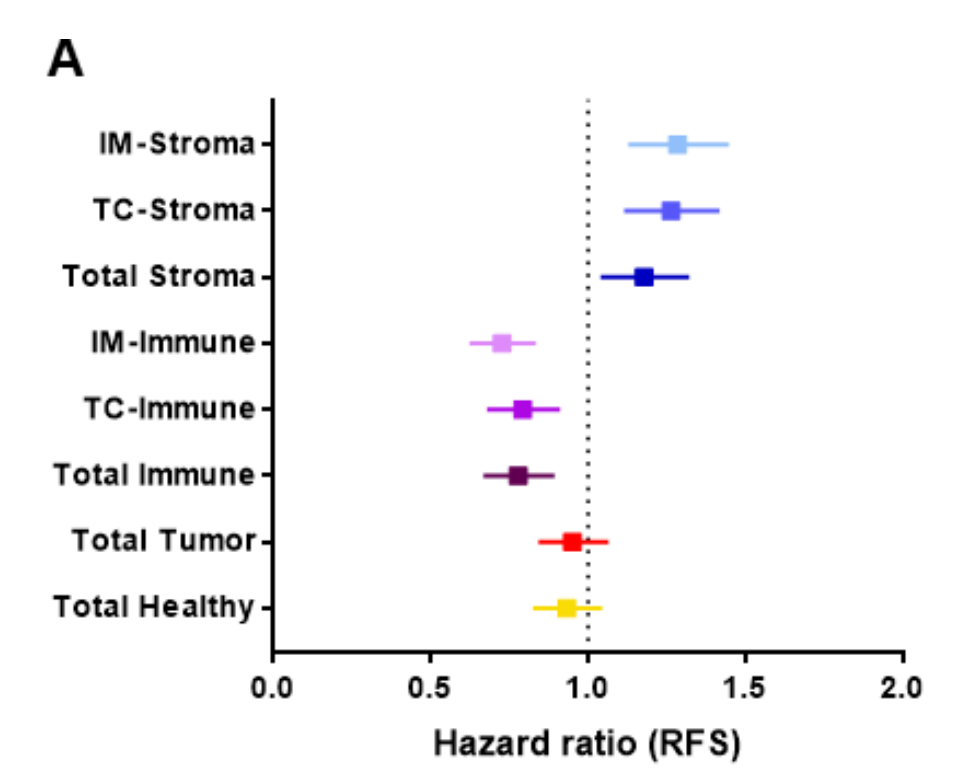
高间质区和免疫区分别与不良和良好结果相关。数据也通过Kaplan-Meier曲线表示,并使用中位数作为截断值来分离组别(在线补充图2)。
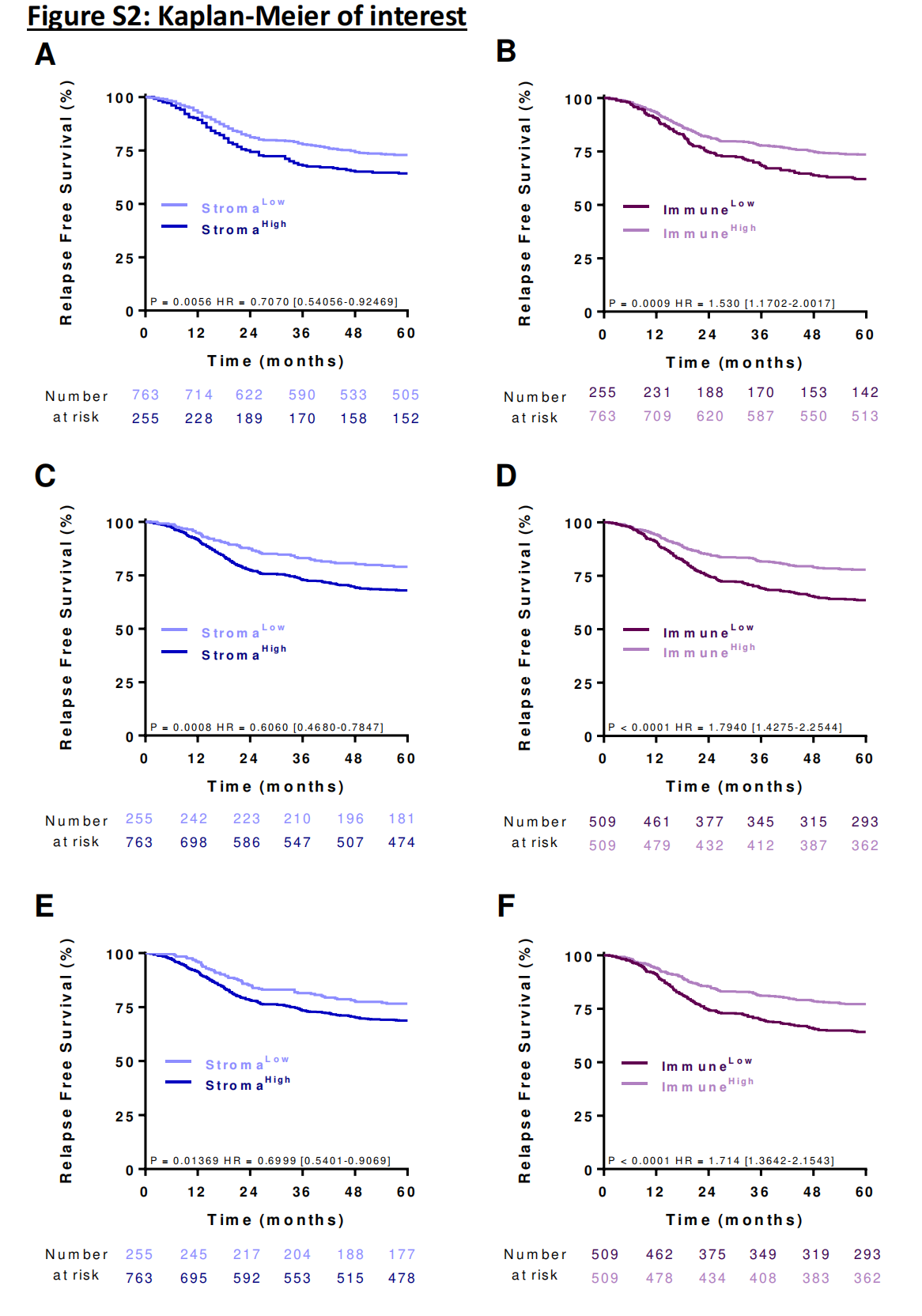
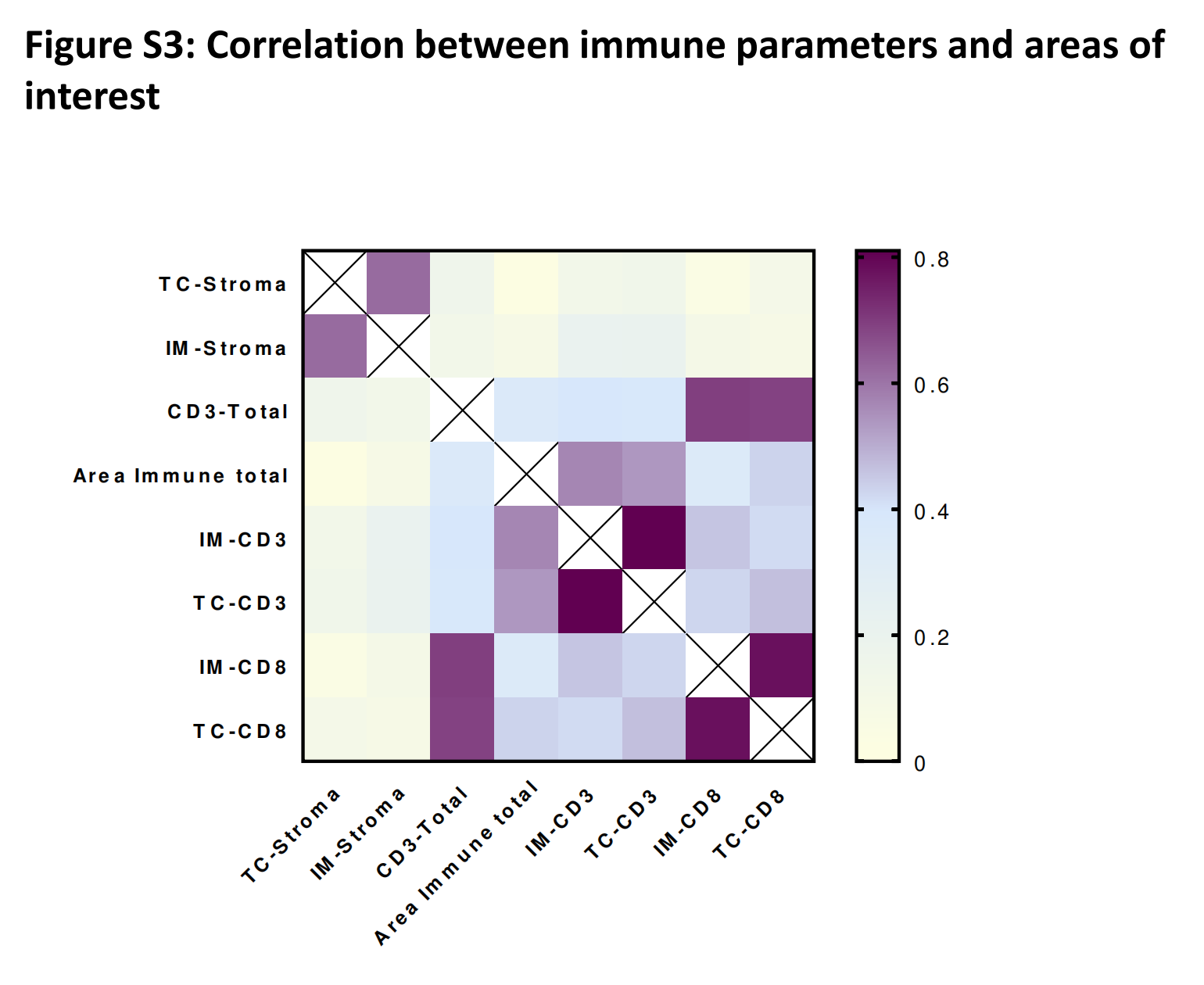
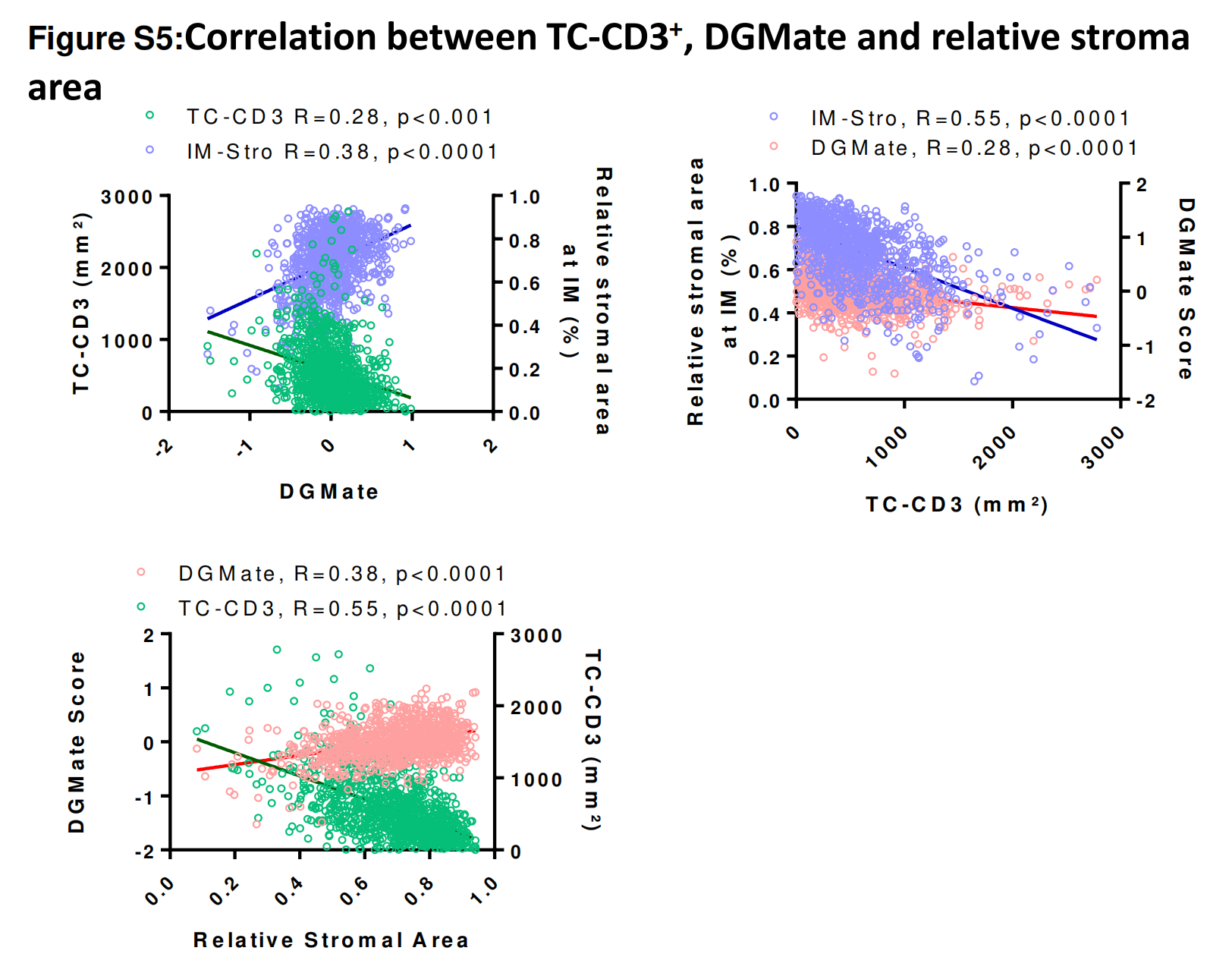
健康区和肿瘤区与RFS无关联。间质区与免疫区或CD3-TC(r=0.4015或0.3676,p<0.001)呈弱负相关。间质区在IM和TC之间呈强相关(在线补充图3)。
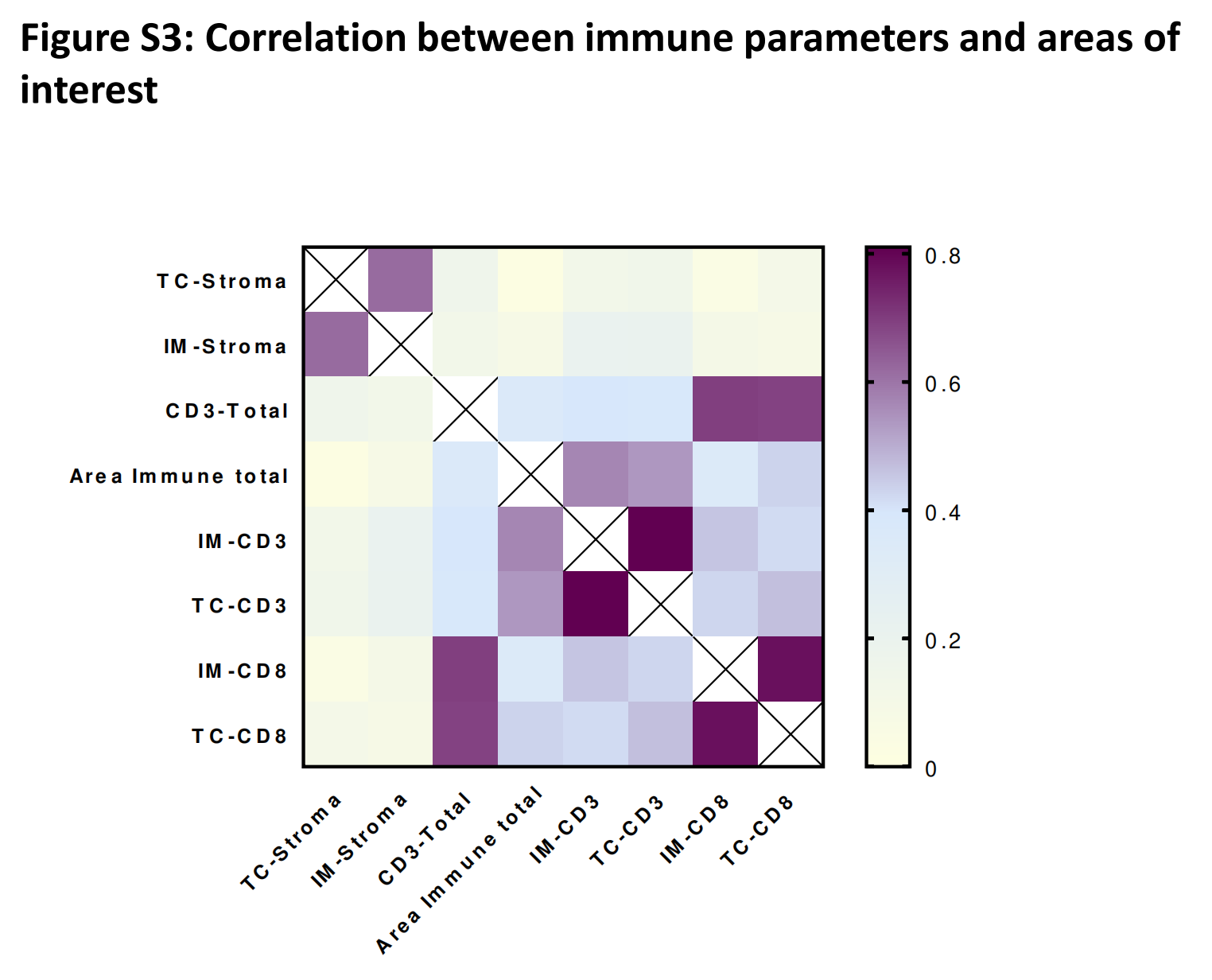
为了进一步分析,作者决定只关注IM中的间质区,因为整体上HR差异更大且p值更显著。同样,免疫区与CD3浸润呈强相关(在线补充图3)。
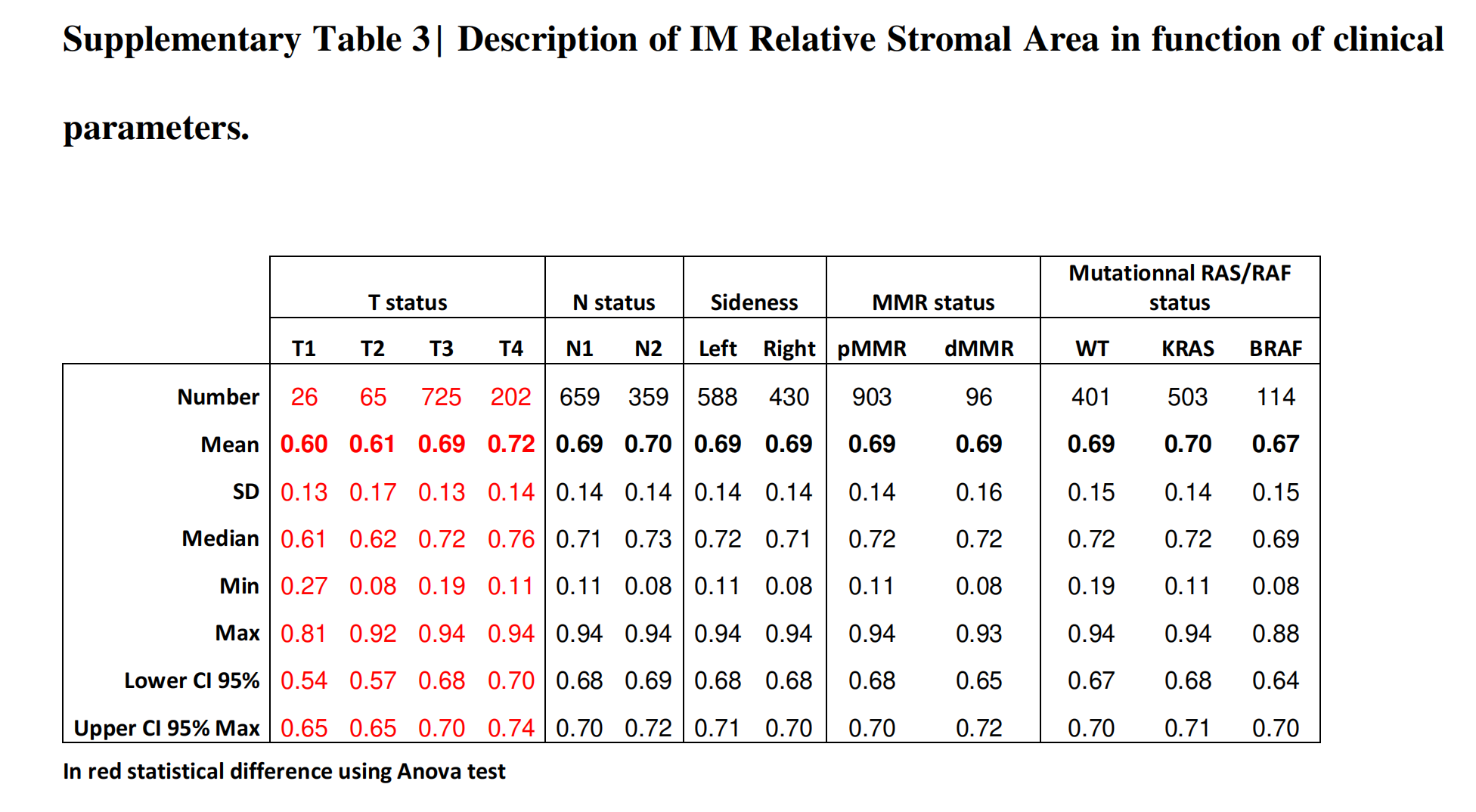
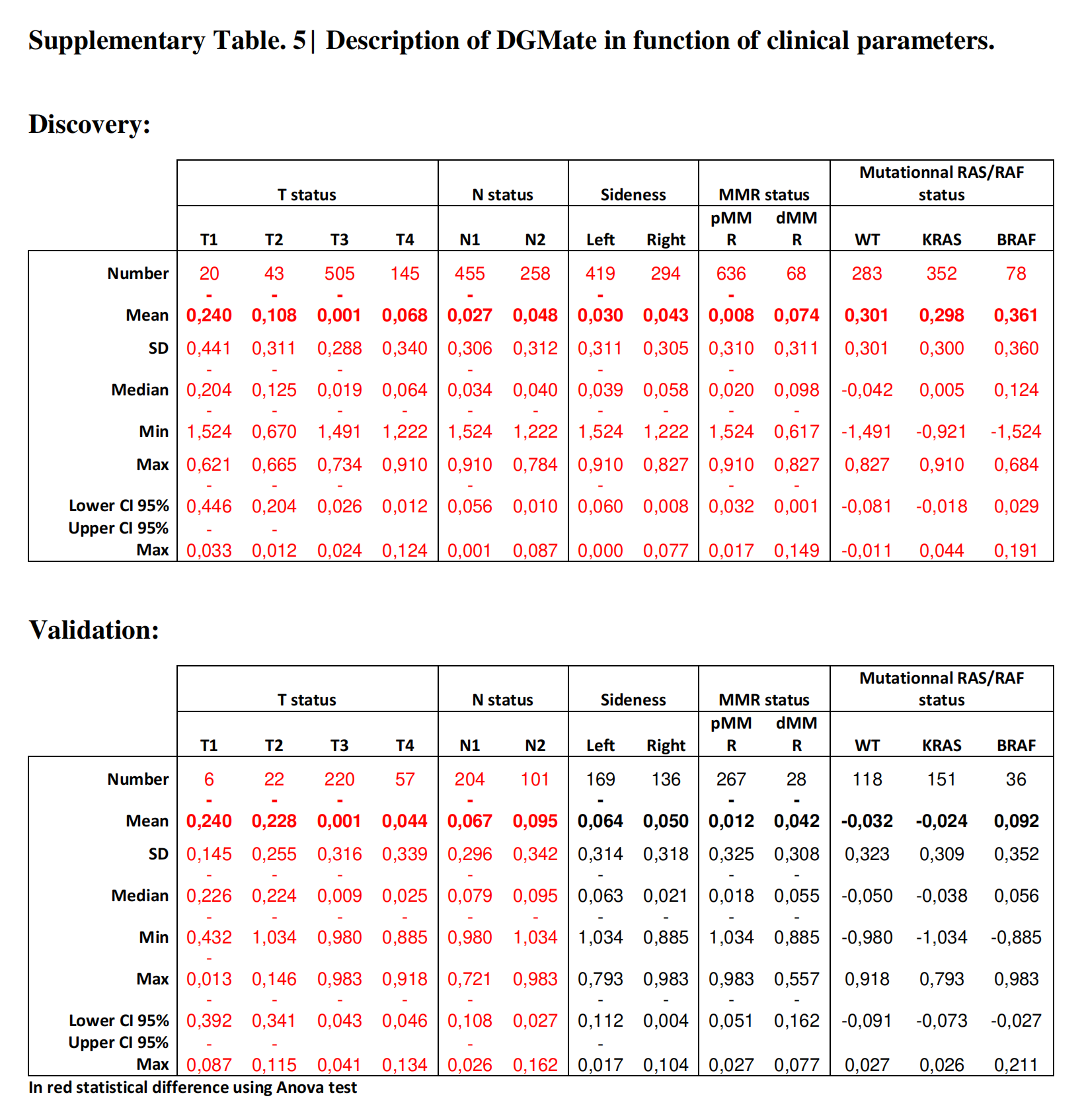
间质区随T期增加,但不受N期、侧位、缺陷错配修复(dMMR)状态和RAS状态的影响(在线补充表S3)。
软件分析了每个tile的127个参数,作者使用LASSO算法选择与结果相关的变量,从而得出DGMate评分。在713名患者的训练集中,作者选择了八个变量(在线补充表S4),这些变量通过LASSO程序与结果相关。
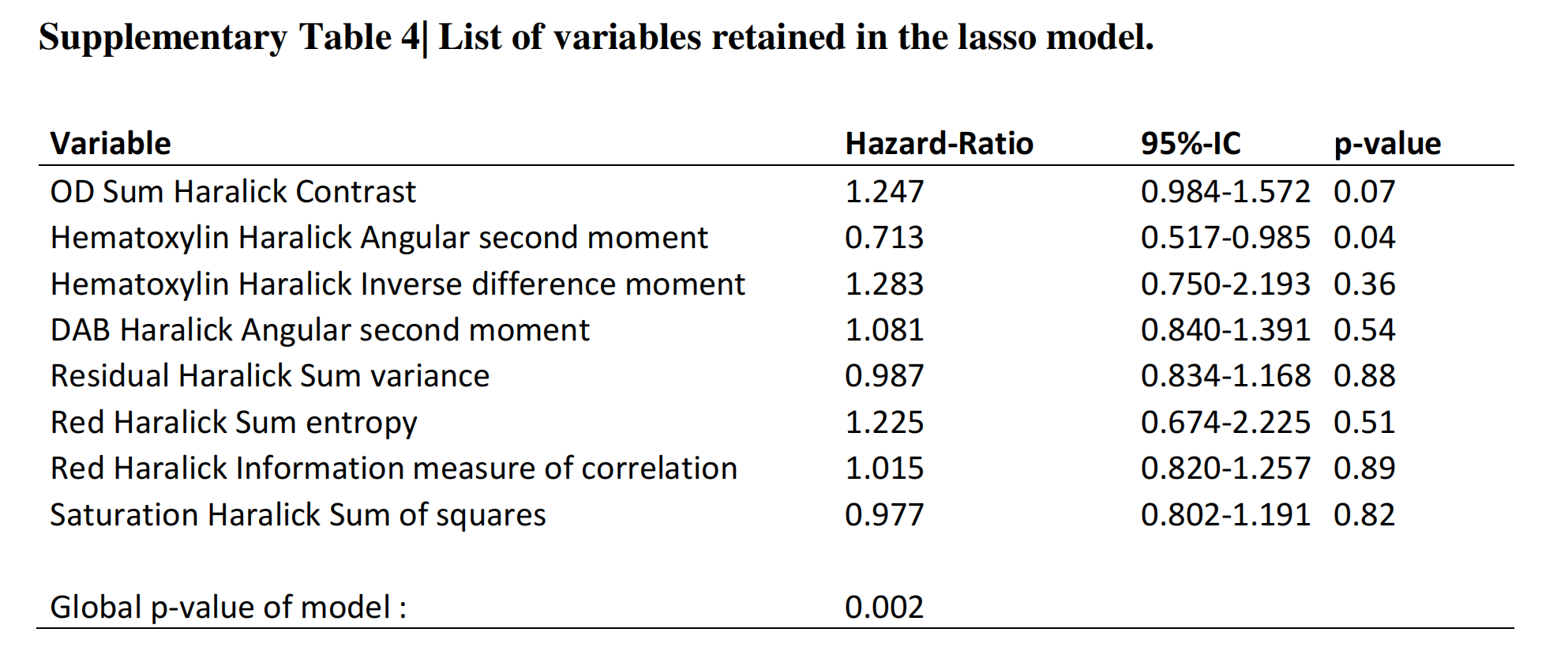
在Supplementary Table 4中,列出的变量名代表了在LASSO模型中筛选出的可能与结肠癌患者无复发生存期(RFS)相关的特征。这些变量主要是基于图像分析的纹理特征,它们是从染色的组织切片图像中提取出来的。
-
OD Sum Haralick Contrast:
- 这个变量是基于Haralick纹理特征的对比度特征,它衡量了组织图像中相邻像素间强度的差异。风险比(HR)为1.247,意味着该特征值每增加一个单位,患者复发的风险增加24.7%。然而,其P值为0.07,这在统计上并不显著,表明该变量与RFS的关联性不强。
-
Hematoxylin Haralick Angular second moment:
- 此变量代表Hematoxylin染色图像的角二阶矩,是纹理均匀性的度量。HR为0.713,表明该特征值每增加一个单位,复发风险减少28.7%。P值为0.04,这在统计上是显著的,表明较高的角二阶矩与较好的预后相关。
-
Hematoxylin Haralick Inverse difference moment:
- 这是Hematoxylin染色图像的逆差分矩,与纹理的局部对比度有关。HR为1.283,表示该特征值每增加一个单位,复发风险增加28.3%。然而,P值为0.36,统计上不显著。
-
DAB Haralick Angular second moment:
- DAB染色的角二阶矩,与Hematoxylin类似,也是衡量纹理均匀性。HR为1.081,意味着该特征值每增加一个单位,复发风险增加8.1%。P值为0.54,统计上不显著。
-
Residual Haralick Sum variance:
- 残差Haralick总方差,可能与图像的局部变化性有关。HR为0.987,几乎与1接近,表明该变量对复发风险的影响很小。P值为0.88,统计上不显著。
-
Red Haralick Sum entropy:
- 红色通道的Haralick熵,是衡量图像随机性的指标。HR为1.225,意味着该特征值每增加一个单位,复发风险增加22.5%。P值为0.51,统计上不显著。
-
Red Haralick Information measure of correlation:
- 红色通道的Haralick相关性信息度量,与纹理的相关系性有关。HR为1.015,表明该特征值每增加一个单位,复发风险增加1.5%。P值为0.89,统计上不显著。
-
Saturation Haralick Sum of squares:
- 饱和度Haralick平方和,可能与颜色分布的均匀性有关。HR为0.977,表明该特征值每增加一个单位,复发风险减少2.3%。P值为0.82,统计上不显著。
这些变量的全局P值为0.002,表明至少有一个变量在整体上与RFS显著相关。然而,单独看每个变量的P值,除了"Hematoxylin Haralick Angular second moment"外,其他变量与RFS的关联都不显著。
这可能意味着在多变量模型中,这些变量的独立预测价值有限,或者它们的影响可能被其他变量所掩盖。在临床实践中,这些发现需要进一步的验证研究来确定它们作为预后生物标志物的潜力。
作者在305名患者的验证数据集中确认了这种肿瘤标志物的预后作用(HR=2.128; 95% CI 1.162到3.898; p=0.01为连续变量)(图2B,C)。
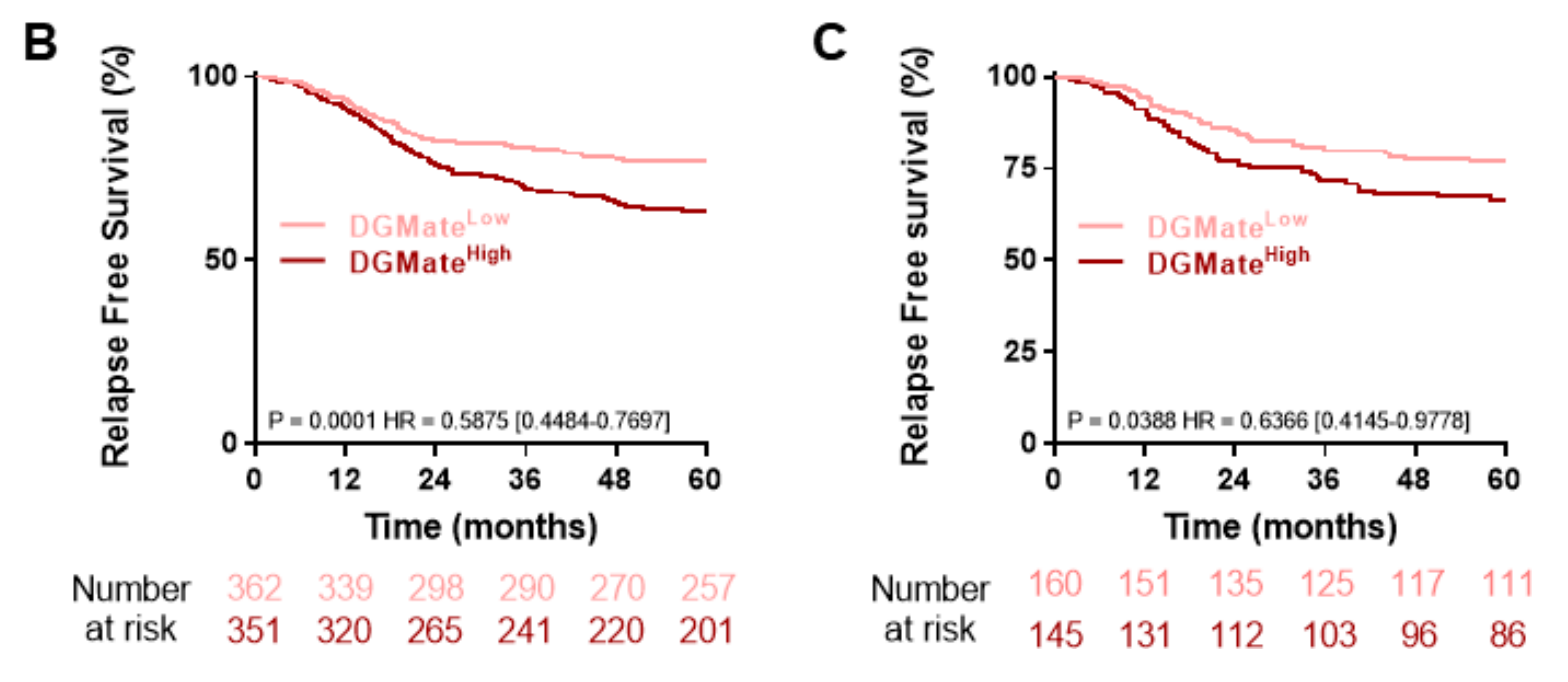
DGMate评分随T期和N期增加,受侧位、RAS状态和dMMR状态的影响(在线补充表S5)。
5-3:免疫T细胞浸润分析的预后作用
基于免疫评分的理由,作者评估了IM和TC中的CD3+和CD8+细胞,并研究了CD3和CD8浸润作为传统预后变量的函数(在线补充表S6)。
Supplementary Table 6 提供了根据临床参数对免疫细胞浸润的描述,特别是在侵袭边缘(IM)和肿瘤核心(TC)的CD3和CD8免疫细胞的统计数据。
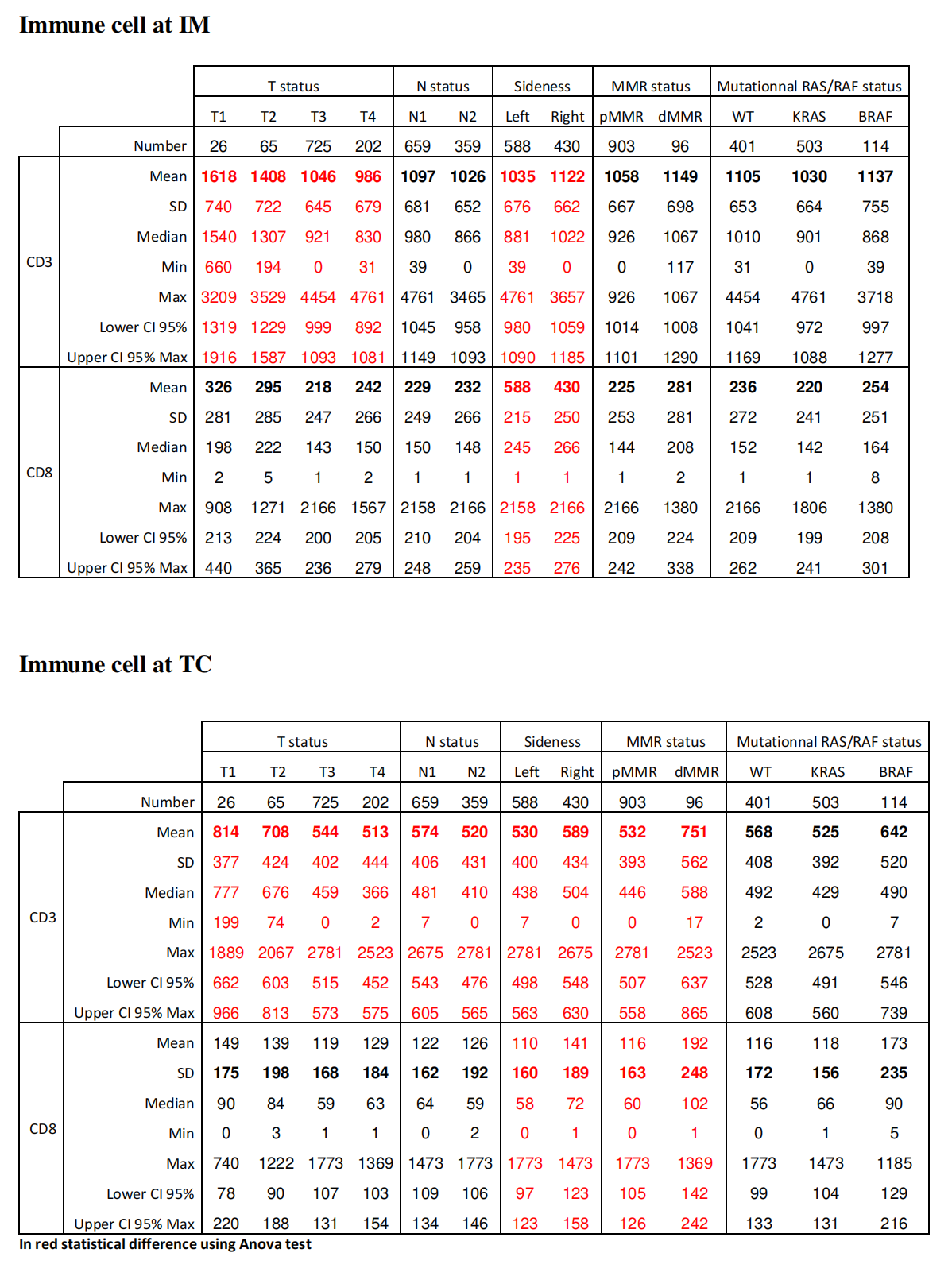
以下是对表格中数据的分析:
免疫细胞在侵袭边缘(IM)的分析:
CD3阳性细胞:
- 平均值(Mean):随着T分期的增加,CD3阳性细胞的平均数量减少,从T1的1618到T4的986。
- 标准差(SD):不同T分期的CD3阳性细胞数量波动较大,特别是在T1和T2分期。
- 中位数(Median):与平均值相似,中位数也显示了随着T分期增加,CD3阳性细胞数量减少的趋势。
- 最小值(Min):在某些情况下,如T3分期,CD3阳性细胞的最小数量为0,表明某些患者可能在这个区域没有CD3阳性细胞的浸润。
- 最大值(Max):CD3阳性细胞的最大数量在T3分期达到4454,显示了患者之间的高度异质性。
CD8阳性细胞:
- 平均值:CD8阳性细胞的平均数量在不同分期中变化不大,但在T4分期中略有增加。
- 标准差:显示了CD8阳性细胞数量的变异性,特别是在T1和T2分期。
- 中位数:中位数数据显示了与平均值相似的趋势,但整体数值较低,表明CD8阳性细胞在IM区域的浸润较少。
免疫细胞在肿瘤核心(TC)的分析:
CD3阳性细胞:
- 平均值:在TC区域,CD3阳性细胞的平均数量随着T分期的增加而减少,但减少幅度不如IM区域明显。
- 标准差:与IM区域相比,TC区域的CD3阳性细胞数量波动较小。
CD8阳性细胞:
- 平均值:CD8阳性细胞在TC区域的平均数量较低,且在不同T分期之间变化不大。
临床参数的相关性分析:
- T分期(T status):随着T分期的增加,CD3阳性细胞在IM和TC区域的浸润减少,这可能与肿瘤的侵袭性和生物学行为有关。
- N分期(N status):N1和N2分期的数据显示,淋巴结受累可能与免疫细胞浸润有关。
- 肿瘤侧(Sideness):左右侧肿瘤的免疫细胞浸润没有显著差异。
- 错配修复状态(MMR status):pMMR和dMMR状态的肿瘤在免疫细胞浸润方面没有显著差异。
- RAS/RAF突变状态(Mutationnal RAS/RAF status):KRAS和BRAF的突变状态可能与免疫细胞浸润有关,但需要进一步分析以确定其临床意义。
结论:
- 免疫细胞浸润的分析显示,CD3阳性细胞在肿瘤的IM和TC区域均与肿瘤的分期有关,而CD8阳性细胞的浸润相对较少,且与分期的关系不明显。
- 免疫细胞浸润的分布可能反映了肿瘤微环境的复杂性,以及不同患者之间免疫反应的差异。
- 这些数据为理解结肠癌的免疫微环境提供了重要信息,并可能有助于开发新的治疗策略和预后评估工具。
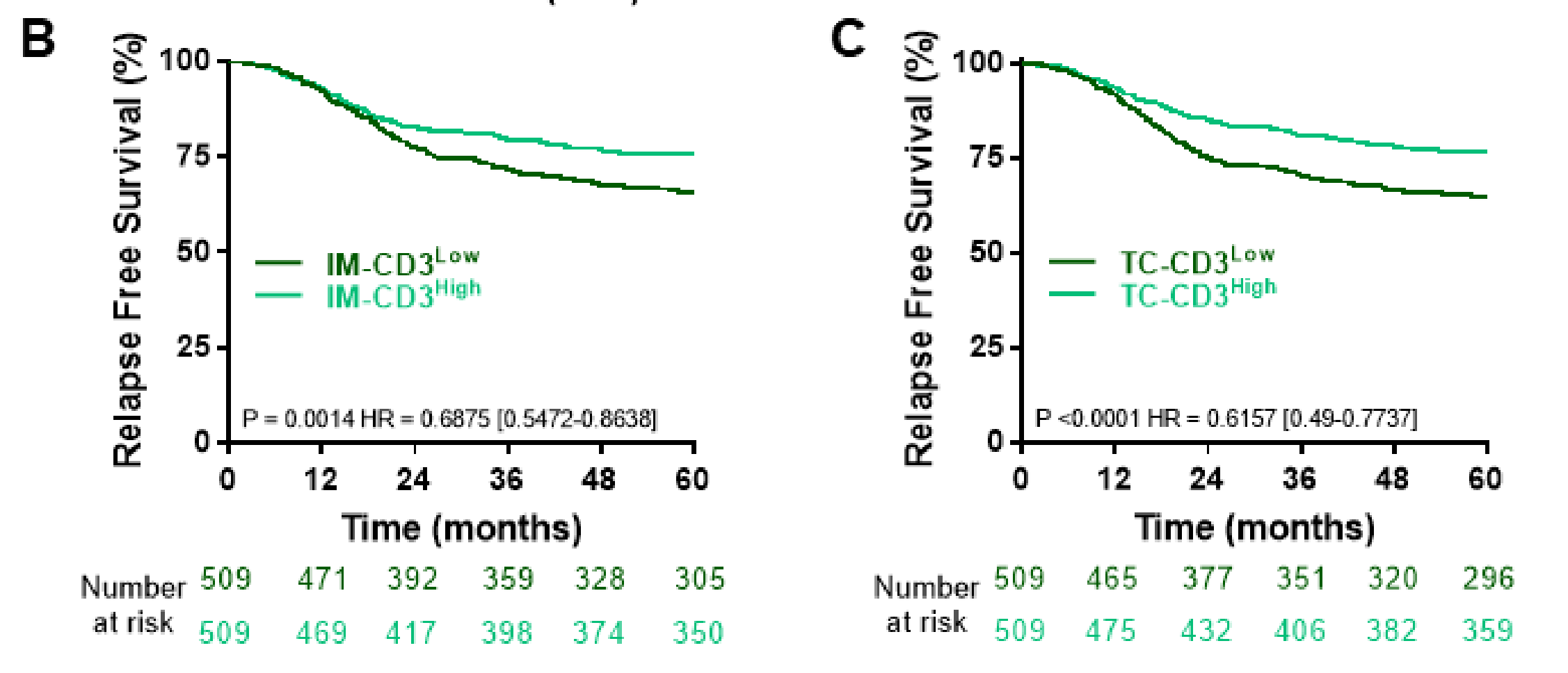
更高的T期与IM和TC中更少的CD3浸润相关。同样,N2期患者的IM中CD3浸润较低。在右侧肿瘤中,IM和TC中CD3和CD8浸润较高。在TC中,但不在IM中,dMMR肿瘤的CD3和CD8浸润较高;相反,RAS/BRAF突变状态不影响免疫浸润。
作者测试了四个免疫变量(CD3+ IM, CD3+ TC, CD8+ IM, CD8+ TC)之间的相关性,并观察到每个变量之间存在强相关性(p<0.0001,相关系数从0.42到0.81)(在线补充图S3)。
使用这四个免疫变量作为连续变量,作者测试了它们在RFS中的预后作用(图3A)。
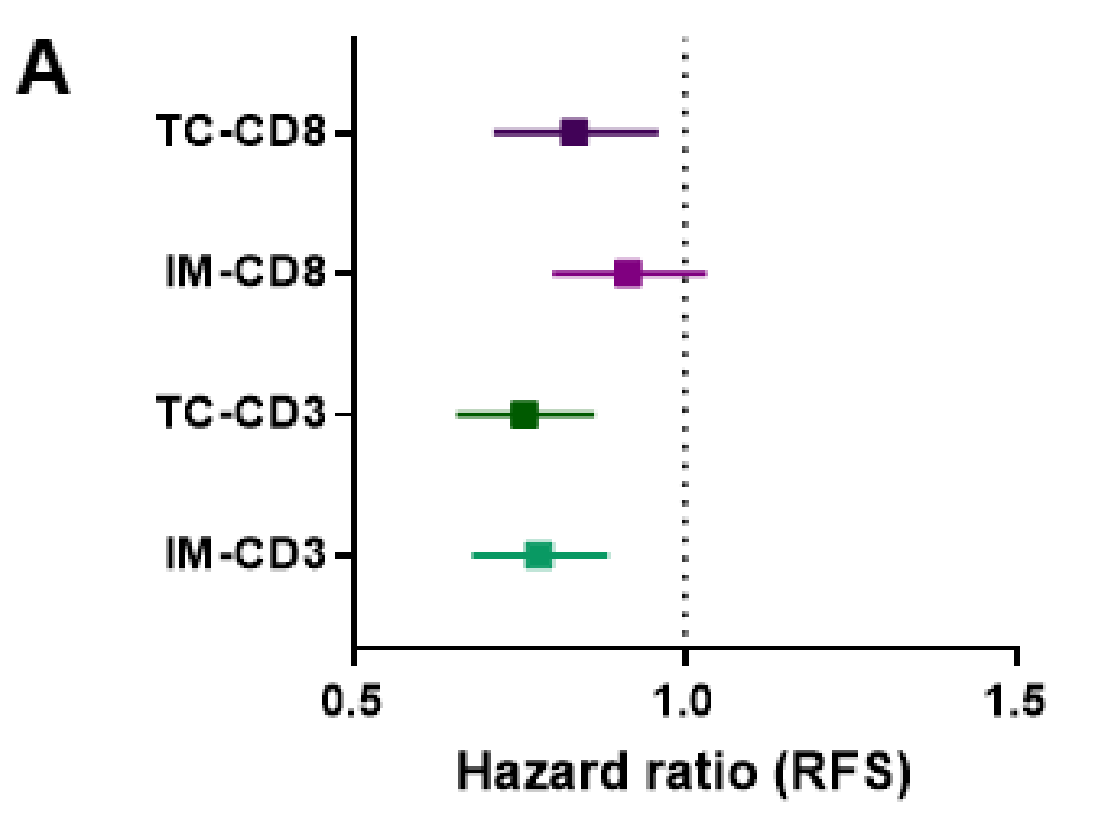
使用中位数作为截断值,高CD3+ IM, CD3+ TC和CD8+ TC与更好的结果显著相关,而CD8+ IM接近显著(图3B,C和在线补充图和S4)。
通过将这四个变量按照Pagès等人描述的方式组合成一个“类似免疫评分”(ISlike)的方法,作者观察到高ISlike患者的预后更好(图3D)。
ISlike预测RFS的能力与单独使用CD3+ IM, CD3+ TC, CD8+ IM或CD8+ TC的预测能力进行了比较,通过测试RFS的预测准确度,基于时间依赖的受试者操作特征曲线(AUC)的1000次自助重采样。ISlike并没有显著优于TC-CD3单一变量(似然比p=0.15)(图3E)。
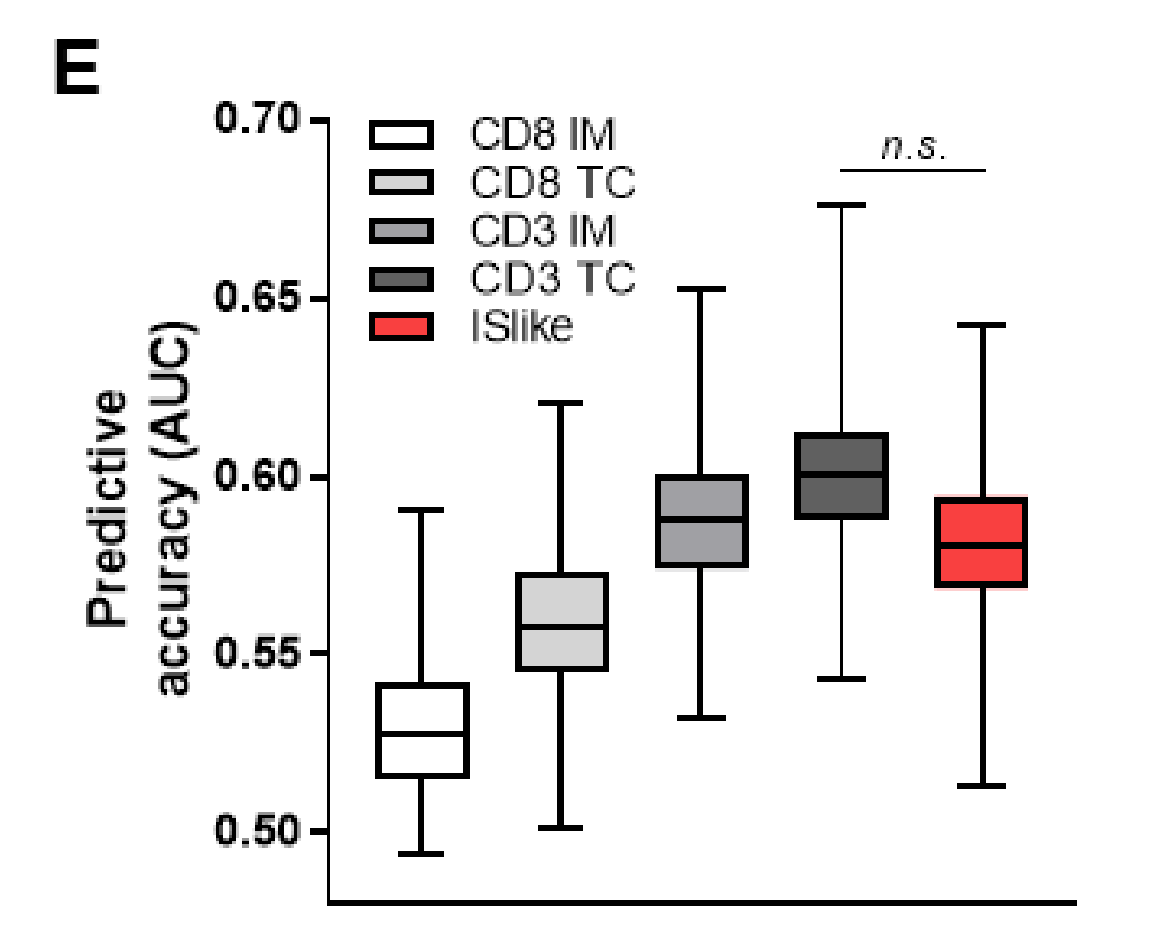
因此,为了进一步分析,作者决定只使用TC中的CD3来评估免疫变量,因为该变量与RFS的相关性更为显著。
包括免疫浸润、间质区和DGMate的复合变量改善了患者预后估计CD3+ TC, IM中的间质区和DGMate之间存在弱相关性(在线补充图S5)。
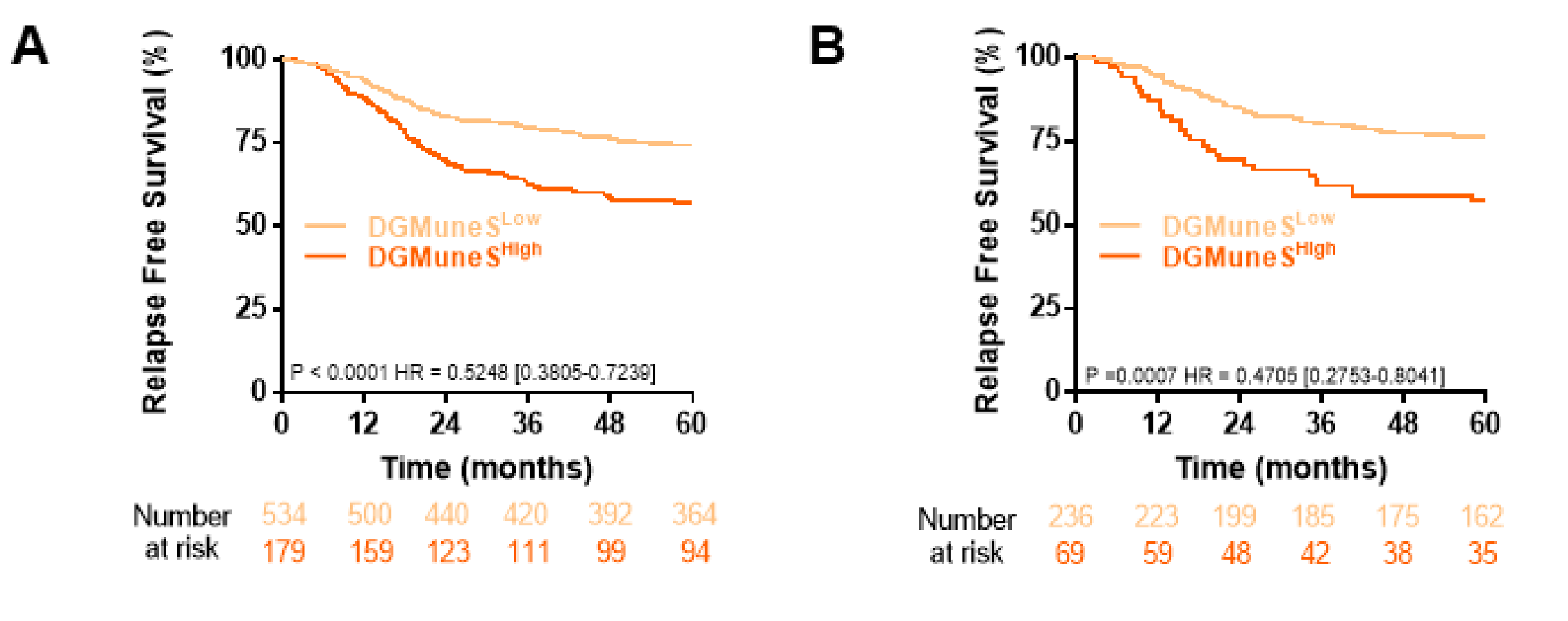
通过基于发现集将CD3+ TC, IM中的间质区和DGMate组合起来,作者生成了DGMuneS评分,该评分在发现数据集中与RFS显著相关,并且在验证数据集中也观察到了类似的结果(图4A,B)。
一个包括所有可用临床参数和DGMuneS复合评分的多变量Cox分析RFS显示,在训练和验证队列中,复合评分与结果独立相关(表1,在线补充表S2和S7)。
在Supplementary Table 7中,展示了Cox多变量分析的结果,这些结果评估了临床和图像变量与结肠癌患者无复发生存期(RFS)之间的关系。
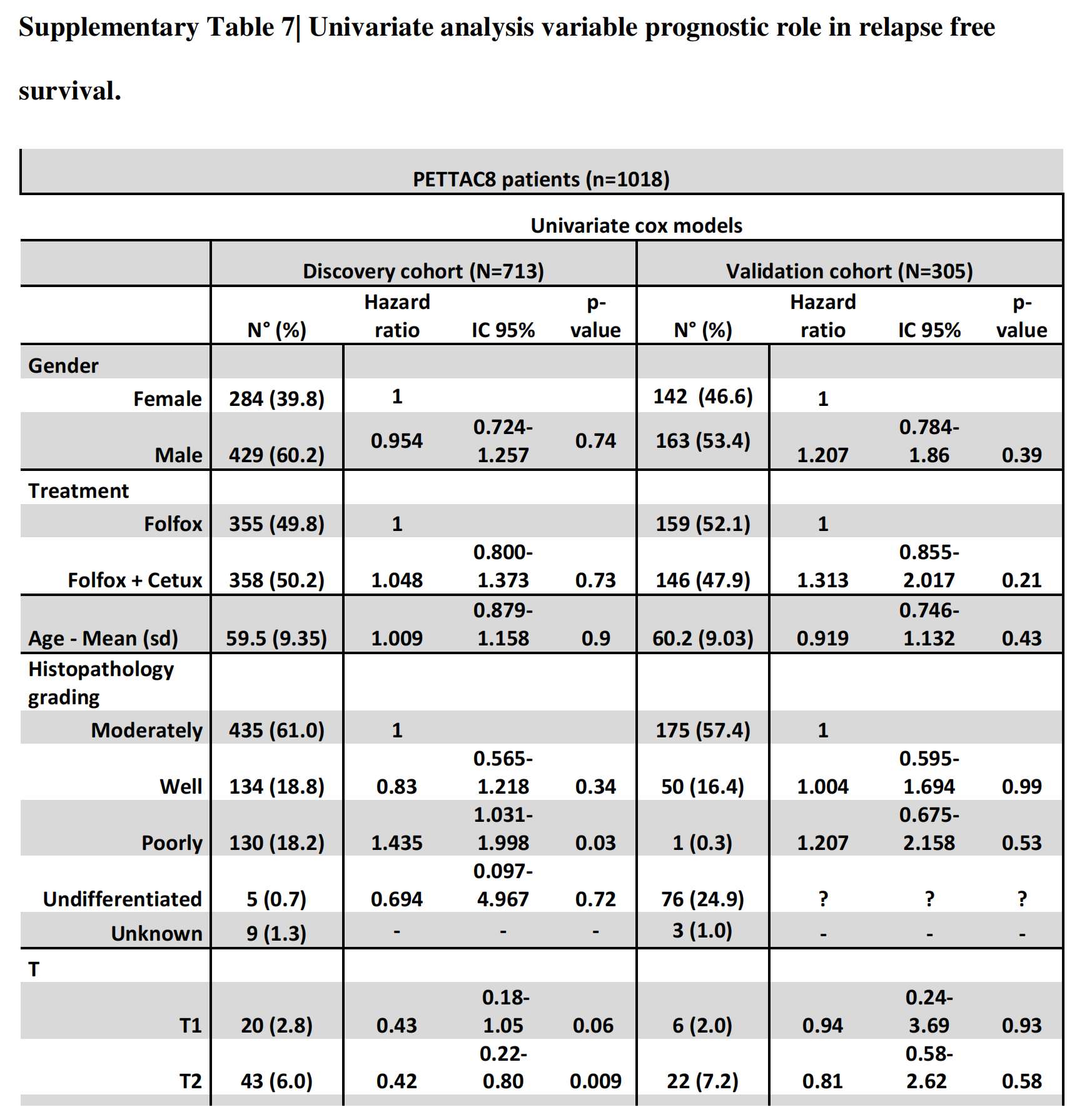
多变量Cox模型分析:
性别(Gender):
- 女性(Female)作为参照组。
- 男性(Male)的HR(风险比)为0.954,表明男性患者的复发风险略低于女性,但95%置信区间(CI)从0.724到1.257,P值为0.74,表示这种差异在统计上不显著。
治疗(Treatment):
- Folfox方案作为参照组。
- Folfox + Cetuximab方案的HR为1.048,95% CI从0.800到1.373,P值为0.73,表明添加Cetuximab的治疗并未显著改善无复发生存期。
年龄(Age):
- 以平均值(Mean)表示,SD(标准差)为9.35。
- 年龄对RFS的影响HR为1.009,95% CI从0.879到1.158,P值为0.9,表明年龄因素在统计上不显著。
组织病理学分级(Histopathology grading):
- 中度分化(Moderately)作为参照组。
- 良好分化(Well)和差分化(Poorly)的HR分别为0.83和1.435,但只有差分化的P值为0.03,表示在统计上与中度分化相比,差分化的肿瘤可能与较差的RFS相关。
T分期(T):
- T1至T4分期中,T3和T4分期的肿瘤具有更高的复发风险,特别是T4分期,HR为2.29,95% CI从1.58到3.32,P值为0.0001,显著预示着更短的无复发生存期。
N分期(N):
- N1分期作为参照组。
- N2分期的HR为2.464,95% CI从1.879到3.231,P值为6.87E-11,明显预示着N2分期患者的复发风险显著增加。
肿瘤侧(Tumor side):
- 左侧(Left side)作为参照组。
- 右侧(Right side)的HR为0.994,95% CI从0.755到1.308,P值为0.97,表明肿瘤位置对RFS没有显著影响。
KRAS和BRAF状态:
- KRAS野生型(Wild-type)作为参照组。
- KRAS突变型(Mutated)的HR为1.602,95% CI从1.221到2.105,P值为0.0007,表明KRAS突变与较短的RFS显著相关。
- BRAF野生型和突变型之间没有显著差异。
微卫星稳定状态(MSS status):
- 微卫星稳定(MSS)作为参照组。
- 微卫星不稳定(MSI)的HR为0.714,95% CI从0.442到1.207,P值为0.21,表明MSI状态对RFS的影响不显著。
图像变量(Image variables):
- CD3 TC(肿瘤核心中的CD3阳性T细胞数量)的HR为0.794,95% CI从0.679到0.929,P值为4.00E-03,表明较高的CD3阳性T细胞浸润与较长的RFS相关。
- 基质区域(Stroma Area IM)的HR为1.271,95% CI从1.098到1.472,P值为1.00E-03,表明基质面积较大的肿瘤与较短的RFS相关。
- 数字评分(Digital score)的HR为2.718,95% CI从1.718到4.3,P值为1.93E-05,表明数字评分较高的肿瘤与较短的RFS显著相关。
结论:
Cox多变量分析显示,T分期、N分期、KRAS突变状态和图像变量(如肿瘤核心中的CD3阳性T细胞数量、基质面积和数字评分)是影响结肠癌患者无复发生存期的显著因素。这些结果可以帮助医生更好地理解肿瘤的生物学行为,并可能有助于制定个性化的治疗策略。
在FOLFOX和FOLFOX–cetuximab组中,观察到了类似的预后结果(在线补充图S6)。
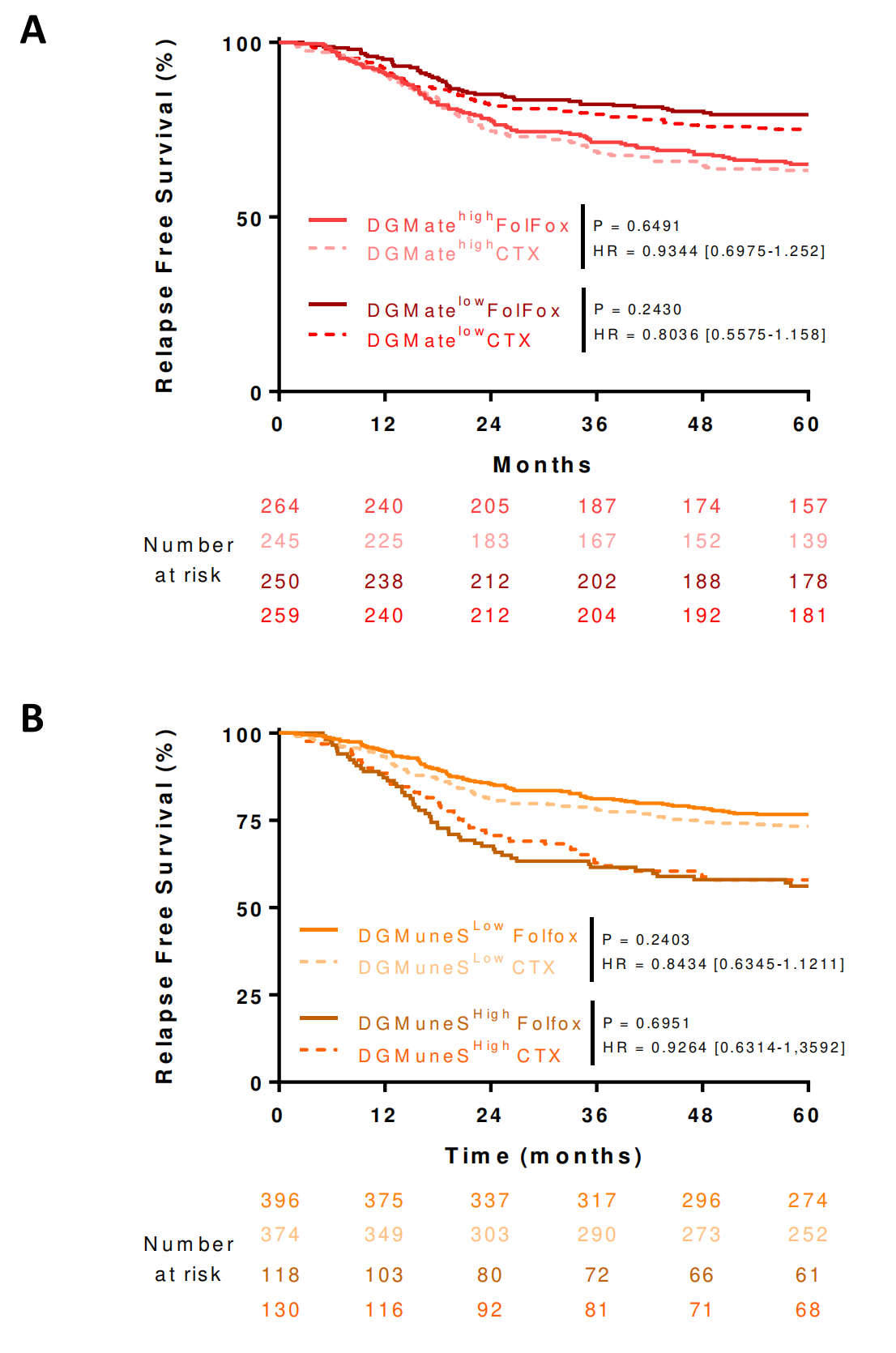
亚组分析显示,DGMuneS变量在T3N1或T3N2肿瘤分期组中与预后显著相关,并且可以显著识别出临床低风险(T1-3, N1)或高风险(T4或N2)组中预后非常好或非常差的患者(图4C)。
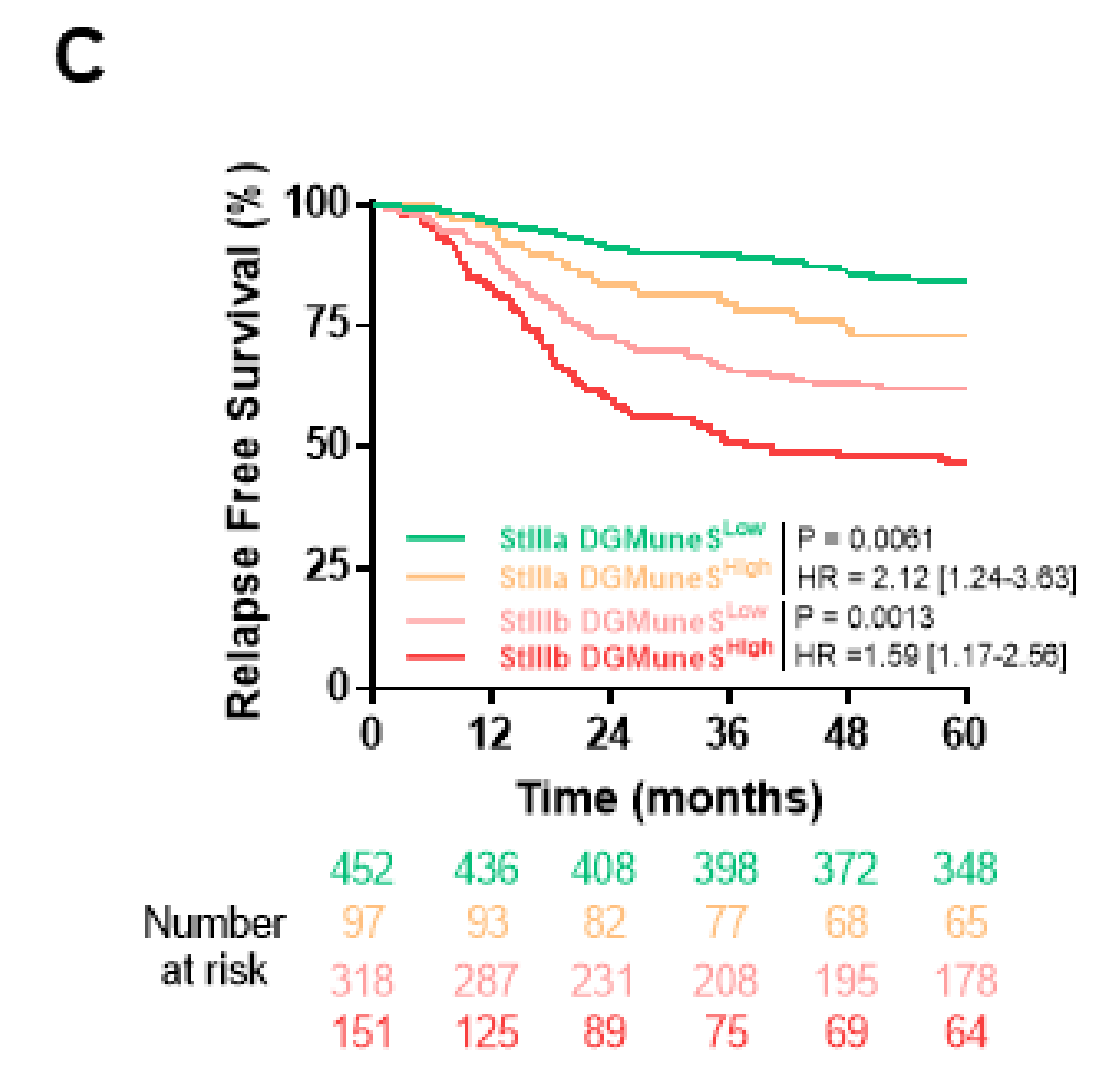
相反,ISlike二元变量在高风险临床分期(T4或N2)患者中无法显著区分预后组(图4D)。
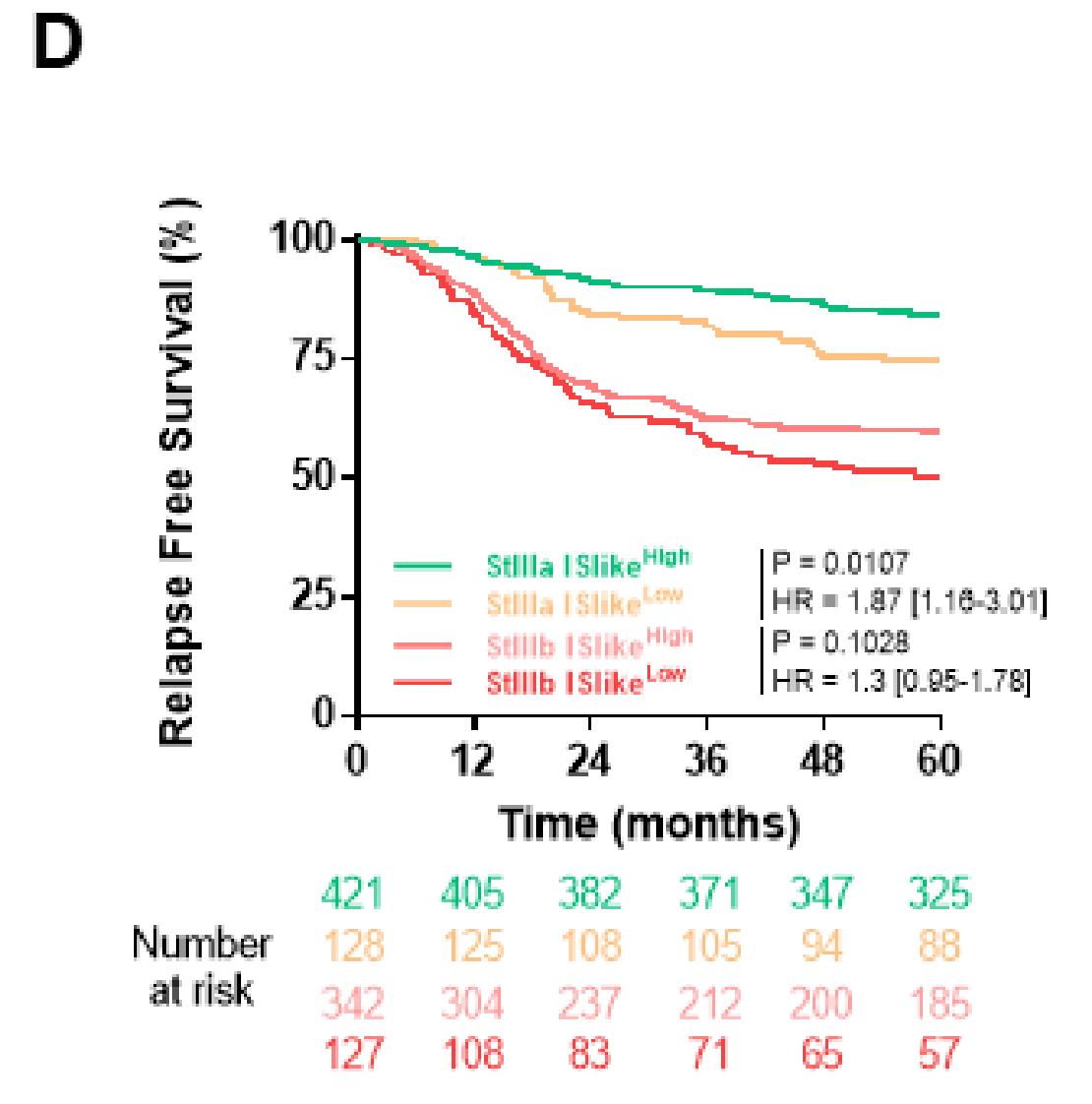
除了DGMate与组织学分级之间的交互作用(p=0.01)外,数字变量与经典临床预后变量之间没有发现显著的相互作用。使用逻辑回归,作者测试了数字变量预测经典预后变量(如T期、N期、分化状态和RAS/BRAF突变)的能力。
没有任何变量能够预测分化状态。只有DGMate能够显著预测N期和RAS/BRAF突变状态。所有变量(TC-CD3, DGMate和间质区)都可以用于预测T期(在线补充表S9)。
Supplementary Table 9 展示了逻辑回归分析的结果,这些分析用于测试数字变量预测临床变量的能力。
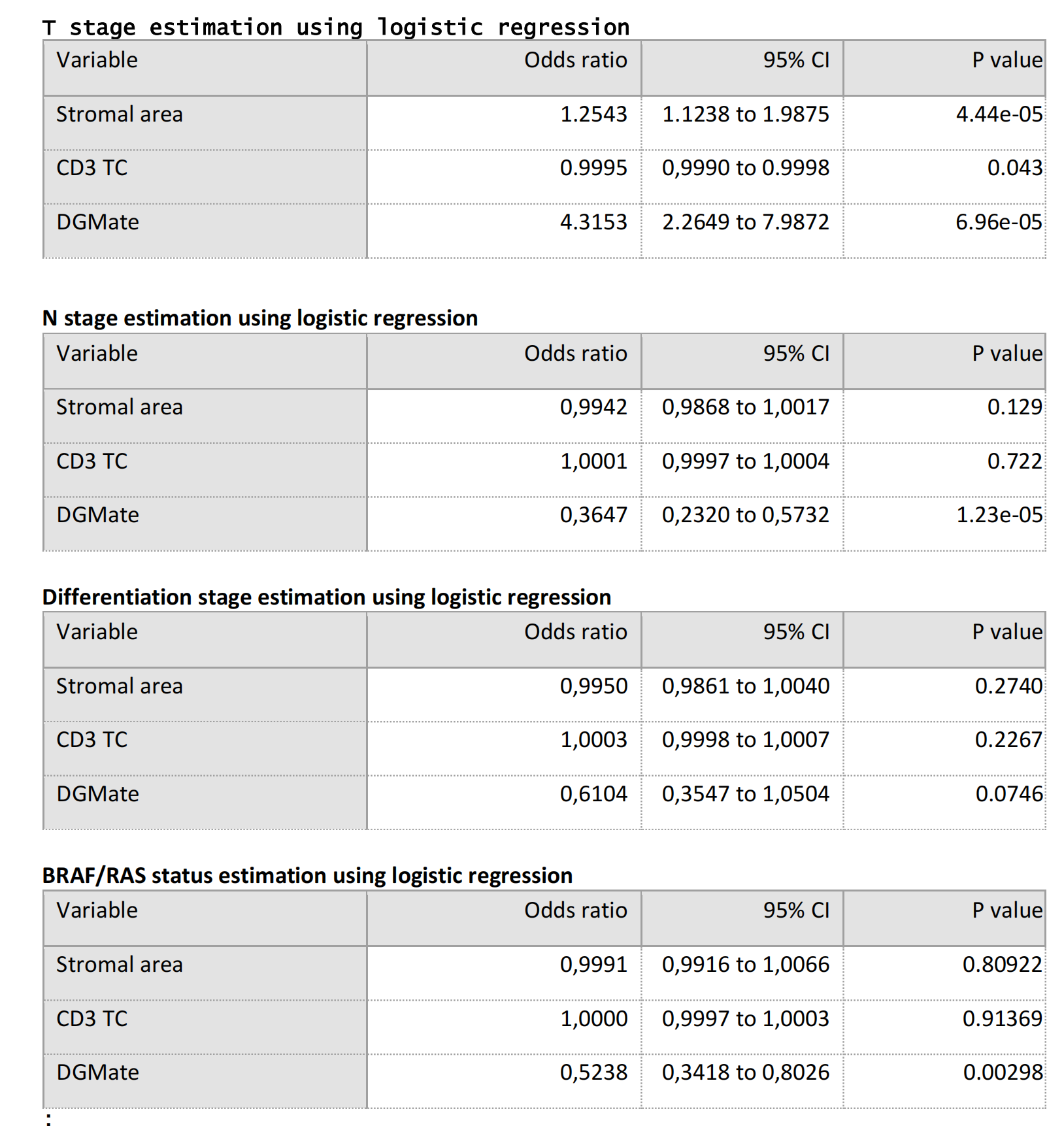
具体来说,表格中列出了基于数字变量(如基质面积、肿瘤核心中的CD3阳性T细胞数量、DGMate评分)来预测T分期、N分期、分化程度和BRAF/RAS状态的逻辑回归模型的参数。
T分期预测模型:
- 基质面积(Stromal area):比值比(Odds ratio, OR)为1.2543,95%置信区间(CI)从1.1238到1.9875,P值为4.44e-05,表明基质面积与T分期呈正相关,并且这种关系在统计上是显著的。
- CD3 TC(肿瘤核心中的CD3阳性T细胞数量):OR为0.9995,95% CI从0.9990到0.9998,P值为0.043,表明CD3 TC与T分期的关系接近统计显著性,但影响非常小。
- DGMate:OR为4.3153,95% CI从2.2649到7.9872,P值为6.96e-05,表明DGMate评分与T分期呈正相关,并且这种关系在统计上是显著的。
N分期预测模型:
- 基质面积:OR为0.9942,95% CI从0.9868到1.0017,P值为0.129,表明基质面积与N分期的关系在统计上不显著。
- CD3 TC:OR为1.0001,95% CI从0.9997到1.0004,P值为0.722,表明CD3 TC与N分期无关。
- DGMate:OR为0.3647,95% CI从0.2320到0.5732,P值为1.23e-05,表明DGMate评分与N分期呈负相关,并且这种关系在统计上是显著的。
分化程度预测模型:
- 基质面积:OR为0.9950,95% CI从0.9861到1.0040,P值为0.2740,表明基质面积与分化程度的关系在统计上不显著。
- CD3 TC:OR为1.0003,95% CI从0.9998到1.0007,P值为0.2267,表明CD3 TC与分化程度的关系在统计上不显著。
- DGMate:OR为0.6104,95% CI从0.3547到1.0504,P值为0.0746,表明DGMate评分与分化程度的关系接近统计显著性。
BRAF/RAS状态预测模型:
- 基质面积:OR为0.9991,95% CI从0.9916到1.0066,P值为0.80922,表明基质面积与BRAF/RAS状态无关。
- CD3 TC:OR为1.0000,95% CI从0.9997到1.0003,P值为0.91369,表明CD3 TC与BRAF/RAS状态无关。
- DGMate:OR为0.5238,95% CI从0.3418到0.8026,P值为0.00298,表明DGMate评分与BRAF/RAS状态呈负相关,并且这种关系在统计上是显著的。
结论:
- 逻辑回归分析表明,DGMate评分是预测T分期和BRAF/RAS状态的显著因素,而基质面积和CD3 TC的预测能力则取决于临床变量的类型。
- 特别是DGMate评分,它在预测T分期和N分期方面显示出较强的统计显著性,这可能表明它在结肠癌的临床评估中具有潜在的应用价值。
- 这些发现需要在更大的患者群体中进一步验证,以确定它们在临床实践中的应用潜力。
DGMuneS评分的预测准确性通过确定时间依赖的AUC进行评估;发现其优于肿瘤分级、RAS状态、MSI状态、侧位或免疫评分;并且与T期和N期的时间依赖AUC值相似。
此外,将DGMuneS评分添加到结合所有临床变量(性别、侧位、MMR状态、分化、T期、N期)的模型中,显著改善了RFS的预测(似然比p=0.0007;图4E)。肿瘤相关(间质区和DGMate)和TC中的CD3免疫变量都是确定患者预后所需的关键因素(似然比p=0.04;图4E)。
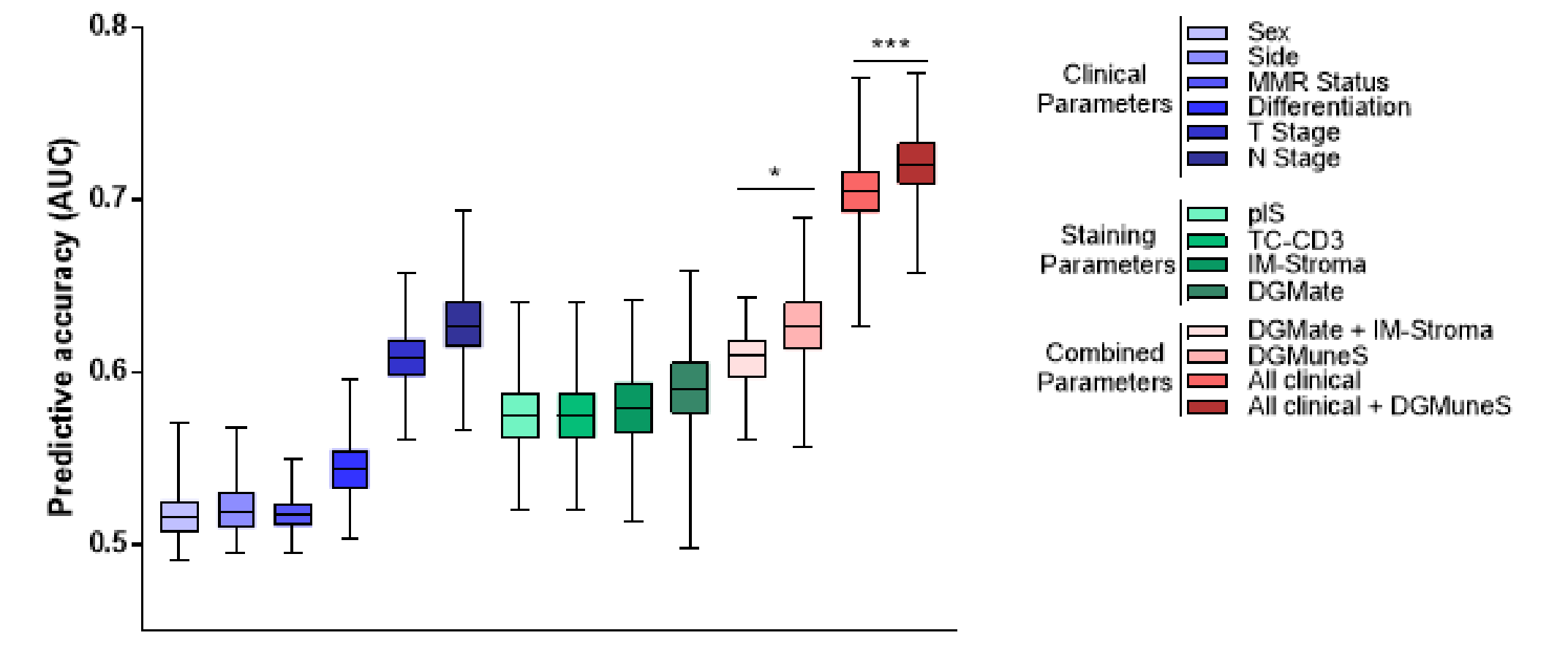
为了评估患者预后,作者基于多变量模型中保留的变量(即DGMuneS、T期、N期、肿瘤分化状态和RAS状态)生成了一个列线图工具。预后评分基于nomogram上的总分(图5A)。
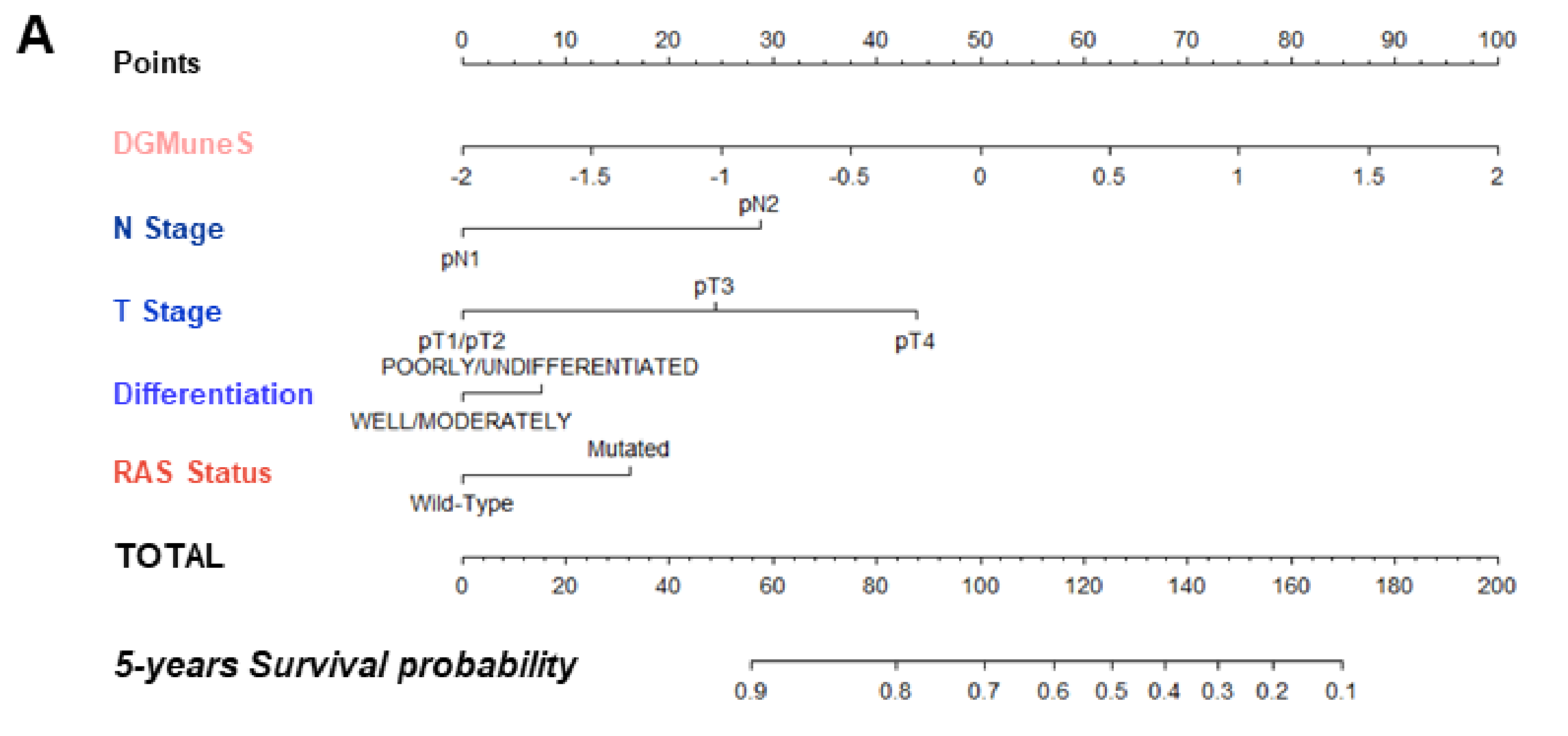
患者被分为三个风险组,代表20%较低、60%中间和20%较高分数。这种分离是任意选择的,以便中间组具有与整个队列相似的RFS模式。5年复发风险在较低组为12%(高vs低;HR 0.167;95%CI 0.099至0.284;p=5e-13),在中间组为28%(高vs中间;HR 0.428;95%CI 0.319至0.573;p=5.6e-09),在较高组为52%(图5B)。
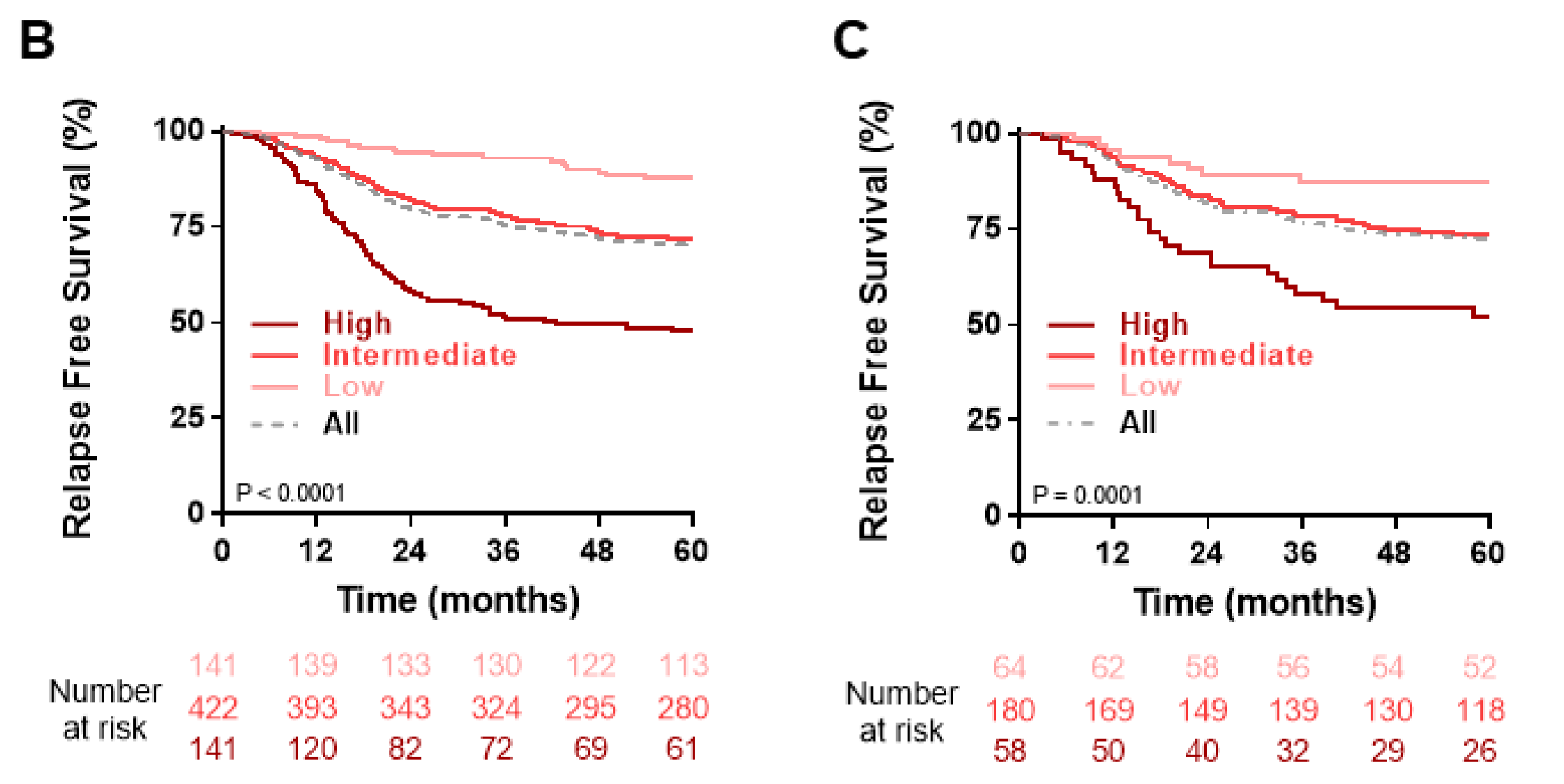
使用与训练集相同的截断值,作者在验证数据集中识别了相同的风险组,RFS通过Kaplan-Meier曲线表示(所有p<0.001)(图5C)。
六、讨论
局部CC的辅助策略优化仍然是一个重要问题。根据最近的国际指南,基于IDEA研究,对于低风险临床分期的CC患者,建议只需接受3个月的FOLFOX或XELOX方案治疗,而对于高风险临床分期的患者,则推荐接受6个月的基于奥沙利铂的化疗。
采用这种治疗方案,低风险和高风险临床分期患者的3年无复发生存率分别为82%和62%。需要额外的预后标志物来更好地确定患者的预后。最近的数据表明,BRAF或RAS突变在MSS状态的患者中与复发时间和总体生存时间缩短独立相关,但与MSI状态无关。
此外,免疫浸润也与肿瘤预后相关,免疫评分被证明可以预测I、II和III期CC患者的预后。作者推测,通过分析组织结构、肿瘤细胞特性和免疫浸润,可以结合预测CC的结果,并可能优于免疫评分。
使用随机森林分类器,作者生成了一种可以描述肿瘤细胞、正常和间质区域的软件。该软件检测IM并计数每个区域的免疫浸润。
作者观察到,从预后角度来看,这种组织分析是很有趣的,因为大的间质区与较差的预后相关。这种数据与以前在II和III期CC中获得的数据显示了高度的相关性,强调了高间质组织患者的较差预后。
作者还使用LASSO算法分离了与患者结果相关的八个肿瘤细胞参数,称为DGMate评分。令人惊讶的是,这个参数与RAS、MSI状态或肿瘤分化状态无关,这表明数字病理学与机器学习相结合,隔离了人类分析无法识别的独立预后表型特征。
作者的CD3和CD8变量分析生成了一个具有时间依赖性区分特性的ISlike评分(AUC为0.56),与最近关于免疫评分国际验证的出版物相似(AUC为0.57)。重要的是,CD3和CD8变量之间存在强相关性,ISlike评分和TC中的CD3肿瘤浸润淋巴细胞(TILs)呈现类似的AUC值。
因此,在III期CC中,作者认为免疫评分对简单TC CD3累积分析没有额外价值。大多数TC-CD3位于肿瘤细胞岛周围的间质组织中,而这些组织在大多数情况下侵入性较差。
分析TC或肿瘤细胞岛中CD3 TILs的预后作用并没有超过全球TC CD3分析,所以作者保留了这个变量用于进一步分析(未显示)。CD8染色在作者的研究中没有提供额外的价值,尽管一个限制是CD8染色是在比CD3染色使用的更老的切片中进行的,这可能意味着染色效率较低。
作者的研究显示,包括间质区、CD3和DGMate的复合变量高度预测结果,并且在与ISlike评分或临床变量相比时具有优越的区分特性。这种观察的一个限制可能是作者使用了基于免疫评分方法的适应性算法。
事实上,当作者在系列中比较ISlike的时间依赖AUC和最近国际验证免疫评分的时间依赖AUC时,这个模型提供了与免疫评分相似的结果。需要进行额外的研究,直接比较免疫评分和DGMuneS。为了确认作者的评分,需要进行交叉验证,并解决使用不同切片扫描仪的问题。
免疫评分小组提出,T和N分期不是必要的预后生物标志物,可以被免疫变量所取代。作者的研究证明相反,并明确指出,免疫或数字变量是附加值,但不能取代临床分期。
作者的数据证实了Laghi等人之前的观察结果,他们发现N分期与CD3浸润之间存在依赖关系。尽管作者的ISlike变量在III期高风险患者中无法预测预后,但DGMuneS仍然具有预后价值,这表明将数字变量添加到免疫浸润评估中可以改善肿瘤预后预测。
作者设计了一个nomogram来实现评分系统。目前,尚无预后模型可用于估计III期CC患者的无复发生存率。使用这种策略,作者识别出了5年RFS率较低(50%)的患者。这些患者可能需要密切的随访,并应包括在测试强化辅助治疗的临床试验中,例如IROCAS研究(NCT02967289)。
作者还确定了一些具有极好预后(90% 5年RFS)的患者。在这种情况下,应讨论辅助治疗的相对风险/收益,并应启动临床试验,以研究如何最小化辅助治疗。作者提供了一个nomogram和所需的软件,以及一个教程。使用这个开放软件,任何病理学家都可以进行CD3分析。
尽管这项研究涉及了大量的III期CC患者,但作者的工作也存在局限性。分析的后验设计和某些亚组患者数量的限制可能限制作者的结论。这项工作的训练和验证队列是从全球试验人群中抽样的。尽管进行了内部验证,但需要进行前瞻性试验的外部验证,以验证作者软件的可重复性,使用不同的数据集。类似的实验也应在II期肿瘤中进行,以测试作者的数据是否可以在不经常接受化疗的患者背景下得到验证。























 455
455

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








