小罗碎碎念
本期推文写作目的
这期推文是一个总结性的推文,花了我四个多小时才整理完,应该是我这几个月耗时最长的一篇推文。
总共分析了六篇文献,前面两篇是临床相关的文献,都是顶刊——Science+Molecular Cancer。通过前面这两篇文献,我们可以对三级淋巴结的临床背景有一个大致的了解。
后面的四篇文献,则是介绍了四篇医工结合的文章,涉及胃肠道肿瘤、肺癌、鼻咽癌的三级淋巴结/肿瘤浸润淋巴细胞的自动量化,感兴趣的可以bing直接阅读相应的部分。

另外,每篇文献解读完,我都列了一些问题,大家读完以后有疑问也可以留言或者进群交流!!科研不易,如果能多一个讨论的,就会多一份解决问题的可能!!
为了方便大家获取文献,我把标题和doi都放在下面的表格了,大家按需自取。
| 标题 | doi | 期刊 | IF |
|---|---|---|---|
| Tertiary lymphoid structures in cancer | 10.1126/science.abf9419 | Science | 44.7 |
| Tertiary lymphoid structural heterogeneity determines tumour immunity and prospects for clinical application | 10.1186/s12943-024-01980-6 | Molecular Cancer | 27.7 |
| Development and Validation of a Machine Learning Model for Detection and Classification of Tertiary Lymphoid Structures in Gastrointestinal Cancers | 10.1001/jamanetworkopen.2022.52553 | JAMA network open | 10.5 |
| AI-Based Risk Score from Tumour-Infiltrating Lymphocyte Predicts Locoregional-Free Survival in Nasopharyngeal Carcinoma | 10.3390/cancers15245789 | Cancers | 4.5 |
| Deep learning on tertiary lymphoid structures in hematoxylin-eosin predicts cancer prognosis and immunotherapy response | 10.1038/s41698-024-00579-w | npj precision oncology | 6.8 |
| Computerized tertiary lymphoid structures density on H&E-images is a prognostic biomarker in resectable lung adenocarcinoma | 10.1016/j.isci.2023.107635 | iScience | 4.6 |
一、Science|癌症中三级淋巴结构的免疫调节作用与治疗潜力

尽管TLSs在多种癌症类型中与更好的预后相关,但其具体功能和作用机制仍需进一步研究。通过标准化测量TLS的数量和组成,可以更好地揭示其在不同疾病设置中的预测和预后价值。
此外,更全面地表征TLS可能有助于定义基于细胞组成、位置、成熟度和功能的TLS状态谱,从而提高其作为预后和预测标志物的价值。
最后,更好地理解TLS的功能及其在自身免疫毒性中的潜在作用将有助于最大化其作为治疗靶点的价值。
一作&通讯
| 作者类型 | 作者姓名 | 单位名称(中文) |
|---|---|---|
| 第一作者 | Ton N. Schumacher | 荷兰癌症研究所 |
| 通讯作者 | Daniela S. Thommen | 荷兰癌症研究所 |
1-1:三级淋巴结的临床背景
三级淋巴结构(Tertiary Lymphoid Structures,TLS)是在非淋巴组织中后天形成的免疫细胞有序聚集体,通常在慢性炎症环境下出现,如自身免疫性疾病、慢性感染和癌症。TLS的形成与机体对长期存在的抗原刺激的免疫应答有关,它们在肿瘤微环境中的存在通常与更好的预后和对免疫治疗的积极反应相关。
TLS的结构和功能类似于正常的二级淋巴器官(如淋巴结),但它们在解剖学上有所不同,通常缺乏被膜结构。TLS可以包含多种免疫细胞,包括T细胞、B细胞、树突细胞、巨噬细胞以及滤泡树突细胞等。它们在肿瘤组织中的分布和组织状态可能影响其功能和与肿瘤进展的关系。
TLS的形成受到多种因素的调控,包括肿瘤微环境中的细胞因子、趋化因子和粘附分子等。肿瘤特异性的T细胞和B细胞可能通过产生特定的细胞因子(如CXCL13和CCN19)来促进TLS的形成和维持。这些细胞因子不仅吸引免疫细胞向TLS区域迁移,还有助于免疫细胞在TLS中的存活和增殖。
TLS在肿瘤中的成熟状态不同,可能从简单的淋巴细胞聚集发展到包含生发中心的复杂结构。生发中心是B细胞增殖、分化和抗体产生的重要场所,它们的存在表明TLS可能在适应性免疫反应中发挥着关键作用。
研究表明,TLS的存在与癌症患者的临床获益相关,它们可能作为预后和预测因素,帮助评估患者对免疫治疗的反应。然而,TLS与肿瘤免疫反应之间的确切关系仍然不完全清楚。一些研究提出,TLS可能增强肿瘤特异性T细胞的反应,而另一些研究则观察到TLS可能与免疫抑制性细胞(如调节性T细胞)的存在有关,这可能限制了免疫反应的有效性。
为了更好地利用TLS作为癌症治疗的潜在靶点,需要进一步研究TLS的形成机制、它们在肿瘤免疫微环境中的作用以及如何通过干预TLS来增强抗肿瘤免疫反应。
此外,开发标准化的方法来评估TLS的数量、组成和成熟状态对于提高它们作为生物标志物的可靠性和预测价值至关重要。随着对TLS在癌症中作用的深入了解,我们可能会发现新的策略来改善癌症患者的治疗结果。
1-2:实验设计
- 数据收集:通过分析多种癌症类型的肿瘤样本,收集了TLSs的存在和组成数据。使用了不同的分子标志物来识别和表征TLSs。
- 样本选择:选择了包括非小细胞肺癌(NSCLC)、结直肠癌(CRC)、卵巢癌和黑色素瘤在内的多种癌症类型进行研究。
- 参数配置:在分析TLS的组成时,考虑了细胞类型(如B细胞、T细胞、DCs)、位置(如外周TLS、肿瘤内TLS)、成熟度和功能等参数。
1-3:结果与分析
- TLS的存在与预后相关:在多种癌症类型中,TLSs的存在与更好的预后相关。例如,在非小细胞肺癌、结直肠癌和胰腺癌中,TLSs的存在与更高的生存率相关。
- TLS与免疫治疗反应相关:在黑色素瘤、肾细胞癌、软组织肉瘤和尿路上皮癌中,TLSs的存在与对ICB治疗的更好反应相关。
- TLS的异质性:不同癌症类型中的TLS异质性显著,可能影响其预后价值。例如,在肝细胞癌中,初级或次级滤泡样分化的TLS与低复发风险相关,而其他类型的TLS则与较高的复发风险相关。
- TLS的功能:TLSs可能通过促进肿瘤特异性免疫反应来增强抗肿瘤免疫应答。TLSs中的B细胞和T细胞可能参与生成高质量的免疫反应,并且TLSs的存在可能提供生成质量不同的免疫反应的可能性。
1-4:重点关注几个问题
问题1
TLSs在肿瘤组织中的具体细胞组成是什么?
TLSs由多种免疫细胞组成,主要包括B细胞、T细胞、树突状细胞(DCs)和内皮细胞。
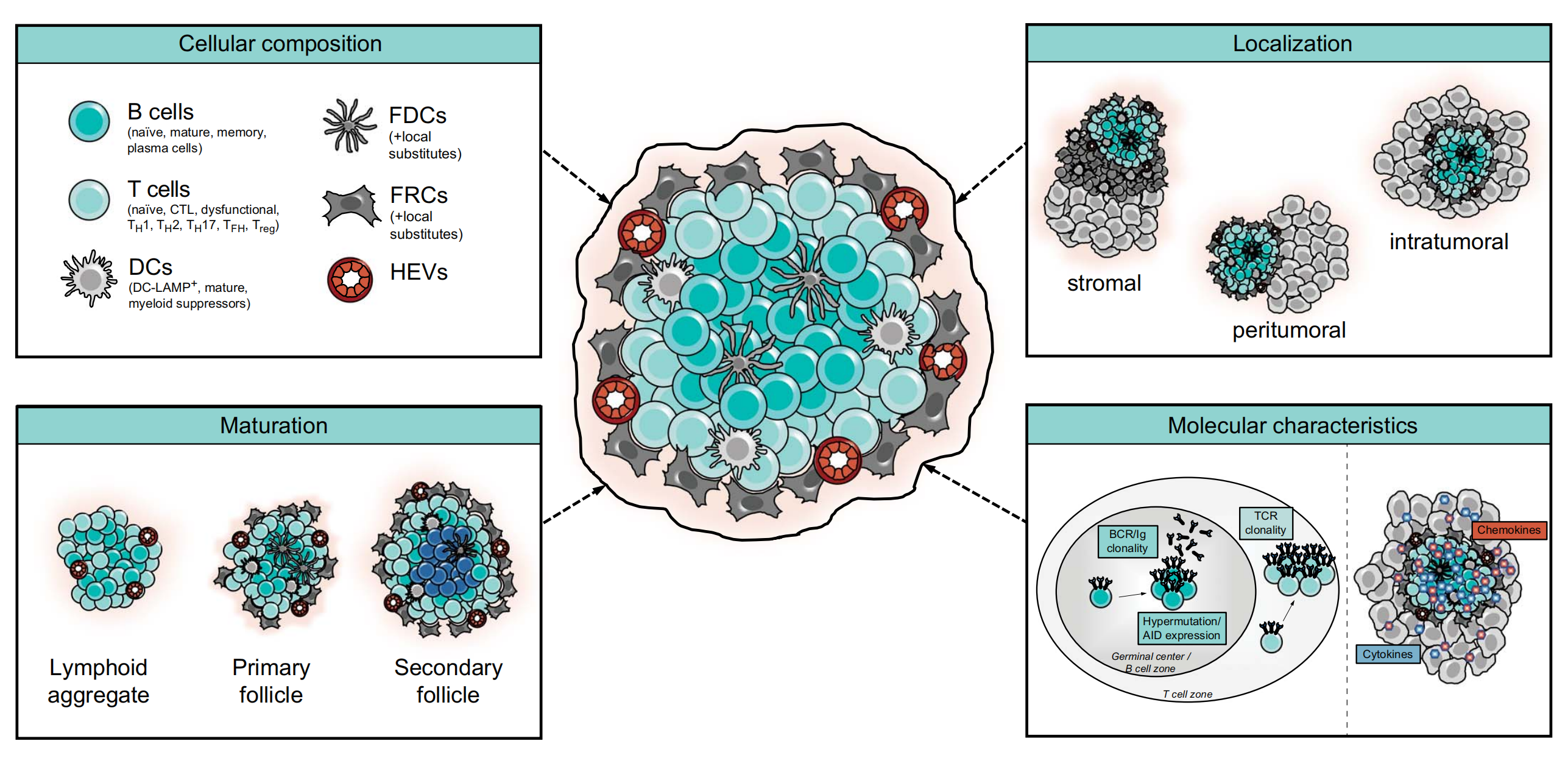
在T细胞区,CD4+ T辅助细胞(尤其是T follicular helper, TFH)占主导地位,但CD8+ 细胞毒性T细胞、CD4+ T辅助细胞1型(TH1)和调节性T细胞(Tregs)也可能存在。B细胞区主要由CD20+ B细胞组成,周围环绕着CD3+ T细胞。
此外,TLSs中还包含特定的DC亚群,如CD21+ 滤泡树突状细胞(FDCs)和CD83+ 成熟DCs。最后,TLSs的结构还包括高内皮静脉(HEVs),这些血管提供了专门的淋巴细胞招募功能。
问题2
TLSs在肿瘤免疫反应中的具体功能是什么?
TLSs被认为在炎症组织部位重现次级淋巴器官(SLOs)的功能,可能通过以下几种方式增强抗肿瘤免疫应答:
- 抗原呈递:TLSs提供了高效的抗原呈递场所,帮助肿瘤抗原特异的T和B细胞相遇并进行反应。
- B细胞反应:TLSs内的B细胞可以进行克隆扩增、体细胞超突变和抗体类别转换,生成高亲和力的抗体,标记抗原表达细胞以便于清除或呈递。
- T细胞反应:TLSs支持T细胞的激活和增殖,特别是TFH细胞在TLSs中的存在促进了生成效应B细胞和记忆B细胞。
- 免疫调节:TLSs中的Tregs可能通过抑制效应T细胞的活动来调节免疫反应,但也可能有抑制抗肿瘤反应的风险。
问题3
TLSs的异质性如何影响其临床结果?
TLSs的异质性在多个方面影响其临床结果:
- 细胞组成:不同癌症类型中的TLSs在细胞组成上存在差异,例如某些癌症类型中TFH细胞的比例较高,而其他类型中则是效应T细胞占主导。
- 位置:TLSs的位置(外周或肿瘤内)也会影响其功能。外周TLS可能与更好的预后相关,而肿瘤内TLS可能与肿瘤发展或进展有关。
- 成熟度:TLSs的成熟度不同,初级或次级TLS可能具有不同的功能。完全成熟的TLS可能更有效支持免疫反应,而未成熟的TLS可能功能较弱。
- 异质性对治疗反应的影响:TLSs的异质性可能影响其对免疫检查点阻断(ICB)治疗的反应。某些TLS亚群可能对治疗更敏感,而其他亚群则可能不响应。因此,理解和利用TLSs的异质性可能是提高治疗效果的关键。
问题4
TLS的预后及预测价值
TLS在癌症中的预后和预测价值的增强,显著提升了这些结构作为抗肿瘤免疫反应潜在介质的兴趣。TLS的预后价值在于它们能够反映出肿瘤微环境中的免疫活性水平。尽管TLS在多种癌症类型中已被识别,但不同研究中用于定义和表征TLS的标记物存在差异,这导致了在不同癌症类型间比较TLS的预测和预后价值时的复杂性。为了解决这一问题,发展标准化的TLS测量方法至关重要,这将有助于更准确地揭示TLS在不同疾病环境中的作用。
TLS的全面表征,包括其细胞组成、位置、成熟度和功能等方面,可能会导致识别出TLS状态的谱系。类似于在癌症中对T细胞状态的定义,对TLS状态的分子层面定义可能有助于提升其作为预后和预测标记物的准确性。这种定义将提高我们对肿瘤特异性免疫中特定T细胞群体作用的理解。深入理解TLS的功能以及它们对自身免疫毒性的潜在贡献,对于最大限度地发挥其作为治疗靶点的价值至关重要。
研究表明,TLS与许多癌症的良好预后相关,并且这种预后价值通常独立于肿瘤的TNM分期。TLS的成熟状态和位置异质性对其预后价值有显著影响。例如,在肝细胞癌(HCC)或结直肠癌(CRC)中,具有原发性或继发性滤泡样结构的TLS患者的复发风险较低。在TLS的位置方面,大多数肿瘤的TLS位于肿瘤周围,但在HCC、生殖细胞肿瘤和肾细胞癌的肺转移中也发现了瘤内TLS的存在。
尽管在多数癌症类型中TLS与良好的预后相关,但在某些情况下,TLS可能与肿瘤的发生和进展相关。例如,在小鼠肺腺癌模型中,TLS中缺乏调节性T细胞(Tregs)可以更有效地控制肿瘤,这表明TLS相关的Tregs可能会抑制内源性抗肿瘤T细胞反应。
此外,TLS中的B细胞除了作为肿瘤特异性抗体的生产者外,也可能对肿瘤特异性免疫产生抑制作用。这些发现强调了对TLS在不同癌症类型和肿瘤微环境中作用的复杂性的理解,以及在开发以TLS为靶点的癌症治疗策略时需要考虑的因素。
二、Molecular Cancer|肿瘤微环境中三级淋巴结构的异质性及其临床应用前景
这篇论文总结了TLS在肿瘤免疫中的双重作用,并强调了TLS作为预测免疫疗法疗效的生物标志物的潜力。
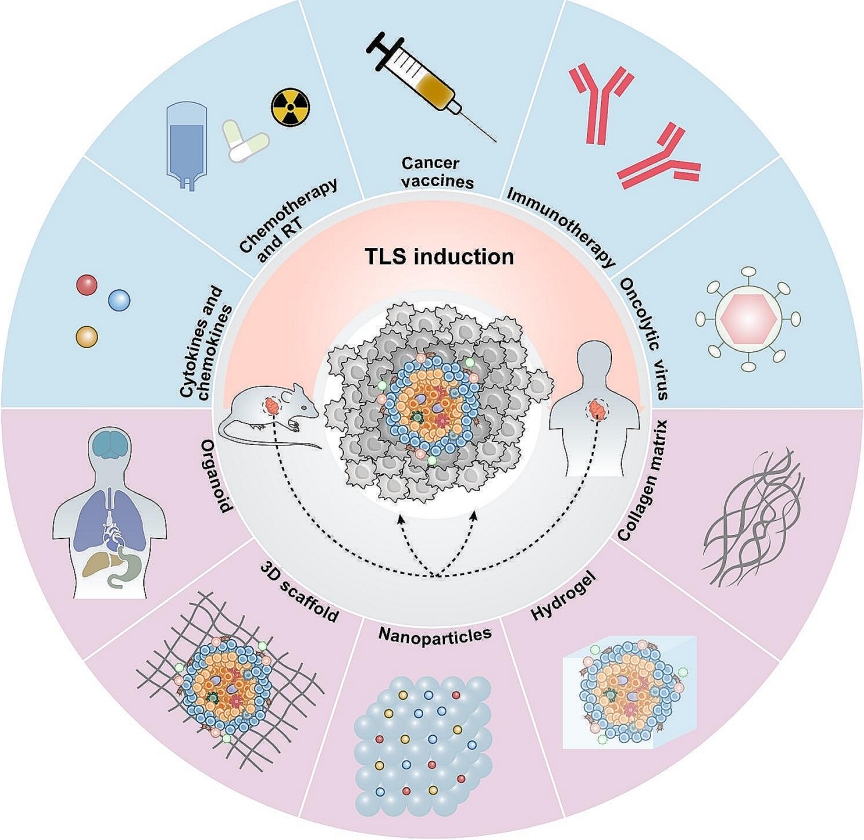
通过结合成像技术和生物材料,研究人员可以更有效地可视化和诱导TLS,从而增强抗肿瘤免疫反应。未来的研究应着重于解决TLS量化和评估的异质性问题,并开发新的生物材料和技术来提高TLS诱导的效率和精度。

一作&通讯
| 角色 | 姓名 | 单位(中文翻译) |
|---|---|---|
| 第一作者 | Yuyuan Zhang | 郑州大学第一附属医院放射介入科 |
| 第一作者 | Mengjun Xu | / |
| 第一作者 | Yuqing Ren | 郑州大学第一附属医院呼吸与危重症医学科 |
| 通讯作者 | Xinwei Han | 郑州大学第一附属医院放射介入科 |
| 通讯作者 | Zaoqu Liu | 郑州大学第一附属医院放射介入科 |
论文详解
这篇文章我详细分析过,感兴趣的可以去看看。
https://mp.weixin.qq.com/s/fAck4elnSNDc5sIYXTgS9w
2-1:研究背景
- 研究问题:这篇文章探讨了三级淋巴样结构(TLS)在肿瘤免疫中的异质性及其在临床应用中的前景。TLS是类似次级淋巴样器官(SLOs)的免疫细胞集群,通常与抗肿瘤免疫反应相关,但在某些情况下也可能促进肿瘤生长。
- 研究难点:TLS的功能异质性主要由肿瘤浸润淋巴细胞(TILs)的组成和肿瘤相关TLS(TA-TLS)内细胞亚群的平衡决定。不同成熟度、密度和位置的TA-TLS可能对肿瘤免疫有不同的影响。
- 相关工作:TLS作为预测免疫疗法疗效的生物标志物受到了广泛关注。现有研究表明,TLS的存在与患者的良好临床结果相关,尤其是在免疫检查点阻断(ICB)治疗中。
2-2:研究方法
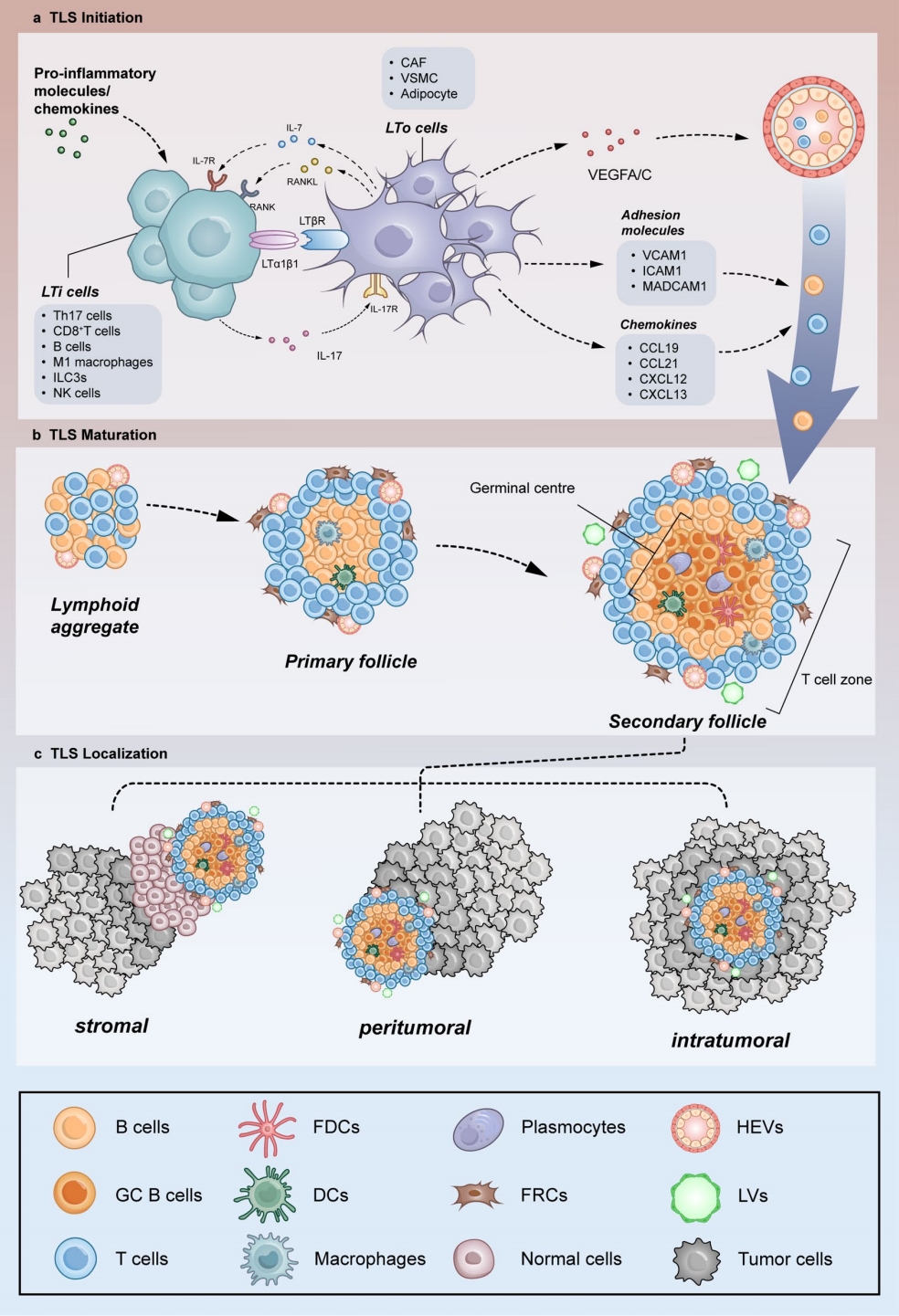
这篇论文提出了通过成像技术和生物材料来研究TLS的形成和诱导方法,以增强抗肿瘤免疫。具体来说,
-
TLS的结构和功能多样性:研究了不同表型的T和B细胞亚群在TLS中的动态相互作用,这些相互作用有助于TLS的结构和功能多样性。
-
TLS成像技术:探讨了现有的和新兴的TLS成像技术,包括多重免疫组化(mIHC)、免疫荧光(IF)、空间转录组学和流式细胞术等。
-
TLS诱导方法:总结了当前用于诱导TLS的各种方法,包括使用细胞因子或趋化因子、化疗、放疗、癌症疫苗和ICB治疗等。
2-3:实验设计
- 数据收集:通过多重免疫组化(mIHC)和免疫荧光(IF)分析39例肝内胆管癌(iCCA)样本中的TLS组成。
- 样本选择:选择了包括结直肠癌(CRC)、非小细胞肺癌(NSCLC)、乳腺癌(BC)和黑色素瘤在内的多种癌症类型的患者样本。
- 参数配置:在成像技术中,使用了不同的抗体组合和染色方法来识别和定位TLS中的不同细胞类型。
2-4:结果与分析
-
TLS与肿瘤预后的关系:分析表明,TLS的数量、密度和位置与患者的预后显著相关。高密度的TLS通常与更好的临床结果相关。
-
TLS的细胞组成:TLS主要由T细胞、B细胞、滤泡树突状细胞(FDCs)、树突状细胞(DCs)和基质细胞等组成。Tfh细胞和调节性T(Treg)细胞在TLS的功能定位中起关键作用。
-
TLS的诱导方法:多种治疗方法,包括使用细胞因子、化疗、放疗和癌症疫苗,已被证明可以诱导肿瘤内TLS的形成,并增加免疫细胞的浸润。
2-5:重点关注几个问题
问题1
TLS在肿瘤免疫中的双重作用是什么?如何解释这种双重作用?
TLS(三级淋巴样结构)在肿瘤免疫中具有双重作用。
一方面,TLS通过促进不同免疫细胞亚群之间的相互作用,特别是Tfh细胞和B细胞,增强了抗肿瘤免疫反应。TLS内的B细胞可以产生肿瘤特异性抗体,参与抗体依赖性细胞毒性(ADCC)和抗体依赖性细胞吞噬(ADCP),而Tfh细胞则通过促进B细胞激活和分化,进一步增强了TLS的抗肿瘤功能。
另一方面,TLS中的调节性T细胞(Treg细胞)和其他免疫抑制细胞可能会抑制免疫反应,导致TLS的功能受到限制,甚至可能促进肿瘤的生长。因此,TLS的双重作用取决于其内部免疫细胞亚群的平衡和相互作用。
问题2
目前有哪些新兴技术被用于TLS的成像和诱导?这些技术的优势和局限性是什么?
目前用于TLS成像和诱导的新兴技术包括多重免疫组化(mIHC)、免疫荧光(IF)、空间转录组学、流式细胞术和人工智能(AI)等。
这些技术的优势在于它们能够提供高分辨率的图像和详细的细胞组成信息,从而帮助研究人员更好地理解TLS的结构和功能。例如,mIHC可以同时检测多种免疫细胞亚群,而IF则可以用于可视化特定蛋白的表达。
然而,这些技术也存在一些局限性,如操作复杂、成本高、耗时长以及主观解释性强等。例如,虽然空间转录组学可以提供全局的基因表达信息,但其空间分辨率较低,难以捕捉到TLS内部的精细结构变化。
问题3
在肿瘤治疗中,如何有效地诱导TLS的形成?目前有哪些常见的诱导方法?
在肿瘤治疗中,有效地诱导TLS的形成可以通过多种方法实现,包括使用细胞因子或趋化因子、化疗、放疗、癌症疫苗和免疫检查点阻断(ICB)治疗等。
例如,使用CXCL13和CCL21等趋化因子可以吸引免疫细胞到肿瘤部位,促进TLS的形成;低剂量的STING激动剂可以增强T细胞和树突状细胞的浸润,促进炎症性TME的形成,进而刺激TLS的发育。
此外,癌症疫苗和ICB治疗也可以间接促进TLS的形成。然而,需要注意的是,虽然这些方法在某些实验模型中显示出有效性,但在临床应用中的效果仍需进一步验证。例如,放疗虽然可以暂时增加TLS的数量,但长期效果并不明确。
三、JAMA network open|自动化定量评估胃肠道肿瘤中三级淋巴结构的机器学习模型
这篇文章报道了一种基于机器学习模型的自动化方法,用于在常规组织病理学图像中检测和分类胃肠道癌症中的三级淋巴结构,并验证了其与患者生存预后的关联。

在这项多中心诊断/预后研究中,开发了一种基于机器学习的计算工具,用于自动化检测和定量评估常规H&E幻灯片上的TLSs,并证实了其在胃肠癌中的生存率关联。
提出的TLSs评分系统可能补充现有的分期系统,并在风险分层中发挥作用。未来的前瞻性验证研究可能会确认这些结果的重复性和广泛适用性。
一作&通讯
| 角色 | 作者姓名 | 单位(中文翻译) |
|---|---|---|
| 第一作者 | Zhe Li | 西北工业大学计算机科学与技术学院 |
| 第一作者 | Yuming Jiang | 斯坦福大学医学院放射肿瘤科 |
| 第一作者 | Bailiang Li | 斯坦福大学医学院放射肿瘤科 |
| 通讯作者 | Ruijiang Li | 斯坦福大学医学院放射肿瘤科 |
3-1:研究背景
- 研究问题:这篇文章旨在解决**如何基于常规组织病理学图像自动检测和分类三级淋巴结构(TLSs)**的问题。TLSs与癌症免疫疗法的良好预后和改善反应相关联,但现有的检测方法存在观察者变异性高和成本高昂的问题。
- 研究难点:该问题的研究难点包括:TLSs的大小、密度和形态高度可变,传统的基于补丁的方法难以处理这些变化;现有的多色免疫组化或荧光成像技术虽然精确,但不常规使用,且成本高、复杂度高。
- 相关工作:之前的研究主要依靠病理学家的手动和定性评估,这种方法不仅耗时耗力,而且受观察者变异性的影响较大。已有研究表明,TLSs的存在与多种癌症类型的良好预后和免疫疗法反应改善相关联。
3-2:研究方法
这篇论文提出了一种基于机器学习的计算方法,用于自动检测和分类TLSs,并提出了一个定量评分系统来评估其与生存率的关系。具体来说,
-
图像预处理:首先,使用卷积神经网络(ResNet18)对全片H&E图像进行肿瘤与正常组织的分割。然后,通过基于掩码的区域卷积神经网络(R-CNN)对单个细胞进行成像分析,将细胞核分类为三种类型:淋巴细胞、肿瘤细胞和其他非恶性细胞。
-
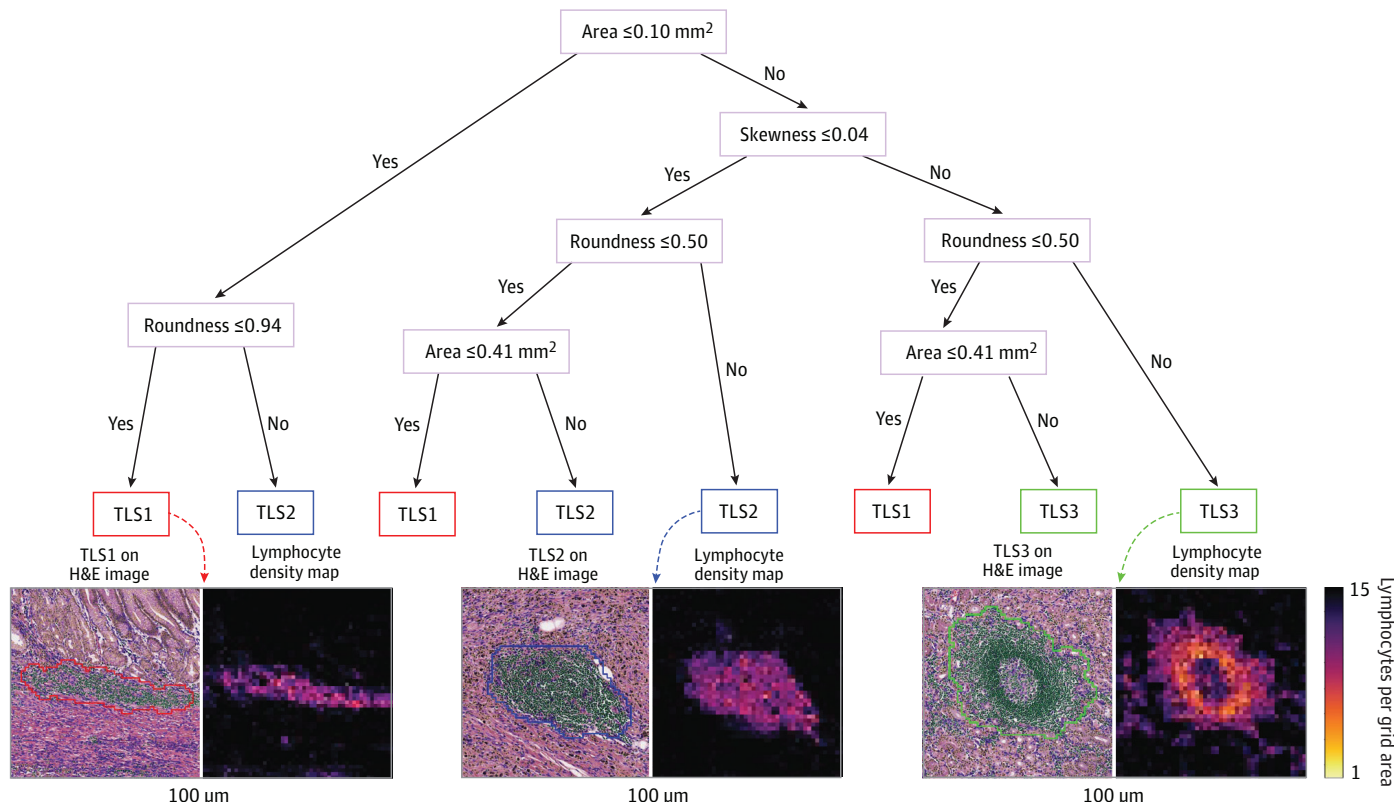
TLSs分割和分类:在获得淋巴细胞掩码后,计算每个16 x 16 μm²网格上的淋巴细胞数量,生成淋巴细胞密度图。通过阈值处理和形态图像处理(开运算),排除过小的淋巴细胞团簇,最终获得TLSs的分割掩码。根据成熟度将TLSs分为三个等级:淋巴滤泡、初级滤泡和具有生发中心的次级滤泡。
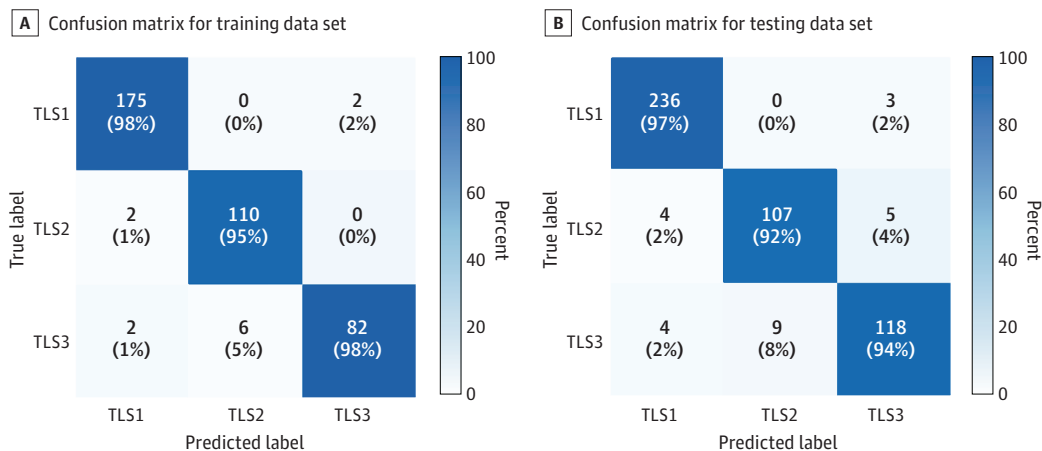
-
定量评分系统:计算每个等级的TLSs总面积和肿瘤面积,分别计算三个个体TLSs评分,并将其线性组合为整体TLSs评分。公式如下:
TLS score = ( w 1 × area TLS1 + w 2 × area TLS2 + w 3 × area TLS3 ) / area tumor \text{TLS score} = \left(w_1 \times \text{area}_{\text{TLS1}} + w_2 \times \text{area}_{\text{TLS2}} + w_3 \times \text{area}_{\text{TLS3}}\right) / \text{area}_{\text{tumor}} TLS score=(w1×areaTLS1+w2×areaTLS2+w3×areaTLS3)/areatumor
其中, a r e a TLS1 、 a r e a TLS2 、 a r e a TLS3 和 a r e a tumor area_{\text{TLS1}}、area_{\text{TLS2}}、area_{\text{TLS3}}和area_{\text{tumor}} areaTLS1、areaTLS2、areaTLS3和areatumor分别是TLS1、TLS2、TLS3和肿瘤的面积,w1、w2和w3是对应的权重。通过Cox回归分析确定最佳权重。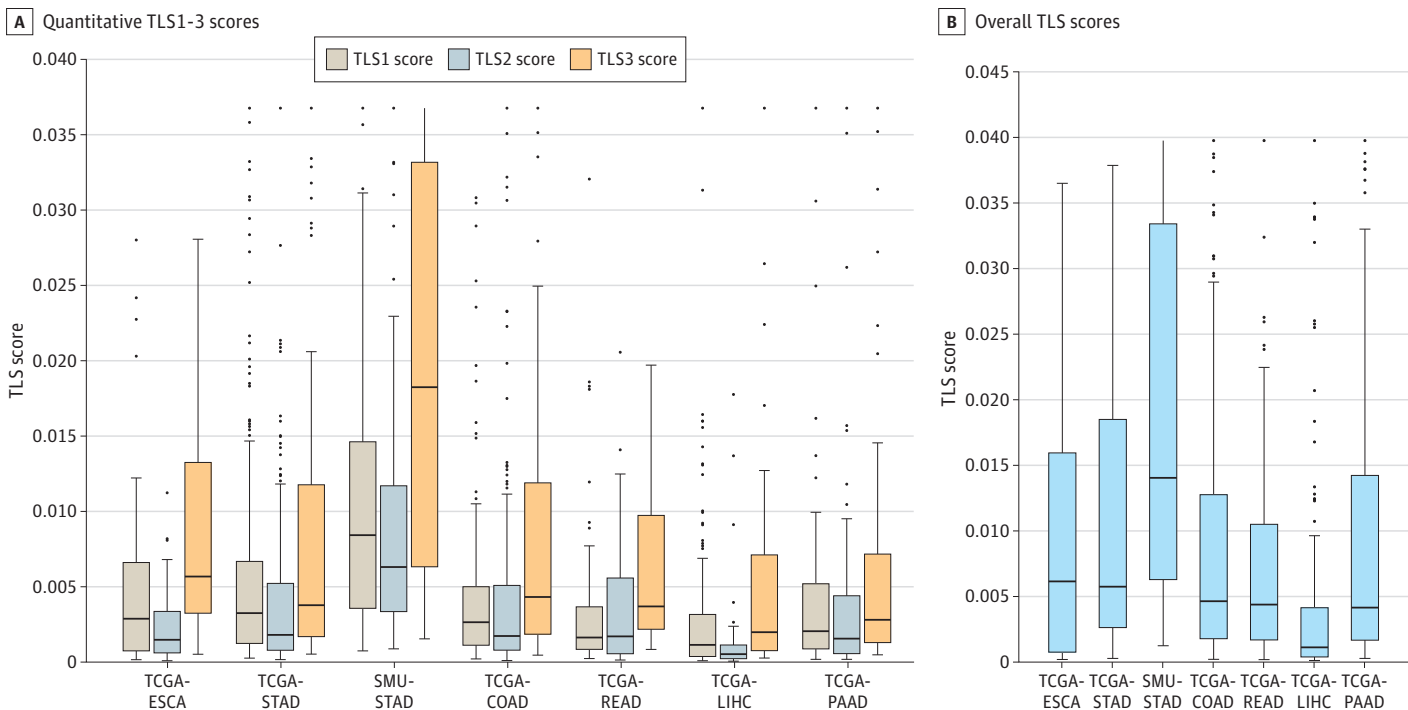
3-3:实验设计
- 数据收集:本研究回顾性收集了1924名胃肠癌患者的全片H&E图像和临床数据。数据来自7个独立的研究队列:TCGA食管癌(TCGA-ESCA)、胃腺癌(TCGA-STAD)、结肠腺癌(TCGA-COAD)、直肠腺癌(TCGA-READ)、肝细胞癌(TCGA-LIHC)和胰腺腺癌(TCGA-PAAD)以及南方医科大学的STAD队列。
- 样本选择:所有样本均来自未经治疗的初诊肿瘤切除标本,仅包括甲醛固定、石蜡包埋的肿瘤切片诊断幻灯片。详细的纳入和排除标准见补充材料。
- 实验流程:首先使用ResNet18模型进行肿瘤检测,然后使用R-CNN模型进行单细胞成像分析,最后计算每个肿瘤的整体TLSs评分,并分析其与生存率的关系。
3-4:结果与分析
-
TLSs检测和分类准确性:机器学习模型在检测和分类TLSs方面表现出色,整体分类准确率超过95%。具体来说,TLS1的准确率为97.7%,TLS2为96.3%,TLS3为95.7%。
-
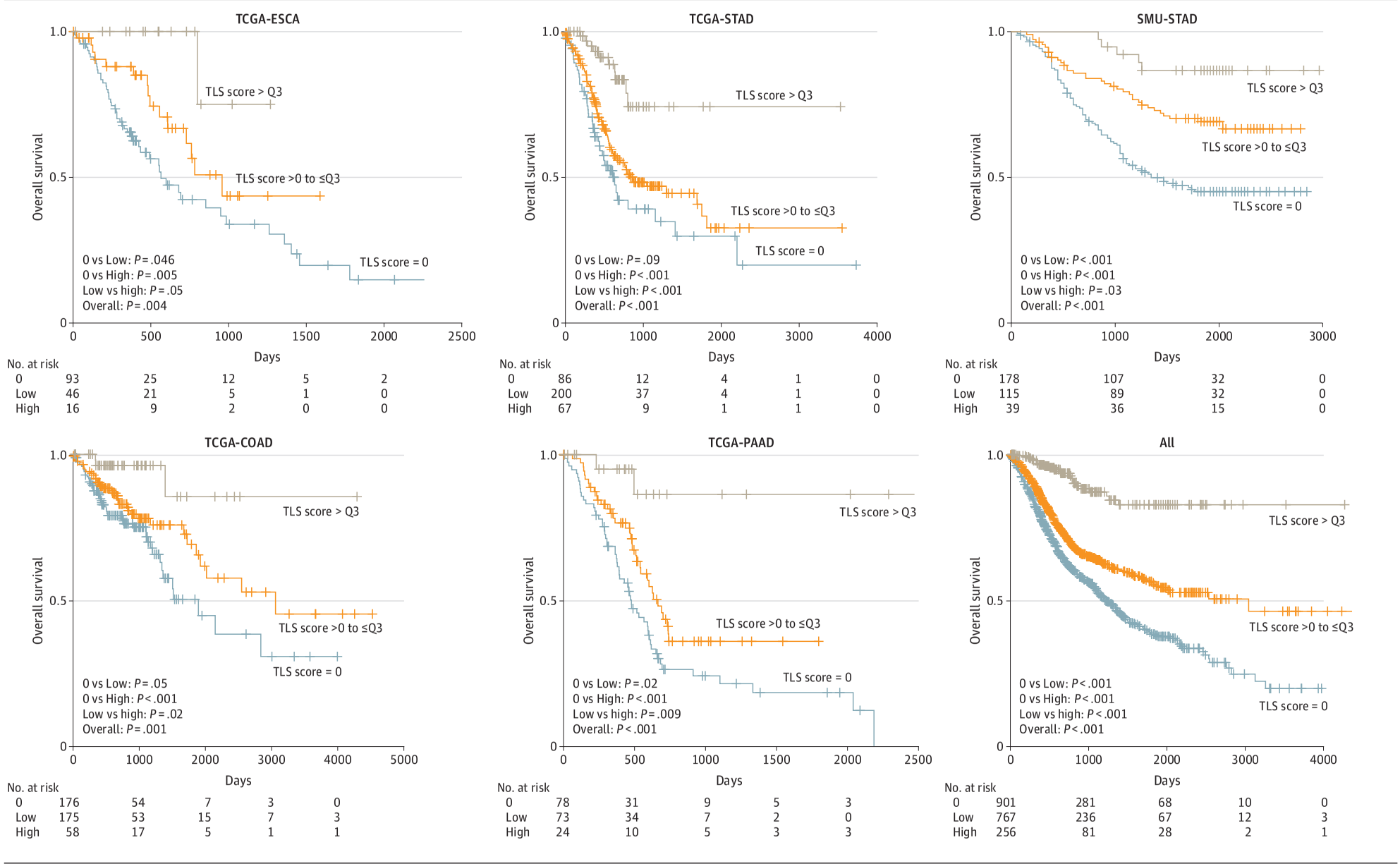
TLSs评分与生存率的关系:TLSs评分与生存率显著相关。高TLSs评分的患者相比低评分患者具有更好的总生存率(HR 0.27,95% CI 0.18-0.41,P<0.001),而低评分患者相比无TLSs的患者也表现出更好的生存率(HR 0.65,95% CI 0.56-0.76,P<0.001)。
-
独立预后因素:在调整了临床病理变量和肿瘤浸润淋巴细胞密度后,TLSs评分仍然是独立的预后因素。例如,在结肠癌中,TLSs评分的HR为0.11(95% CI 0.02-0.47,P=0.003)。
3-5:重点关注几个问题
问题1
论文中提到的机器学习方法是如何实现TLSs的自动检测和分类的?
- 卷积神经网络(ResNet18):首先,使用ResNet18模型对全片图像进行肿瘤与正常组织的分割。
- 单细胞图像分析:接下来,使用基于掩码的区域卷积神经网络(R-CNN)对单个细胞进行成像分析,将细胞核分类为三种类型:淋巴细胞、肿瘤细胞和其他非恶性细胞。
- TLSs分割和分类:基于淋巴细胞密度图,进行图像处理和机器学习模型训练,以获得TLSs的分割和分类。具体地,计算每个TLSs的面积、圆度和淋巴细胞密度的偏度三个特征,并使用分类和回归树(CART)算法进行分类。
- 定量评分系统:计算每个肿瘤的TLSs总分,并将其与患者的预后相关联。
问题2
论文中提出的TLSs定量评分系统的具体构建过程是怎样的?
- 计算每个TLSs的面积:首先,计算每个TLSs的面积。
- 计算权重:确定TLS1、TLS2和TLS3的权重,分别为0.81、0.84和1.00。
- 计算总分:使用以下公式计算每个肿瘤的TLSs总分:
TLS score = ( w 1 × area TLS1 + w 2 × area TLS2 + w 3 × area TLS3 ) / area tumor \text{TLS score} = \left(w_1 \times \text{area}_{\text{TLS1}} + w_2 \times \text{area}_{\text{TLS2}} + w_3 \times \text{area}_{\text{TLS3}}\right) / \text{area}_{\text{tumor}} TLS score=(w1×areaTLS1+w2×areaTLS2+w3×areaTLS3)/areatumor
其中, w 1 , w 2 , w 3 w_1, w_2, w_3 w1,w2,w3 分别是TLS1、TLS2和TLS3的权重, area TLS1 , area TLS2 , area TLS3 \text{area}_{\text{TLS1}}, \text{area}_{\text{TLS2}}, \text{area}_{\text{TLS3}} areaTLS1,areaTLS2,areaTLS3 和 area tumor \text{area}_{\text{tumor}} areatumor 分别是TLS1、TLS2、TLS3和肿瘤的面积。
问题3
论文中如何验证TLSs评分系统的预后相关性?
- 生存率分析:将患者分为高TLSs评分组、低TLSs评分组和无TLSs组,比较各组的总生存率和无进展生存率。结果显示,高TLSs评分的患者相比低TLSs评分的患者具有更好的总生存率(HR, 0.27; 95% CI, 0.18-0.41; P<.001),而低TLSs评分的患者相比无TLSs的患者也具有更好的生存率(HR, 0.65; 95% CI, 0.56-0.76; P<.001)。
- 独立预后因素:在调整了临床病理变量和肿瘤浸润淋巴细胞密度后,TLSs总分仍然是独立的预后因素。例如,在结肠癌中,TLSs总分的HR为0.11(95% CI, 0.02-0.47; P=.003)。
- 多变量分析:通过多变量生存分析,进一步确认了TLSs评分在预测生存率方面的独立性和优越性。
四、cancers|人工智能驱动的肿瘤浸润性淋巴细胞评分预测鼻咽癌局部复发风险
这篇文章是关于鼻咽癌(Nasopharyngeal Carcinoma, NPC)预后研究的,特别是探讨了肿瘤浸润性淋巴细胞(Tumour-Infiltrating Lymphocytes, TILs)在NPC预后中的作用。

这篇论文提出了一种基于AI的新方法,利用常规H&E组织切片图像自动生成TILs评分,以预测NPC的预后。研究结果表明,数字化TILs评分是NPC LRFS和其他生存终点的独立预后因素。
该方法为NPC治疗决策提供了新的数字免疫标志物,有望改善局部复发患者的治疗效果。未来的研究需要在多中心队列中进行大规模验证,以验证这些发现的普适性和临床应用潜力。
一作&通讯
| 角色 | 作者姓名 | 单位(中文翻译) |
|---|---|---|
| 第一作者 | Made Satria Wibawa | 华威大学计算机科学系,组织图像分析中心,英国考文垂 |
| 第一作者(共同) | Jia-Yu Zhou | 中山大学肿瘤防治中心,广东省鼻咽癌诊断与治疗重点实验室,中国广州 |
| 第一作者(共同) | Ruoyu Wang | 华威大学计算机科学系,组织图像分析中心,英国考文垂 |
| 通讯作者 | Nasir Rajpoot | 华威大学计算机科学系,组织图像分析中心,英国考文垂 |
4-1:研究背景
- 研究问题:这篇文章要解决的问题是如何利用肿瘤浸润淋巴细胞(TILs)的数字评分来预测鼻咽癌(NPC)的无局部复发生存率(LRFS)。
- 研究难点:该问题的研究难点包括:EBV DNA水平在检测局部复发时不如在检测远处转移时敏感;现有的预后标志物对局部复发的敏感性不足;TILs的存在与NPC的预后相关,但缺乏统一的标准来量化TILs。
- 相关工作:已有研究表明,TILs在多种癌症中与更好的临床结果相关,但在NPC中的具体作用尚需进一步研究。AI和计算病理学在癌症诊断和预后中的作用日益显著,但在NPC中自动化量化TILs的研究尚未见报道。
4-2:研究方法
-
数据收集:收集了385张全视野图像(WSIs),这些图像来自367例NPC患者。所有WSIs均以40倍放大倍数扫描,分辨率为0.255微米每像素。
-
肿瘤细胞核检测和聚类:使用HoverNet模型检测WSIs中的肿瘤细胞核,并使用形态学特征进行校正。然后,使用DBSCAN算法对肿瘤细胞核进行密度聚类,形成内部和外部肿瘤簇。
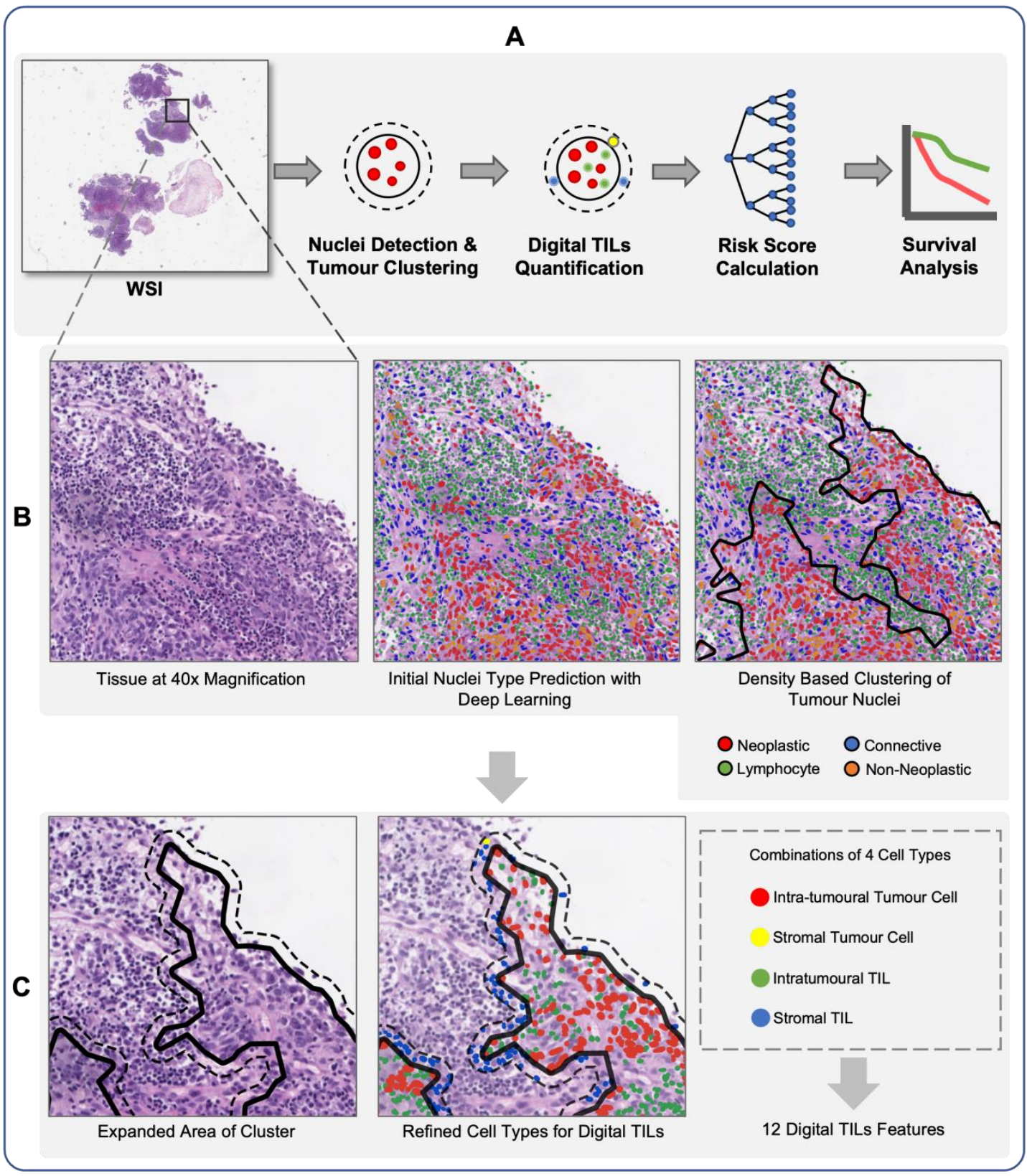
-
数字化TILs量化:根据肿瘤细胞核和TILs的计数和面积,生成了12个数字化TILs特征,包括TIL比率、TIL密度簇等。
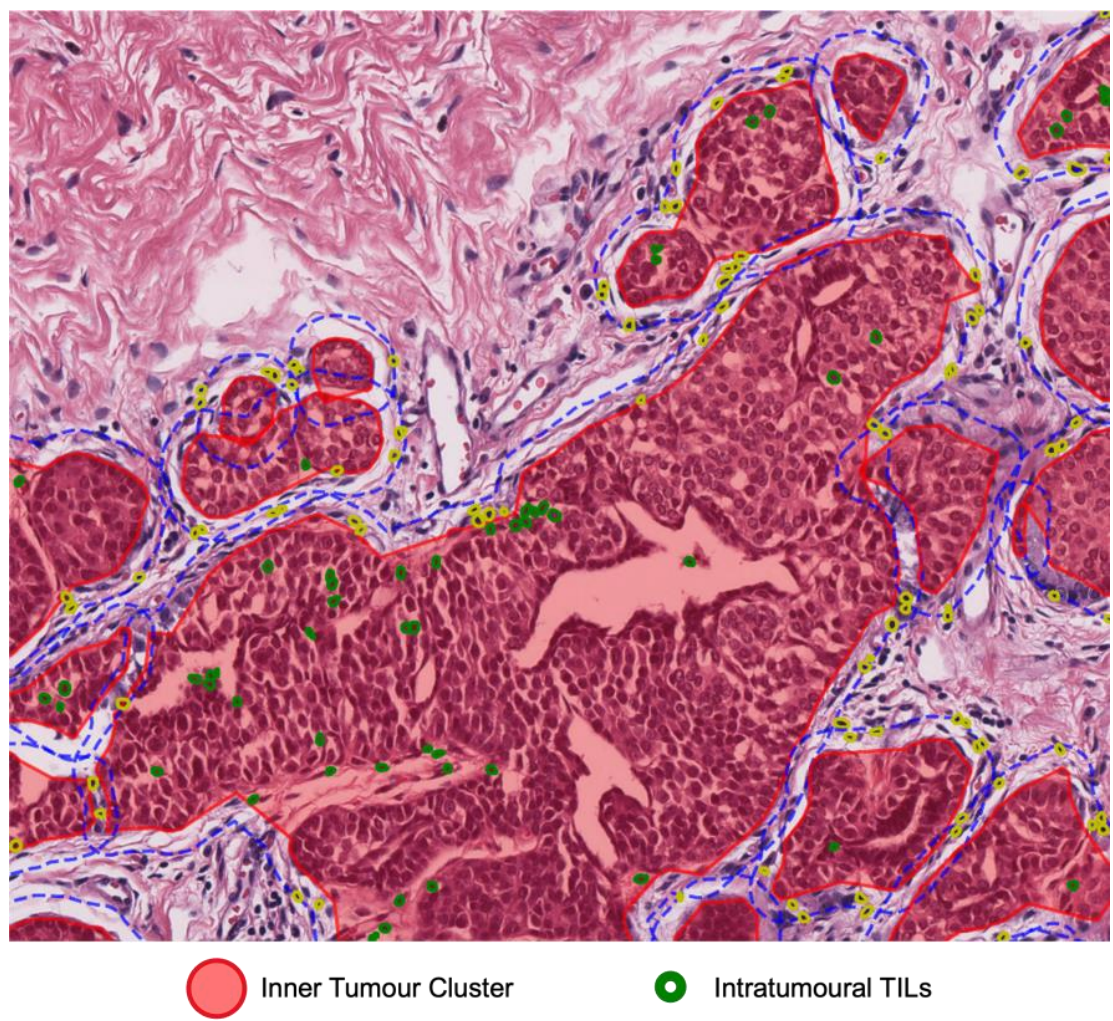
-
风险评分计算:使用随机生存森林(RSF)模型,结合临床病理数据、肿瘤形态学和数字化TILs特征,计算风险评分。
-
生存分析:以LRFS为主要终点,进行Kaplan-Meier分析和多变量Cox比例风险回归分析,评估风险评分的预后价值。
4-3:实验设计
- 数据收集:从中山大学癌症中心收集了396张WSIs,最终数据集包含367例患者,共385张WSIs。临床数据包括年龄、性别、原发肿瘤(T)、区域淋巴结(N)、分期组和血浆EBV DNA水平。
- 样本选择:排除了11例仅有WSIs而无临床信息的病例,最终数据集包含367例患者。
- 参数配置:使用Adam优化器训练模型,训练50个周期。使用Harrell’s C-index评估模型性能,并通过三折交叉验证确保模型的泛化能力。
4-4:结果与分析
-
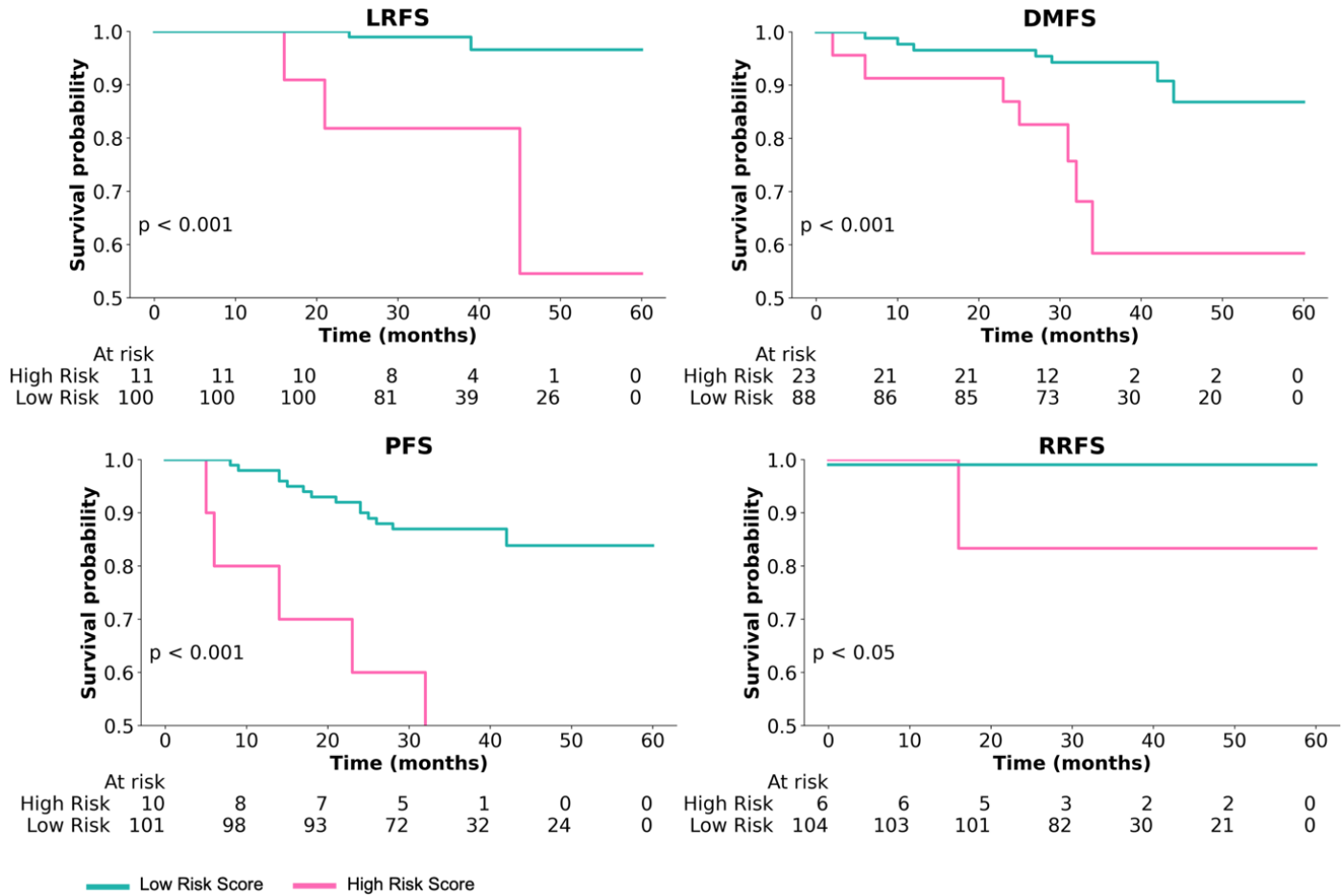
患者分层:基于数字化TILs风险评分,能够将NPC患者分为低危和高危两组,LRFS的Kaplan-Meier分析结果显示差异具有统计学意义(p=8.13x10^-5)。
-
风险评分与事件时间的相关性:数字化TILs风险评分在LRFS中的C-index为0.923,在其他生存终点(如DMFS、PFS和RRFS)中也表现出色,表明其具有强大的预后价值。
-
单变量和多变量分析:单变量分析显示,仅数字化TILs风险评分对LRFS具有预后价值(p<0.05,HR=1.58)。多变量分析进一步证实了数字化TILs风险评分在LRFS、DMFS和PFS中的预后价值。
-
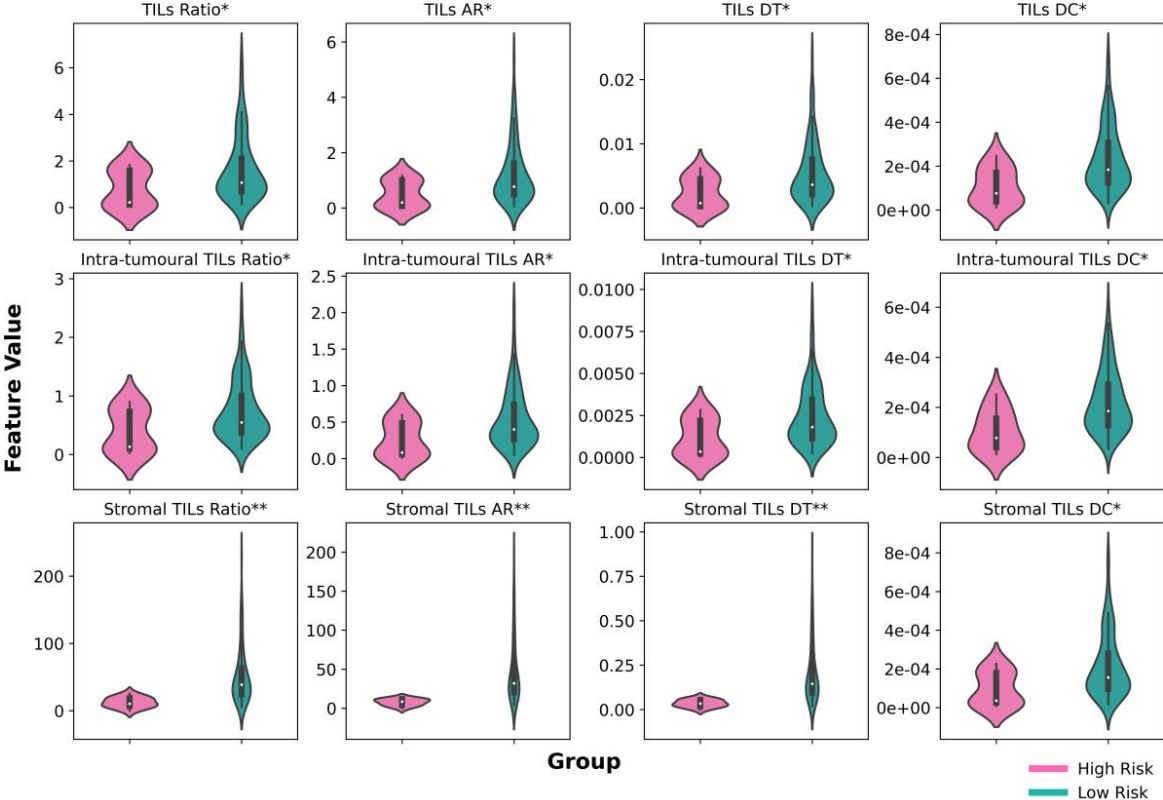
数字化TILs特征分析:低风险组在12个数字化TILs特征中的均值显著高于高风险组(p<0.05),表明数字化TILs评分能够有效区分不同风险的NPC患者。
-
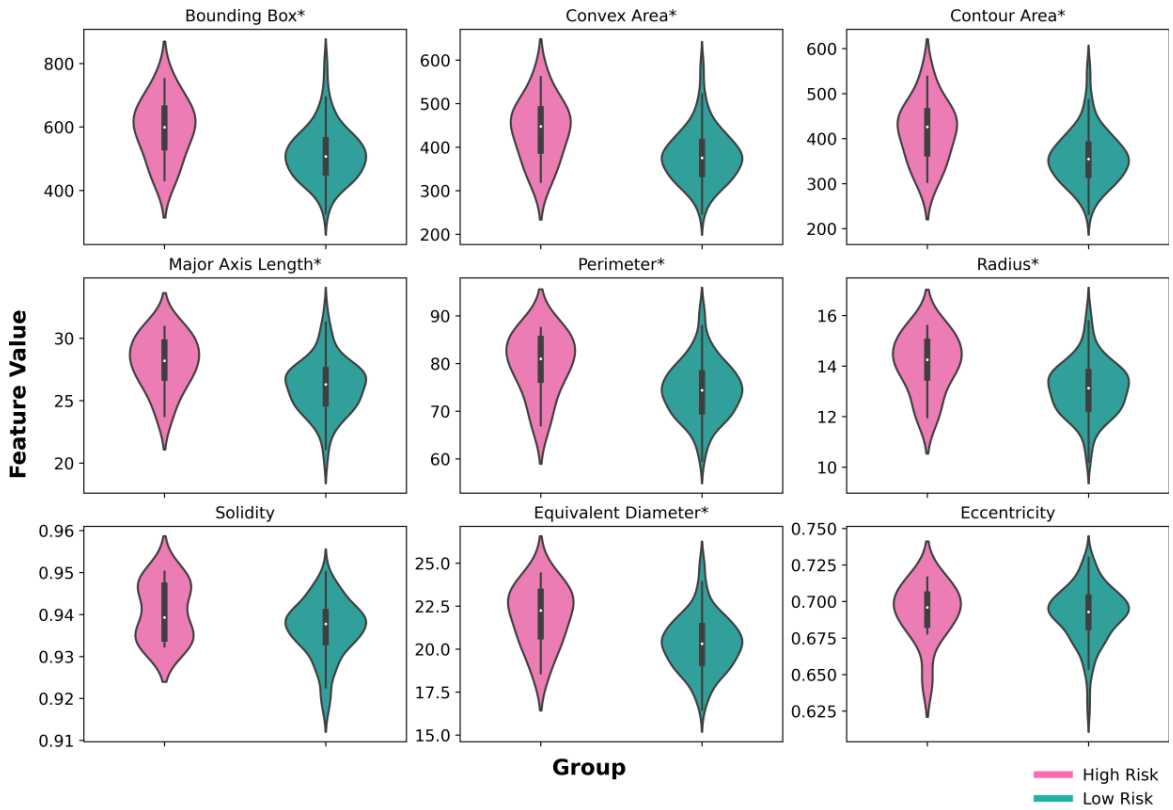
肿瘤细胞核形态分析:低风险组的肿瘤细胞核形态特征均值显著低于高风险组(p<0.05),表明肿瘤细胞核形态与预后相关。
4-5:重点关注几个问题
问题1
在肿瘤细胞核检测和聚类过程中,使用了哪些具体的模型和技术?这些技术如何协同工作以实现肿瘤细胞核的准确检测和聚类?
- HoverNet模型:用于检测WSIs中的肿瘤细胞核。HoverNet是一种同时进行目标检测和实例分割的深度学习模型,适用于多模态医学图像分析。
- 形态学特征校正:为了纠正HoverNet模型的误分类,研究团队开发了一个名为MorphResNet的深度学习模型。该模型结合了ResNet的深度特征和核的形态学特征。具体来说,形态学特征包括偏心率、凸面积、轮廓面积、等效直径、主轴长度、副轴长度、周长、固体度、方向、半径和边界框面积。
- 基于密度的聚类算法(DBSCAN):用于对检测到的肿瘤细胞核进行聚类。DBSCAN通过密度连接的点形成簇,能够有效地识别出不同形状和大小的肿瘤细胞核团簇。研究中将肿瘤细胞核聚类分为内部肿瘤团簇和外部肿瘤团簇,以便进一步量化肿瘤浸润淋巴细胞(TILs)。
这些技术协同工作的过程如下:
- 首先,使用HoverNet模型检测WSIs中的肿瘤细胞核;
- 然后,通过MorphResNet模型对这些检测结果进行校正,以提高检测的准确性。
- 最后,利用DBSCAN算法对校正后的肿瘤细胞核进行聚类,分为内部和外部肿瘤团簇,从而实现对肿瘤微环境中TILs的量化分析。
问题2
数字化TILs特征是如何生成的?这些特征在预测NPC无局部复发生存率(LRFS)方面的作用是什么?
-
TILs特征生成:根据肿瘤团簇内外的淋巴细胞核数量和面积,生成了12个数字化TILs特征。这些特征包括:(注意,特征分类这一列的四个特征也是单独算一个特征)
特征分类 位置 描述 TIL比率 内肿瘤 内肿瘤TIL比率 外肿瘤 外肿瘤TIL比率 TIL密度团簇 内肿瘤 内肿瘤TIL密度团簇 外肿瘤 外肿瘤TIL密度团簇 TIL密度肿瘤 内肿瘤 内肿瘤TIL密度肿瘤 外肿瘤 外肿瘤TIL密度肿瘤 TIL面积比率 内肿瘤 内肿瘤TIL面积比率 外肿瘤 外肿瘤TIL面积比率 -
作用:这些数字化TILs特征在预测NPC无局部复发生存率(LRFS)方面表现出显著的预后价值。具体表现为:
- 患者分层:基于数字化TILs风险评分,能够将NPC患者分为低危和高危两组,LRFS的Kaplan-Meier曲线显示两组之间的差异具有统计学意义(p=8.13x10^-5)。
- 风险评分与事件时间的相关性:数字化TILs风险评分在LRFS中的表现优于其他特征集,其在发现集和验证集上的C-index分别为0.923和0.785。
- 单变量和多变量分析:在单变量分析中,仅数字化TILs风险评分对LRFS具有预后价值(p<0.05,HR=1.58)。在多变量分析中,数字化TILs风险评分仍然是LRFS的独立预后因素(p<0.05,HR=1.59)。
这些特征通过提供肿瘤微环境中TILs的数量和分布信息,帮助医生更准确地评估患者的预后风险,从而制定更为个性化的治疗方案。
问题3
在生存分析中,数字化TILs风险评分与其他临床病理特征相比,表现出哪些独特的优势?
- 更高的C-index:在发现集和验证集上,数字化TILs风险评分的C-index分别为0.923和0.785,均高于其他特征集,如临床特征(发现集C-index=0.873,验证集C-index=0.644)和肿瘤形态学特征(发现集C-index=0.908,验证集C-index=0.624)。
- 更显著的统计学差异:数字化TILs风险评分在单变量分析中表现出显著的相关性(p<0.05),并且在多变量分析中仍然是LRFS的独立预后因素(p<0.05)。
- 全面的预后信息:数字化TILs风险评分不仅捕捉了TILs的数量,还考虑了它们的空间分布和密度,提供了更全面的预后信息。例如,TIL密度团簇特征在所有生存终点中都是最重要的特征之一,表明肿瘤微环境中的免疫反应对患者预后有重要影响。
综上所述,数字化TILs风险评分在预测NPC无局部复发生存率(LRFS)方面表现出更高的准确性、更显著的统计学差异以及更全面的预后信息,显示出其在NPC预后评估中的独特优势。
五、npj precision oncology|深度学习揭示三级淋巴结构在癌症预后和免疫治疗中的作用
研究团队开发了一个基于深度学习模型的自动化方法,用于从常规的H&E(苏木精-伊红)染色全切片图像(Whole-Slide Images, WSIs)中预测癌症预后和免疫治疗反应。

这篇论文展示了一种基于深度学习的自动化方法,用于从H&E组织切片中分割和量化TLSs。该方法不仅在内部和外部验证集中表现出色,还在预测癌症预后和免疫治疗反应方面显示出巨大潜力。TLS比例作为一种新的泛癌生物标志物,有望在临床应用中提供有价值的见解。
一作&通讯
| 角色 | 作者姓名 | 单位(中文翻译) |
|---|---|---|
| 第一作者 | Ziqiang Chen | 上海复旦大学中山医院(Zhongshan Hospital of Fudan University) |
| 第一作者(共同) | Xiaobing Wang | 中国医学科学院肿瘤医院(Cancer Hospital, Chinese Academy of Medical Sciences) |
| 第一作者(共同) | Zelin Jin | 上海复旦大学中山医院(Zhongshan Hospital of Fudan University) |
| 第一作者(共同) | Bosen Li | 上海复旦大学中山医院(Zhongshan Hospital of Fudan University) |
| 通讯作者 | Yuchen Jiao | 中国医学科学院肿瘤医院(Cancer Hospital, Chinese Academy of Medical Sciences) |
| 通讯作者 | Jianming Ying | 中国医学科学院肿瘤医院(Cancer Hospital, Chinese Academy of Medical Sciences) |
| 通讯作者 | Zhihua Liu | 上海复旦大学中山医院(Zhongshan Hospital of Fudan University) |
| 通讯作者(共同) | Yun Liu | 上海复旦大学基础医学院生物化学与分子生物学系(Department of Biochemistry and Molecular Biology, School of Basic Medical Sciences, Fudan University) |
5-1:研究背景
- 研究问题:这篇文章研究了如何利用深度学习技术自动分割和量化三级淋巴结构(TLSs),以预测癌症的预后和免疫治疗反应。
- 研究难点:TLSs的量化使用多重免疫组化(mIHC)染色对T和B淋巴细胞进行,这一过程劳动密集型且资源密集,限制了其在临床上的实用性。
- 相关工作:现有工作主要依赖于病理学家的手动标注,缺乏系统评估其基于H&E染色的敏感性和准确性。已有研究表明,TLSs的存在与多种癌症的积极免疫治疗反应和预后相关。
5-2:研究方法
这篇论文提出了一种基于深度学习的方法,用于从H&E全视野图像(WSIs)中自动分割和量化TLSs。具体来说,
-
数据收集和预处理:首先,作者从一个包含60例食管鳞状细胞癌(ESCC)和5例非小细胞肺癌(NSCLC)患者的样本中收集了匹配的mIHC和H&E WSIs。这些图像被裁剪成22,497个瓦片,并随机分为内部训练集、验证集和测试集。
-
模型开发:作者采用了一种基于EfficientNet-B0的改进编码器-解码器模型来分割TLSs。该模型通过AdamW优化器进行训练,批量大小为64,训练周期为100,学习率和权重衰减均为1e-4。
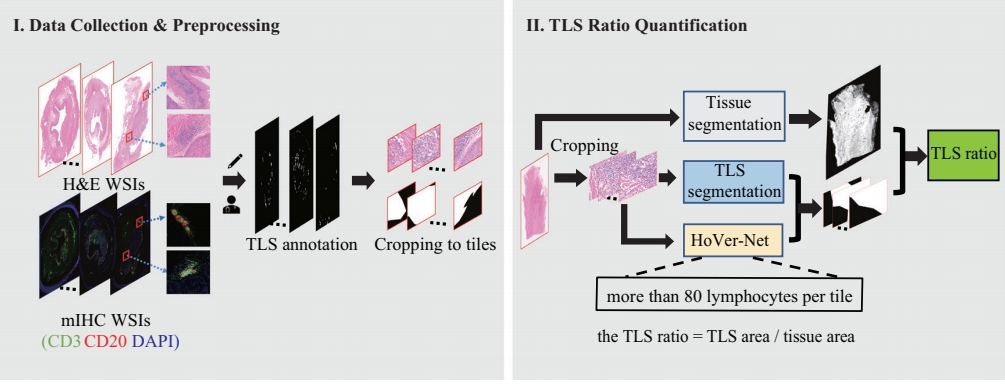
-
TLS比例计算:在TLS分割后,作者开发了一个深度学习管道来计算每个H&E WSI的TLS比例。该管道包括三个分支:组织面积确定分支、分割的TLS面积确定分支和淋巴细胞计数分支。淋巴细胞计数分支使用了公开可用的HoVer-Net模型。
5-3:实验设计
- 内部数据集:从60例ESCC和5例NSCLC患者中收集的H&E WSIs被用于模型的训练和验证。这些图像被裁剪成22,497个瓦片,并随机分为内部训练集、验证集和测试集。
- 外部验证集:从TCGA中随机选择了5例ESCC和10例NSCLC患者的H&E WSIs,组成了一个外部验证集。这些图像被裁剪成667个瓦片。
- 临床数据集:作者还从四个独立的数据集中评估了TLS比例与免疫治疗结果的关系,包括一个ESCC队列、两个NSCLC队列和一个胃腺癌(STAD)队列。
5-4:结果与分析
-
模型性能:在内部测试集上,模型达到了0.91的Dice系数和0.819的交并比(IoU)。在外部验证集上,模型的性能略有下降,但仍保持了0.866的Dice系数和0.787的IoU。
-
TLS比例与分子标志物的相关性:在TCGA的74例ESCC和936例NSCLC患者中,估计的TLS比例与B淋巴细胞水平和CXCL13表达显著相关。例如,在ESCC中,TLS比例与B淋巴细胞水平的皮尔逊相关系数为0.46(P值<0.0001)。
-
预后相关性:在TCGA的16种肿瘤类型中,TLS比例与总生存率显著相关。例如,在ESCC中,高TLS比例与延长总生存率相关(风险比[HR]:0.28;95% CI:0.090–0.84;P值=0.016)。
-
免疫治疗反应预测:在四个独立的数据集中,高TLS比例与积极的免疫治疗反应相关。例如,在一个ESCC队列中,接受抗PD-1单疗法的响应者中TLS比例为33%,而非响应者为67%(P值=0.046)。
5-5:重点关注几个问题
问题1
论文中如何验证TLS比例与分子标志物之间的关联?具体发现了什么?
论文通过分析TCGA数据库中的RNA测序和DNA甲基化数据,估计B细胞水平和CXCL13表达水平,并与TLS比例进行相关性分析。具体发现如下:
-
在ESCC和NSCLC患者中,TLS比例与B细胞水平显著相关。ESCC患者中TLS比例与B细胞水平的ρ值为0.46,P值<0.0001;NSCLC患者中TLS比例与B细胞水平的ρ值为0.26,P值<0.0001。
-
TLS比例也与CXCL13表达水平显著相关。ESCC患者中TLS比例与CXCL13表达的ρ值为0.39,P值=0.0062;NSCLC患者中TLS比例与CXCL13表达的ρ值为0.31,P值<0.0001。
这些结果表明,TLS比例可以作为反映肿瘤免疫环境的重要指标。
问题2
论文中如何评估TLS比例对癌症患者总生存率的影响?具体发现了什么?
论文在TCGA的16种肿瘤类型中评估了TLS比例与总生存率之间的关系。
- 使用单变量生存分析方法,发现10种肿瘤类型的TLS比例与总生存率显著相关。
- 进行多变量生存分析,调整年龄、性别和TNM分期等混杂因素后,发现TLS比例对总生存率的积极影响在10种肿瘤类型中仍然显著。
六、iScience|自动化计算流程揭示三级淋巴结构密度在肺腺癌预后中的作用
这篇文章报道了一种自动化计算方法,用于在常规的H&E染色全切片图像上量化肺癌组织中的三级淋巴结构(TLS)密度,并验证了其作为可切除肺腺癌患者无病生存期的独立预后生物标志物。

这篇论文开发了一种自动化计算工作流程,用于量化常规H&E染色WSIs中的TLSs密度,并评估了其与DFS的相关性。研究发现,TLSs密度是一个独立的预后生物标志物,具有良好的可靠性、可重复性和泛化能力。
将TLS密度与临床病理变量结合可以提高可切除LUAD患者的预后分层。未来的研究将进一步验证TLS密度在更大前瞻性队列中的预后价值,并开发完全自动化的TLS识别工作流程。
一作&通讯
以下是根据您提供的文件内容,列出的第一作者和通讯作者及其对应的单位:
| 角色 | 作者姓名 | 单位(中文翻译) |
|---|---|---|
| 第一作者 | Yumeng Wang | 桂林电子科技大学计算机科学与信息安全学院,桂林,中国 |
| 第一作者(共同) | Huan Lin | 广东省人民医院(广东省医学科学院)放射科,南方医科大学,广州,中国 |
| 第一作者(共同) | Ningning Yao | 山西省肿瘤医院/山西医科大学附属医院放射科,中国医学科学院肿瘤医院/山西医学大学附属肿瘤医院,太原,中国 |
| 通讯作者 | Xipeng Pan | 桂林电子科技大学计算机科学与信息安全学院,桂林,中国 |
| 通讯作者 | Cheng Lu | 广东省人民医院(广东省医学科学院)医学研究所,南方医科大学,广州,中国 |
| 通讯作者 | Jun Liu | 中南大学湘雅二医院放射科,长沙,中国 |
| 通讯作者 | Zhenbing Liu | 桂林电子科技大学,桂林,中国 |
| 通讯作者(共同) | Zaiyi Liu | 广东省人民医院(广东省医学科学院)放射科,南方医科大学,广州,中国 |
6-1:研究背景
-
研究问题:这篇文章研究了计算机化三级淋巴结构(TLSs)密度在可切除肺腺癌(LUAD)患者中的预后价值。具体来说,文章旨在开发一种自动化工作流程来量化常规H&E染色全视野图像(WSIs)中的TLSs密度,并探讨其与无病生存期(DFS)的相关性。
-
研究难点:手动评估TLSs密度是一个经验依赖且耗时的过程,限制了其在临床上的应用。此外,现有的TLSs评估方法大多依赖于多重免疫组化(mlHC)或免疫荧光(mlF),这些方法成本高且不常用。
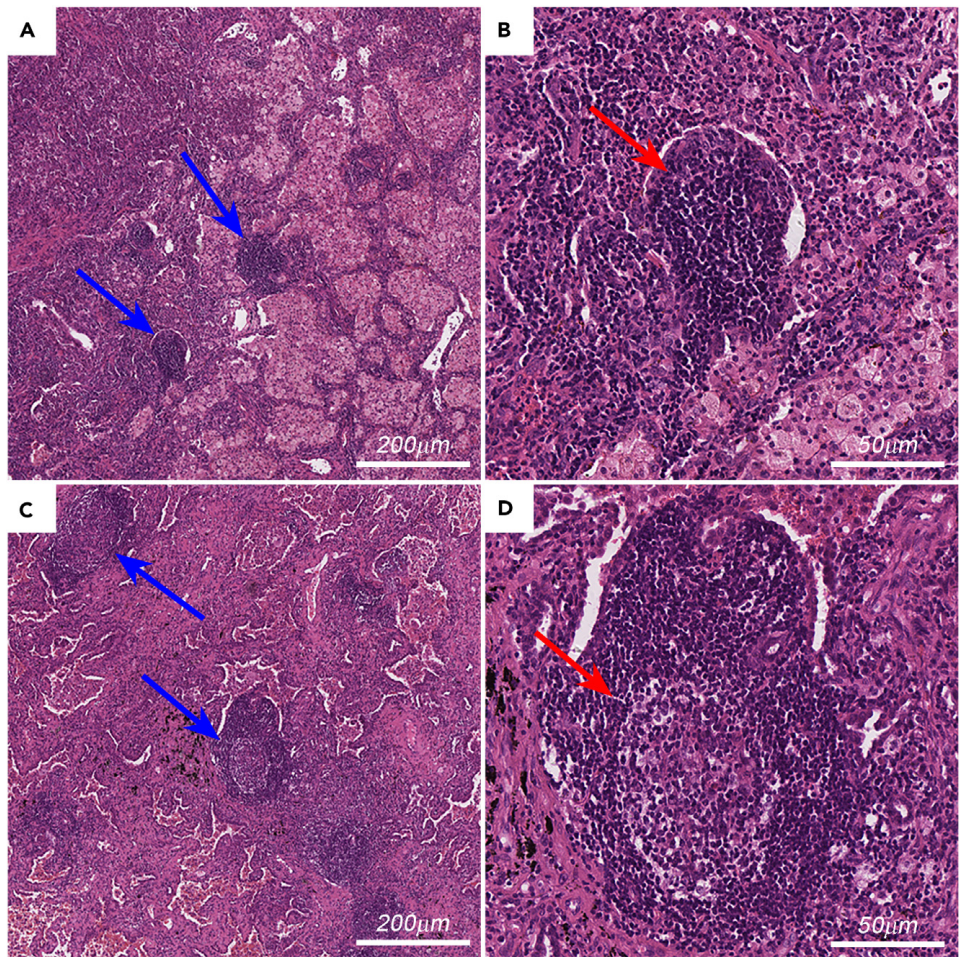
-
相关工作:已有研究表明,TLSs在多种癌症类型中与更好的预后相关。然而,大多数研究使用手动和定性方法评估TLSs,缺乏客观、高效和准确的量化工作流程。
6-2:研究方法
这篇论文提出了一种自动化计算工作流程,用于量化常规H&E染色WSIs中的TLSs密度,并评估其预后价值。具体来说,
-
肿瘤区域分割:首先,使用迁移学习方法对肿瘤区域进行半自动分割。通过从Camelyon16数据集中提取大量小正负图像块来预训练ResNet50模型,然后使用67张标注的LUAD WSIs对模型进行微调。
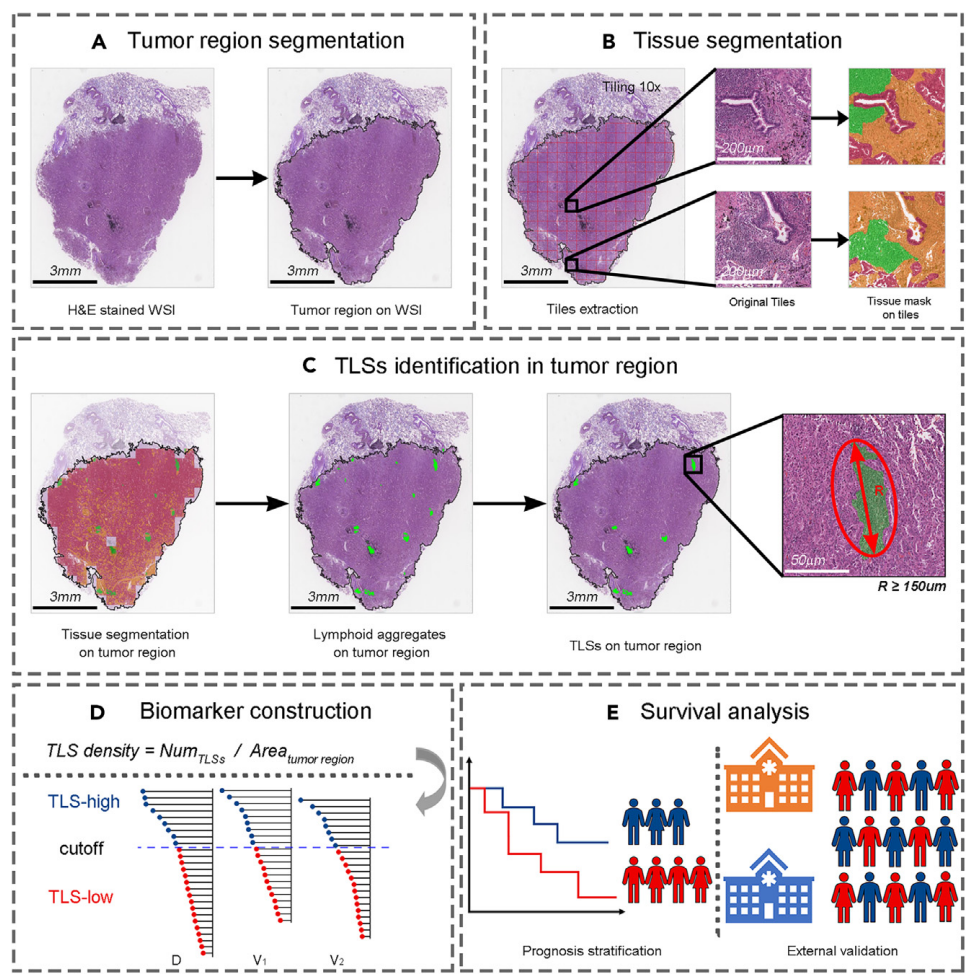
-
组织分割和分类:在肿瘤区域分割的基础上,采用基于补丁级别分类标签的弱监督语义分割方法,将肿瘤区域分类为肿瘤上皮、肿瘤间质和淋巴细胞聚集区。然后,使用Hover-Net在40倍放大率下对肿瘤区域的细胞进行分割和分类。
-
TLSs识别和密度计算:根据组织分割掩码,识别直径大于或等于150微米(或椭圆形TLSs的主轴)的淋巴细胞聚集区作为TLSs。TLS密度定义为肿瘤区域内TLSs数量与肿瘤区域面积的比值:
TLS density = 肿瘤区域内TLSs数量 肿瘤区域面积 \text{TLS density} = \frac{\text{肿瘤区域内TLSs数量}}{\text{肿瘤区域面积}} TLS density=肿瘤区域面积肿瘤区域内TLSs数量 -
生存分析和外部验证:使用最大选定秩统计方法在发现集中确定TLS密度的截断值。通过Kaplan-Meier曲线和Cox比例风险回归模型评估TLS密度与DFS的相关性,并进行外部验证。
6-3:实验设计
- 数据收集:研究收集了来自四个中国不同地区医院的1196名可切除LUAD患者的数据,最终有802名患者符合纳入和排除标准。数据集包括广东省人民医院(GDPH)、中南大学湘雅二医院(XYSH)、山西省肿瘤医院(SXCH)和云南肿瘤医院(YNCH)。
- 样本选择:纳入标准为年龄≤75岁、未接受新辅助治疗、无残留肿瘤、无其他恶性肿瘤史的患者。排除标准包括缺失临床病理变量、接受过新辅助治疗、存在残留肿瘤或有其他恶性肿瘤史的患者。
- 参数配置:使用Leica Aperio系列扫描仪在不同放大率下扫描H&E染色和CD3染色切片。图像质量由经验丰富的病理学家审核,排除模糊、含有伪影、染色不良或肿瘤组织不足的WSIs。
6-4:结果与分析
-
分割结果和一致性分析:自动化TLSs计数与病理学家的手动TLSs计数之间具有良好的一致性(H&E染色:ICC=0.894,p<0.001;IHC染色:ICC=0.903,p<0.001)。
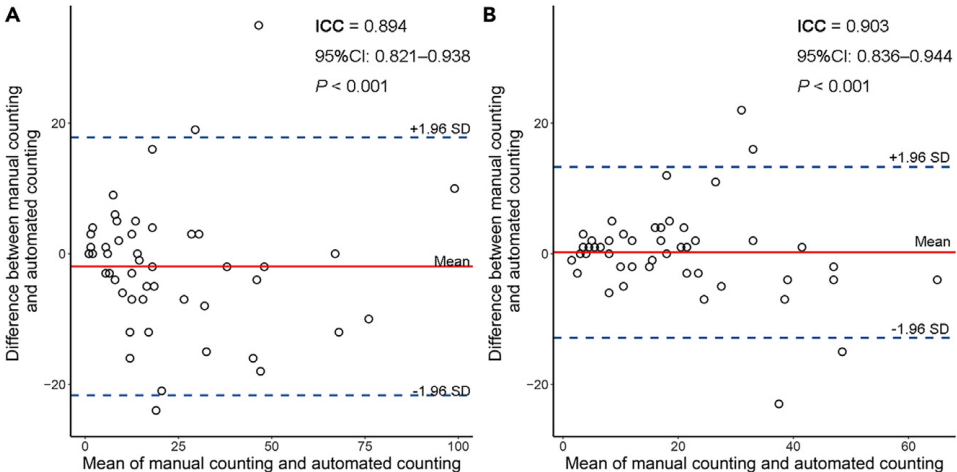
-
预后价值:Kaplan-Meier曲线显示,在发现集和两个外部验证集中,TLS低组的无病生存期显著低于TLS高组(发现集:HR 0.66,95%CI 0.44-0.98,p=0.037;V1:HR 0.60,95%CI 0.39-0.93,p=0.022;V2:HR 0.29,95%CI 0.16-0.55,p<0.0001)。
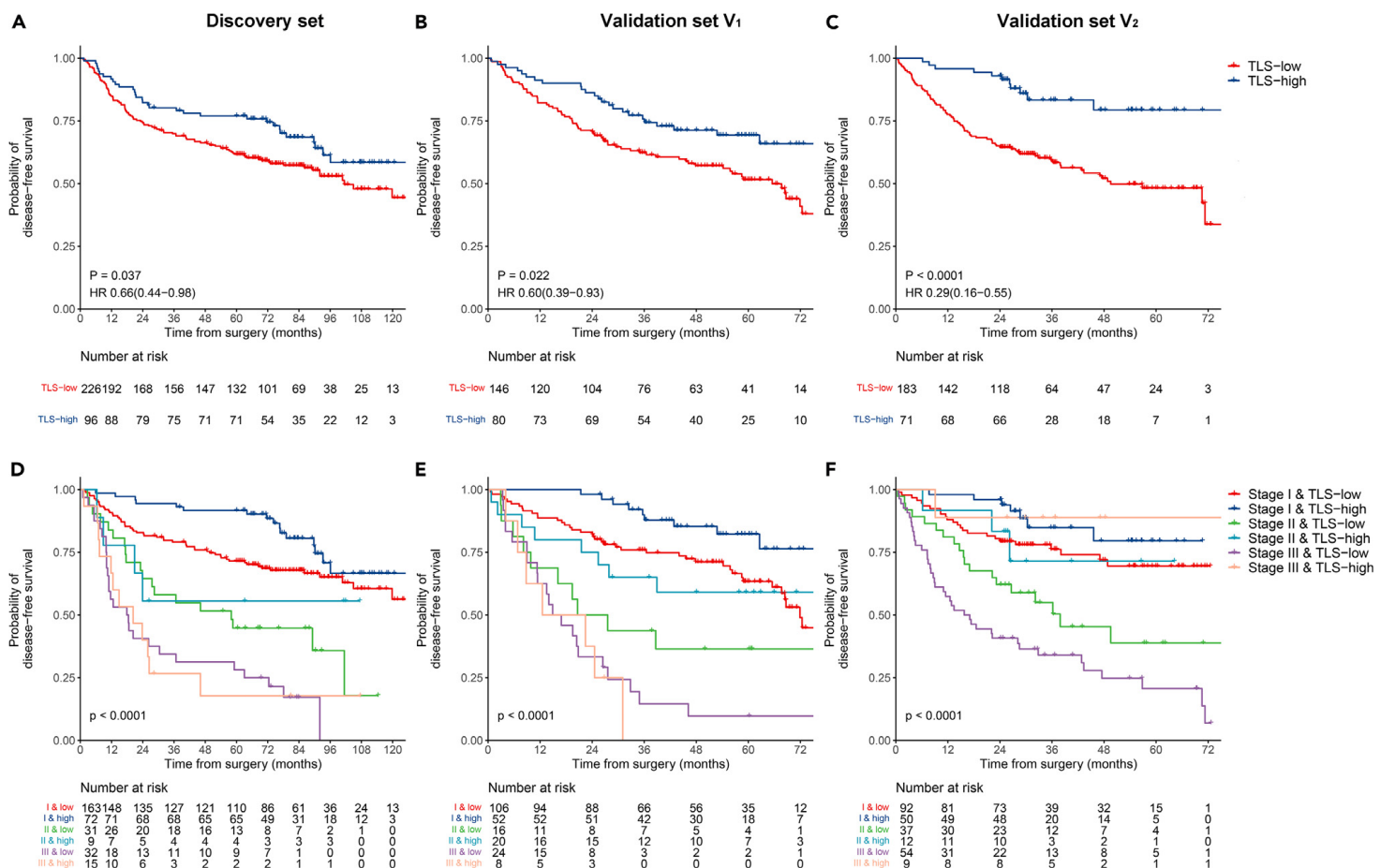
-
预测模型的开发和验证:基于发现集中的独立预后因素(吸烟状态、分化等级、TNM分期、LVI和TLS密度),建立了Cox模型(全模型)以预测DFS。与临床模型相比,全模型在三个数据集中表现出更好的区分度和校准能力(发现集:C-index 0.716 vs. 0.702,iAUC 0.702 vs. 0.690,AIC 1373.345 vs. 1377.481)。
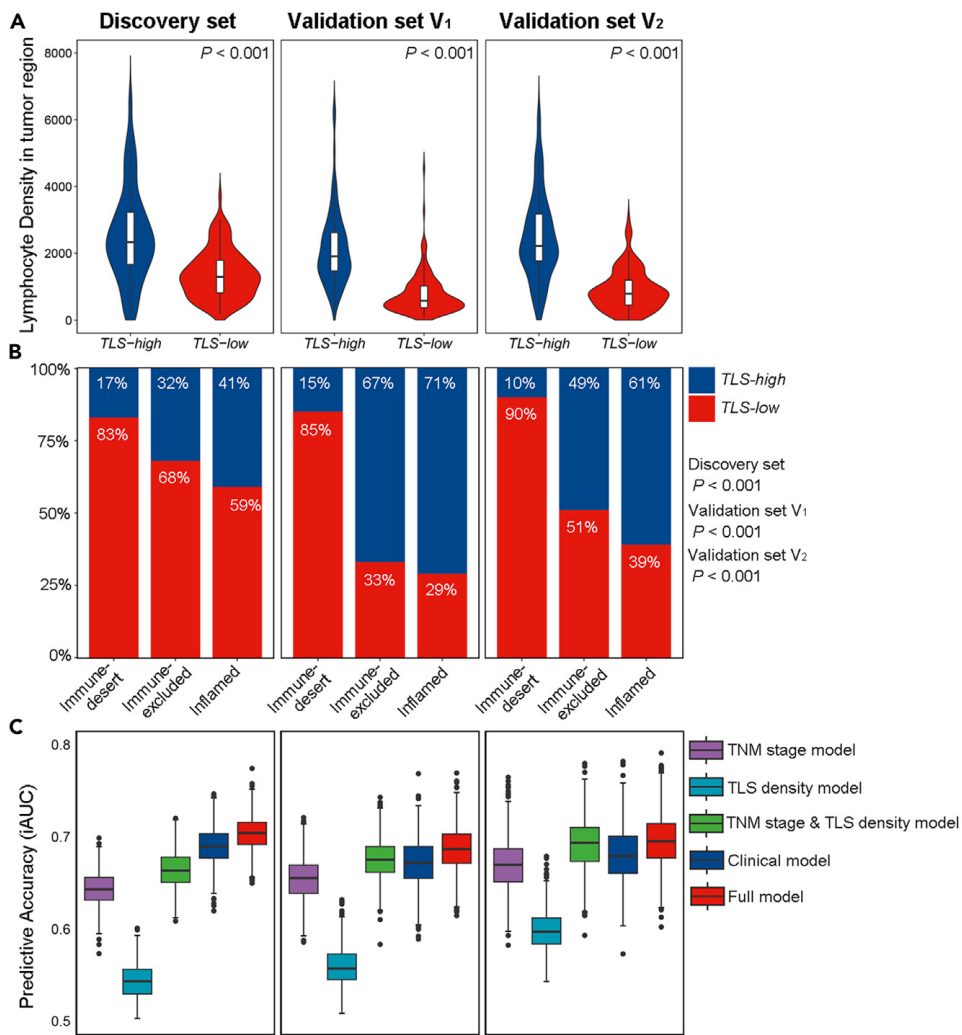
6-5:重点关注几个问题
问题1
论文中提出的自动化TLS密度量化工作流程具体是如何实现的?
- 肿瘤区域分割:采用半自动策略对肿瘤区域进行分割,使用迁移学习方法预训练ResNet50模型进行肿瘤区域的分割。预训练模型使用Camelyon16数据集中的数百万个小正负图像块进行预训练,然后使用67张标注的LUAD WSIs进行微调。
- 组织和细胞分类:在肿瘤区域内进行组织和细胞的分类,使用弱监督语义分割方法基于补丁级分类标签进行组织分割,最终将肿瘤区域分为肿瘤上皮、肿瘤间质和淋巴细胞聚集区。
- TLSs识别和密度计算:基于组织分割掩码,识别直径大于或等于150微米(或椭圆形TLSs的主轴)的淋巴细胞聚集区作为TLSs。TLSs密度定义为肿瘤区域内TLSs数量与肿瘤区域面积的比值:
TLSs density = 肿瘤区域内TLSs数量 肿瘤区域面积 \text{TLSs density} = \frac{\text{肿瘤区域内TLSs数量}}{\text{肿瘤区域面积}} TLSs density=肿瘤区域面积肿瘤区域内TLSs数量
- 生存分析和外部验证:使用最大选定秩统计方法在发现集中确定TLSs密度的截断值,将患者分为TLSs低组和TLSs高组,并进行生存分析。
问题2
论文中如何验证自动化TLS计数与病理学家的手动TLS计数之间的一致性?
- 数据收集:随机选择50张H&E染色WSIs和50张IHC染色WSIs,这些图像来自所有可用的组织病理学图像。
- 手动计数:由一位经验丰富的病理学家(B.B.L.)在这些选定的WSIs上进行手动TLSs计数,确定每个WSIs中的TLSs数量。
- 一致性分析:使用ICC和Bland-Altman图来评估自动化TLS计数与手动TLS计数之间的一致性。结果显示,自动化TLS计数与病理学家的手动TLS计数之间具有良好的一致性,ICC分别为0.894(95%CI: 0.821-0.938, p<0.001)和0.903(95%CI: 0.836-0.944, p<0.001)。
问题3
论文中如何分析TLSs密度与免疫表型之间的关联?
- 数据收集:从三个数据集中收集肿瘤组织中的淋巴细胞密度数据。
- 免疫表型分类:根据肿瘤区域内淋巴细胞密度,将患者分为三种免疫表型:炎症型(inflamed)、免疫排斥型(immune-excluded)和免疫沙漠型(immune-desert)。
- 统计分析:使用Cochran-Armitage趋势检验分析TLSs密度与免疫表型之间的关联。结果显示,TLSs高密度组中的肿瘤区域内淋巴细胞密度显著高于TLSs低组(p<0.001),低TLSs密度与免疫沙漠表型显著相关(p<0.001)。























 1250
1250

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








