导读
功能性磁共振成像(fMRI)和脑电图(EEG)是用于测量人脑神经活动的非侵入性技术。fMRI测量的是与神经活动血流动力学变化相关的磁共振信号,具有良好的空间分辨率(2-3mm各向同性)和较低的时间分辨率(1-3s)。而EEG用于以毫秒级的时间分辨率记录大脑中的电活动,但空间分辨率有限。通过fMRI和EEG的结合,可以生成人脑功能的高时空分辨率图,这对于理解人脑的复杂动力学是至关重要的。此外,fMRI期间的EEG记录可用于识别大脑中异常电活动的来源。本文探讨了人类同步EEG-fMRI记录的最新进展;重点关注同步EEG-fMRI记录存在的挑战;去除伪影的技术;fMRI和EEG研究的实验设计;以及整合fMRI和EEG数据的方法。
前言
人脑是一个复杂而动态的网络,在多个时空尺度上存储和处理信息。这种信息处理是通过神经元中电活动的产生和通过轴突通路的传递来实现的。神经电活动的产生和传递的异常变化会导致大脑功能紊乱。功能性磁共振成像(fMRI)和脑电图(EEG)可用于无创记录大脑神经活动。fMRI测量的是与神经活动引起的血流动力学变化相关的磁共振信号强度的变化。fMRI具有比EEG更高的空间分辨率(2-3mm),但时间分辨率有限(1-2s)。另一方面,EEG可以以高时间分辨率(毫秒)记录神经活动,但空间分辨率有限。同时记录fMRI和EEG可用于结合两种技术的优点,并更好地了解大脑中异常神经电活动的神经来源(例如,在癫痫发作期间)或生成人脑功能的高时空分辨率图。
本文重点介绍了使用同步fMRI-EEG对人脑功能进行体内成像,探论了基于fMRI和EEG同步成像的人脑功能的最新进展,概述了同步fMRI-EEG记录存在的挑战,以及从MRI扫描仪内记录的EEG数据中去除伪影的技术。最后,给出了设计实验以提高fMRI和EEG实用性的技术指南,以及整合fMRI和EEG数据以实现高时空分辨率的各种方法。
血氧水平依赖(BOLD)fMRI
血氧水平依赖(BOLD)fMRI最早是由Ogawa等人(1990)通过对高磁场中的大鼠研究发现的。神经元活动的增加需要更大的能量(图1a),这引起了血流、含氧(抗磁性)和脱氧(顺磁性)血液、血容量和耗氧量之间的复杂相互作用。由于MRI扫描仪内顺磁性和抗磁性血液的不平衡,产生的小额外磁场会在磁场中产生局部不均匀性,从而导致MR信号的弛豫常数T2*降低。因此,对T2*敏感的MR脉冲序列在血液高度氧合时显示出更多的MR信号,而在血液高度脱氧时显示较少的MR信号。对短暂神经元刺激的典型BOLD反应一般伴随着延迟开始、峰值和下降。这种BOLD反应被称为血流动力学响应函数(HRF)。许多研究还报告了HRF在神经元活动之后和HRF升高之前出现短暂(1-2s)的初始下降,称为初始下降。

图1.BOLD fMRI信号生成示意图。
fMRI生成时空数据(图1b)。BOLD HRF的显著增加仅发生在神经元活动1-2s后,并在约5s时达到峰值。fMRI的采样率为1-2s。因此,BOLD信号只是测量在毫秒级上发生的非常快速的神经元活动。对于fMRI中使用的典型脉冲序列,每重复一次(TR)获得一个volume。多波段fMRI技术的最新进展允许以亚秒级的时间分辨率采集BOLD。
fMRI的空间分辨率由体素大小决定,体素大小通常在2-3mm各向同性范围内。较小的体素会降低信噪比(SNR),而较大的体素则会引入较低的空间特异性和部分容积效应。超高场MRI扫描仪中高空间分辨率fMRI的最新进展允许以亚毫米空间分辨率记录fMRI。例如,亚毫米分辨率fMRI可以揭示人体的层流和柱状电路。然而,超高场MRI存在的困难包括,扫描成本,有限的可用性和安全问题,因而经常使用这些扫描仪是不切实际的。
脑电图(EEG)
EEG通过在头皮上放置导电电极来测量大脑的电活动(图2)。与fMRI相比,EEG可以以高时间分辨率捕获电活动。因此,它在临床上通常用于神经系统疾病的诊断和评估,特别是癫痫。EEG也是对人类不同睡眠阶段进行分类的黄金标准方法。它通常用于睡眠障碍的评估,对此已有既定的临床指南。

图2.EEG记录及其特点。
EEG测量的是由定位在相似空间方向上的神经元集群产生的总同步电活动。因此,EEG的起源在很大程度上取决于潜在神经元集群的功能和结构连接。尽管如此,头皮上记录的大多数EEG信号来自皮层锥体神经元,而在常规EEG记录中,深部(皮层下区域)脑电信号源更容易被遗漏。
脑电波通常以<4Hz(delta)、4-7Hz(theta)、7-13Hz(alpha)、13-30Hz(beta)和>30Hz(gamma)的频带为特征。Delta波是深度睡眠的一个显著特征,但在高认知需求和某些脑部病变中也能观察到。Theta波可在嗜睡时观察到,经常出现在睡眠不足的大脑中。Alpha波反映了闭上眼睛时放松的清醒状态。Beta波和gamma波在执行认知任务时最为明显。刺激锁定神经元放电(例如,听觉或视觉刺激)在EEG数据中也表现为事件相关电位。
在MRI扫描仪中记录EEG
90年代初,首次报告了在MRI扫描仪内记录的EEG信号。这些早期举措主要是由于临床需要使用MRI内记录的EEG来识别癫痫样活动的空间来源。因此,EEG主要用于检测癫痫发作,而fMRI则用于定位,使其具有良好的空间精度。从那时起,硬件和软件的进步使得同步fMRI-EEG在认知和临床神经科学中的使用呈指数级增长。研究的重点已扩大到包括理解放松时的清醒状态、睡眠以及复杂认知任务期间EEG活动的fMRI相关性。
由于MRI的电磁环境较差,同步fMRI-EEG记录在技术上具有挑战性。MRI扫描仪中的磁场梯度会产生时变电磁场,现代高场MRI扫描仪的磁场梯度最高可达200T/m/s。当EEG电极被放置在MRI扫描仪内时,时变磁场会在电极导线中诱发电流。这些电流在EEG中表现为大的梯度伪影。此外,由于患者运动或心脏动脉搏动而引起的EEG电极运动会在EEG中产生伪影,其振幅与实际EEG信号相似。早期同步fMRI-EEG记录系统通过使用MRI兼容的EEG电极解决了这些技术挑战,并且只有在EEG中发现感兴趣的事件(例如癫痫样尖峰)后才触发fMRI数据采集。这允许在没有梯度伪影的情况下获得合理质量的EEG。第一个真正同步的fMRI-EEG系统是在2000年代初报道的,该系统结合了EEG信号的模拟预处理和数字后处理来抑制MRI伪影。他们证明,通过采用适当的扫描协议和最小化梯度伪影的策略,可以在fMRI扫描期间持续监测EEG。
MR兼容的EEG硬件
自90年代初首次在MRI扫描仪内记录EEG以来,在优化EEG硬件方面已经取得了相当大的进展。最新的商用硬件符合安全标准,并减少了与静态磁场、梯度磁场和射频场的相互作用。尽管如此,在MRI内部建立EEG记录系统时,仍应考虑许多安全性和设计方面的因素(表1)。
表1.与MRI环境中的EEG记录相关的重要考虑因素和设计挑战。

注意事项
将EEG电极放置在MRI扫描仪中患者的头部有几个风险,包括(1)金属EEG电极附近组织的局部发热,(2)电击和(3)神经刺激。当暴露于射频(RF)产生的时变磁场或不断变化的梯度场时,在导电回路中诱发电流时,可能会发生局部加热。当由EEG放置形成的导电环在扫描仪内轻微移动(如移动或心跳/呼吸相关的运动),并与空间变化的静态磁场相互作用时,也可能发生加热。磁场强度和频率的增加会增加感应电流。因此,在设计MR兼容的EEG系统时需要仔细考虑,以满足所需的安全标准。
EEG硬件
通过仔细考虑EEG中使用的组件、印刷电路板(PCB)设计、集成电路的选择以及数据传输和采集方法,可以最大限度地减少EEG硬件、MRI环境和患者之间的相互作用。目前有两种设计已被广泛用于在MRI扫描仪内获取EEG。第一种设计将所有有源电子元件(例如放大器和任何其他电子设备)放置在MRI扫描仪之外。EEG电极导线通过一根长碳线连接到放大器。电极是氯化银电极。因为放大器的有源电子器件位于扫描仪外部,所以这种设计能最大限度地减少MR图像上的伪影。通过扭转双导线,导线中的射频感应电流也被最小化。Goldman等人提出了该系统的许多变体,包括使用高限流电阻器和金电极,以及通过穿过波导的长碳纤维导线将电极导线连接到位于MRI扫描仪室外的放大器。在微睡眠研究中,基于长碳导线的EEG系统已成功地用于3T MRI扫描仪内进行EEG记录。
第二种设计将EEG放大器放置在MRI室内。在这种设计中,放大器/数字转换器被屏蔽并放置在靠近磁头线圈的位置。放大器通常由电池供电,可减少与磁场的相互作用,最大限度地减少成像伪影,并提高患者的安全性。为了衰减MR信号采集过程中EEG诱发的大量高频梯度伪影,通常还会使用耦合到低通电阻-电容(RC)滤波器(例如250Hz)的差分放大器。数字化的EEG信号通过光纤传输到MRI扫描仪外部的采集系统。在这种设计中,通过将放大器放置在更靠近脑电帽的位置,可以将EEG信号损失降至最低。此外,放大器由非磁性材料制成,可以放置在扫描仪孔内。
EEG+fMRI数据采集协议
EEG硬件设置
下面提供的方法学考虑因素有助于改进EEG+fMRI研究的工作流程。
①大多数EEG硬件应该安装在控制室,尽管一些系统也允许将EEG放大器放置在更靠近参与者头部(即MR孔的末端)的位置。
②MRI扫描仪需要发送slice/volume触发器以供EEG系统检测。TTL脉冲是同步MRI层采集与EEG记录所必需的,这样可以很容易地在EEG数据上定位梯度伪影的起始点。如果触发时间太短,则可能需要外部硬件来扩展触发器脉冲。
③同样,EEG系统需要连接到刺激呈现计算机来接收刺激呈现的触发器。
④任何其他外围设备也可以通过额外的触发器与EEG系统同步。
⑤采样率的选择对于EEG数据采集也至关重要。至少5000Hz或更高的采样率应该能捕获与梯度伪影相关的动态范围,以便在预处理步骤中使用自适应减法去除伪影。
⑥EEG记录可以是交流或直流耦合的,具体取决于研究的需求。
⑦此外,EEG电极可以根据参考或双极配置。双极配置是早期EEG+fMRI设置的首选方法。在这种设置中,使用双极配置来显著降低梯度噪声。对于双极配置,每个电极的参考电极是相邻电极。相反,对于参考配置,中性电极被放置在耳垂后乳突或中央电极上。
参与者准备
①标准操作程序、知情同意和定期检查都是必要的,并确保参与者在MRI扫描仪内处于舒适状态。
②在招募参与者参加研究之前,应对参与者进行MR安全性筛查,特别是金属植入物的存在。
③应该要求他们用洗发水(不含护发素)洗头,不要使用任何其他护发产品。使用护发素和其他护发产品可能会在头皮表面和电极之间形成绝缘屏障。
④EEG电极帽必须根据参与者的头部大小来选择。将导电凝胶(脑电膏)注入每个电极内,以确保与头皮的导电接触。
⑤测量脑电图(ECG)或眼电图(EOG)的电极也应注入导电凝胶。电极阻抗应尽可能低(<10kΩ),以确保高质量的信号。注意不要使用过量的凝胶,因为这会导致电极之间的桥接。
⑥目视数据检查对于确保EEG数据的质量非常重要。这应该首先在扫描仪外部完成。一种简单的睁眼/闭眼协议可以在后部电极(例如,Oz,O1,O2)的闭眼期间显示出alpha波。
采集方法
研究中常用的采集有两种类型:交错采集和连续采集。
①交错采集
当实验协议需要无梯度伪影的EEG数据epoch时,或者当实验协议需要没有MRI音频噪声的短暂间歇期(例如,在听觉实验期间)时,则使用交错采集。交错采集是指fMRI以交错方式采集,而EEG则是连续采集。交错采集具有MRI静默期,可作为听觉刺激呈现的窗口。在典型的交错采集中,首先呈现刺激,并在刺激呈现后立即采集无梯度伪影的干净EEG窗口。未采集fMRI的脑电图部分仍有与动脉搏动相关的伪影(心动图(BCG)),应使用伪影拒绝技术将其去除。这种技术的一个重要局限是刺激需要以相对较长(>10s)的刺激间隔呈现,这将大大增加总扫描时间。
②连续采集
连续采集EEG和fMRI是大多数临床同步fMRI-EEG研究(例如癫痫)和认知神经科学研究的首选方法。连续采集是同时采集EEG和fMRI。这对于事件相关研究和采用连续任务的研究来说非常重要,这些研究需要随着时间的推移对神经元活动进行连续采样。连续采集的另一个优点是能够捕获不可预测的事件。例如,在临床研究中,对于癫痫活动或睡眠阶段的调查,感兴趣的事件是不可预测的。因此,需要连续采集fMRI和EEG,并在事后识别EEG中感兴趣的事件。连续采集的局限性是大的梯度伪影会淹没感兴趣的EEG信号。因此,为了避免在fMRI采集过程中出现饱和现象,拥有一个大动态范围的EEG放大器是非常重要的。目前已经开发了新的算法来去除EEG数据中的梯度和BCG伪影,这将在下文进行讨论。
伪影去除技术
①梯度伪影
MRI扫描仪使用由梯度和RF线圈产生的时变磁场对MR信号的空间信息进行编码并创建图像。因此,当EEG硬件(电极、电线和放大系统)放置在MRI扫描仪内时,时变电磁场会在被试头部和EEG硬件形成的导电回路内产生杂散电压信号(梯度伪影)。与神经生理EEG信号相比,梯度伪影的振幅非常大(>100倍)。有几种方法可以减少梯度伪影。这些方法大致可分为:(1)基于减法的去噪,(2)盲源噪声分离和(3)基于硬件的技术。
A.基于减法的去噪
这种方法由Allen等人提出,从固定数量的样本中计算出平均成像伪影模板,然后从每个样本的EEG信号中减去该模板。减法包括以下步骤:
从EEG数据中去除低频波动(使用1Hz的高通滤波器)。
梯度伪影的平均模板是通过对多个slices或volumes的伪影信号求平均值来创建的。
从信号中减去伪影模板以去除较大的梯度伪影。
采用自适应降噪技术去除残差噪声。
自适应伪影减法(AAS)方法正常工作的先决条件是必须准确计算伪影模板。为了创建精确的伪影模板,重要的是EEG和fMRI采集之间的同步是精确的。同步中的任何时间抖动都会使该方法不可用。可以使用成像slices或volumes来创建模板。根据在EEG数据上观察到的trigger,fMRI扫描的时间段用于创建模板。结合基于slices或volumes的方法可以获得最佳结果。因此,将每个成像层的层触发器发送到EEG系统是非常重要的。
基于减法去噪的第二个重要考虑因素是第一次去噪后的残差噪声。由于平均模板减法是一种线性方法,因此任何非线性和随机噪声都将持续存在于EEG数据中。为了消除这种残差噪声,已经开发了一种基于特征值分解的方法。该方法采用基于主成分分析(PCA)的残差信号分解方法。然后可以使用自适应降噪(ANC)滤波器来解释与残差噪声相关的最大方差的成分。另一种方法是直接对EEG数据应用PCA,从信号中分离噪声成分。但是,这种方法也需要ANC滤波器来去除残差噪声。第三种方法使用迭代减法,其中梯度模板的振幅通过线性回归优化调整。
为了捕获和去除伪影模板中与运动相关的方差,已经提出了基于加权、聚类和回归的方法。伪影模板可以根据时间或频谱相似性对每个事件进行加权,从而调整与运动相关的噪声。此外,基于聚类的方法可以根据为每个聚类计算的伪影模板之间的相似性测量对伪影进行聚类。其他基于fMRI时间序列的头部运动估计方法也被提出并应用。
B.梯度伪影的盲源分离
盲源分离技术,如独立成分分析(ICA),已被成功地用于从EEG数据中提取噪声污染。
ICA试图从M个线性组合的源信号中分离出N个统计上相互独立的源信号。ICA可用于原始EEG数据,将EEG分为信号源和噪声源。然后通过成分回归从信号中去除噪声成分。自动化技术使用监督学习通过识别类似于伪影模板的独立成分(IC)来识别伪影相关的信号,也可用于从MRI扫描仪内部识别EEG记录中的伪影(图3)。

图3.从EEG数据中去除梯度(GA)和心动图(BCG)伪影的管道概览。
C.基于硬件的方法
基于硬件的方法使用额外的硬件组件来捕获、表征和去除EEG数据中的梯度伪影。将单独的EEG电极层作为参考层放置在顶部。参考层下方的电极通过导电凝胶连接到头皮上。这些电极记录大脑信号以及梯度和运动伪影,而参考层中的电极与头皮隔离,仅记录MRI伪影。然后通过从累积EEG和伪影信号(通过头皮电极记录)中去除伪影信号(通过新的参考电极记录)来估计无伪影的EEG信号。
在另一种称为“碳线环”的方法中,将四个碳线环缝合在脑电帽的外表面,并将两个碳线环缝合在从脑电帽到脑电放大器的连线上(图4)。这四根碳丝的内阻为160Ω/m,分别位于左额、左后、右额和右后位置。然后,这些碳线记录的噪声信号从脑电帽记录的大脑信号中回归出来。该方法已被证明适用于去除任何与运动相关的伪影,以及脉冲和梯度伪影。

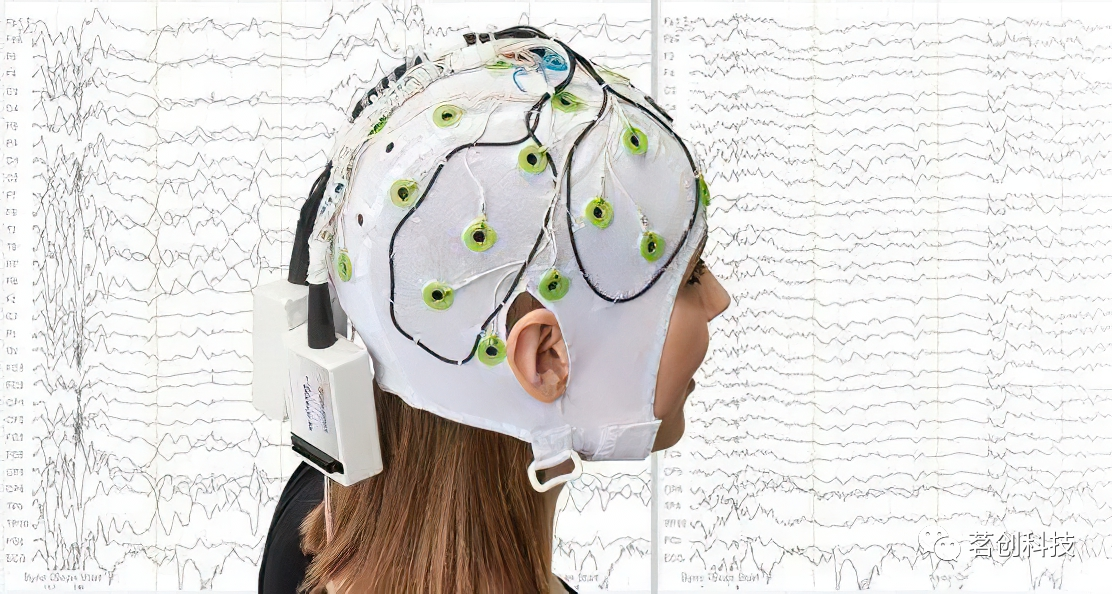
图4.为基于硬件去除MR伪影而开发的碳线环配置。
②心冲击图(BCG)伪影
由于在MRI扫描仪的强磁场中,脉动使头皮扩张或收缩时,头皮电极上会产生杂散电压,以及传导血液的脉动而引起的霍尔效应。即使是由于脉动运动引起EEG电极的微小运动也可以转化为电信号,该电信号可能比感兴趣的EEG信号大几倍。由于心搏的时间变异性,BCG伪影很难从EEG数据中完全去除。
A.BCG伪影的自适应减法
BCG伪影可以通过使用自适应降噪技术去除:
心动周期的开始通过QRS检测技术检测。QRS复合波是在心电图轨迹中观察到的三个波的组合。为此需要单独的ECG记录。
伪影模板是通过对多个心动周期求平均值而形成的。
使用奇异值分解计算伪影的所有锁时出现的时域主成分。这将生成一个最优基集(OBS),其中包括解释BCG随时间变化方差的主成分。
然后,从每次出现的BCG伪影中回归出OBS。
B.BCG伪影的盲源分离
BCG伪影也可以通过使用基于ICA的盲源分离技术来去除。ICA将EEG数据分解成源成分,其中一些将是噪声,另一些将是感兴趣的大脑信号。由于ICA能够识别噪声源,可以简单地从原始EEG数据中回归出噪声源,从而得到更清晰的EEG信号。其他几种方法也已用于基于ICA的BCG伪影去除,包括:(1)时域ICA和(2)混合AAS+ICA方法。在时域ICA方法中,将ICA算法应用于连续的EEG数据,得到与噪声和大脑信号相对应的成分时程。在这种方法中,必须准确识别噪声成分,才能有效地去除它们。然而,对BCG成分进行客观和有效的鉴别是困难的。为了识别噪声成分,通常采用基于ECG信号相关性的方法。目前还提出并使用了其他更先进的方法,用于检测每个IC中与心动周期相关峰值的自相关或使用成分的频谱分析。混合AAS+ICA方法利用了基于AAS和ICA方法的优点。该方法首先从心脏周期锁定的EEG数据生成的伪影模板中计算最优基集。使用这种方法可以删除大部分BCG伪影。然后使用ICA去除残留的BCG伪影。
C.基于硬件的方法
基于硬件的方法也可用于从EEG数据中去除BCG伪影。这种方法使用额外的传感器来监测同步EEG-fMRI采集期间与心脏脉搏相关的运动和头动。也有人提出使用碳线环来记录和去除EEG数据中的BCG伪影。运动和BCG伪影也可以通过将脑电帽上的几个电极绝缘,并相对于参考电极测量这些电极上的信号来记录。然后,将这些伪影信号从EEG数据中回归出来。
同步fMRI-EEG数据分析
同步fMRI-EEG分析的方法可分为模型驱动技术和数据驱动技术(图5)。模型驱动技术旨在将源自EEG的大脑信号拟合到fMRI数据(EEG-informed fMRI),或者相反,将源自fMRI的大脑信号拟合到EEG数据(fMRI-informed EEG),从而提高时空分辨率,循证神经过程。相比之下,数据驱动技术旨在整合fMRI和EEG数据,并对潜在神经活动进行最少的预先假设。

图5.用于分析同步fMRI-EEG数据的过程概览图。
①模型驱动技术
模型驱动技术使用线性或非线性模型来结合EEG和fMRI中固有的时域、频谱或时空活动。该方法已被用于研究在个体被试水平上,EEG数据中的振荡和事件相关神经元活动的fMRI相关性。为了研究特定频段(例如,7-13Hz alpha)振荡EEG活动的空间fMRI相关关系,可以通过视觉(使用主观知识)或使用时频分析将该活动标记为感兴趣的事件。特定频段内EEG功率的滑动窗口时间序列可用作一般线性模型(GLM)分析中的回归量,其中fMRI时间序列是结果变量,EEG功率是预测因子。在事件相关设计中,可以使用EEG的不同特征,例如EEG相干性、特定频率的EEG功率以及ERP振幅或潜伏期。然后将这些特征用于事件相关或epoch模型中,以模拟神经活动对fMRI的瞬态/相位效应。然后将该设计与血流动力学响应函数进行卷积,以模拟与EEG变化相关的fMRI的时间波动。这种方法的基本假设是,EEG特征的时间波动与fMRI的波动共变。
②数据驱动技术
数据驱动技术可以融合fMRI和EEG数据,提供高分辨率的脑功能图。数据驱动技术可以在没有先验模型的情况下分析fMRI数据。这在一些行为驱动的实验中尤其重要,例如静息态,在静息态下没有明确的数据模型。然而,由于EEG信号本质上是皮层信号,数据驱动技术的实用性受到了限制。最常用的数据驱动技术是独立成分分析(ICA)和聚类。
使用独立成分分析进行融合。ICA在fMRI中用于识别数据中空间或时间上独立的结构。ICA在fMRI中的大多数应用都寻求空间上最大独立的成分。ICA假设观察到的信号是独立信号源的线性组合,并使用高阶统计量来识别它们。联合ICA已被用于提取与运动序列学习、目标识别和静息态网络相关的BOLD信号的时空模式。例如,一种基于ICA的联合方法融合了多模态EEG和fMRI数据,可以在没有ERP振幅或相位的先验信息情况下将单试次EEG和fMRI结合起来。在这种方法中,单试次EEG响应和fMRI响应可以合并到一个矩阵中,并进行联合时空分解。另一种方法是使用ICA源来融合EEG+fMRI数据。该方法还结合了约束和基于滞后的信号分解方法来演示电生理信号和BOLD信号之间的可变滞后结构。
同步fMRI-EEG实验技术
同步fMRI-EEG已被广泛用作回答大脑功能相关问题的工具,近年来其使用呈指数级增长。这些研究大多数使用高度受控的实验操作,比较受控刺激呈现期间的fMRI或EEG活动。然而,在没有任何实验输入(例如,自发行为)的情况下研究大脑的必要性也得到了广泛认可。因此,近年来出现了对睡眠和其他现象的同步fMRI-EEG研究。下面概述了使用EEG+fMRI研究人脑的各种实验方法(图6)。

图6.同步记录系统示意图。
①对照实验
对照实验是通过在同步fMRI-EEG研究中呈现预定持续时间的实验刺激来进行的。刺激类型和实验条件取决于被调查的研究问题,实验至少需要两种类型的条件:基线和任务条件。这是必需的,因为fMRI BOLD信号不是神经元活动的绝对测量值。因此,所有研究都必须具备将感兴趣的神经元活动与合适的背景(即基线)条件进行统计对比的能力。大多数同步fMRI-EEG研究使用事件相关设计,并消除潜在的混淆因素,如习惯化、预期、假定或其他策略效应。假设每个事件产生的神经元活动会导致短暂的BOLD和EEG反应。通过比较不同类型事件之间的同步fMRI-EEG活动,可以回答神经活动变化作为自变量函数的研究问题。事件相关设计还允许分析个体对试次的反应,从而提供了识别行为反应的神经相关性的方法。
以block形式呈现相同类型刺激的实验称为block设计研究。该模式假设每个block内都能获得稳定的神经元活动和血流动力学。混合设计结合了事件相关和block设计方法。与block设计类似,有控制block和任务block。但与block设计不同的是,每个任务block试次之间的间隔时间不同,就像事件相关设计中的那样。该方法允许估计与每个试次相关活动的时间变化,以及估计整个任务block中的持续活动。
②行为驱动实验
在行为驱动实验中,同步fMRI-EEG用于研究自发行为的变化。简单的行为驱动实验是一种静息态实验,其中被试躺在MRI扫描仪内,除了静态视觉注视外什么都不做,测量与静息行为相关的EEG和BOLD fMRI活动。从这个角度来看,静息态下的自发活动可以揭示大脑的功能组织。第二种行为驱动的fMRI研究是研究与生理活动自发波动相关的BOLD和EEG信号。通常,这些研究记录了fMRI扫描期间的生理活动,例如皮肤电反应、EEG和ECG,这些变化是在事后发现的,并与BOLD反应相关。
结论
同步fMRI-EEG是一种先进的脑成像技术,可用于更好地了解人类大脑活动的时空动态。这种模式提供了研究大脑网络功能的能力,并能够以高时间和空间分辨率提供有关大脑电活动来源的信息。然而,在计划同步fMRI-EEG研究之前,应该考虑到一些技术挑战。预处理方法的选择取决于硬件类型和数据中的噪声量。然而,该领域仍然缺乏一种可靠的、可重复的最佳综合和标准化分析方案。未来的研究需要对EEG+fMRI研究的数据采集,预处理和分析管道进行标准化。尽管如此,认知神经科学领域从这种技术的可用性中获益良多。
相关文章推荐 (点击链接查看)
基于联合独立成分分析(jICA)的EEG与fMRI耦合与解耦
参考文献(上下滑动查看):
1. Ives, J.R., et al.: Monitoring the patient’s EEG during echo planar MRI. Electroencephalogr. Clin. Neurophysiol. 87(6), 417–420 (1993)
2. Goldman, R.I., et al.: Acquiring simultaneous EEG and functional MRI. Clin. Neurophysiol. 111(11), 1974–1980 (2000)
3. Abreu, R., Leal, A., Figueiredo, P.: EEG-informed fMRI: a review of data analysis methods. Front. Hum. Neurosci. 12, 29 (2018)
4. Simoes, M., et al.: Correlated alpha activity with the facial expression processing network in a simultaneous EEG-fMRI experiment. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2017, 2562–2565 (2017)
5. Poudel, G.R., et al.: Losing the struggle to stay awake: divergent thalamic and cortical activity during microsleeps. Hum. Brain Mapp. 35(1), 257–269 (2014)
6. Noth, U., et al.: Simultaneous electroencephalography-functional MRI at 3 t: an analysis of safety risks imposed by performing anatomical reference scans with the EEG equipment in place. J. Magn. Reson. Imaging. 35(3), 561–571 (2012)
7. Huster, R.J., et al.: Methods for simultaneous EEG-fMRI: an introductory review. J. Neurosci. 32(18), 6053–6060 (2012)
8. Michels, L., et al.: Simultaneous EEG-fMRI during a working memory task: modulations in low and high frequency bands. PLoS One. 5(4), e10298 (2010)
9. Kaufmann, C., et al.: Brain activation and hypothalamic functional connectivity during human non-rapid eye movement sleep: an EEG/fMRI study. Brain. 129(Pt 3), 655–667 (2006)
10. Laufs, H., et al.: EEG-correlated fMRI of human alpha activity. NeuroImage. 19(4), 1463–1476 (2003)
11. Goldman, R.I., et al.: Simultaneous EEG and fMRI of the alpha rhythm. NeuroReport. 13(18), 2487–2492 (2002)
12. Liu, Z.M., He, B.: FMRI-EEG integrated cortical source imaging by use of time-variant spatial constraints. NeuroImage. 39(3), 1198–1214 (2008)
13. Poudel, G.R., Innes, C.R.H., Jones, R.D.: Distinct neural correlates of time-on-task and transient errors during a visuomotor tracking task after sleep restriction. NeuroImage. 77, 105–113 (2013)
14. Poudel, G.R., Innes, C.R.H., Jones, R.D.: Temporal evolution of neural activity and connectivity during microsleeps when rested and following sleep restriction. NeuroImage. 174, 263–273 (2018)
15. Ogawa, S., et al.: Brain magnetic resonance imaging with contrast dependent on blood oxygenation. Proc. Natl. Acad. Sci. 87, 9868–9872 (1990)
16. Arthurs, O.J., Boniface, S.: How well do we understand the neural origins of the fMRI bold signal? Trends Neurosci. 25(3), 169–169 (2002)
17. Salek-Haddadi, A., et al.: Studying spontaneous EEG activity with fMRI. Brain Res. Rev. 43(1), 110–133 (2003)
18. Buxton, R.B., Wong, E.C., Frank, L.R.: Dynamics of blood flow and oxygenation changes during brain activation; the balloon model. Magn. Reson. Med. 39, 855–864 (1998)
19. Logothetis, N.K., et al.: Neurophysiological investigation of the basis of the fMRI signal. Nature. 412(6843), 150–157 (2001)
20. Lindquist, M.A., et al.: Modeling the hemodynamic response function in fMRI: efficiency, bias and mis-modeling. NeuroImage. 45(1 Suppl), S187–S198 (2009)
21. Menon, R.S., et al.: BOLD based functional MRI at 4 Tesla includes a capillary bed contribution: echo-planar imaging correlates with previous optical imaging using intrinsic signals. Magn. Reson. Med. 33(3), 453 (1995)
22. Hu, X., Yacoub, E.: The story of the initial dip in fMRI. NeuroImage. 62(2), 1103–1108 (2012)
23. Gras, V., et al.: Optimizing bold sensitivity in the 7t human connectome project resting-state fMRI protocol using plug-and-play parallel transmission. NeuroImage. 195, 1–10 (2019)
24. Kim, S.-G., Ogawa, S.: Insights into new techniques for high resolution functional MRI. Curr. Opin. Neurobiol. 12(5), 607–615 (2002)
25. Kashyap, S., et al.: Resolving laminar activation in human v1 using ultra-high spatial resolution fMRI at 7t. Sci. Rep. 8, 17063 (2018)
26. Tsuchida, T.N., et al.: American clinical neurophysiology society: EEG guidelines introduction. J. Clin. Neurophysiol. 33(4), 301–302 (2016)
27. Kirschstein, T., Kohling, R.: What is the source of the EEG? Clin. EEG Neurosci. 40(3), 146–149 (2009)
28. Buzsaki, G., Anastassiou, C.A., Koch, C.: The origin of extracellular fields and currents–EEG, ECOG, LFP and spikes. Nat. Rev. Neurosci. 13(6), 407–420 (2012)
29. Cajochen, C., Foy, R., Dijk, D.J.: Frontal predominance of a relative increase in sleep delta and theta EEG activity after sleep loss in humans. Sleep Res. Online. 2(3), 65–69 (1999)
30. Accolla, E.A., et al.: Clinical correlates of frontal intermittent rhythmic delta activity (FIRDA). Clin. Neurophysiol. 122(1), 27–31 (2011)
31. Makeig, S., Jung, T.P., Sejnowski, T.J.: Awareness during drowsiness: dynamics and electrophysiological correlates. Can. J. Exp. Psychol. 54(4), 266–273 (2000)
32. Makeig, S., Jung, T.P.: Tonic, phasic, and transient EEG correlates of auditory awareness in drowsiness. Brain Res. Cogn. Brain Res. 4(1), 15–25 (1996)
33. Brueggen, K., et al.: Early changes in alpha band power and dmn bold activity in Alzheimer’s disease: a simultaneous resting state EEG-fMRI study. Front. Aging Neurosci. 9, 319 (2017)
34. Dang-Vu, T.T., et al.: Spontaneous neural activity during human slow wave sleep. Proc. Natl. Acad. Sci. U. S. A. 105(39), 15160–15165 (2008)
35. Liu, Y., et al.: Top-down modulation of neural activity in anticipatory visual attention: control mechanisms revealed by simultaneous EEG-fMRI. Cereb. Cortex. 26(2), 517–529 (2016)
36. Mullinger, K., et al.: Effects of simultaneous EEG recording on MRI data quality at 1.5, 3 and 7 tesla. Int. J. Psychophysiol. 67(3), 178–188 (2008)
37. Hawsawi, H.B., Carmichael, D.W., Lemieux, L.: Safety of simultaneous scalp or intracranial EEG during MRI: a review. Front. Phys. 5, 42 (2017)
38. Lemieux, L., et al.: Recording of EEG during fMRI experiments: patient safety. Magn. Reson. Med. 38(6), 943–952 (1997)
39. Salek-Haddadi, A., et al.: EEG quality during simultaneous functional MRI of interictal epileptiform discharges. Magn. Reson. Imaging. 21(10), 1159–1166 (2003)
40. Srivastava, G., et al.: Ica-based procedures for removing ballistocardiogram artifacts from EEG data acquired in the MRI scanner. NeuroImage. 24(1), 50–60 (2005)
41. Jonmohamadi, Y., et al.: Source-space ICA for EEG source separation, localization, and timecourse reconstruction. NeuroImage. 101, 720–737 (2014)
42. Toppi, J., et al.: Time-varying effective connectivity of the cortical neuroelectric activity associated with behavioural microsleeps. NeuroImage. 124(Pt A), 421–432 (2016)
43. Bayer, M., Rubens, M.T., Johnstone, T.: Simultaneous EEG-fMRI reveals attention-dependent coupling of early face processing with a distributed cortical network. Biol. Psychol. 132, 133–142 (2018)
44. Bonmassar, G., et al.: Spatiotemporal brain imaging of visual-evoked activity using interleaved EEG and fMRI recordings. NeuroImage. 13(6), 1035–1043 (2001)
45. Portas, C.M., et al.: Auditory processing across the sleep-wake cycle: simultaneous EEG and fMRI monitoring in humans. Neuron. 28(3), 991–999 (2000)
46. Menon, V., Crottaz-Herbette, S.: Combined EEG and fMRI studies of human brain function. Neuroimaging. 66(Pt A), 291 (2005)
47. Hall, D.A., et al.: “Sparse” temporal sampling in auditory fMRI. Hum. Brain Mapp. 7(3), 213–223 (1999)
48. Schwarzbauer, C., et al.: Interleaved silent steady state (ISSS) imaging: a new sparse imaging method applied to auditory fMRI. NeuroImage. 29(3), 774–782 (2006)
49. Poudel, G.R., et al.: Neural correlates of decision-making during a Bayesian choice task. NeuroReport. 28(4), 193–199 (2017)
50. McGlashan, E.M., et al.: Imaging individual differences in the response of the human suprachiasmatic area to light. Front. Neurol. 9, 1022 (2018)
51. Schabus, M., et al.: Neural correlates of sleep spindles as revealed by simultaneous electroencephalography (EEG) and functional magnetic resonance imaging (fMRI). J. Sleep Res. 15, 50–51 (2006)
52. Fang, L., et al.: Simultaneous EEG-fMRI reveals spindle-related neural correlates of human intellectual abilities during NREM sleep. Sleep Med. 40, E99–E99 (2017)
53. Mullinger, K.J., Castellone, P., Bowtell, R.: Best current practice for obtaining high quality EEG data during simultaneous fMRI. J. Vis. Exp. (76) (2013)
54. Allen, P.J., Josephs, O., Turner, R.: A method for removing imaging artifact from continuous EEG recorded during functional MRI. NeuroImage. 12(2), 230–239 (2000)
55. Negishi, M., et al.: Removal of time-varying gradient artifacts from EEG data acquired during continuous fMRI. Clin. Neurophysiol. 115(9), 2181–2192 (2004)
56. Niazy, R.K., et al.: Removal of fMRI environment artifacts from EEG data using optimal basis sets. NeuroImage. 28(3), 720–737 (2005)
57. Ritter, P., Villringer, A.: Simultaneous EEG-fMRI. Neurosci. Biobehav. Rev. 30(6), 823–838 (2006)
58. Chowdhury, M.E.H., et al.: Simultaneous EEG-fMRI: evaluating the effect of the EEG capcabling configuration on the gradient artifact. Front. Neurosci. 13, 690 (2019)
59. Cunningham, C.J.B., et al.: Simultaneous EEG-fMRI in human epilepsy. Can. J. Neurol. Sci. 35(4), 420–435 (2008)
60. Sartori, E., et al.: Gradient artifact removal in co-registration EEG/fMRI. World Congress on Medical Physics and Biomedical Engineering, Vol 25, Pt 4: Image Processing, Biosignal Processing, Modelling and Simulation. Biomechanics. 25, 1143–1146 (2010)
61. Freyer, F., et al.: Ultrahigh-frequency EEG during fMRI: pushing the limits of imagingartifact correction. NeuroImage. 48(1), 94–108 (2009)
62. de Munck, J.C., et al.: The hemodynamic response of the alpha rhythm: an EEG/fMRI study. NeuroImage. 35(3), 1142–1151 (2007)
63. Moosmann, M., et al.: Realignment parameter-informed artefact correction for simultaneous EEG-fMRI recordings. NeuroImage. 45(4), 1144–1150 (2009)
64. Ryali, S., et al.: Development, validation, and comparison of ICA-based gradient artifact reduction algorithms for simultaneous EEG-spiral in/out and echo-planar fMRI recordings. NeuroImage. 48(2), 348–361 (2009)
65. Mantini, D., et al.: Complete artifact removal for EEG recorded during continuous fMRI using independent component analysis. NeuroImage. 34(2), 598–607 (2007)
66. Chechile, R.A.: Independent component analysis: a tutorial introduction. J. Math. Psychol. 49(5), 426–426 (2005)
67. Islam, M.K., Rastegarnia, A., Yang, Z.: Methods for artifact detection and removal from scalp EEG: a review. Clin. Neurophysiol. 46(4-5), 287–305 (2016)
68. Acharjee, P.P., et al.: Independent vector analysis for gradient artifact removal in concurrent EEG-fMRI data. IEEE Trans. Biomed. Eng. 62(7), 1750–1758 (2015)
69. Chowdhury, M.E.H., et al.: Reference layer artefact subtraction (RLAS): a novel method of minimizing EEG artefacts during simultaneous fMRI (vol 84, pg 307, 2014). NeuroImage. 98, 547–547 (2014)
70. Maziero, D., et al.: Towards motion insensitive EEG-fMRI: correcting motion-induced voltages and gradient artefact instability in EEG using an fMRI prospective motion correction (PMC) system. NeuroImage. 138, 13–27 (2016)
71. van der Meer, J.N., et al.: Carbon-wire loop based artifact correction outperforms postprocessing EEG/fMRI corrections-a validation of a real-time simultaneous EEG/fMRI correction method. NeuroImage. 125, 880–894 (2016)
72. Abbott, D.E., et al.: Constructing carbon fiber motion-detection loops for simultaneous EEGfMRI. Front. Neurol. 5, 260 (2015)
73. Debener, S., et al.: Properties of the ballistocardiogram artefact as revealed by EEG recordings at 1.5, 3 and 7 t static magnetic field strength. Int. J. Psychophysiol. 67(3), 189–199 (2008)
74. Grouiller, F., et al.: A comparative study of different artefact removal algorithms for EEG signals acquired during functional MRI. NeuroImage. 38(1), 124–137 (2007)
75. Wang, K., et al.: Clustering-constrained ICA for ballistocardiogram artifacts removal in simultaneous EEG-fMRI. Front. Neurosci. 12, 59 (2018)
76. Mayeli, A., et al.: Real-time EEG artifact correction during fMRI using ICA. J. Neurosci. Methods. 274, 27–37 (2016)
77. Masterton, R.A.J., et al.: Measurement and reduction of motion and ballistocardiogram artefacts from simultaneous EEG and fMRI recordings. NeuroImage. 37(1), 202–211 (2007)
78. Valdes-Sosa, P.A., et al.: Model driven EEG/fMRI fusion of brain oscillations. Hum. Brain Mapp. 30(9), 2701–2721 (2009)
79. Dong, L., et al.: Simultaneous EEG-fMRI: trial level spatio-temporal fusion for hierarchically reliable information discovery. NeuroImage. 99, 28–41 (2014)
80. Daunizeau, J., et al.: Symmetrical event-related EEG/fMRI information fusion in a variational Bayesian framework. NeuroImage. 36(1), 69–87 (2007)
81. Singh, M., Patel, P., Al-Dayeh, L.: FMRI of brain activity during alpha rhythm. International Society for Magnetic Resonance in Medicine, Concord, CA (1998)
82. Omata, K., et al.: Spontaneous slow fluctuation of EEG alpha rhythm reflects activity in deepbrain structures: a simultaneous EEG-fMRI study. PLoS One. 8(6), e66869 (2013)
83. Ragazzoni, A., et al.: “Hit the missing stimulus”. A simultaneous EEG-fMRI study to localize the generators of endogenous ERPs in an omitted target paradigm. Sci. Rep. 9, 3684 (2019)
84. Scheeringa, R., et al.: Frontal theta EEG activity correlates negatively with the default mode network in resting state. Int. J. Psychophysiol. 67(3), 242–251 (2008)
85. Jann, K., et al.: Bold correlates of EEG alpha phase-locking and the fMRI default mode network. NeuroImage. 45(3), 903–916 (2009)
86. Calhoun, V.D., et al.: Neuronal chronometry of target detection: fusion of hemodynamic and event-related potential data. NeuroImage. 30(2), 544–553 (2006)
87. Moosmann, M., et al.: Joint independent component analysis for simultaneous EEG-fMRI: principle and simulation. Int. J. Psychophysiol. 67(3), 212–221 (2008)
88. McKeown, M.J., et al.: Analysis of fMRI data by blind separation into independent spatial components. Hum. Brain Mapp. 6(3), 160–188 (1998)
89. Kincses, Z.T., et al.: Model-free characterization of brain functional networks for motor sequence learning using fMRI. NeuroImage. 39(4), 1950–1958 (2008)
90. Habas, C., Cabanis, E.A.: Dissociation of the neural networks recruited during a haptic objectrecognition task: complementary results with a tensorial independent component analysis. Am. J. Neuroradiol. 29(9), 1715–1721 (2008)
91. Damoiseaux, J.S., et al.: Consistent resting-state networks across healthy subjects. Proc. Natl. Acad. Sci. U. S. A. 103(37), 13848–13853 (2006)
92. Jonmohamadi, Y., et al.: Constrained temporal parallel decomposition for EEG-fMRI fusion. J. Neural Eng. 16(1), 016017 (2019)
93. Laufs, H., et al.: Where the BOLD signal goes when alpha EEG leaves. NeuroImage. 31, 1408 (2006)
94. Spiers, H.J., Maguire, E.A.: Neural substrates of driving behaviour. NeuroImage. 36(1), 245–255 (2007)
95. Hutchison, K., et al.: Cortical activation can be visualized during sleep using simultaneous EEG-fMRI. Sleep. 30, A36–A37 (2007)
96. Culham, J.C.: Functional neuroimaging: experimental design and analysis. In: Handbook of Functional Neuroimaging of Cognition, pp. 53–82. MIT Press, Cambridge, MA (2006)
97. Dale, A.M.: Optimal experimental design for event-related fMRI. Hum. Brain Mapp. 8(2-3), 109–114 (1999)
98. Hopfinger, J.B., Buonocore, M.H., Mangun, G.R.: The neural mechanisms of top-down attentional control. Nat. Neurosci. 3, 284–291 (2000)
99. Weissman, D., et al.: The neural bases of momentary lapses in attention. Nat. Neurosci. 9, 971–978 (2006)
100. Mechelli, A., et al.: Comparing event-related and epoch analysis in blocked design fMRI. NeuroImage. 18(3), 806–810 (2003)
101. Visscher, K.M., et al.: Mixed blocked/event-related designs separate transient and sustained activity in fMRI. NeuroImage. 19(4), 1694–1708 (2003)
102. Fox, M.D., et al.: The human brain is intrinsically organized into dynamic, anticorrelated functional networks. Proc. Natl. Acad. Sci. 102(27), 9673–9678 (2005)
103. Critchley, H.D., et al.: Neural activity relating to generation and representation of galvanic skin conductance responses: a functional magnetic resonance imaging study. J. Neurosci. 20(8), 3033 (2000)
104. Spiers, H., Maguire, E.: Decoding human brain activity during real-world experiences. Trends Cogn. Sci. 11(8), 356–365 (2007)
小伙伴们点个“在看”,加
(星标)关注茗创科技,将第一时间收到精彩内容推送哦~




























 485
485

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








