低强度经颅超声刺激(LITUS)是一种新型的无创神经调控技术。我们进行了一项系统综述,以评估目前关于LITUS神经调控的有效性和安全性的证据。检索5个数据库,检索时间从建库至2023年5月31日。纳入随机对照人体试验和对照动物研究。总结LITUS对临床或临床前、神经生理、神经影像学、组织学和生化转归以及不良事件的神经调控作用。共确定了11项人体研究和44项动物研究。LITUS对神经系统疾病、精神疾病、疼痛、睡眠障碍、高血压等均有较好的疗效。发现与LITUS相关的神经元结构和皮质活动的改变。从组织学和生化角度来看,突出的发现包括抑制炎症反应和促进神经发生。在我们的综述中包括的对照动物研究中没有报告不良反应,而在少数人类受试者中报告了可逆性头痛、恶心和呕吐。总体而言,LITUS可缓解各种症状,调节相关脑回路,且无严重副作用。未来的研究需要建立一个坚实的LITUS治疗框架。
1. 简介
低强度经颅超声刺激(LITUS)是一种新发展的非侵入性脑刺激(NIBS)技术,通过声能传入脑实质实现神经调控。与经颅磁刺激(TMS)或经颅电刺激(TES)相比,LITUS通常以高空间分辨率到达更深的脑区,这引起了该领域的兴趣。与高强度经颅聚焦超声(通过热效应或消融病变的脑结构来调节脑功能)不同,LITUS旨在通过非热效应机制来调节神经元活动,且组织损伤风险最小。这种通过多个超声脉冲进行的神经调控在LITUS文献中称为超声化。
LITUS近年来发展迅速。2008年,一项体外研究通过使用低强度(时间平均强度,ITA <300 mW/cm2)、低频率(<0.65 MHz)的超声刺激,首次发现LITUS对神经元活动和脑网络的兴奋性调制效应。两年后,通过颅骨将类似的低强度、低频超声波应用于小鼠大脑,在运动皮层和海马中检测到超声诱发的神经元活动。首次LITUS人体研究于2013年进行。更高的频率(8 MHz),低的声强度(ITA<152 mW/cm2)非聚焦超声对慢性疼痛患者额叶后皮质进行靶向治疗。与安慰剂组相比,治疗组在情绪方面有显著改善。此后,越来越多的研究将LITUS应用于动物和人类。然而,迄今为止,尚无关于LITUS治疗应用的指南。为了建立超声NIBS技术的安全边界和促进其治疗应用,大多数研究基于FDA推荐的诊断性超声的时间-空间峰值平均强度(ISPTA)< 720 mW/cm2来确定刺激强度和空间峰值脉冲平均强度(ISPPA)<190 W/cm2,或基于国际电工委员会(IEC标准60601-2-5)推荐的具有ISPTA<3 W/cm2的物理治疗超声设备。ISPPA表示空间最大位置的平均脉冲强度,与短期力学生物效应相关。ISPTA是指与热生物效应相关的空间最大位置的时间平均强度。此外,LITUS可分为以下三种类型:(1)聚焦经颅超声刺激(fTUS):采用聚焦超声换能器进行;(2)非聚焦经颅超声刺激(unfocused transcranial ultrasound stimulation, unfocused TUS):使用非聚焦超声换能器进行;(3)经颅脉冲刺激(TPS):使用频率为1 ~ 5 Hz的单次超短超声脉冲(3 μs), ISPPA = 100 mW/cm2和ISPPA = 111 W/cm2。
之前的系统综述总结了显示经颅超声刺激对脑兴奋性和行为产生影响的研究。然而,纳入的研究设计具有高度异质性,包括随机对照设计、受试者内设计、非对照设计和病例报告,这限制了对该技术在临床和研究中的应用的解读。此外,本研究还纳入了没有足够洗脱期的受试者内研究,这可能会引入遗留效应,因为有令人瞩目的证据表明,一次LITUS治疗可诱导长达40分钟的持久神经调节效应。因此,本研究旨在系统回顾和综合随机对照人体试验和体内对照动物研究,以探讨LITUS的神经调节作用和副作用。
2. 方法
本研究遵循系统综述和meta分析首选报告条目(PRISMA)声明中确立的标准,并在PROSPERO上注册(CRD42023399150)。
2.1 搜索策略
检索MEDLINE(通过PubMed)、Embase(通过Embase)、CENTRAL(在Cochrane Library)、CINAHL(通过EBSCOHost)和WOS(通过Web of Science),检索时间从数据库建库至2023年5月31日。语言仅限于英文和中文。以“低强度经颅超声”、“经颅聚焦超声”、“经颅非聚焦超声”、“低强度经颅聚焦超声”、“经颅脉冲刺激”、“经颅超声”、“聚焦超声”、“经颅”、“超声”、“神经调节”为关键词进行研究。详细的检索策略见补充附录1。检索相关综述和纳入研究的参考文献列表,以确定潜在的记录。
2.2 纳排标准
研究纳入标准如下:(1)人体研究采用随机对照设计(包括交叉设计)或动物对照研究(纳入研究不限于动物研究的随机对照设计,因为动物研究的随机化不标准化);(2) LITUS通过机械效应调节脑功能;在这里,我们纳入了报告使用低强度超声或非热超声的研究,或者使用符合FDA或IEC建议的声学强度的研究;(3)空白对照组或假手术对照组;(4)具有临床或临床前、神经电生理、神经影像学、组织学和生化检查结果。排除以下研究:(1)采用LITUS开放血脑屏障联合微泡注射进行物质递送;(2)重复测量,冲洗时间不超过40 min。
2.3 研究选择和数据提取
由PQ和WLX两名评价者独立筛选标题和摘要。根据纳入和排除标准对全文进行评估。两名审稿人意见不一致时,通过与第三审稿人(MXJ)讨论解决。由2名独立的评价者(PQ和WLX)提取数据,并以标准化表格记录。提取以下信息:(1)研究对象或动物模型特征;(2) LITUS类型及对照;(3) LITUS治疗参数(总干预次数、刺激靶点、超声参数);(4)结局指标。(5) LITUS神经调控作用的主要结果;(6) LITUS的不良反应。两名审稿人意见不一致时,通过与第三审稿人(MXJ)讨论解决。
2.4 评估纳入研究的偏倚风险
由2名评价者(PQ和WLX)独立评估每项研究的偏倚风险。采用Cochrane偏倚风险2工具(Cochrane RoB 2.0)评估人体研究的偏倚风险,包括随机化过程、时期和遗留效应(适用于交叉试验)、与预期干预的偏差、缺失的结局数据、结局的测量和报告结果的选择6个方面。我们使用实验动物实验偏倚风险系统评价中心(sycle的RoB)工具进行动物实验,评估选择偏倚、操作偏倚、检测偏倚、损耗偏倚、报告偏倚和其他偏倚。两名审稿人意见不一致时,通过咨询第三名审稿人(MXJ)解决。
2.5 定性综合策略
鉴于纳入研究的高度异质性,无法进行荟萃分析。我们将LITUS的神经调控结果分为四个方面:临床和临床前、神经生理、神经影像、组织学和生化结果。将结局相同的研究进行分组,总结LITUS组与对照组的比较结果。此外,总结各研究报道的LITUS相关不良反应。
3. 结果
3.1 研究选择和研究特征
共检索到1618篇文献和180篇文献进行全文综述。共纳入11项人体研究和44项动物研究。研究选择过程见补充图1。引用全文综述后排除的研究,排除原因见补充附录2。表1显示了个体人体研究的详细特征。11项人体研究中有8项包括健康受试者,2项包括抑郁症患者,1项包括慢性疼痛患者。表2显示单个动物研究的详细特征。在动物研究中使用了多种疾病模型,包括帕金森病(PD)、抑郁、癫痫、疼痛、缺血性脑损伤、脱髓鞘、阿尔茨海默病(AD)、注意缺陷多动障碍(ADHD)、创伤性脑损伤(TBI)、高血压、精神分裂症、睡眠障碍、成瘾障碍和特发性震颤。
3.2 纳入研究的偏倚风险
根据Cochrane RoB 2, 11项人体研究中有4项被评为总体高偏倚风险,6项被评为中等偏倚风险,1项被评为低偏倚风险(补充图2a,补充表S1)。采用10项SYRCLE的RoB工具对44项动物研究进行质量评价。条目患病率评级为:“无”(3.9%),提示偏倚风险高;"不清楚"(58.5%),表示细节不足;“是”(37.6%),表明偏倚风险低(补充图2B,补充表S2)。补充图2总结了人类和动物研究的偏倚风险评估结果。每种工具的完整标准以及每种研究的完整分类见补充表S1和补充表S2。
3.3 LITUS的神经调节作用
我们将LITUS的神经调节作用分为4个方面:临床和临床前、神经影像学、神经生理以及组织学和生化结局。桑基图(图1)说明了LITUS对人体的主要神经调节作用。两个太阳爆发图(图2,图3)分别说明了LITUS在健康动物和疾病模型中的主要神经调节作用。
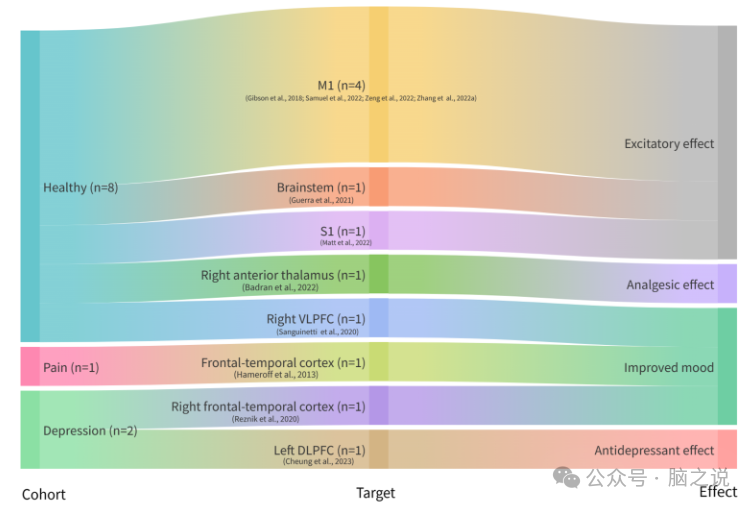
图1 LITUS对人体主要神经调节作用的桑基图。
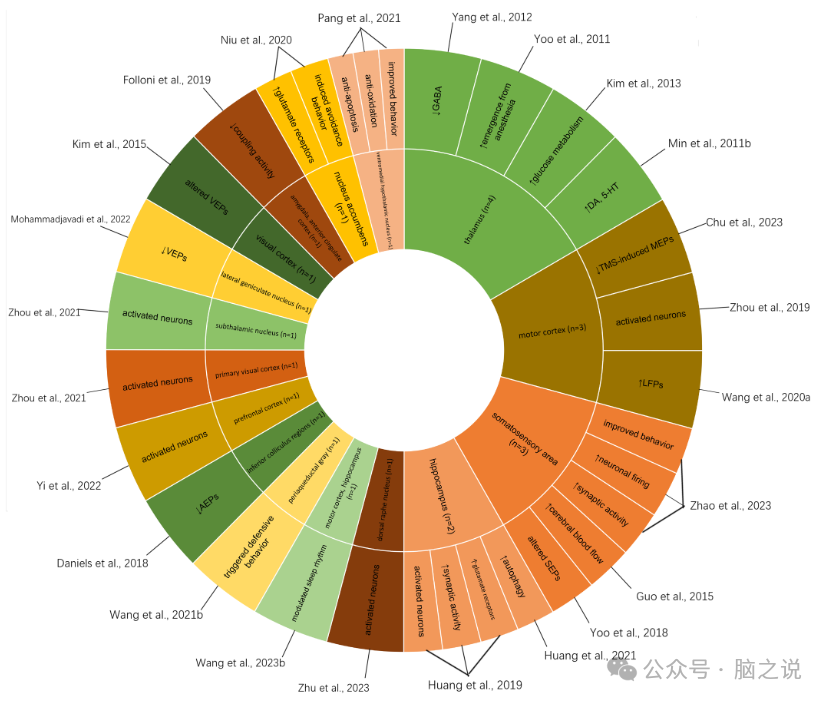
图2 健康动物中LITUS的主要神经调节作用的Sunburst图表。
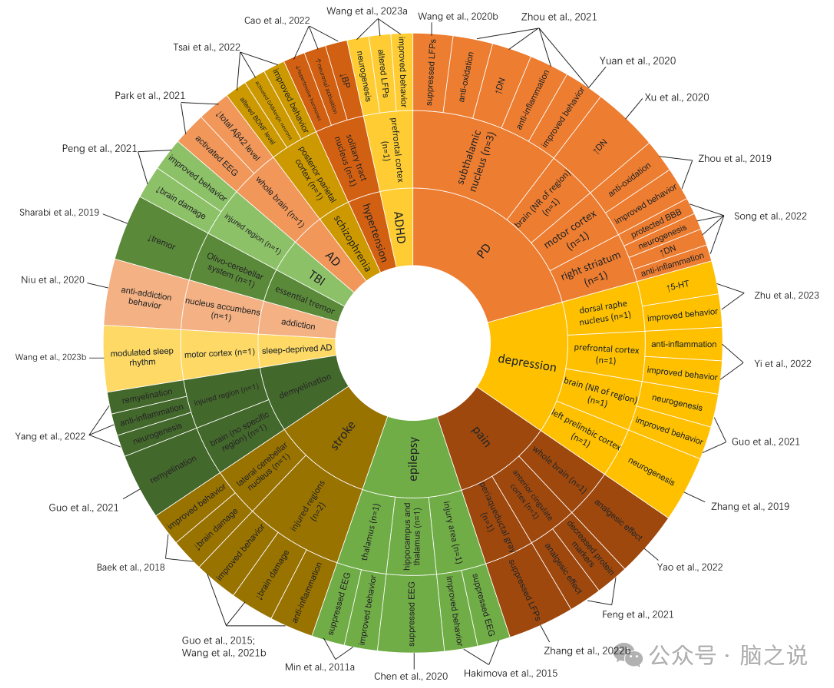
图3 在动物疾病模型中LITUS的主要神经调节作用的Sunburst图。
3.3.1 临床和临床前结局
我们研究了LITUS对多种临床和临床前结局的影响,包括疼痛、情绪、运动功能、认知功能等。在疼痛方面,一项人体研究和两项动物研究调查了fTUS的镇痛作用。一项研究表明,在右侧丘脑前进行两次10分钟的fTUS可降低健康受试者的疼痛敏感性。动物研究发现,在啮齿类动物疾病模型中,10分钟的全脑fTUS和21天的前扣带回皮质(ACC) fTUS可减轻疼痛。值得注意的是,fTUS对急性和慢性神经性疼痛有不同的影响。在慢性神经病理性疼痛中发现了在线镇痛效应,而在急性神经病理性疼痛中发现了离线镇痛效应。
在情绪方面,四项人体研究和四项动物研究调查了LITUS的抗抑郁作用。健康受试者接受30秒的右侧腹外侧前额叶皮质(VLPFC)超声检查,慢性疼痛患者接受15秒的额颞叶皮质非聚焦超声检查,超声检查可使患者在超声处理后10-40分钟内的情绪得到短期改善。另一项研究对抑郁症患者的右额颞叶皮层进行了5次30秒的fTUS测试,观察到特质焦虑在治疗后有所缓解。值得注意的是,在左侧背外侧前额叶皮质(DLPFC)进行的6次TPS治疗减轻了抑郁症患者的抑郁症状。动物研究发现,fTUS通过刺激内侧前额叶皮质、左侧边缘前皮质、中缝背核和海马来减少抑郁行为。
两项人体研究和10项动物研究探讨了fTUS对运动功能的调节作用。两项针对左侧初级运动皮层的健康受试者研究表明,在10分钟fTUS和80秒θ -burst fTUS (tb-fTUS)后,视觉运动任务中的运动速度有所改善。啮齿类动物经超声处理后运动功能得到恢复。通过在运动皮层和丘脑底核(STN)给予fTUS,可以改善啮齿类PD模型的尾肌力量、运动持续时间和距离、运动协调、运动迟缓和平衡障碍。TBI大鼠模型和缺血性卒中啮齿类动物模型。除一项研究将超声导向外侧小脑核(LCN)外,超声治疗应用于大脑的损伤区域。在衰老大鼠中,下丘脑核接受28次10 hz的fTUS增强了抓力。在针对前额叶皮质的12次fTUS治疗后2-4天,我们观察到对减少ADHD大鼠模型多动的短期效果。
5项动物实验研究了fTUS对认知功能的影响。健康小鼠、衰老小鼠和啮齿动物疾病模型,包括ADHD、精神分裂症和癫痫,这些研究中刺激的目标不同。总之,fTUS针对桶状皮质(小鼠的躯体感觉皮质区域)、前额叶皮质、海马和位于小鼠脑后叶后部3.0 mm和外侧2.5 mm的脑区后,显示了认知功能的改善。fTUS的其他调节作用已在个别动物研究中得到证实。这些效应包括在啮齿类动物疾病模型中,通过靶向丘脑减少癫痫行为,以及通过靶向孤立束核降低收缩压;在健康小鼠和成瘾性障碍小鼠模型中,通过靶向伏隔核诱导回避行为,通过靶向导水管周围灰质触发防御行为,以及通过靶向丘脑促进健康啮齿类动物的麻醉恢复。
3.3.2 神经生理学的结果
我们通过记录肌电图(EMG)和脑电图(EEG)以及测量兴奋性自发突触后电流来研究LITUS对各种神经生理学结果的影响。7项研究利用肌电图检测LITUS的刺激效果。5项人体研究中有4项通过测量tms诱发的运动诱发电位(MEP)来评估超声处理后的运动皮质兴奋性。fTUS, unfocused TUS和tb-fTUS在健康受试者左侧初级运动皮质的热点区域进行一次超声处理后增加了MEP。兴奋效应在非聚焦TUS后持续6分钟,在tb-fTUS后持续30分钟(Zeng等,2022)。tb-fTUS方案还将tms诱导的短间隔皮质内抑制(SICI)减弱至30分钟,并在超声处理后促进tms诱导的皮质内易化(ICF)达5分钟。在另外一项刺激上丘,并在眶上神经电刺激诱发的眼轮匝肌中记录到肌电图的人体研究中,无聚焦超声对三叉神经瞬目反射也有类似的兴奋效应。相比之下,动物研究表明,在健康大鼠的左侧初级运动皮层中,fTUS对tms诱导的MEP有抑制作用,并且在原发性震颤小鼠模型的橄榄-小脑系统中,fTUS对震颤肌中的肌电信号有在线抑制作用。总之,通过EMG测量,LITUS表现出双向(兴奋性或抑制性)神经调节作用。
13项动物实验评估了LITUS的脑电图调控效果。在健康大鼠中,通过分别靶向下丘和外侧膝状体核,我们证明了fTUS对听觉诱发电位(AEPs)和视觉诱发电位(VEPs)的抑制作用。而一项研究表明,通过靶向视皮层,fTUS诱导的VEP振幅变化具有剂量依赖性。当ISPPA为3 W/cm2时,5%的占空比(DC)抑制VEP, 8.3%的DC促进VEP, 1%的DC对VEP振幅无影响。我们还发现,fTUS通过靶向躯体感觉皮层来调节躯体感觉诱发电位(SEP),并且在10分钟fTUS后,差异性SEP特征持续超过35分钟。此外,fTUS通过表现出更高的局部场电位(LFP)振幅,在运动皮质中发现了在线兴奋效应。总体而言,在健康动物中使用脑电图检测LITUS效应的研究表明,脑兴奋性有明显的调节,并且这种调节的方向(兴奋或抑制)可能会受到超声参数的影响。此外,动物研究发现,LITUS逆转了数种啮齿类动物疾病模型中的疾病相关LFPs,包括睡眠剥夺模型、AD模型、PD模型、ADHD模型、疼痛模型和癫痫模型。一项动物实验通过记录fTUS诱导的兴奋性自发性突触后电流检测健康大鼠的功能性突触可塑性。每天10分钟的fTUS治疗10次后,海马神经元的自发兴奋性突触后电流频率增加。
3.3.3 神经成像结果
研究包括磁共振成像(MRI)、脑磁图(MEG)、正电子发射断层扫描(PET)、激光散斑成像和双光子荧光成像等多种神经影像学结果。一项人体研究和两项动物研究利用MRI来研究LITUS的调节作用。在健康受试者接受三次针对左侧初级躯体感觉皮层的TPS后,测量结构磁共振成像(sMRI)、静息态功能MRI (rs-fMRI)和扩散张量成像(DTI)。sMRI未见灰质体积变化;而rs-fMRI显示,在最后一次刺激后1周,左侧感觉运动网络的功能连接增加。DTI显示TPS后初级躯体感觉区和初级运动区轴向扩散率降低。作者认为,轴向扩散率的降低表明轴突的形成。在动物实验中也进行了Rs-fMRI检查,但发现在健康猕猴中,fTUS对目标区域(杏仁核和ACC)及其相互连接区域之间的功能连接具有抑制作用。在Folloni的研究中,使用了19.5 W/cm2和5.63 W/cm2的高ISPTA,这可能会引起热效应,导致可逆的神经抑制。在TBI大鼠模型中,DWI显示治疗期间表观扩散系数降低,部分各向异性升高。作者认为fTUS能有效减轻脑水肿和脑白质损伤。
一项人体研究应用MEG评估了tb-fTUS后左侧运动皮质的振荡脑反应和网络连接。结果表明,tb-fTUS在不同的区域产生了与运动相关的α和β频谱功率的变化。左侧边缘区、左侧小脑、双侧感觉运动皮质和右侧辅助运动区α波谱功率降低,右侧顶叶区和右侧基底节β波谱功率明显降低。作者的结论是,这些发现表明运动网络内的区域参与了对tb-fTUS的应答。在对健康大鼠的动物研究中,我们使用FDG(18-氟脱氧葡萄糖)PET检查了超声靶点(丘脑)的局部葡萄糖代谢。经过40分钟的fTUS后,我们观察到超声病灶中心的局部葡萄糖代谢较高,而其他区域没有。两项动物研究使用激光散斑成像来研究fTUS对疼痛大鼠模型和健康大鼠模型脑血流的影响。以不同数量的短声(600、800、1000)进行超声处理后,缺血皮质的脑血流速度在fTUS后立即升高,并在超声处理后4-12 s内保持较高水平,这取决于参数。然而,在疼痛大鼠模型中,全脑fTUS并未改变脑血流速度。一项动物研究在健康大鼠中使用了双光子荧光成像。它表明,桶状皮质的fTUS诱导了神经元放电活动的增强和桶状皮质中树突棘生长速度的增加。
3.3.4 组织学和生物学结局
我们研究了LITUS对多种组织学和生物学结果的影响,包括抗炎反应、神经发生过程、抗氧化反应和其他疾病特异性变化。7项动物研究检测了fTUS在啮齿动物疾病模型(包括PD模型)中的抗炎作用,缺血性脑损伤模型、衰老模型、抑郁模型和脱髓鞘模型。减少炎性神经元,如星形胶质细胞和小胶质细胞,炎症细胞如中性粒细胞,以及炎症细胞因子(TNF-α, IL-1β)的减少和神经炎症的蛋白标志物(COX-2, NF-κB),fTUS后观察到右侧纹状体、脱髓鞘病变区、丘脑底核(、缺血皮质、下丘脑腹内侧核和前额叶皮质。另一方面,在缺血半球fTUS后,检测到抗炎M2小胶质细胞和抗炎细胞因子(IL-10和IL-10R)的增加。
12项动物研究调查了fTUS在啮齿类动物疾病模型和健康啮齿类动物中的神经发生作用。LITUS增加了抑郁症模型中神经营养因子的水平,包括脑源性神经营养因子(BDNF)和胶质细胞源性神经营养因子(GDNF),以及神经发生相关蛋白的表达, PD模型、ADHD模型和脱髓鞘模型,通过靶向边缘前皮质、右侧纹状体、前额叶皮质和脱髓鞘病变区域。在一项关于精神分裂症模型的研究中,fTUS同时逆转了海马和前额叶皮质中的BDNF水平。此外,fTUS通过增加髓鞘碱性蛋白促进了髓鞘再生过程和海马fTUS通过增加树突棘密度激活海马神经元。LITUS还可调节多巴胺和GABA信号通路。多巴胺能神经元;在PD模型中,在丘脑底核和右侧纹状体进行fTUS后,黑质中的多巴胺转运体增加。在精神分裂症模型中,在fTUS后24小时检测到内侧前额叶的GABA能神经元增加。在健康大鼠中,丘脑fTUS 20分钟后,额叶细胞外多巴胺水平增加到100分钟,而细胞外GABA水平下降。在健康啮齿类动物中,通过刺激海马和伏隔核,检测到fTUS诱导的目标区域突触蛋白增加。此外,fTUS通过增加超声区域(皮质和海马)的LC3BII/LC3BI比值和降低p62水平激活健康小鼠的自噬过程。推测fTUS对神经退行性疾病具有神经保护作用,可能是通过增加陈旧细胞中异常成分的自我消化来实现的。综上所述,fTUS在调节神经营养因子和神经发生相关蛋白水平、促进髓鞘化过程、增加神经元树突棘密度、调节多巴胺和GABA信号通路、诱导突触可塑性和激活自噬过程等方面显示了神经发生效应。
三项动物实验研究了fTUS在啮齿类动物PD模型和衰老模型中的抗氧化作用。PD模型经fTUS后,通过靶向运动皮质和丘脑底核,黑质和纹状体中的抗氧化酶(包括超氧化物歧化酶和谷胱甘肽过氧化物酶)增加,而氧化酶之一的诱导型一氧化氮合酶降低。在衰老模型中,下丘脑腹内侧核经超声处理后,NMDA R2B受体表达降低,细胞凋亡启动子(Bax)表达降低。综上所述,fTUS通过增加抗氧化酶,减少氧化酶,抑制年龄相关的细胞凋亡过程,表现出抗氧化作用。
8项动物研究发现了fTUS引起的疾病特异性改变。在啮齿类动物脑损伤模型中,损伤皮质fTUS后显示损伤区域的恢复和LCN。在AD小鼠模型中,fTUS降低了边缘皮质中的总Aβ42水平。在小鼠神经病理性疼痛模型中,ACC-fTUS下调了Hnrnph1和Hnrnpd的高表达。在高血压大鼠模型中,发现孤束核- fTUS对降低血浆醛固酮(Aldo)、血管紧张素II (ANGII)、内皮素(et -1)、心钠素(ANF)和皮质醇(Cor)水平具有治疗作用。
3.4 纳入研究报告的不良反应
在11项人体研究中,共有282例参与者接受了LITUS治疗。三项fTUS研究)、一项无重点的TUS研究和一项TPS研究报告,整个实验期间未观察到不良事件。两项fTUS研究未检查不良反应。两项研究报告,在不适或异常感觉方面,verum组和假手术组之间没有显著差异,一项无重点的TUS研究提到刺痛是常见的感觉,一项fTUS研究没有提到任何细节。在一项TPS研究中,少数受试者(4%)报告了头痛,一名受试者在第一次治疗后诉有恶心和呕吐,但症状在2小时内缓解,不需要用药,并且没有进一步的症状发生。另一项无重点的TUS研究报道,一名受试者在超声处理后头痛加重,但很快消退且无后遗症。总之,4项fTUS研究均未报告不良事件。3项非重点研究和2项TPS研究分别报告了1%和5%的受试者发生不良事件。
44项动物实验中,25项fTUS研究和1项非聚焦TUS研究通过he染色、尼氏染色、珀尔斯普鲁士蓝染色、TUNEL染色、胶质纤维酸性蛋白免疫组织化学染色、热监测、MRI和行为学测试进行安全性评估。所有患者在LITUS术后均未出现组织学、生化及行为学异常。
关于机械指数(MI),纳入的39篇文献中有36篇(16篇文献未获得MI)使用LITUS联合MI <1.9,而两项人体研究使用的TPS的MI为10.95和使用MI为2.88的fTUS的动物研究。”
4. 讨论
本文就LITUS在人类和动物研究中对临床和临床前、神经生理、神经影像学、组织学和生化结果的神经调控作用进行综述。综述了其在神经系统疾病(包括帕金森病、阿尔茨海默病、脱髓鞘、癫痫、脑损伤和特发性震颤)、精神疾病(包括抑郁症、注意缺陷多动障碍、精神分裂症、成瘾障碍)、疼痛、睡眠障碍和高血压等方面的疗效。LITUS还调节了健康受试者的痛阈,改善了情绪和增强了运动功能,诱导了防御和回避行为,改善了认知功能,调节了睡眠节律,并促进了健康动物的麻醉唤醒。LITUS诱导的神经元兴奋性改变发生在目标区域及其连接区域,包括运动皮质、脑干、海马、橄榄-小脑系统、前额叶皮质、视皮质、下丘区、体感皮质、导水管周围灰质、丘脑、杏仁核和前扣带回皮质。从组织学和生化角度来看,LITUS通过调节抗炎反应、神经发生过程、抗氧化反应、凋亡过程和自噬过程来调节神经功能。
本综述中纳入的动物研究未发现组织学、生化或行为学方面的副作用。在两项人体研究中,少数受试者出现了可逆性不良事件,如头痛、恶心和呕吐。
LITUS包括fTUS、unfocused TUS和TPS。fTUS与非聚焦TUS的作用机制相似。根据几种假说,超声波通过声空化、声辐射力和声流与细胞内外环境相互作用,激活膜门控动力学,改变膜电容,触发突触传递,诱导NMDA依赖的突触可塑性。尽管机制相似,但fTUS和非聚焦超声的不同超声参数和所涉及的设备可能会导致不同的刺激效果。值得注意的是,TPS的神经调节机制可能不同于fTUS和非聚焦TUS,因为TPS保留了冲击波的内在特性。低能量体外冲击波通过机械转导促进抗炎作用以及血管生成过程和再生。研究表明,低能量体外冲击波的生物学机制涉及BDNF和血管内皮生长因子(VEGB)的上调,以及促进内皮氮氧化物转变为酪氨酸去磷酸化形式,增加NO生成并抑制核因子κB。鉴于LITUS治疗模式的多样性和不同的生物机制,未来的研究需要明确LITUS的类型和所用的超声参数,并对fTUS、非聚焦TUS和TPS的神经调控作用进行个体化的研究。
为了建立一个可靠的LITUS治疗框架,需要解决几个问题。首先,需要研究传递到靶点的声波的有效和安全剂量。纳入的研究均采用不同强度的声波。在动物实验中,ISPPA的功率从120 mW/cm2增加到64.9 W/cm2, ISPPA的功率从0.014 mW/cm2增加到19.5 W/cm2。在人体研究中,fTUS使用的ISPPA值范围为2.26 ~ 14 W/cm2, ISPTA值范围为71 ~ 995 mW/cm2;非聚焦超声采用的ISPPA为34.96 W/cm2, ISPPA值范围为132.85 ~ 152 mW/cm2;在TPS方面,采用了111 W/cm2的ISPPA和100 mW/cm2的ISPPA。使用过低的超声强度可能不足以表现出神经调节作用。动物实验表明,0.014 mW/cm2的弱fTUS并没有改变健康大鼠的运动皮质兴奋性,而0.338-12.15 mW/cm2的fTUS增加了皮质兴奋性。对于人类来说,最低有效刺激强度应该更高,因为69-87%的超声波被人类颅骨衰减。此外,声波在颅骨处的衰减随声波频率的增加而增加,因此,声波频率较高的非聚焦超声可以进一步减小声波传递到大脑的强度。另一方面,随着声强度的增加,大脑受到机械和热损伤的风险也会增加。根据目前的知识,对于什么样的LITUS强度才能保证稳健的神经元效应,同时避免副作用,目前尚未达成共识。在临床试验之前可以进行模拟研究和体外研究,以确定超声治疗的合适剂量。其次,需要明确介导治疗效果的超声参数。剂量-反应研究表明,较高的声强度增加了运动反应的可能性,并且fTUS诱发的VEPs的幅度随着声强度的增加而增加。此外,研究发现更高强度的fTUS具有更强的镇痛作用和更强的皮质兴奋性抑制作用。除声强外,其他超声参数如脉冲重复频率和脉冲持续时间、短纯音数、占空比和刺激时间可以影响神经元的调制效应。Kim et al.发现5% DC联合3 W/cm2 ISPPA抑制vep,而8.3% DC联合3 W/cm2 ISPPA增强vep振幅。然而,决定双向效应的因素尚不确定。此外,tb-fTUS的超声持续时间为80 s,每200 ms重复20 ms的超声脉冲(脉冲重复频率:5 Hz, DC: 10%,脉冲数:400)显示出比相同强度的常规fTUS更好的兴奋效果。第三,由于LITUS具有高度的区域特异性,因此适当的靶点选择对于确定LITUS的治疗结局至关重要。纳入的研究提出了几个潜在的靶点,包括丘脑和ACC的疼痛调节;DLPFC,内侧前额叶皮质,边缘前皮质和中缝背核治疗抑郁症;VLPFC和右侧额颞叶皮质用于改善情绪;运动皮质、丘脑底核和外侧小脑核改善运动功能。第四,进行LITUS时应优先考虑精确的神经导航。使用头部标志点经验定位可能会影响LITUS的精确性和有效性;因此,实时神经导航方法如MRI引导和光学跟踪应该被采用。
关于本综述的局限性,首先,鉴于严格的纳入/排除标准,一些可能很重要的先导性研究未被纳入本综述。可参考Darmani等人(2022)和Sarica等人(2022)来总结这些研究。其次,我们没有搜索专门研究LITUS不良后果的研究。纳入的人体随机对照试验和动物对照研究不足以评估LITUS的不良事件发生情况。第三,纳入研究的方法学质量不充分。11项人体研究中有10项存在中至高偏倚风险。在44项动物研究中,大部分SYRCLE条目评级为"不明确",提示缺乏足够的细节来评估潜在的偏倚风险。第四,治疗模式、刺激靶点和超声参数研究之间的高度异质性影响了结果的普遍适用性。因此,必须谨慎解读本研究的结果。
5. 结论
LITUS是一种很有前景的无创性技术,可以调节动物和人类的脑回路。LITUS诱导的神经调控作用包括改变神经元兴奋性和调节炎症反应、神经发生等生化过程,有助于改善临床行为和临床症状和体征。纳入的研究中未发现显著的不良事件;然而,在一些人类受试者中报告了可逆的症状,如头痛、恶心和呕吐。未来的研究需要利用精确的目标和实时的神经导航技术来研究最佳的超声参数和治疗策略。
参考文献:The effectiveness and safety of low-intensity transcranial ultrasound stimulation: A systematic review of human and animal studies.





















 863
863

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








