医药研发行业里,药物临床试验数据是申办方向监管机构递交的重要资料之一,对于监管机构和申办方来说都是宝贵的资源。
规范地收集、整理、分析和呈现临床试验数据对于提高药物临床研发的效率和质量、缩短审评时间具有重要的作用,并且有利于药品全生命周期管理,促进研发或监管的信息互通或共享。
申办方递交的临床试验数据若不遵循一定的规范,熟悉和理解数据结构及内容将占用大量的审评资源。这个时候就有一个组织应运而生了——
CDISC,中文名称:临床数据交换标准协会(CDISC - the Clinical Data Interchange Standards Consortium)
2000年,32家跨国公司为了最优化来自医学研究全体成员的实 践和理念,开始着手建立一系列标准.这些公司也成为CDISC 的缔造者.由此创建了这个日臻完善,全球性的非盈利组织, 用于支持临床及临床前数据的电子获取,交换,递交和归档。
类似于战国时期秦统一度量衡之前的各国都有其自己的一个度量衡标准,在不同的环境以及条件下,各个临床试验的数据收集可能会不太一致。但是随着商品生产和交换的日益兴盛,不同的一个标准势必会导致效率的降低,也就有了CDISC统一度量衡的一个标准出现。
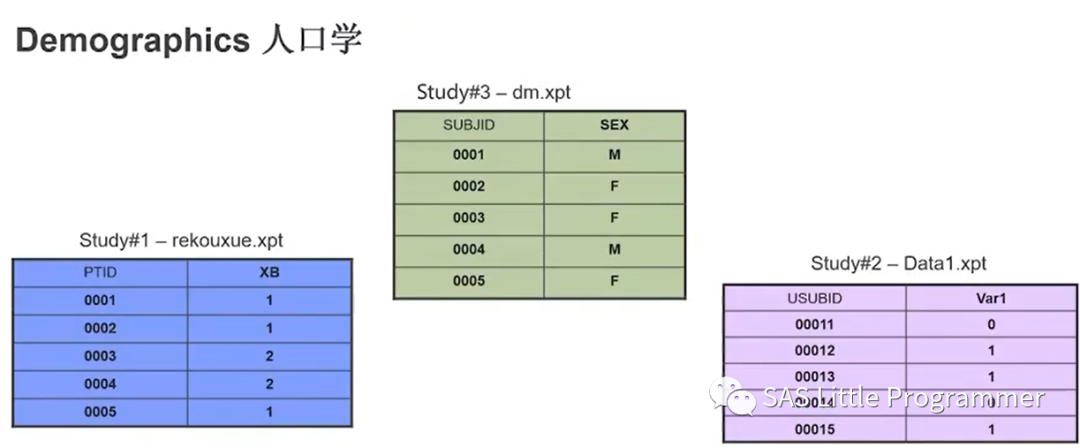
一些简单的数据像人口学资料,上图的一个实例中就可以发现,Study1-3的人口学数据集dm,renkouxue,data1中受试者变量及性别变量可以看的出来,三个试验所收集的信息都是有各自的一个标准,如果说没有统一的一个标准去规范,那么在熟悉和理解数据结构及内容是会浪费掉很多的时间,不方便数据的互通及共享,尤其是监管部门的审批。
CDISC标准用语数据递交现状
中国NMPA
1.《药物临床试验数据递交知道原则(试行)》2020年10月1日生效;
2. 鼓励申办方参照CDISC标准递交临床试验数据及相关的申报资料。
美国FDA
2016Dec开始的临床试验强制要求遵循CDISC标准
日本PMDA
2020年4月起,强制要求遵循CDISC标准
CDISC流程的话主要包括了以下的部分:
1.aCRF(注释病例报告表, annotated Case Report Form)
2.SDTM (Study Data Tabulation Model)
3.ADaM(Analysis Data Model)
4.Define
5.(SD/AD)RG(Review Guide)

SAS程序员是要了解整个CDISC过程,将试验所收集的源数据经过CDISC的标准化过程,从aCRF开始将源数据映射到SDTM,就是将各式各样的源数据转换成统一标准的数据,然后以SDTM为基础生成ADaM以帮助我们实现统计分析的需求。
以上掺杂个人观点(如有错误希望各位指出修改,谢谢)






















 5947
5947











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








