相较于空间转录组本身而言,"空间转录组做到啥程度能毕业?"显然是各位博士研究生更关注的问题。回答这个问题的最好方法,就是去知网翻一番各位博士的毕业论文。
首先,我以“空间转录组”为关键词在“博士学位论文”的范围内进行检索,由于毕业论文没有影响因子一说,我们挑了几篇博士论文中下载次数较高和时间较近的。
第一篇
这篇是来自海军军医大学的名为“基于空间转录组学技术对原发性肝癌空间异质性的研究”的文章【1】,于2021年11月毕业,下载次数1670次,该毕业论文全长107页,掐头去尾(去除目录、声明、致谢等内容)共92页内容。这位博士的专业为外科学,应该是一位临床医生,6年读完硕博也算效率很高了。在学期间以第一作者或共同第一作者共发表了3篇SCI,其中一篇更是发表在了《Science Advances》.(IF=14.822)。

论文中涉及的疾病是原发性肝癌,其是一种高度异质性的肿瘤,而肿瘤异质性主要包括时间异质性和空间异质性两个维度,针对空间异质性作者使用空间转录组学(Spatial transcriptomics,ST)进行分析。接下来,我们来看一下具体内容。首先作者采集7例PLC患者肿瘤组织标本,包括4例肝细胞癌、1例胆管细胞癌、1例混合型肝细胞胆管细胞癌以及1例合并门静脉癌栓的肝细胞癌肿瘤和癌栓样本;局部取样和整体拼接获取共21个不同空间区域的样本进行ST分析。
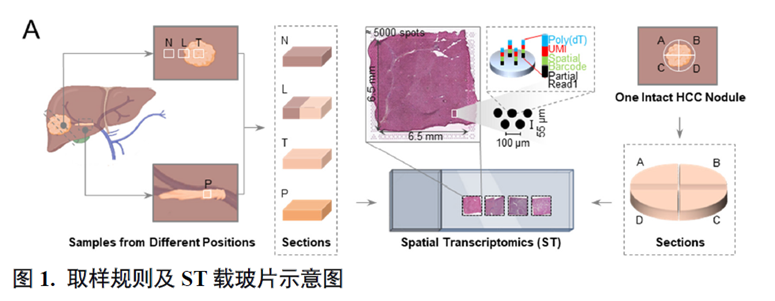
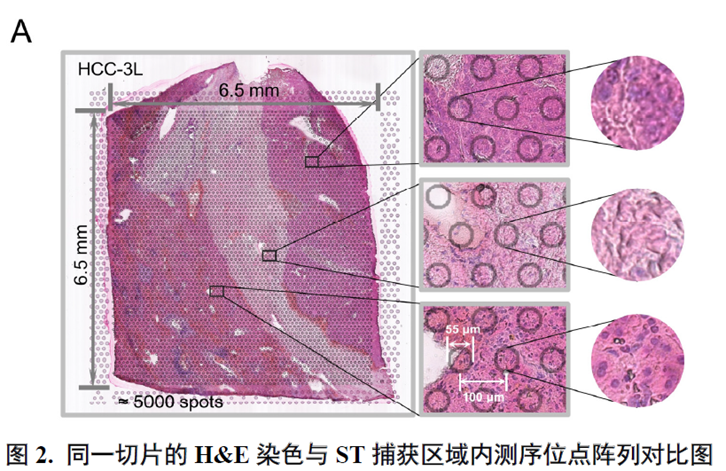
接着,作者评估了ST的测序稳定性及可靠性,通过测序位点的直径与对应的H&E 染色图像比对评估出每个位点大致包含的细胞数量。同时,作者对于测序数据进行统一流形逼近与投影技术(Uniform Manifold Approximation and Projection,UMAP)降维处理后鉴定细胞亚群,并对特定组织的标记基因表达进行展示来验证ST数据可靠性。
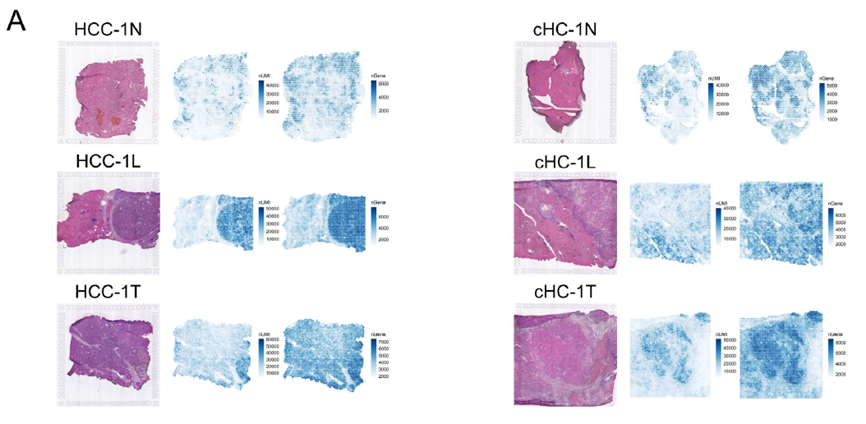
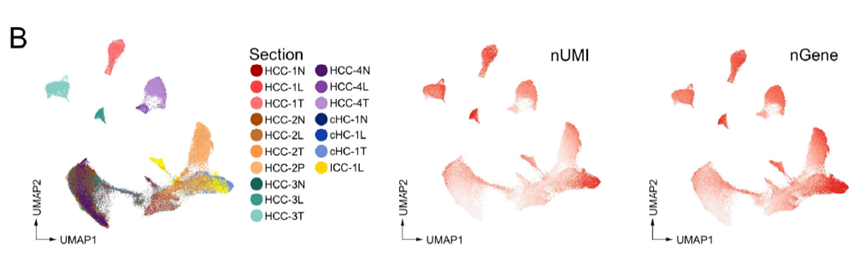
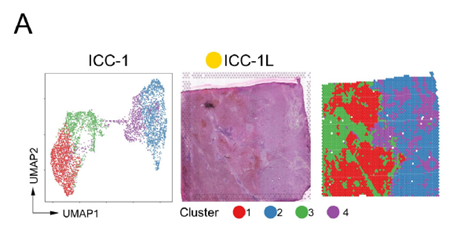
接下来就是常规的对于测序数据进行UMAP分析鉴定亚群,并对ICC-1癌症中的亚群进行相关性分析。
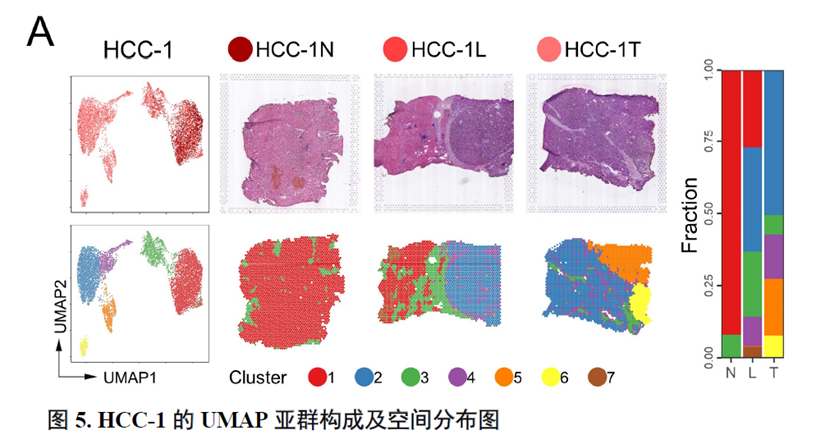
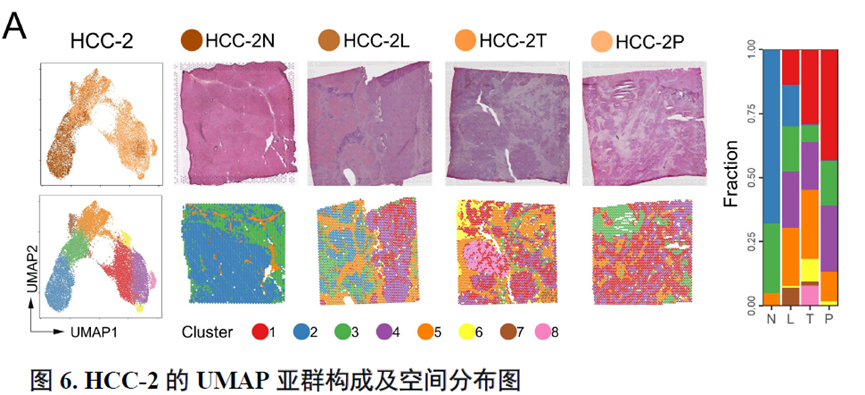
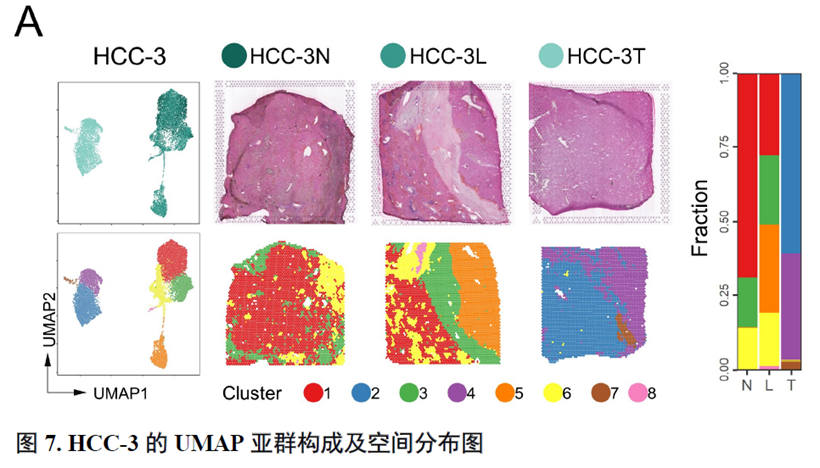
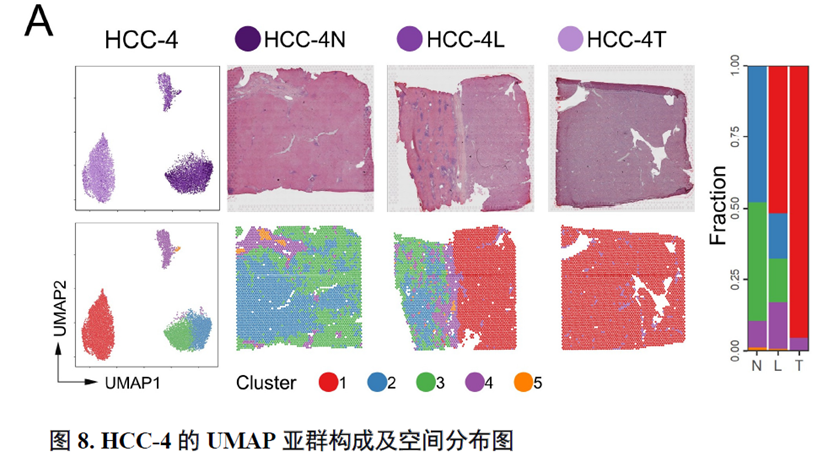
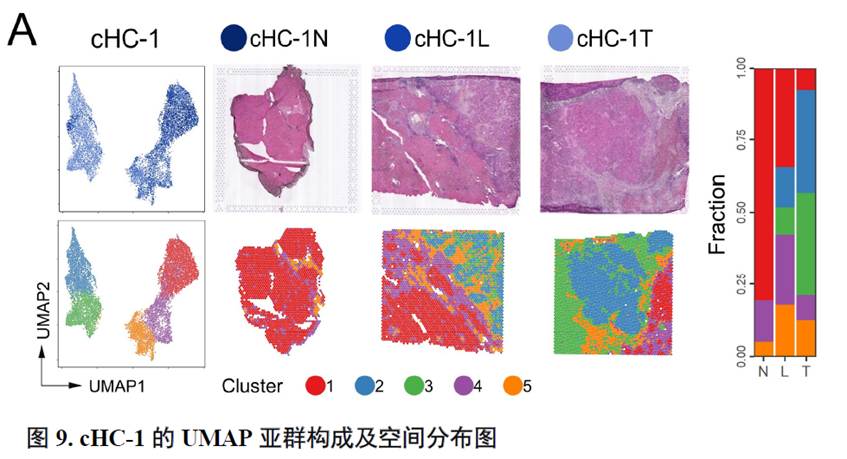
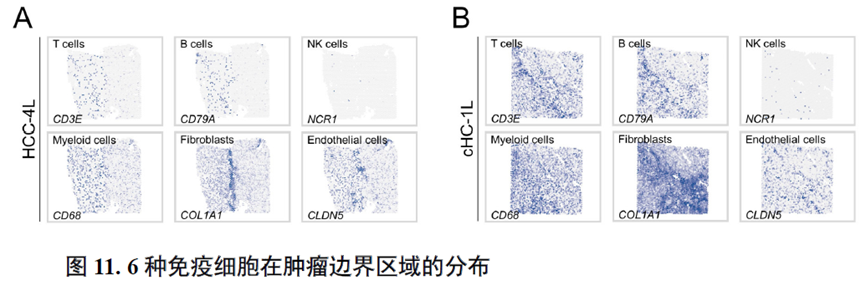
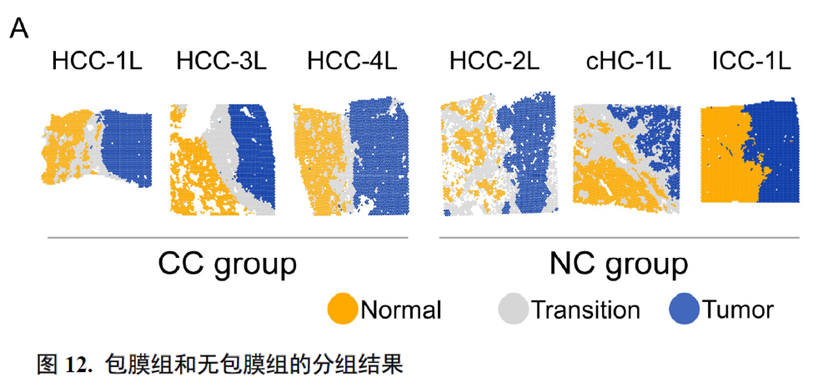
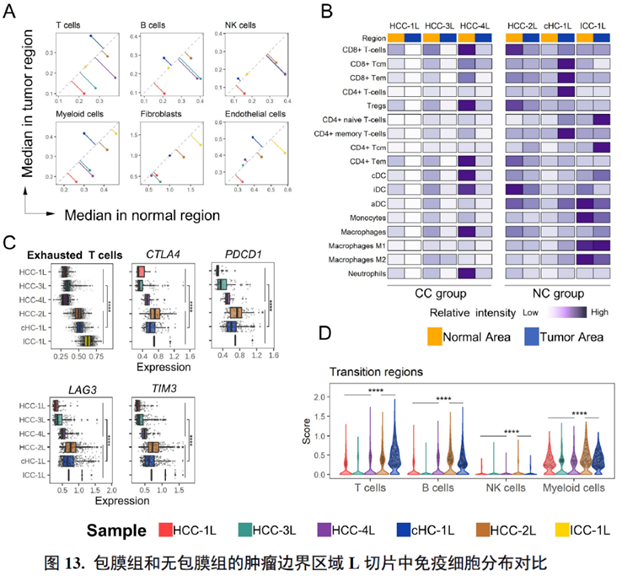
这里,作者探究了原发性肝癌边界区域的免疫微环境和实质细胞功能的空间异质性特点。首先肿瘤纤维包膜的存在与两侧的免疫细胞分布相关,以纤维包膜存在与否分为两组并进行免疫微环境分析,分别展示了免疫细胞比例及相关基因表达水平,随后分析了肿瘤实质细胞的分布位置及肿瘤相关信号通路变化趋势。
接下来,作者使用GSVA分析进行了各个肿瘤内部亚群的功能分析,并选择区域性最为明显的HCC-1T进行肿瘤内部亚群之间的差异分析,同时通过TCGA和HCCDB数据库进行肿瘤内部亚群的预后分析;通过CellPhoneDB进行配体受体表达水平分析,作者发现不同亚群间会进行细胞通讯。比较不同亚群的拷贝数变异(Copy number variations,CNV),发现它们可能来自同一个克隆。
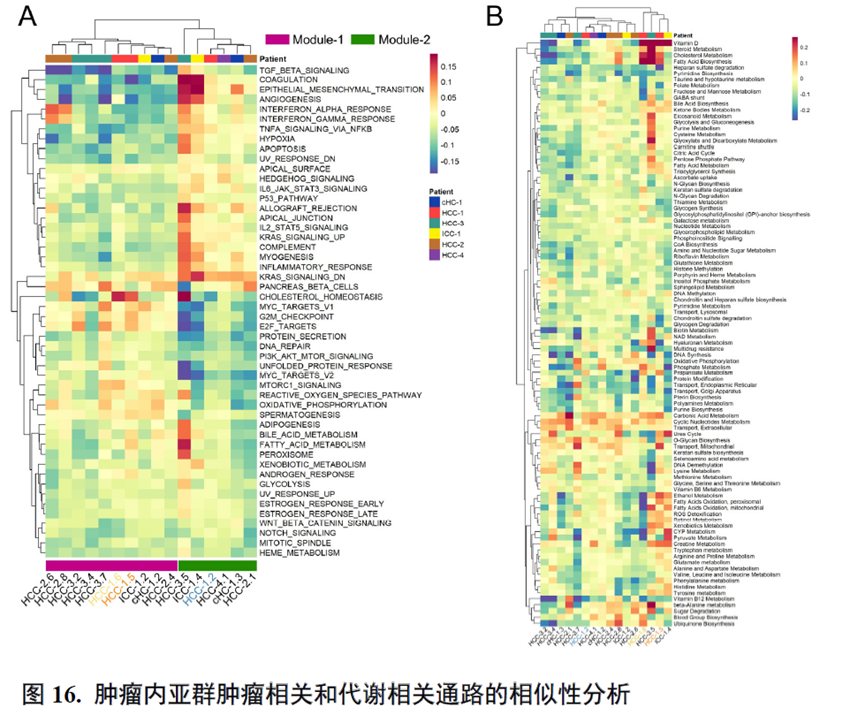
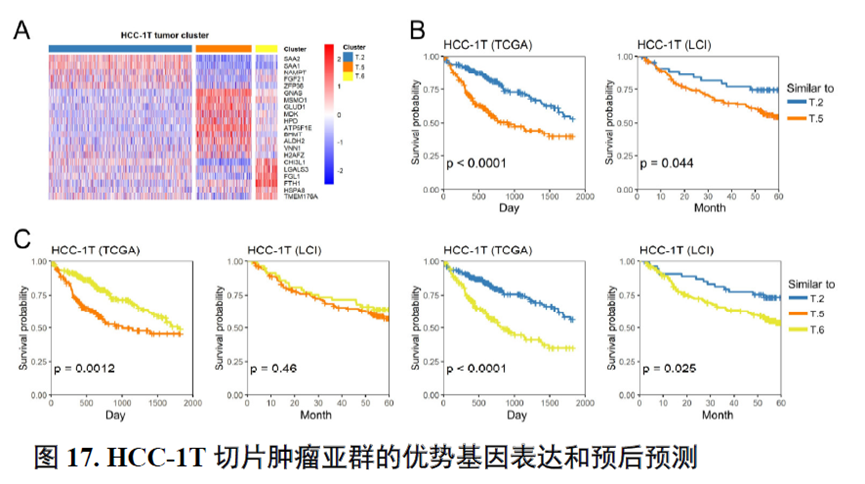
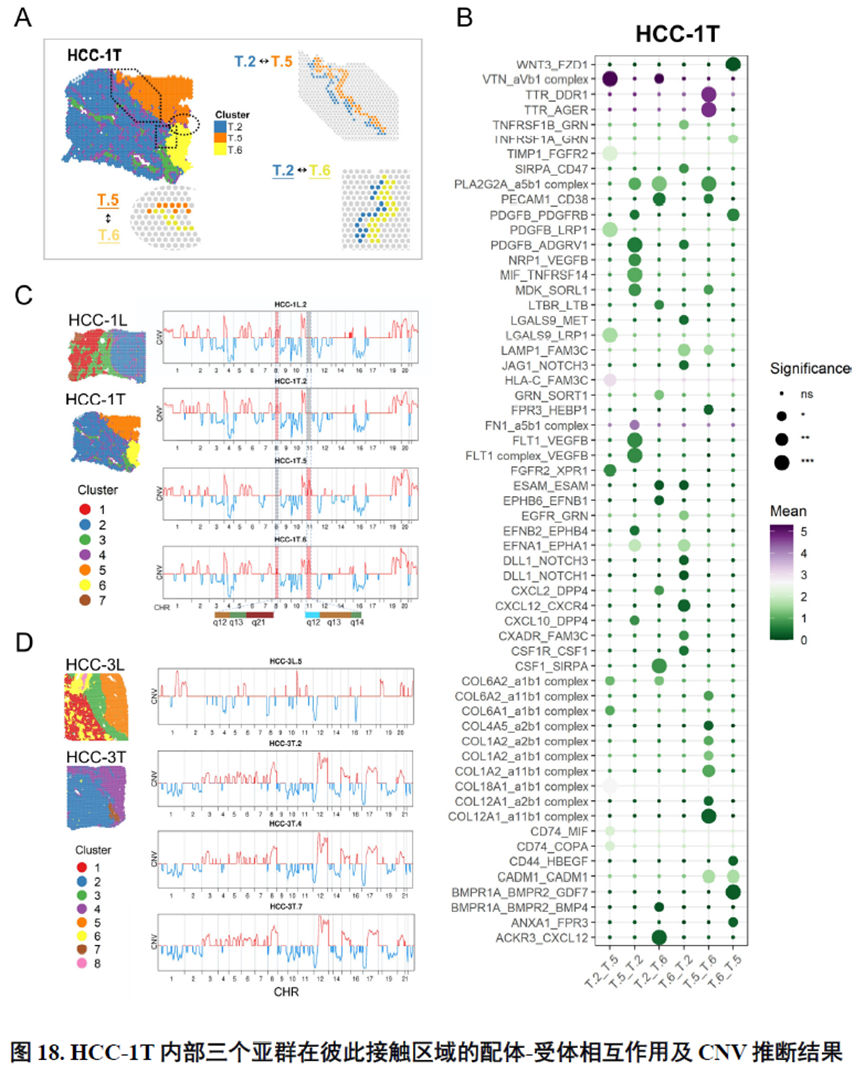
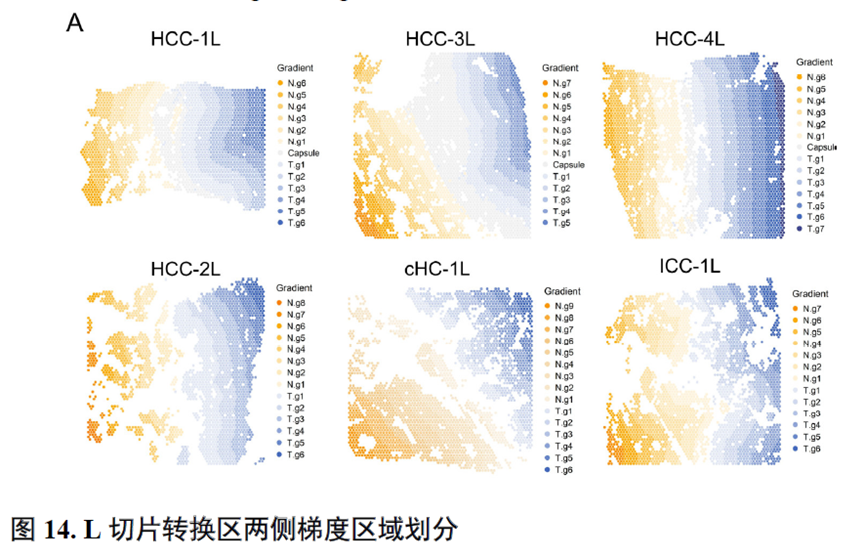
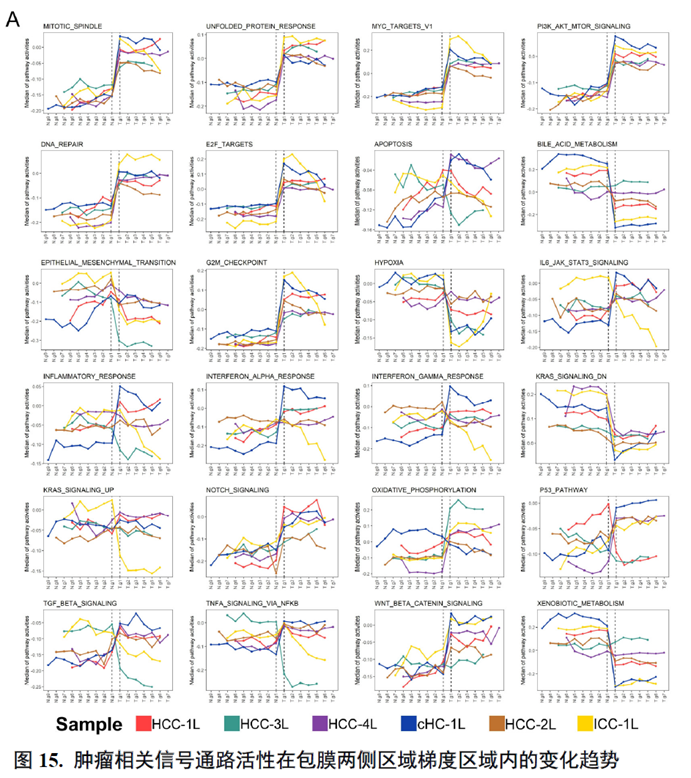
以上数据展现了原发性肝癌边界和内部位置不同亚群的空间特征,进一步作者进行了一例完整肿瘤平面的空间异质性分析,主要通过亚群鉴定,基因表达,肿瘤相关通路活性及梯度变化进行展示。
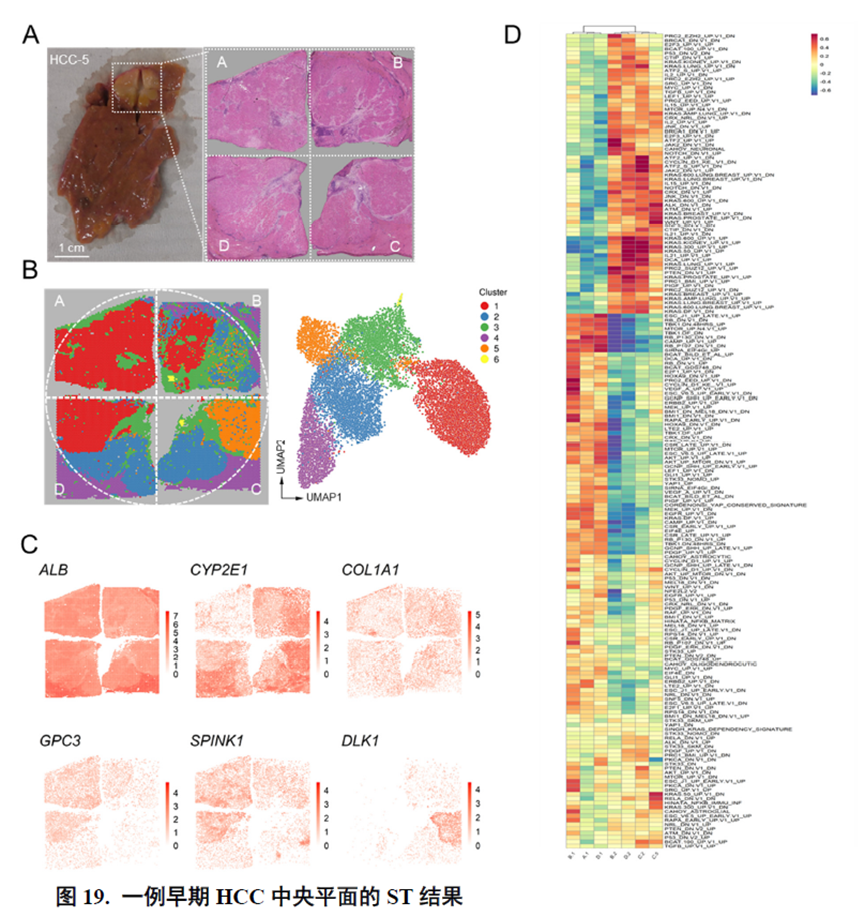
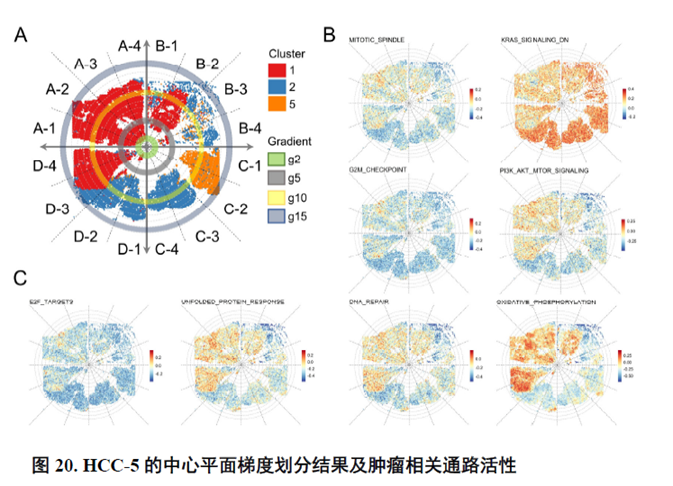
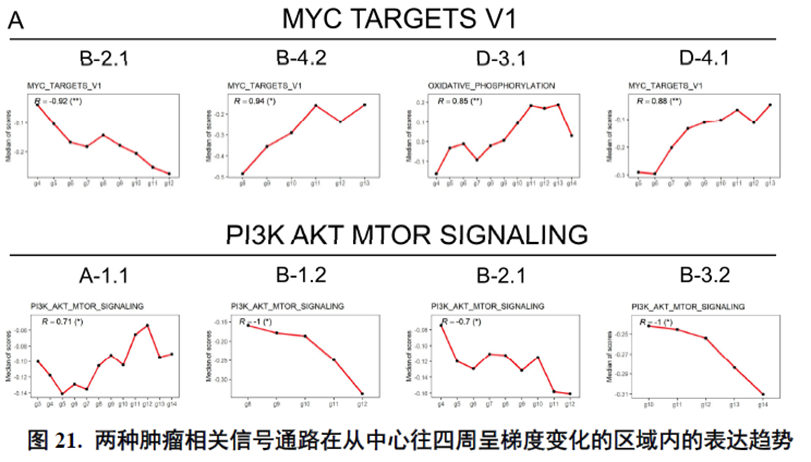
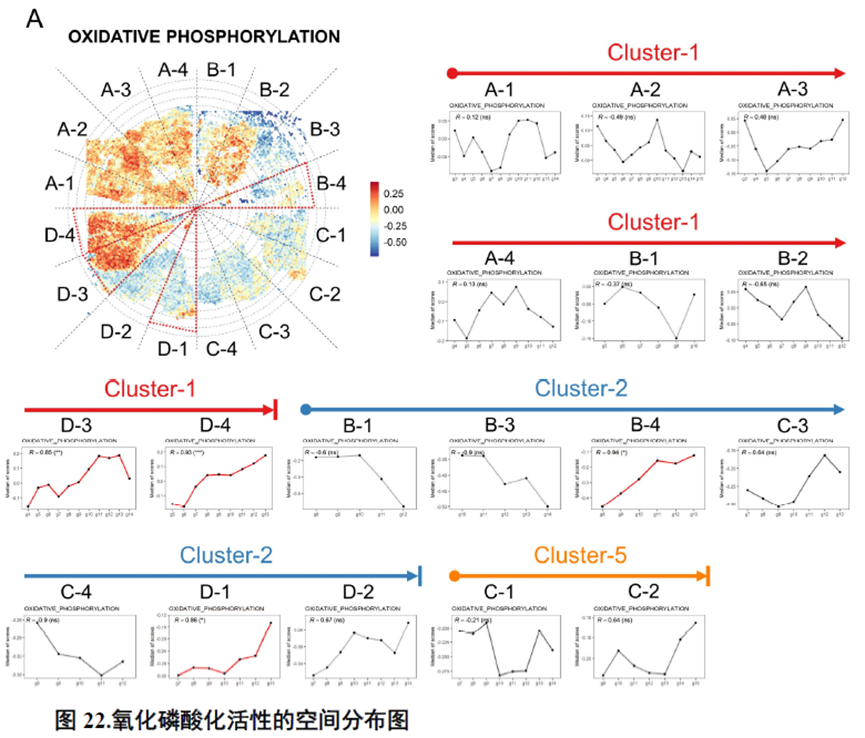
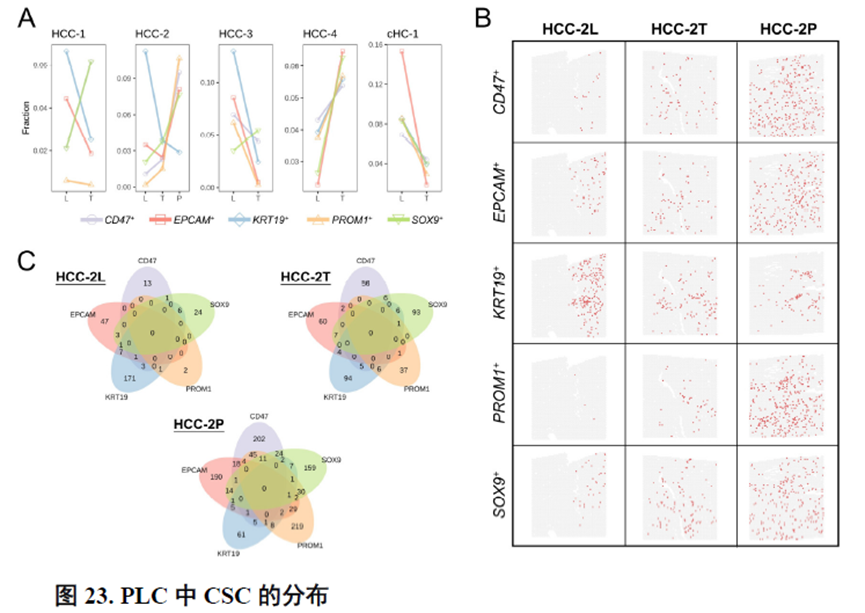
进一步,通过肿瘤干细胞(Cancer stem cell,CSC),一类可以引起肿瘤内部异质性的细胞,检测其标志物在不同切片中的分布特点,发现CD47+和PROM1+的CSC在HCC中的高度富集与肿瘤的侵袭和迁徙增加相关。
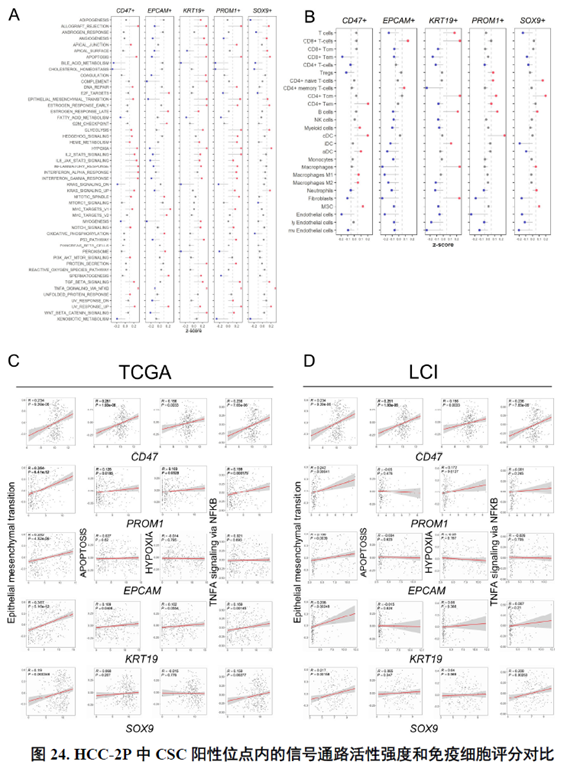
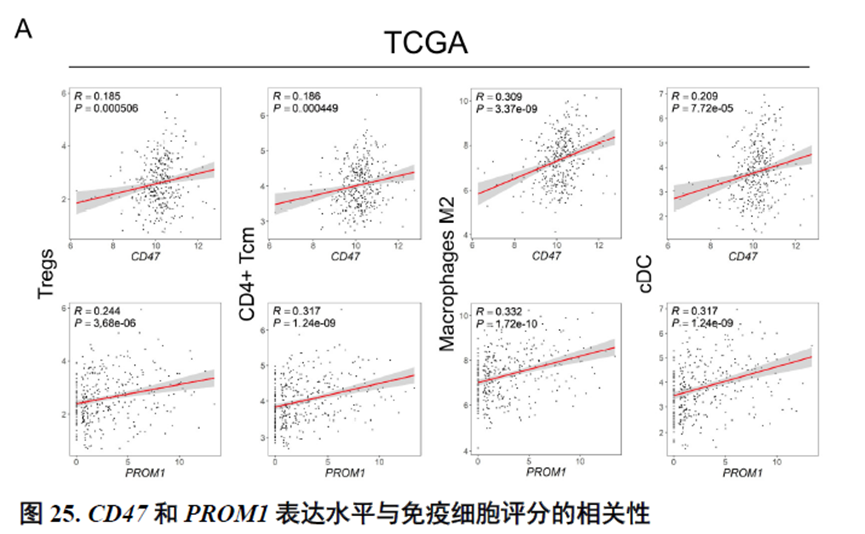
最后,作者通过HCC-5转录组数据中显示的极其微小不同于周围组织的非肿瘤实质细胞亚群鉴定出了三级淋巴结构(TLS)分布及其内部免疫细胞亚群分析,同时发现TLS的评分与肿瘤大小、分期和预后存在相关性,为在临床中评估患者预后提供了新的指标。
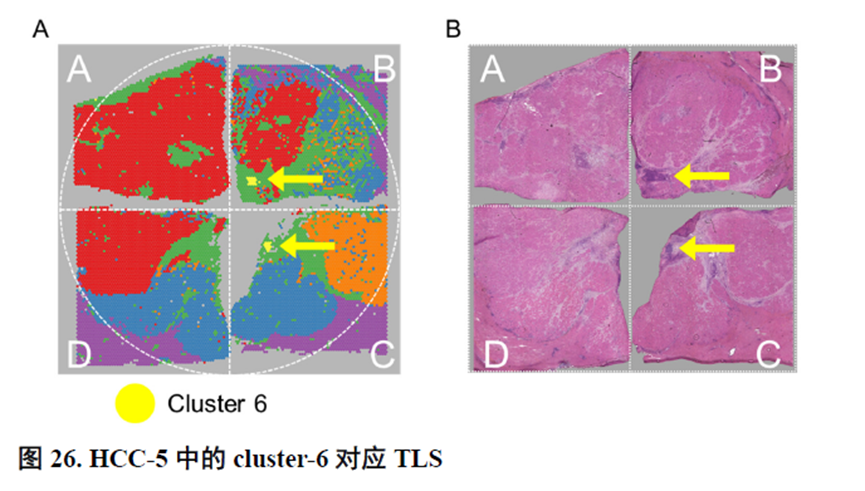
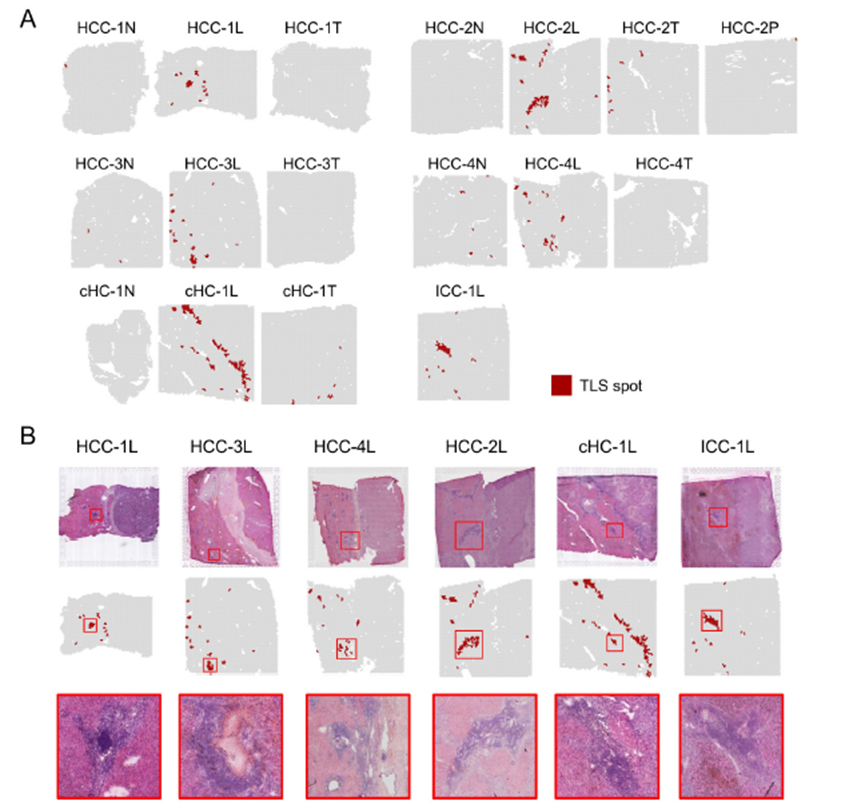
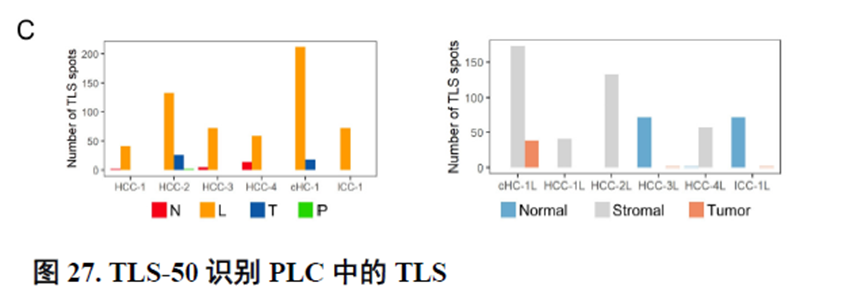
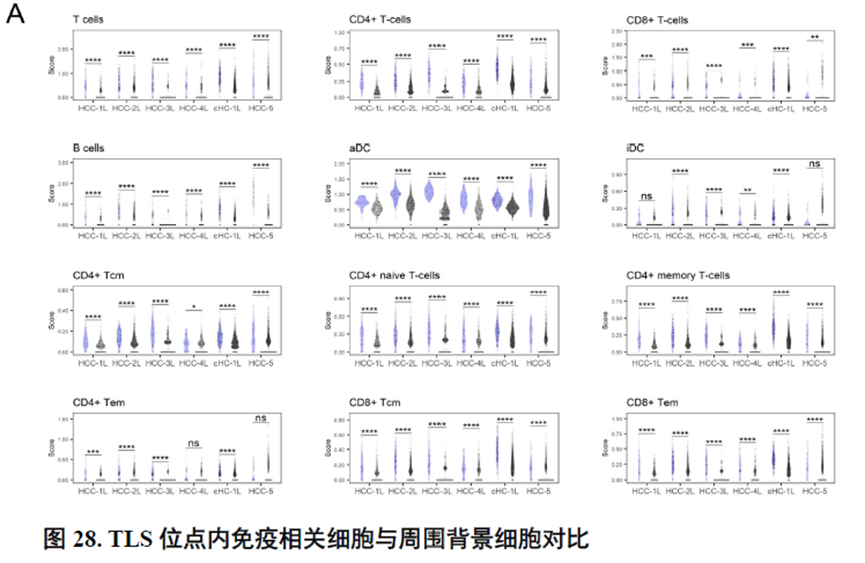
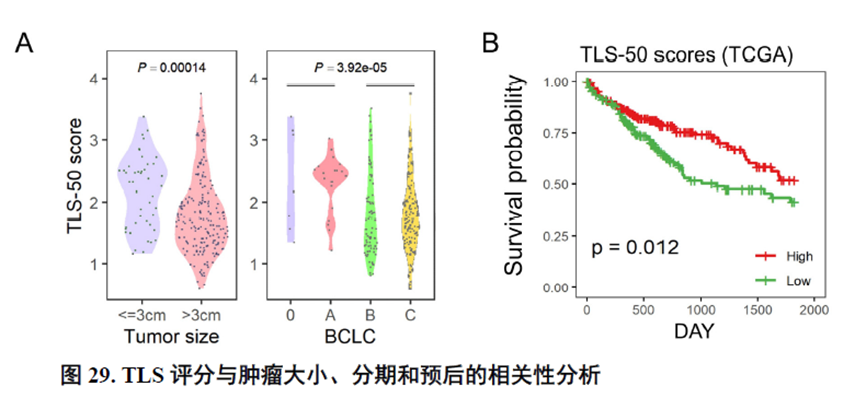
这篇博士论文通篇是对肿瘤的空间转录组学分析,并没有进行实验验证,不过在结尾处进行了疾病相关三级淋巴结构的鉴定,具有一定的临床意义,可能也是能够发14分的主要原因。
第二篇
这篇是来自吉林大学的名为“利用时空多组学解析肝脏功能结构及肝再生、肝纤维化分子机制的研究”的文章【2】,这位博士于2023年6月毕业,毕业论文被下载903次,全长167页,掐头去尾(去除目录、声明、致谢等内容)共143页内容。作者的专业为基础兽医学,在pubmed搜索作者名字,发现他与华大基因合作共一的文章发表在《naturegenetics》上,这个杂志今年的影响因子是30.8,也是让人非常羡慕了,让我们一起来看看什么样的数据能够发出这么高分的文章。
全文重点关注了肝脏中的组织结构和细胞异质性,文中提到的肝脏细胞分区,代谢,增殖,再生及纤维化的背景和空间转录组学进展我就不一一赘述了,感兴趣的同学可以去看看原文,直接来看我们最关注的,转录组学数据的测序和分析。
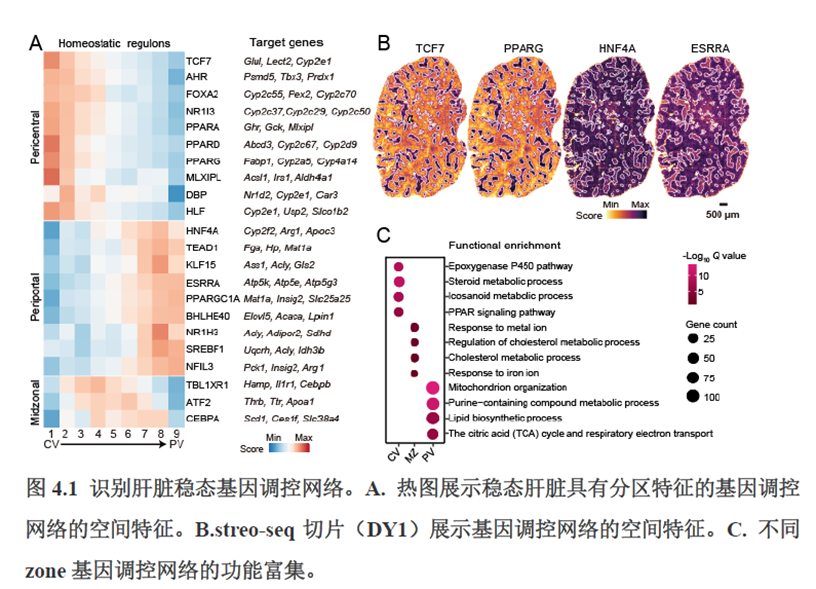
首先作者选择了C57BL/6小鼠进行肝脏稳态下的单细胞和空间转录组学测序,对于文库结构及建库流程,论文中都描写的很具体,技术主要是华大自主研发的高分辨的时空组学技术(Stereo-seq)和高通量单细胞转录组测序技术DNBelab C。两种测序技术联合分析确定细胞亚群,通过标志基因确定肝脏分区同时还展示了肝脏细胞的空间分布特征及分区基因。
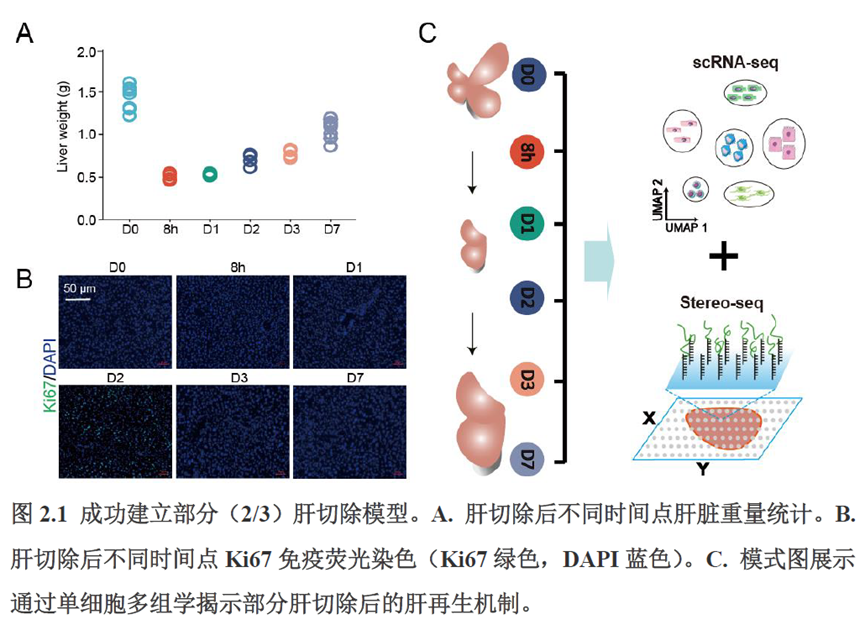
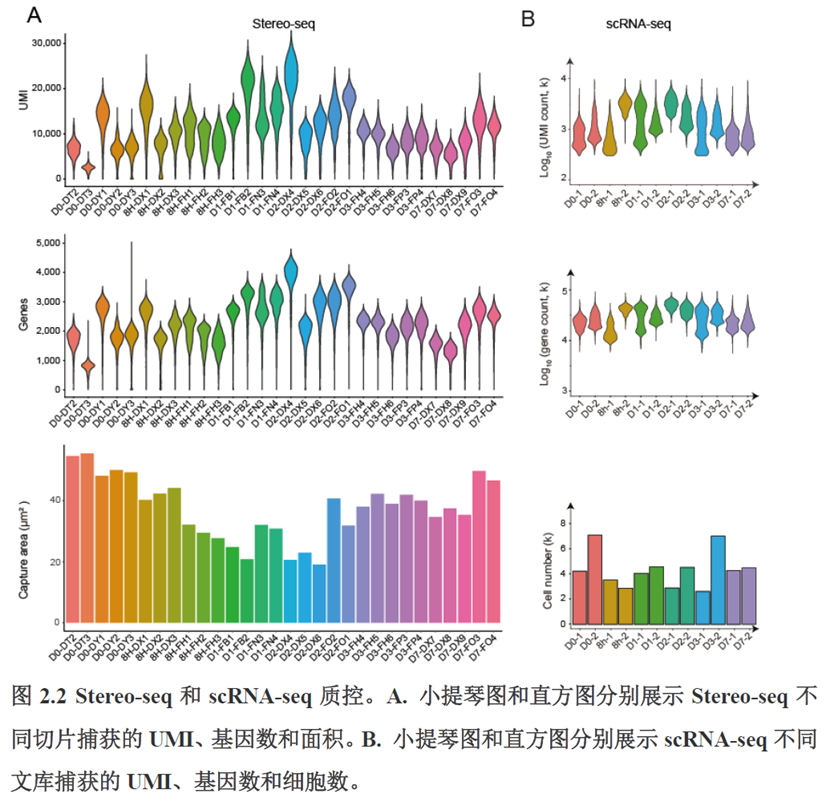
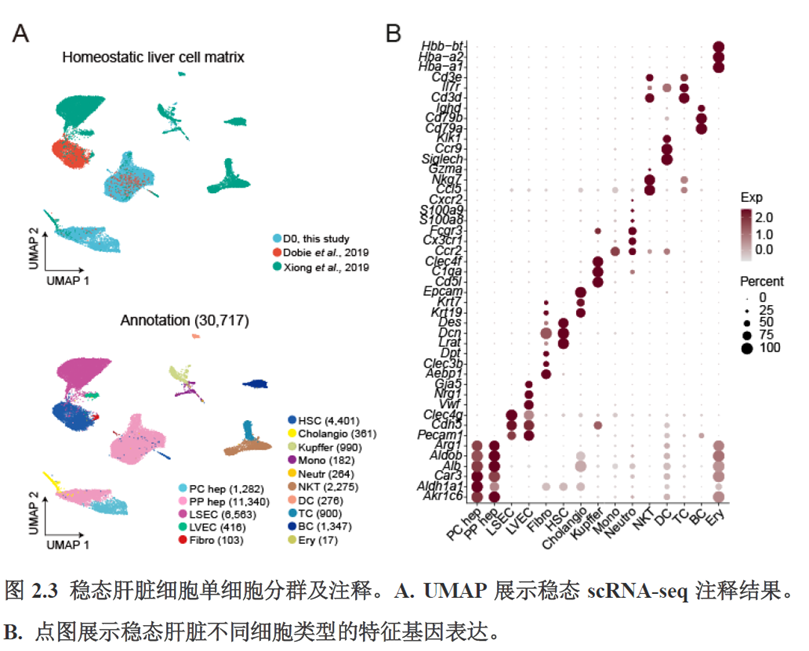
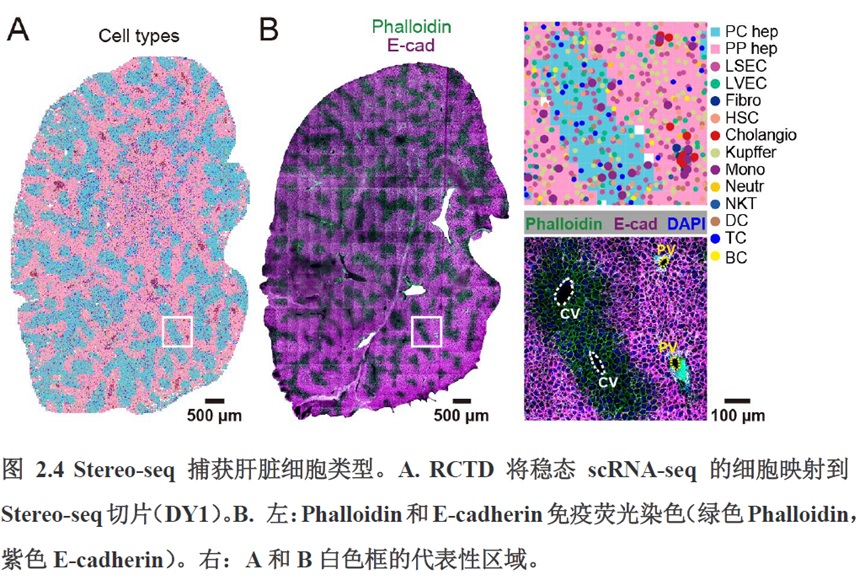
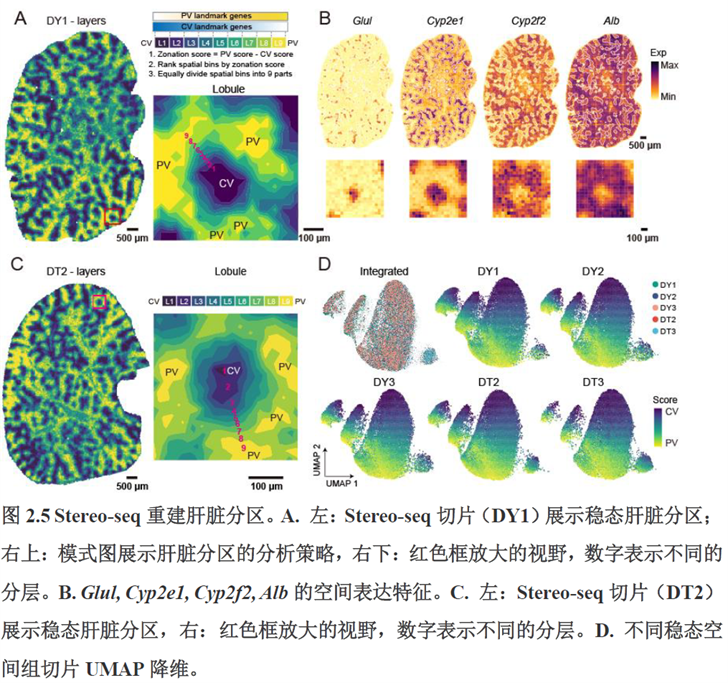
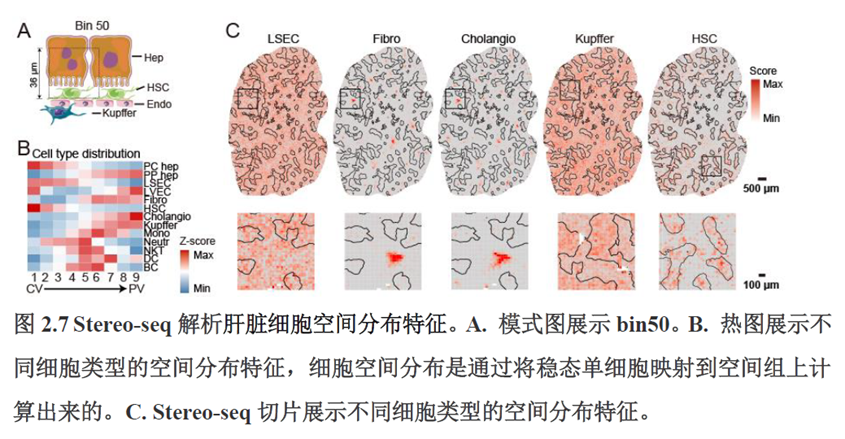
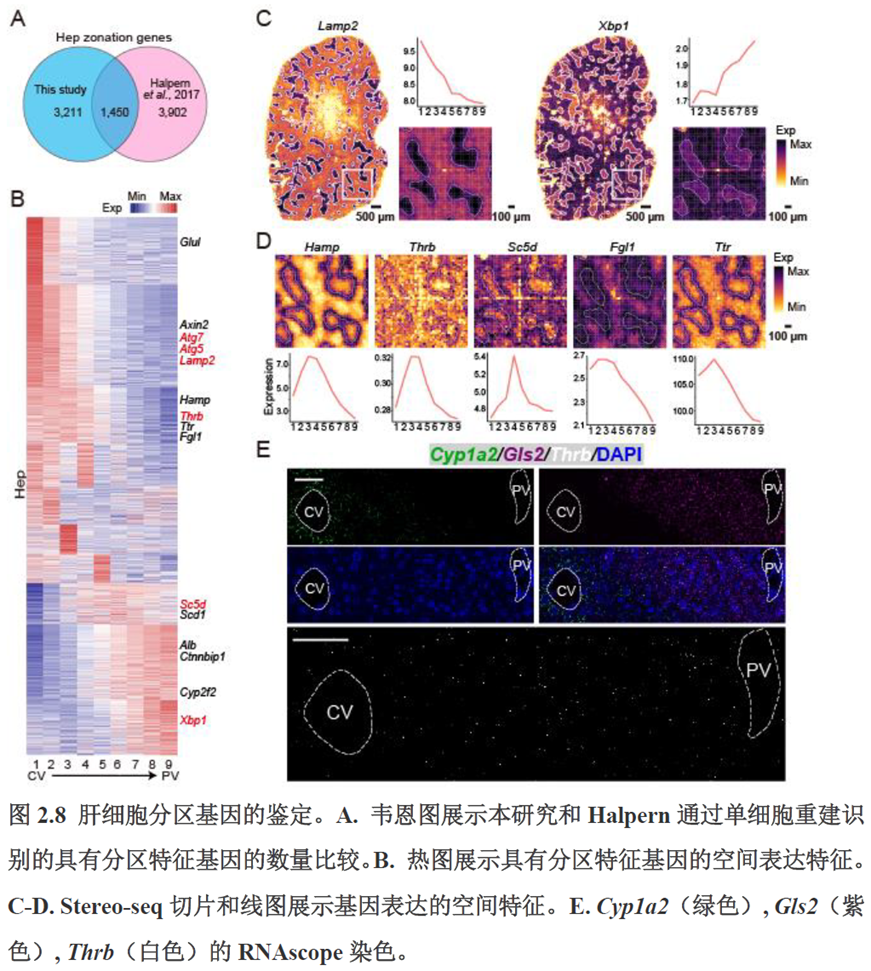
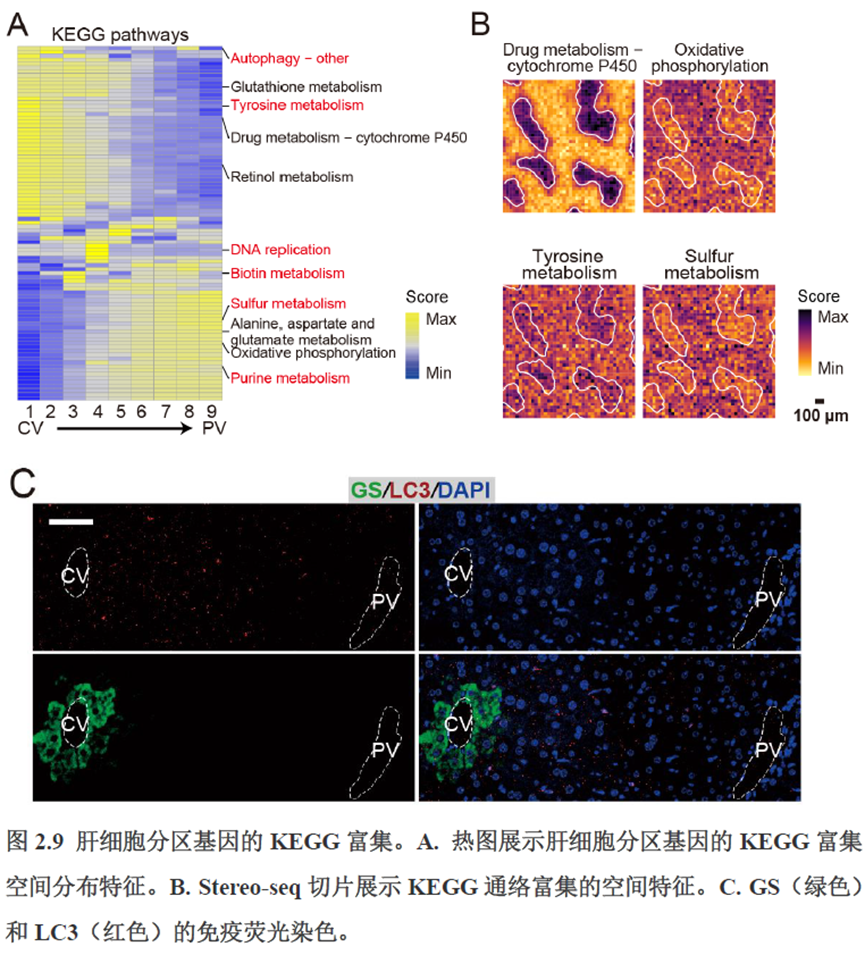
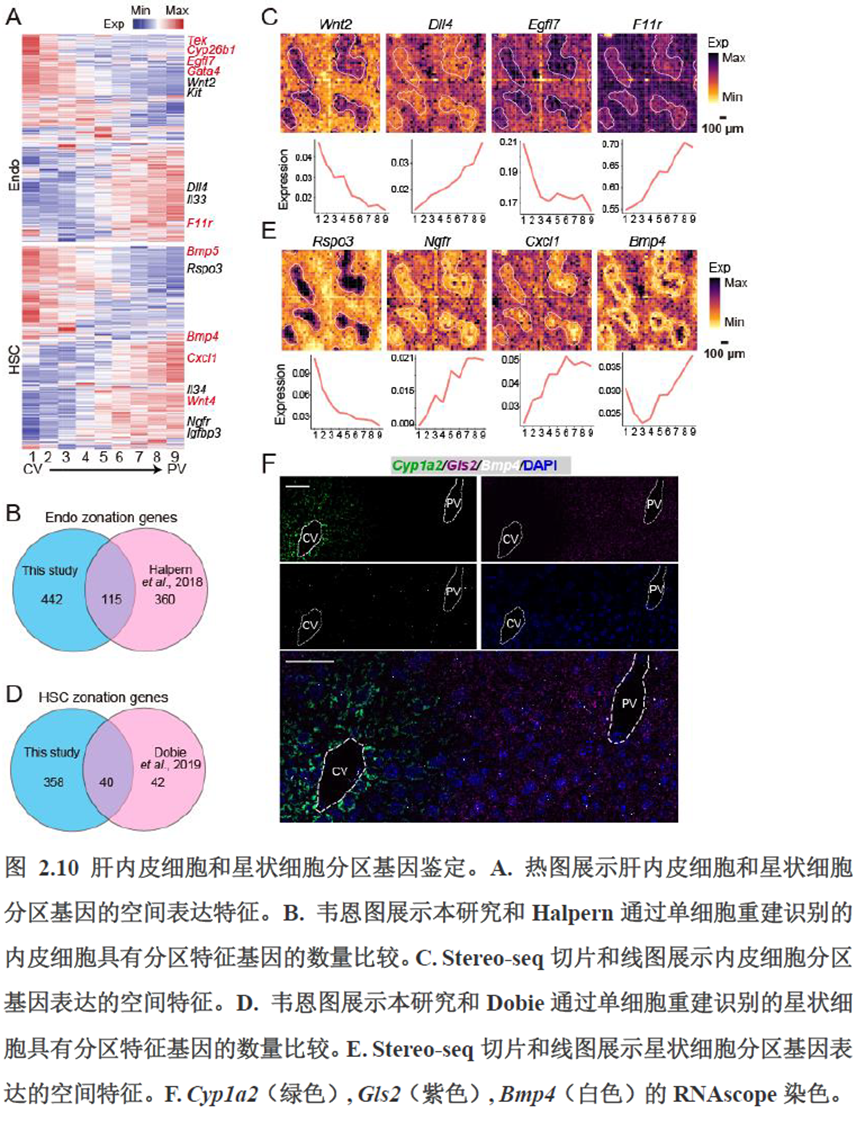
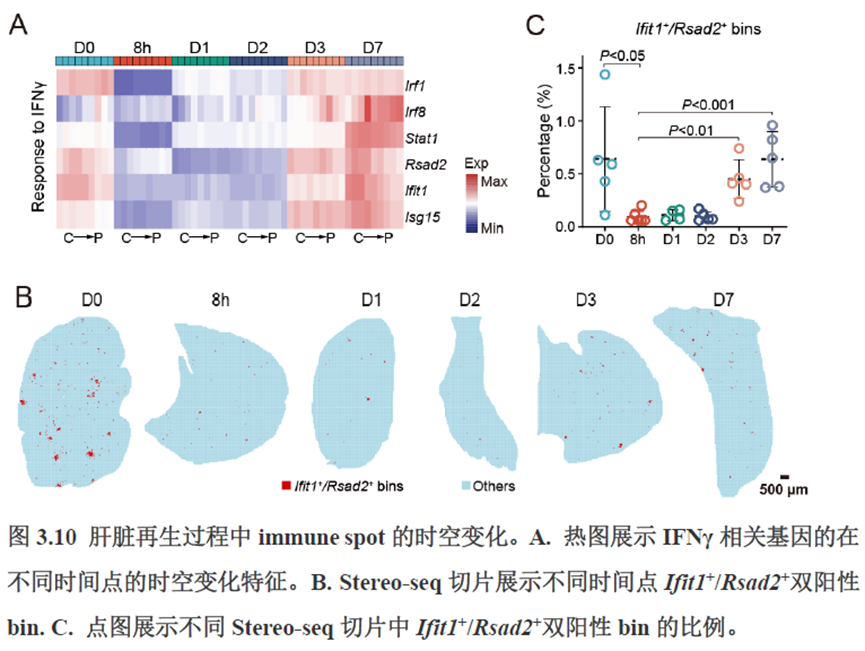
除此之外,作者还发现了肝脏中存在约50~200 μm大小的解剖微结构“immune spot”,对其进行定位并解析了其中的免疫细胞类型组成,发现主要由T细胞和单核细胞组成。
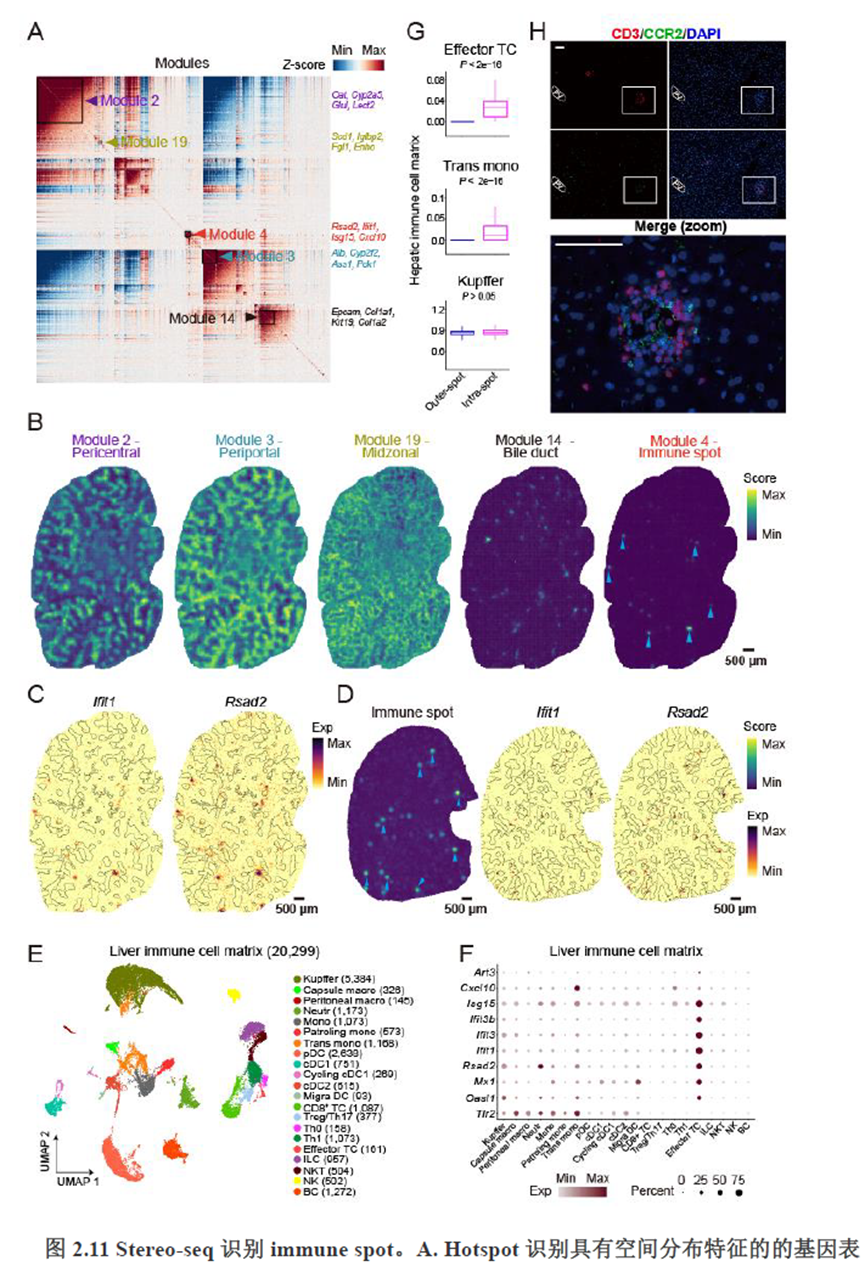
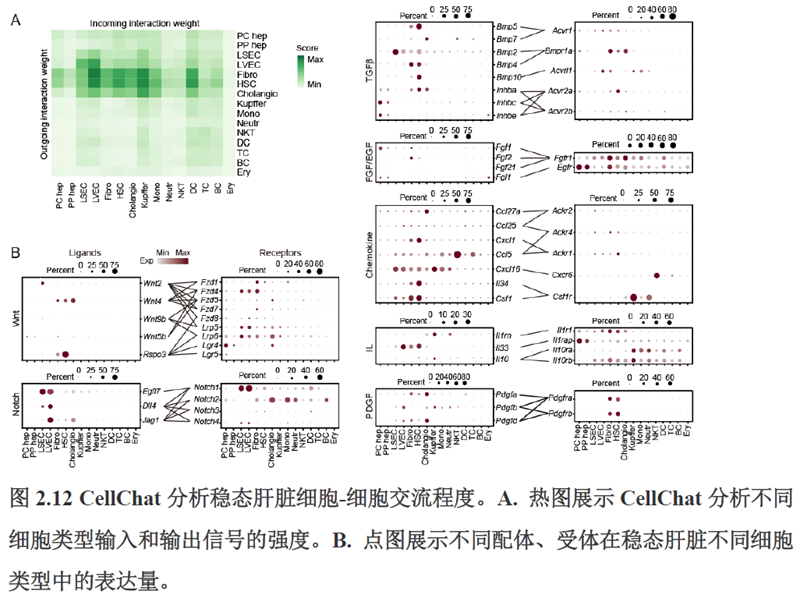
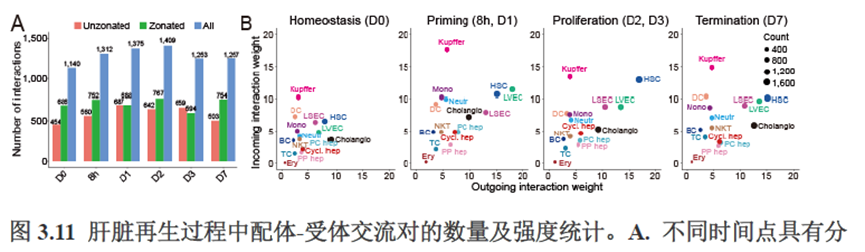
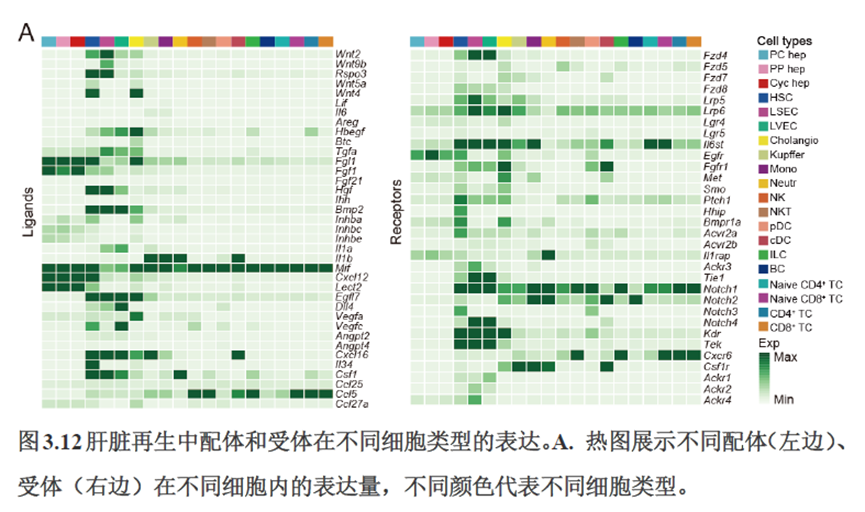
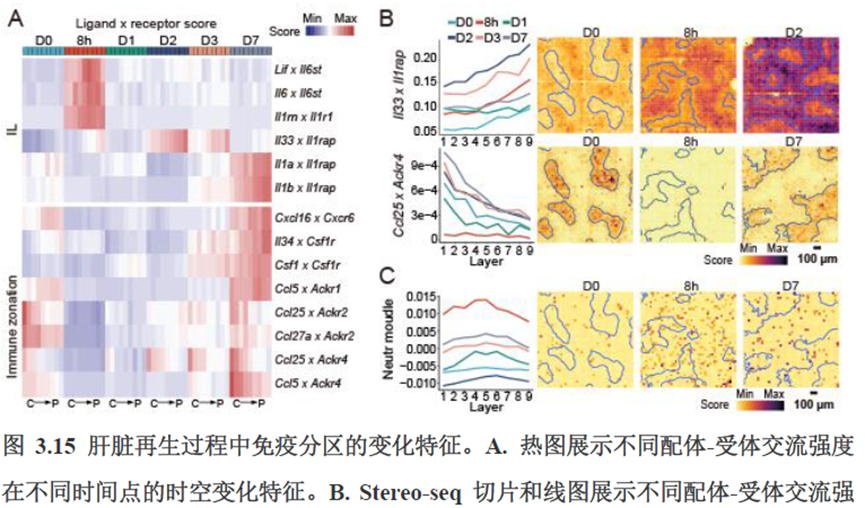
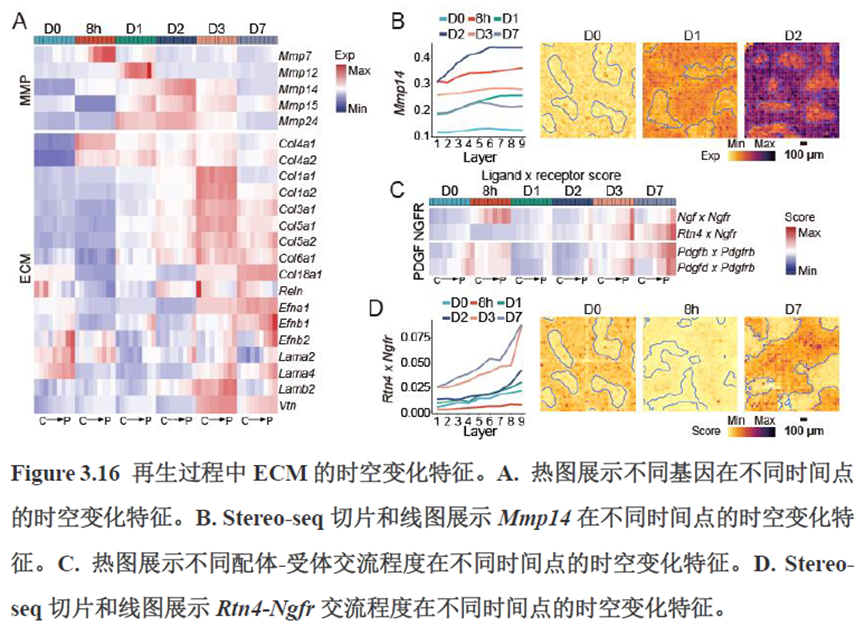
接下来,作者根据CellTalkDB数据库里已知的配体-受体对通过CellChat分析肝脏细胞之间的交流程度,还确定了信号通路相互作用,免疫分区和胞外细胞基质的空间分布特征。
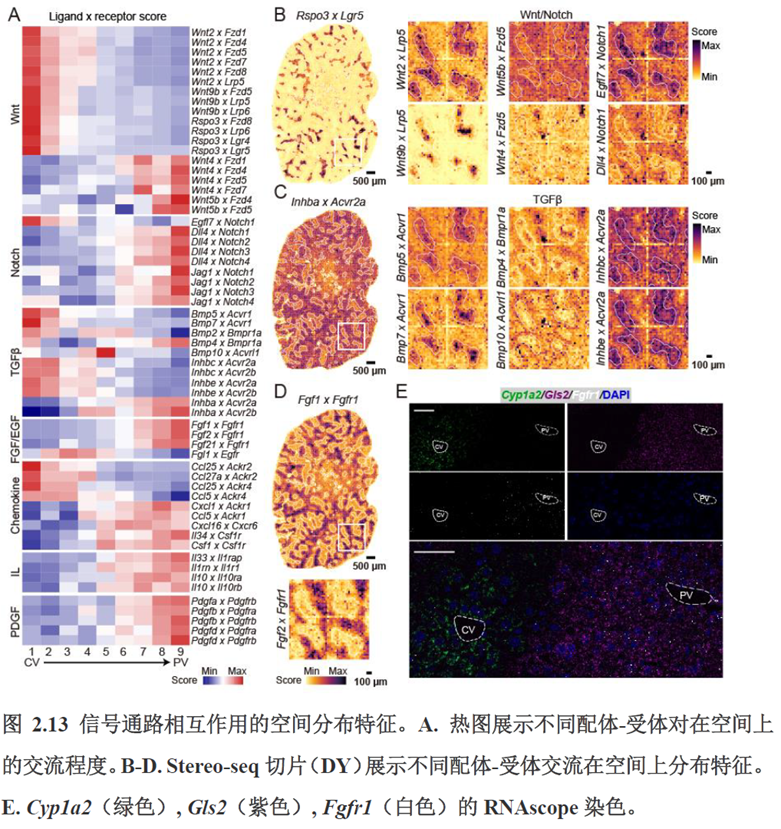
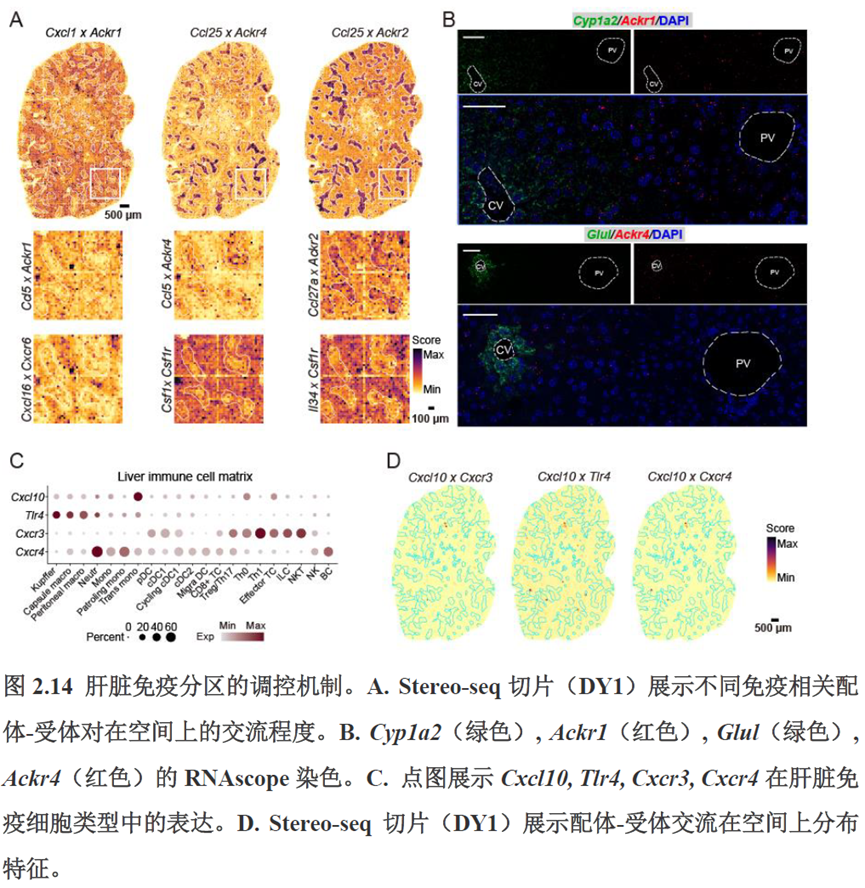
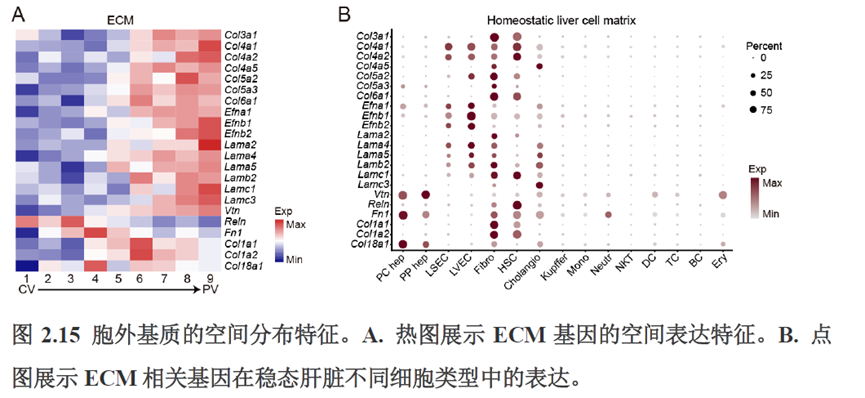
第三章中作者进一步进行了小鼠肝切除后再生的时空多组学图谱,方法中写到数据分析步骤是先提取再生scRNA-seq 数据中平均标准化表达>0.001 的基因,再通过肝再生不同时间点的Stereo-seq 数据进行pseudo-bulk 分析,然后找到时间点的差异基因进行Z-score 转换,并通过mFuzz (V2.50.0)执行c-means 模糊聚类获得八个基因簇来展示肝脏再生过程中的变化情况。另外,当把干细胞”maker基因表达量映射到空间切片上发现表达这些基因的细胞对肝脏再生的贡献很低,此章节重点展示了肝再生过程中各个信号通路,应激反应,表观调控因子和immune spot的时空变化。
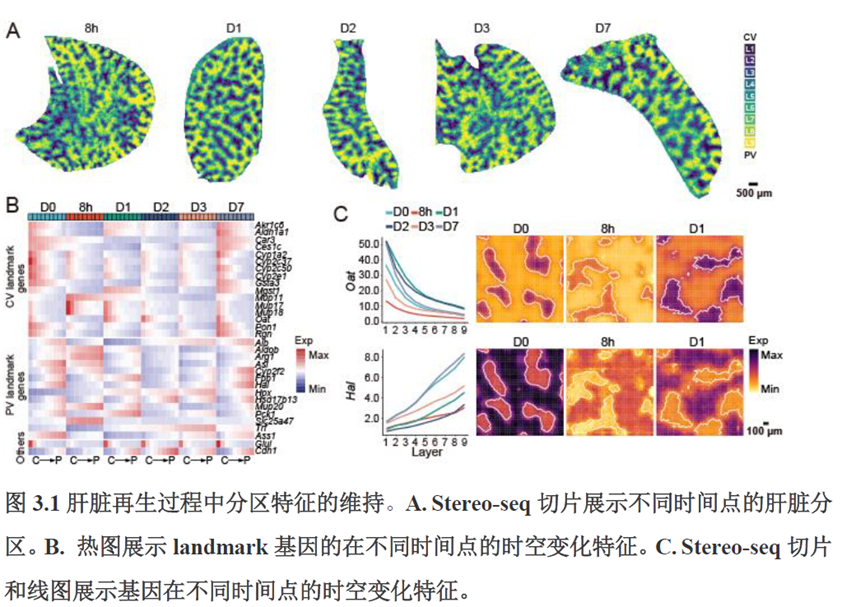
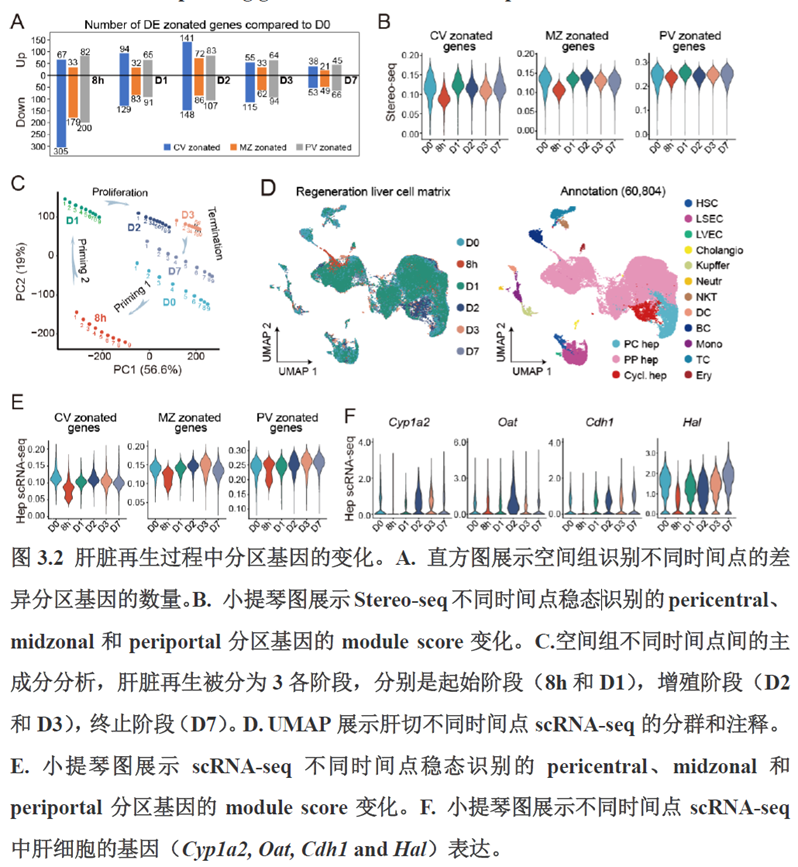
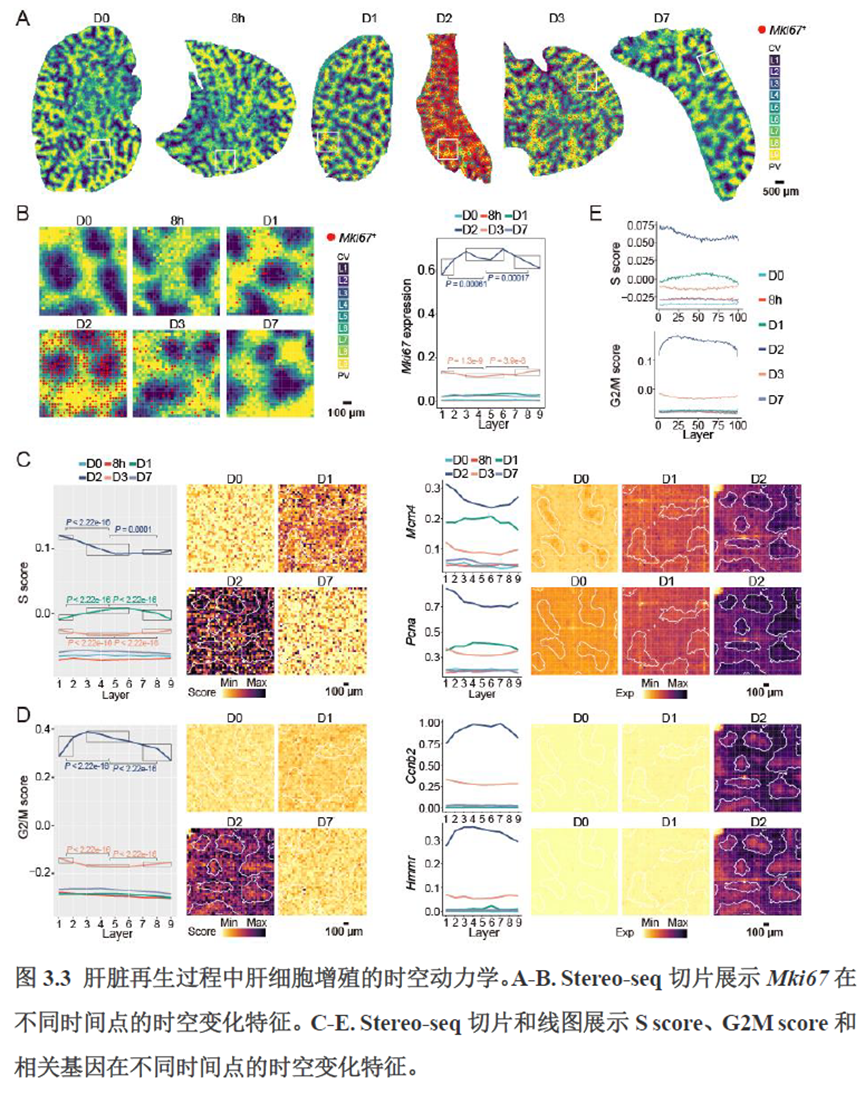

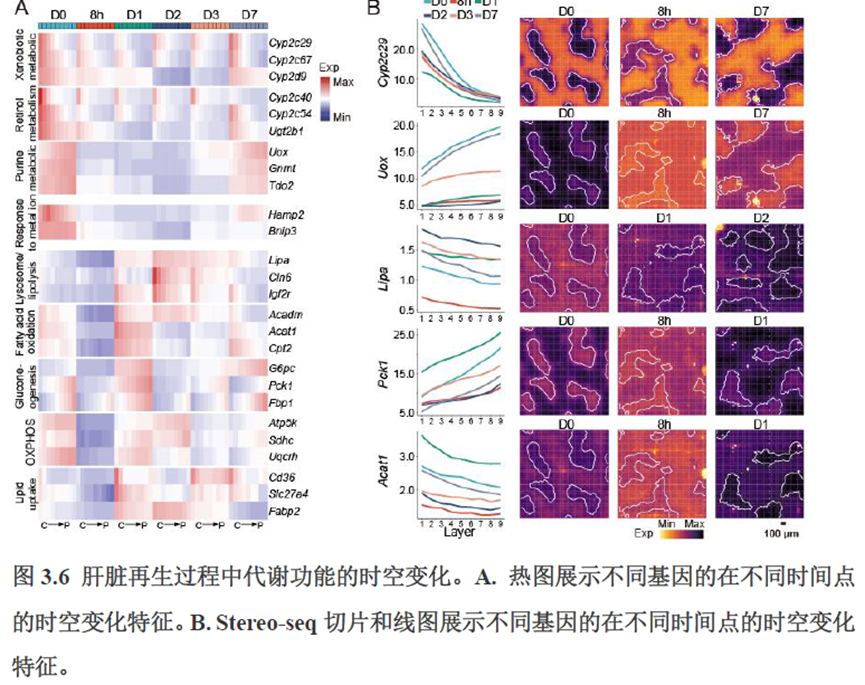
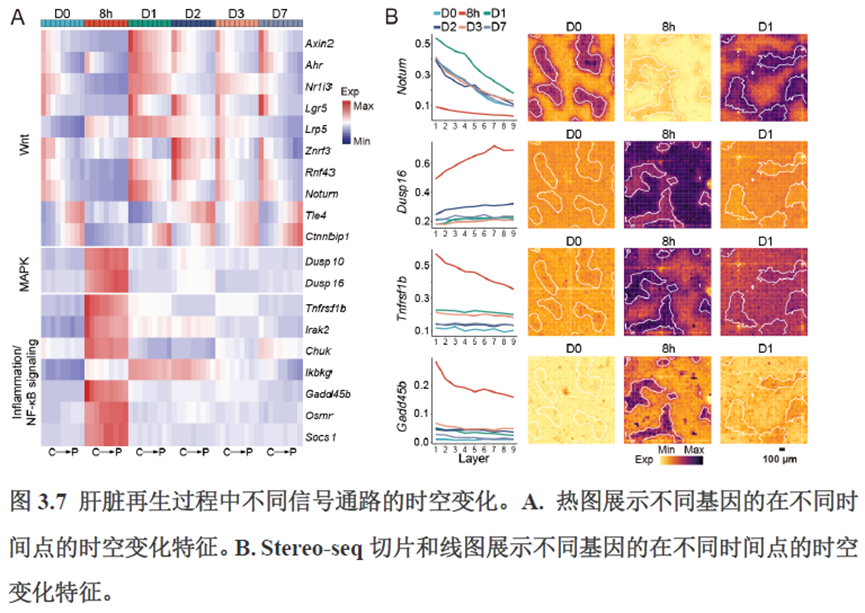
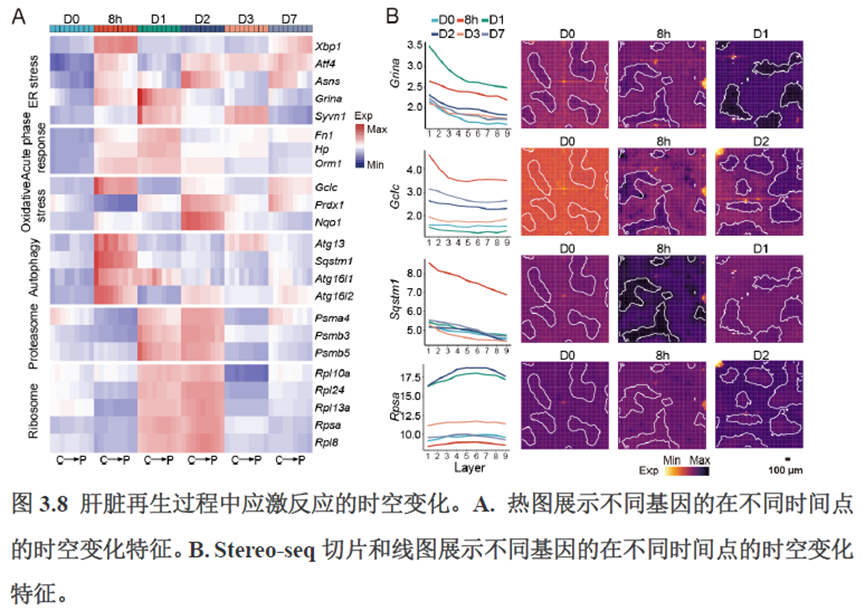
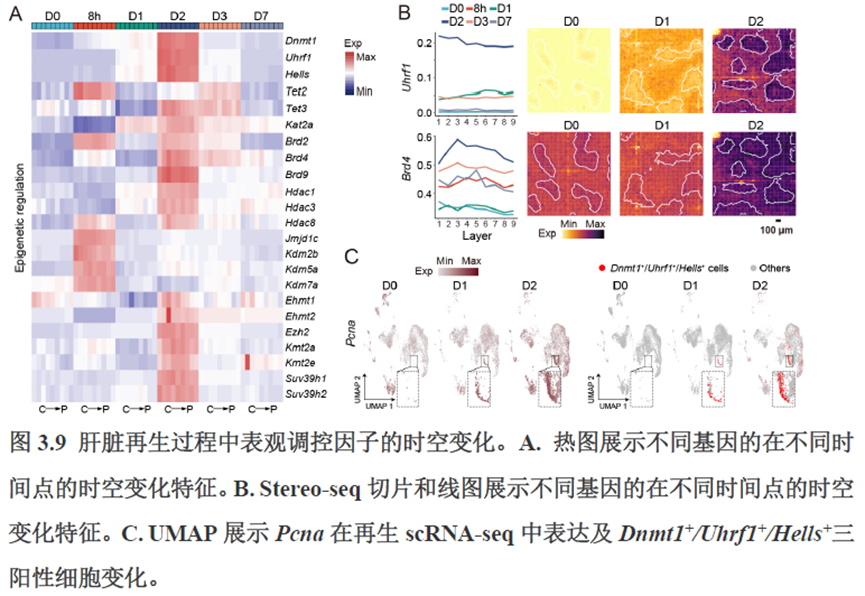
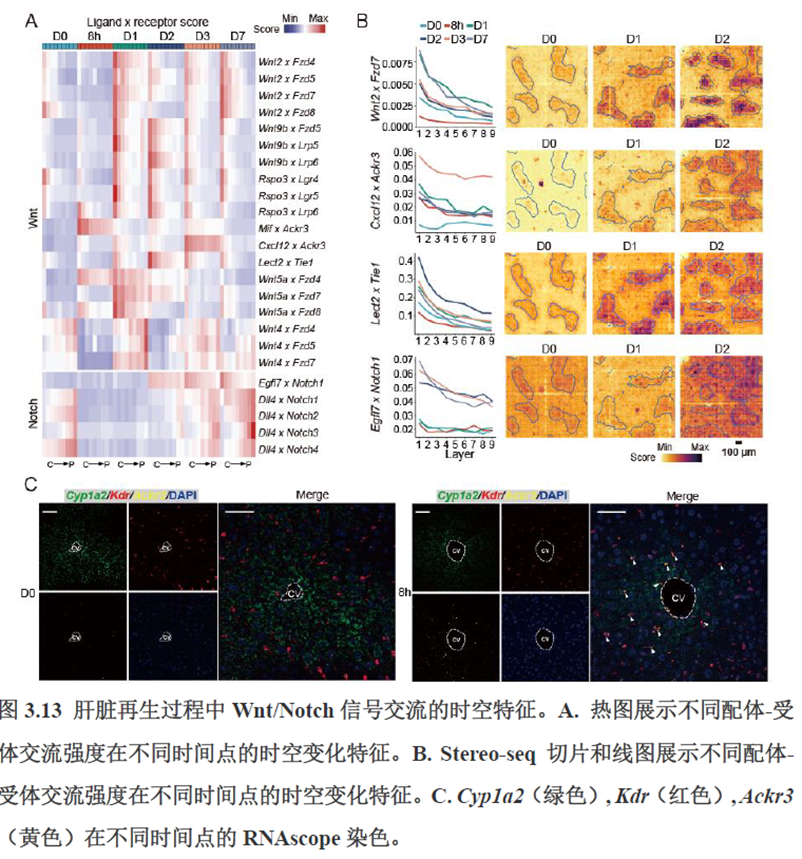
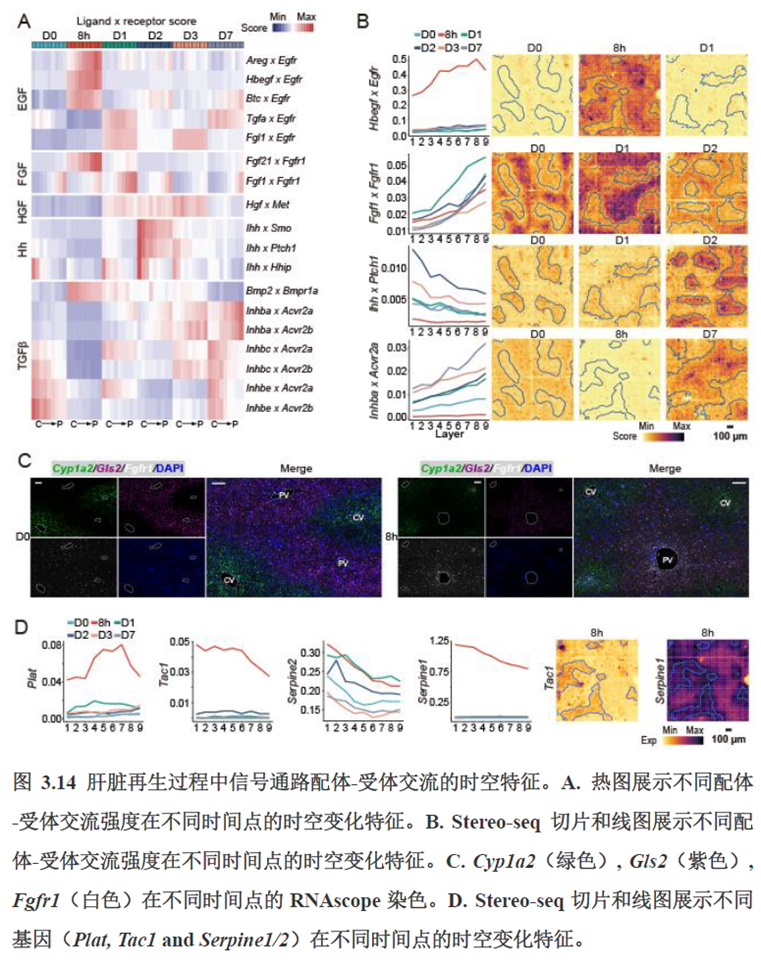
第四章通过SCENIC模型在空间水平对转录因子活性进行分析,展示空间基因调控的网络,作者鉴定了TBL1XR1可能是参与肝脏分区维持的重要转录因子,同时阐明了基因调控网络是如何在时间和空间上协调肝脏再生的。并经动物实验进行验证,通过AAV8介导肝细胞特异性敲降Tbl1xr1,发现敲降Tbl1xr1后显著降低了肝切除后肝细胞增殖水平,Bulk RNA-seq和Bulk ATAC-seq分析发现其可能通过抑制Wnt信号通路和脂肪酸氧化通路而影响肝再生。
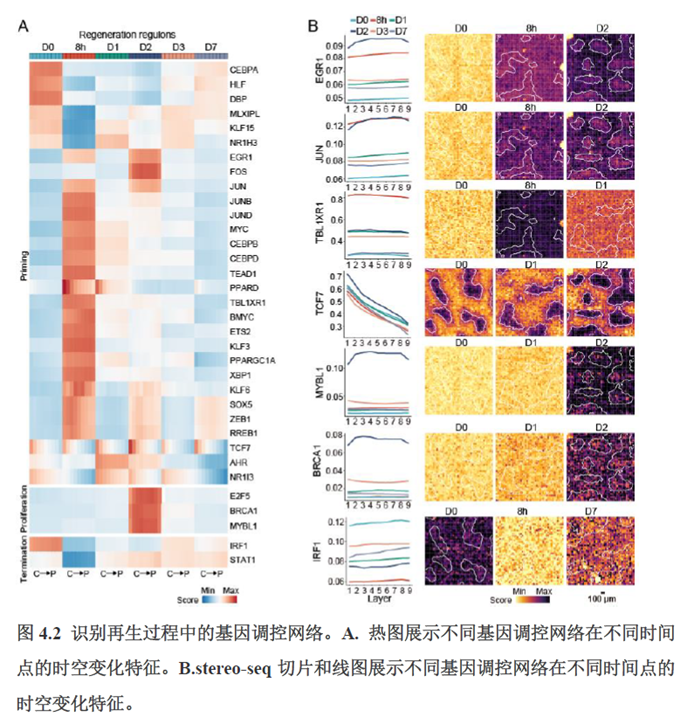
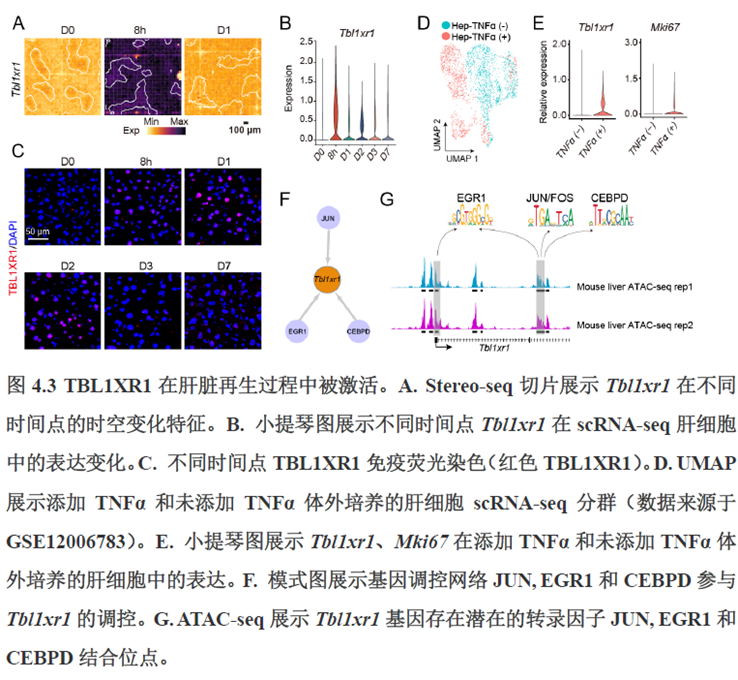
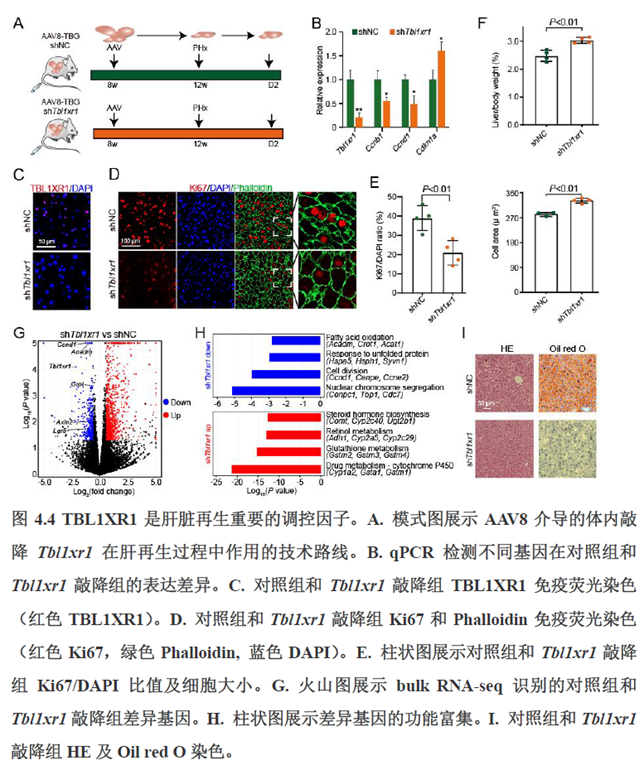
最后一章则是关注了肝脏的再生修复能力遭到破坏后,常会出现的肝脏纤维化病理现象,单细胞转录组学分析,进行细胞分群及注释,差异基因和功能富集分析,pseudotime分析和psupertime 分析,每个分析的工具包在方法部分都标注的很清楚。
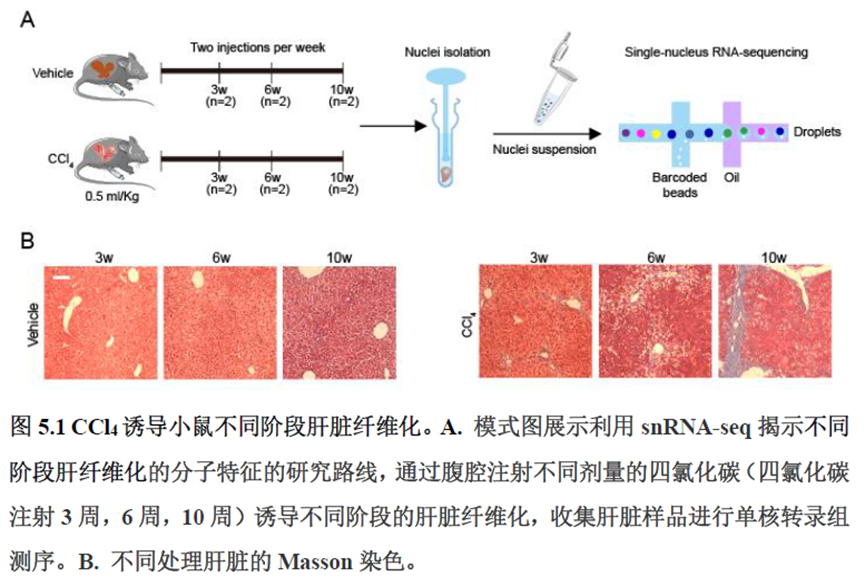
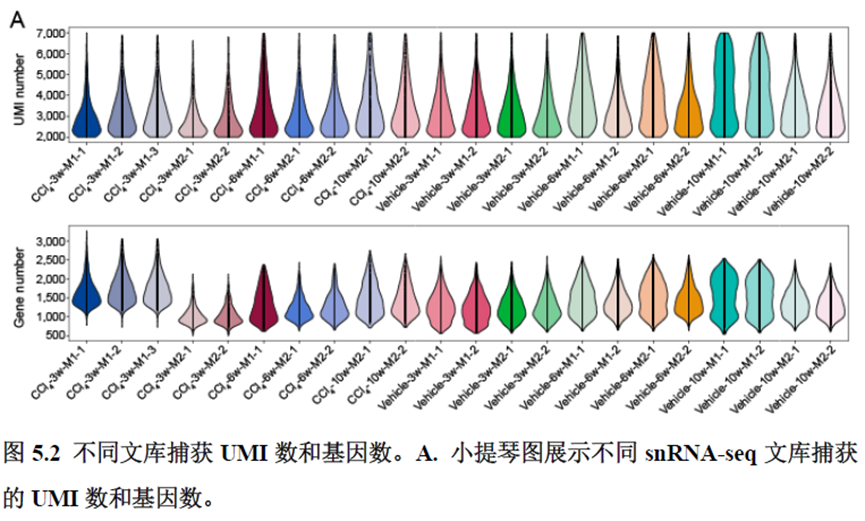
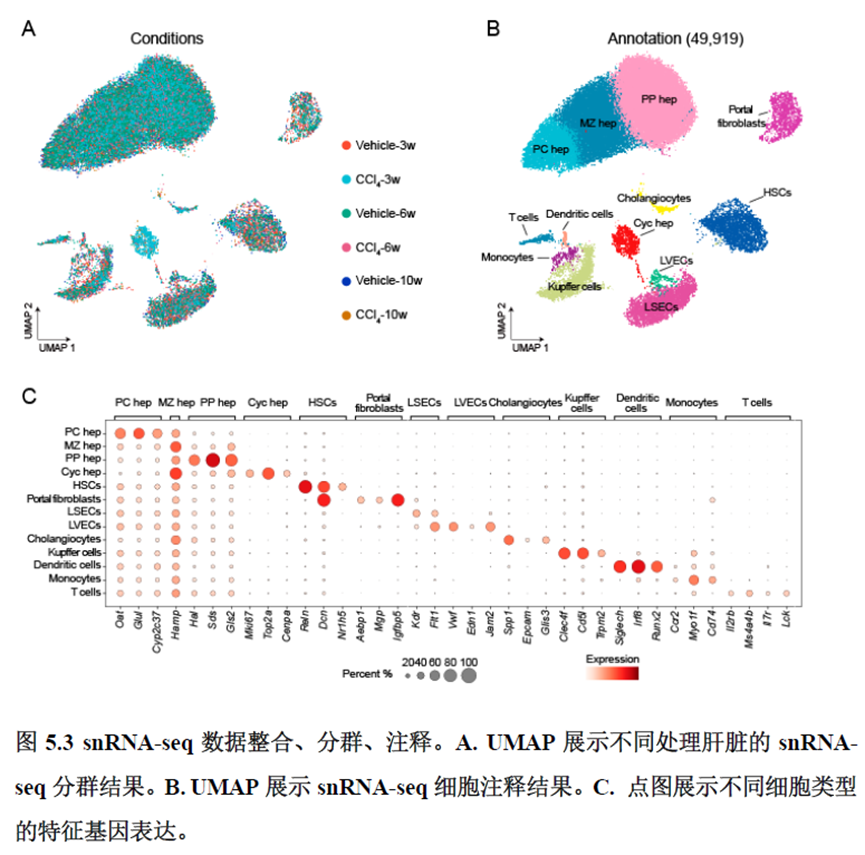
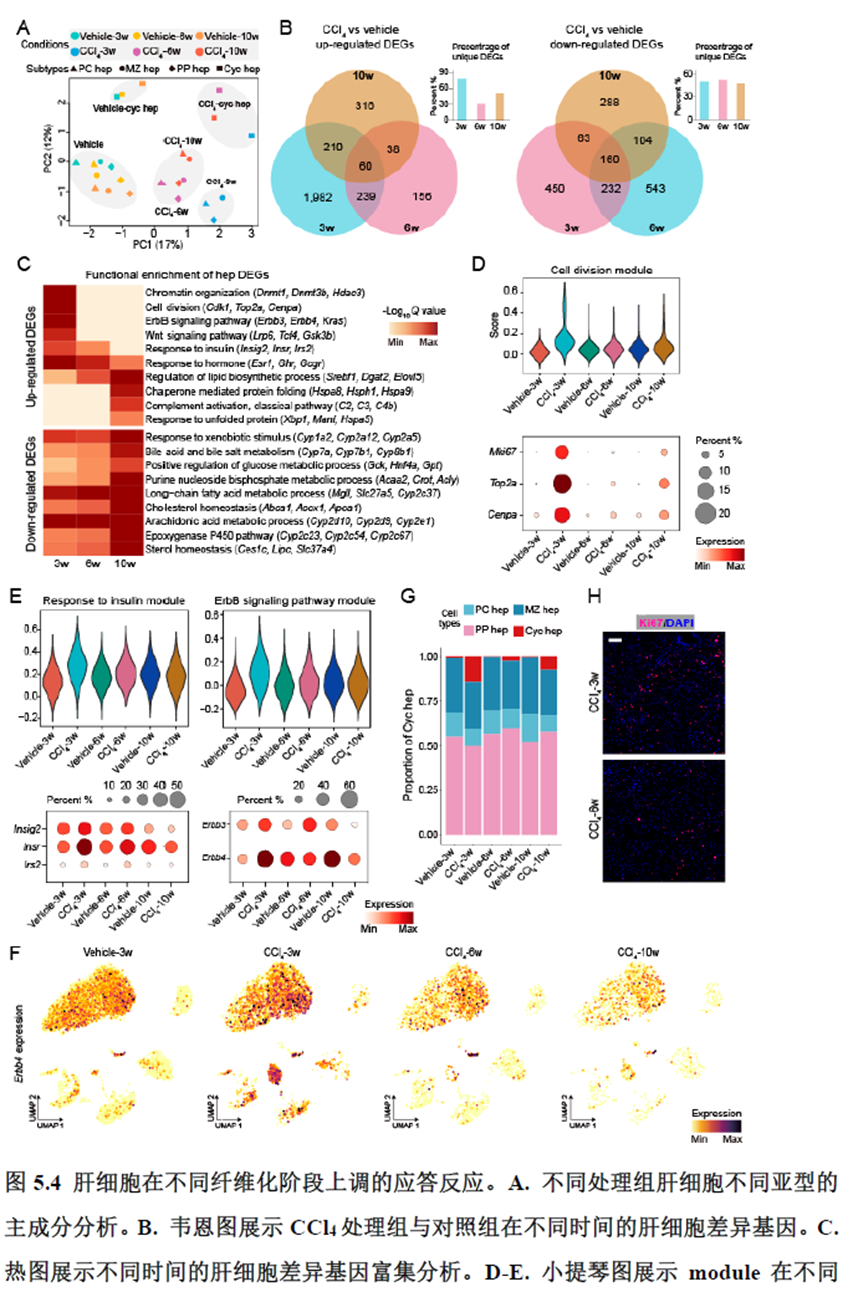

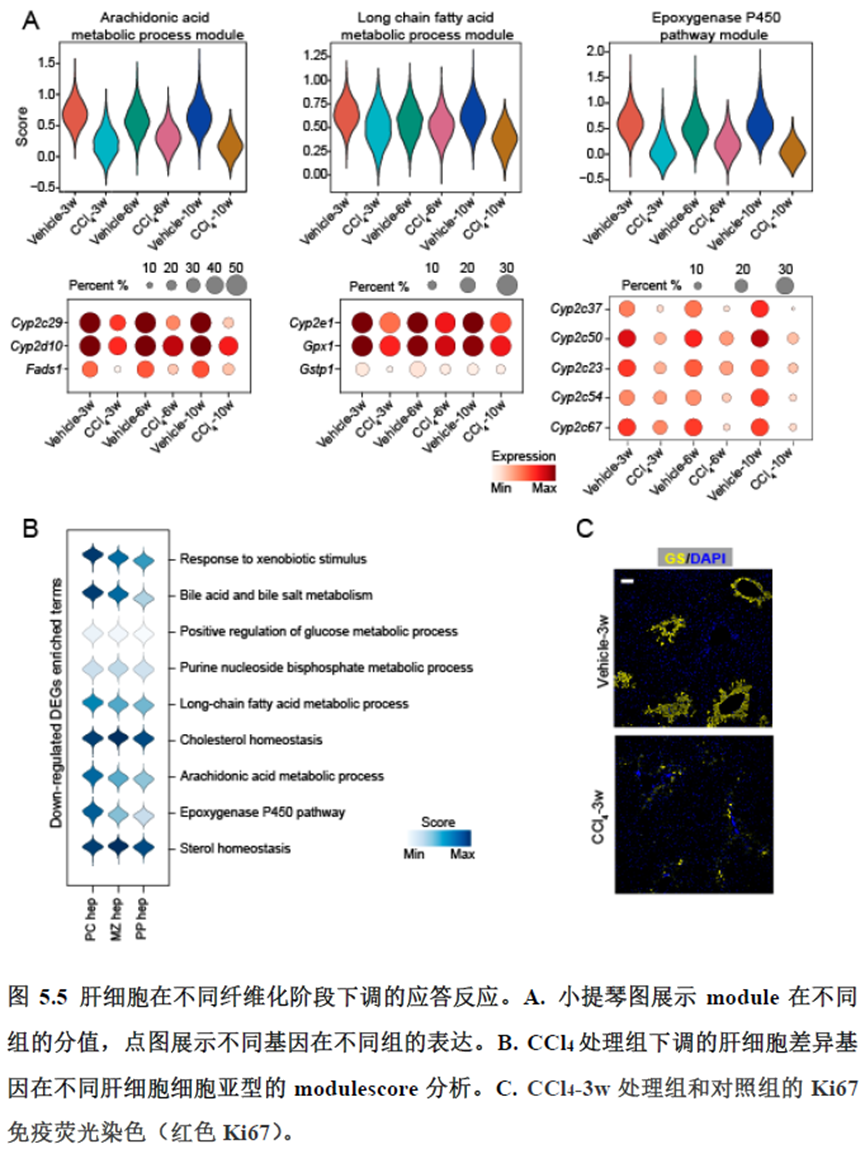
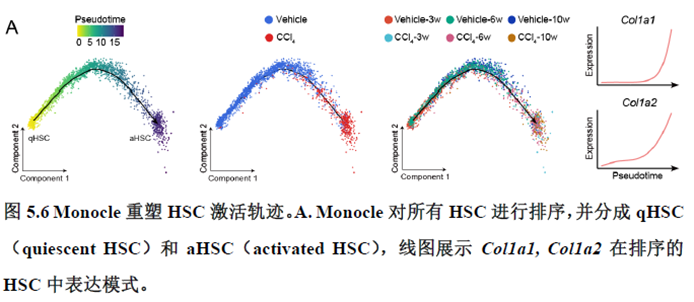
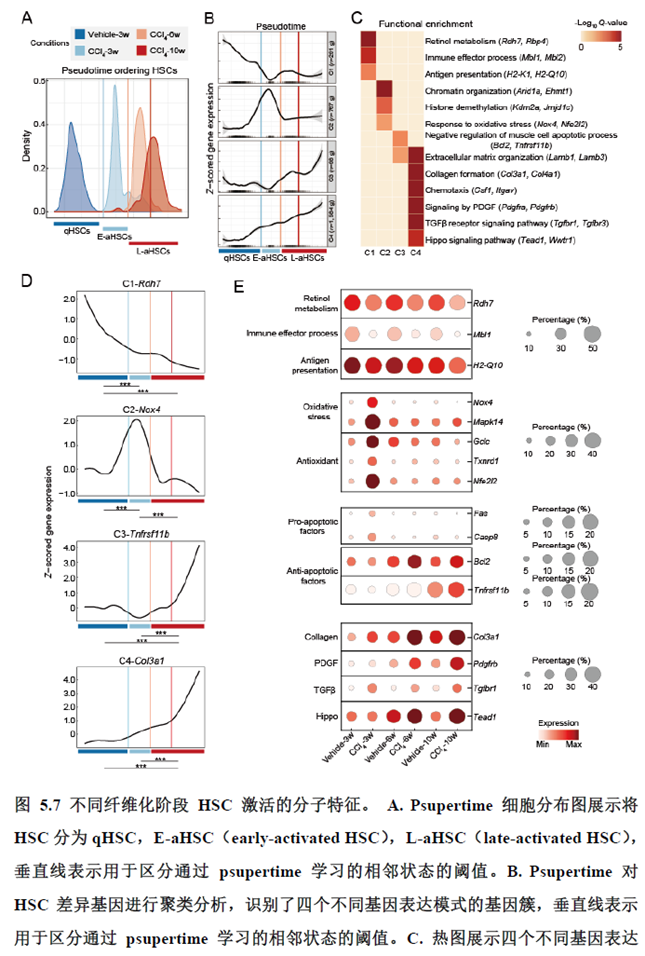

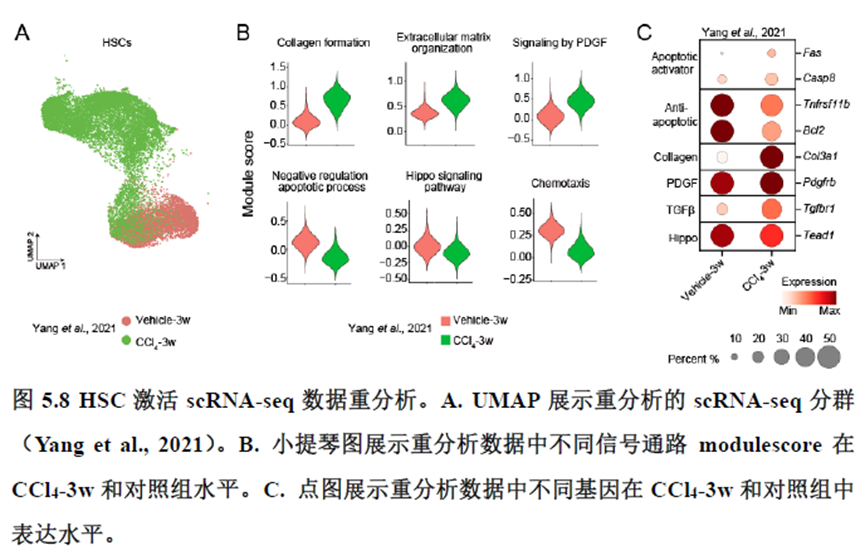
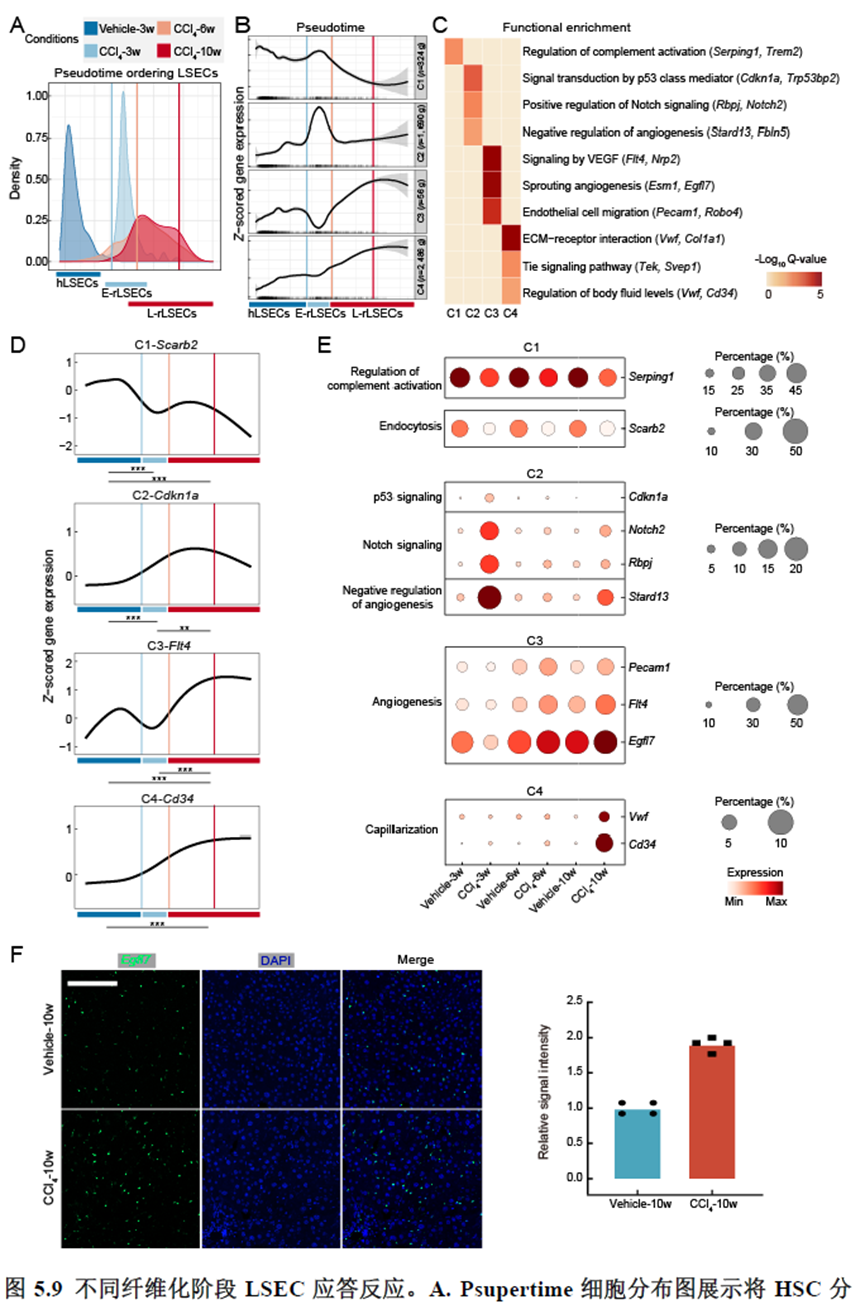

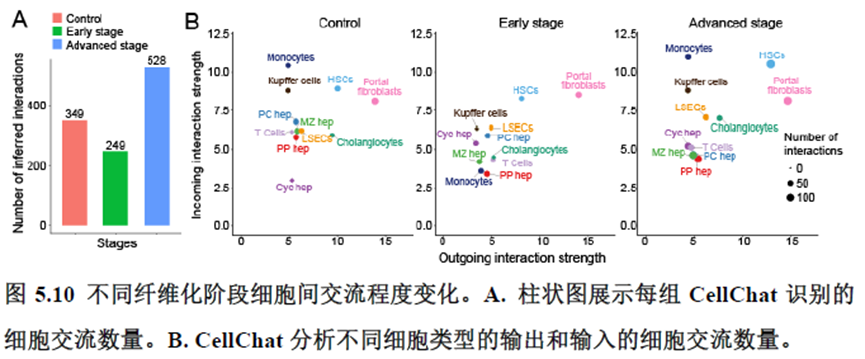
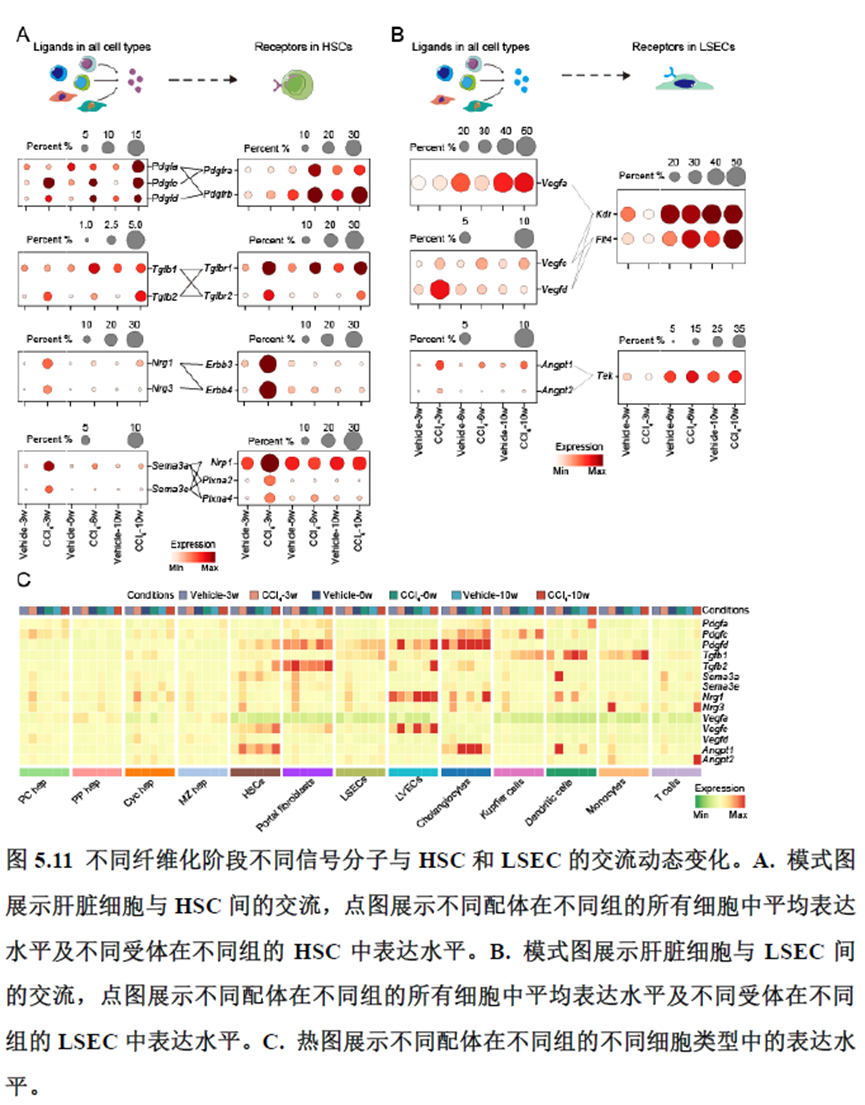
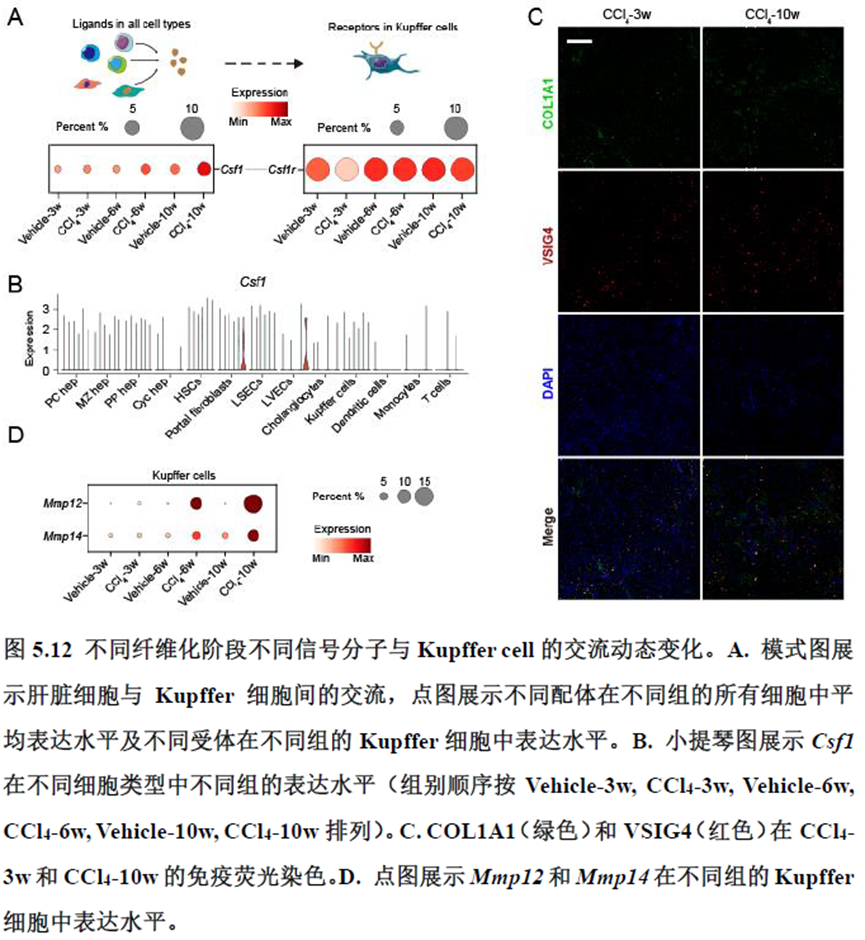
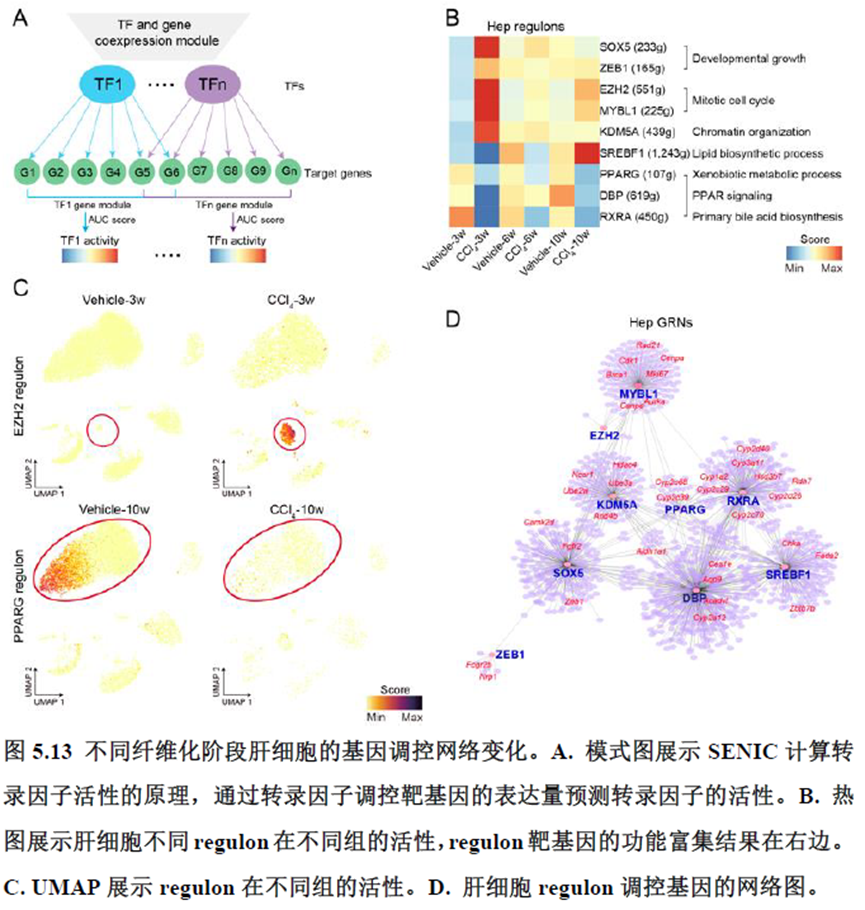
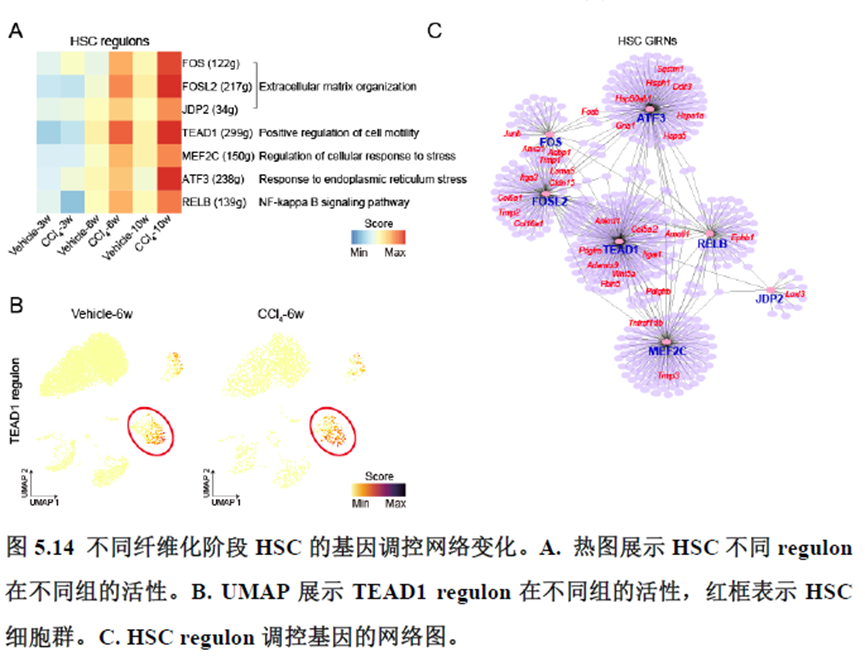
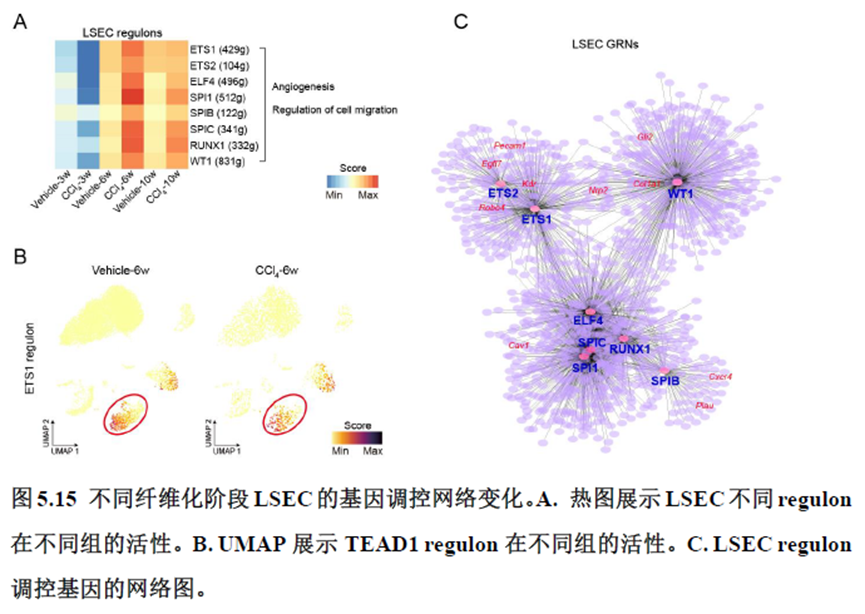
该研究以空间分辨率揭示了稳态肝脏不同细胞类型基因表达、微环境信号交流的分区特征,展示了庞大的数据分析数据,利用动物实验进行验证更是点睛之笔。从肝脏稳态,切除后再生,再生修复后异常导致的纤维化三个方面展示了肝脏分区,所有相关数据可通过在线交互式数据库查询和下载(LISTA: https://db.cngb.org/stomics/lista/),本人认为参考意义极大。
第三篇
接下来这篇是来自东南大学的名为“空间转录组测序样本准备及在帕金森病中的应用研究”的文章【3】,作者于2022年7月毕业,论文下载次数共151次,、全长137页,掐头去尾(去除目录、声明、致谢等内容)共104页内容。这位博士的专业为生物医学工程,在学期间以第一作者或共同第一作者共发表了4篇SCI,之所以分享这篇文章,也是因为文中对于空间转录组学样本的处理方法及文库构建描述的非常详细,具有一定的参考价值。作者主要从事单细胞文库构建方法研究及其空间转录组样本处理相关研究和应用。目前已完成超微量起始RNA建库方法的研究,并确定了保护剂对冰冻切片样本的保护作用及RNA完整性的影响。
绪论部分我就不展开介绍了,但是文中写到的组织样本制备和转录组文库制备的研究进展非常详细,需要了解的同学可以去看看原文。我们重点来看看研究内容,全文分为两大部分,第一部分是对用于空间转录组测序的样本准备方案研究;第二部分是帕金森病模型小鼠空间转录组测序研究。
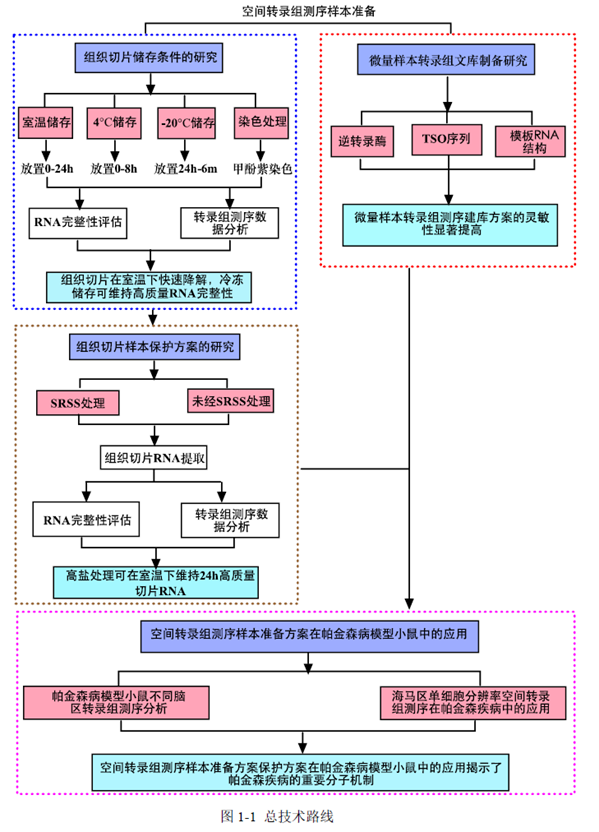
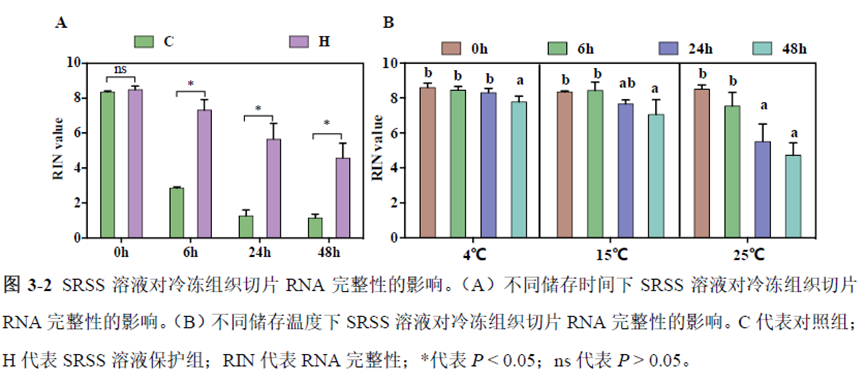
第一部分中作者首先探究了储存温度、储存时间和染色处理是否影响冷冻组织切片中RNA的稳定性,在储存0 h、2 h、4 h、8 h、12 h、16 h 和24 h 不同时间或4°C、室温和-20°C 不同温度下或是否经历染色等不同处理条件下,通过RNA-seq对各组RNA的质量及完整性进行评估。
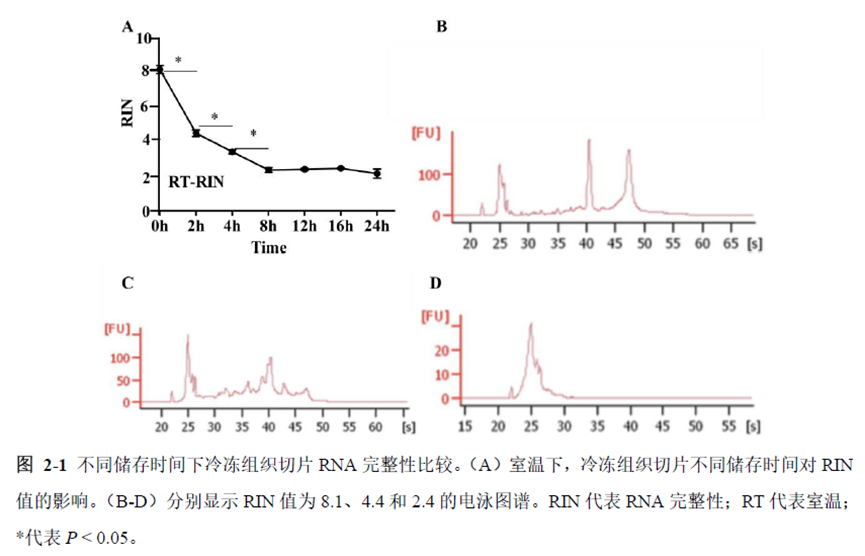
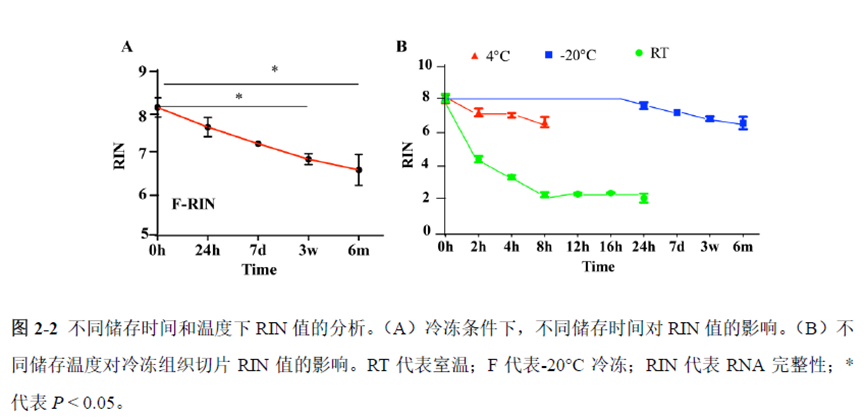
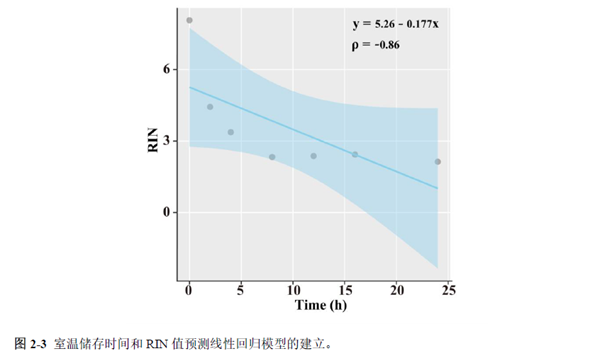
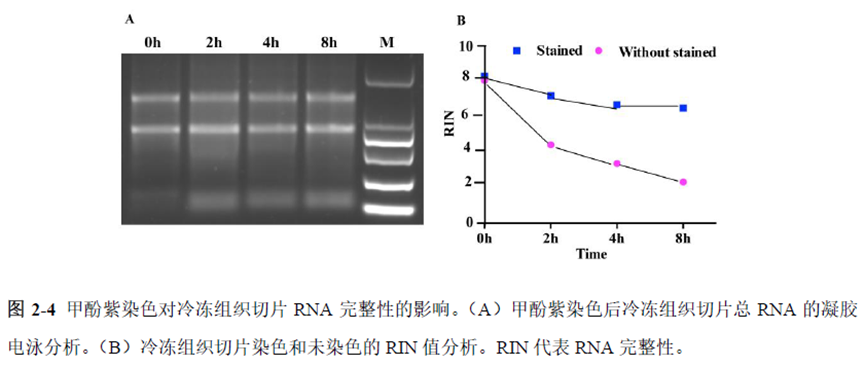
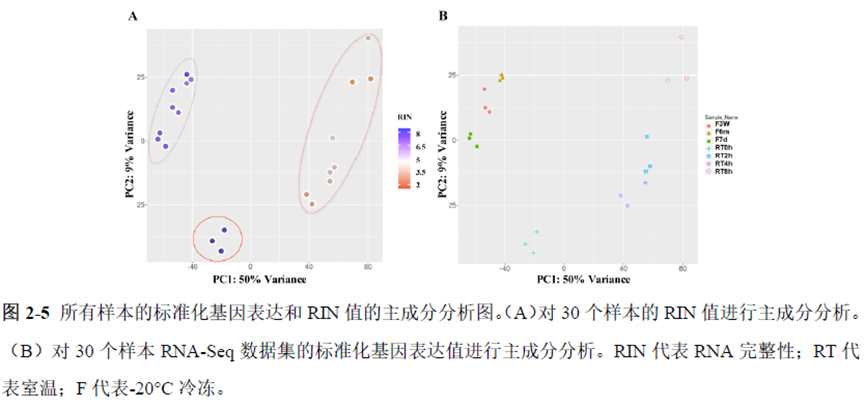
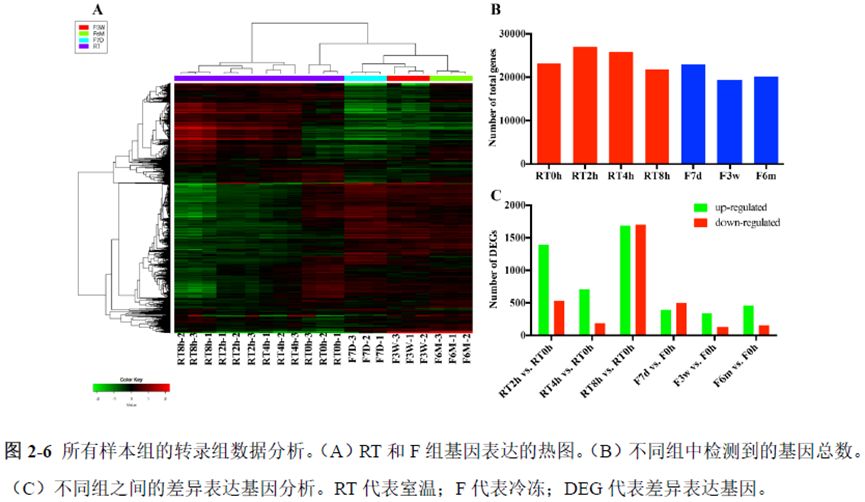
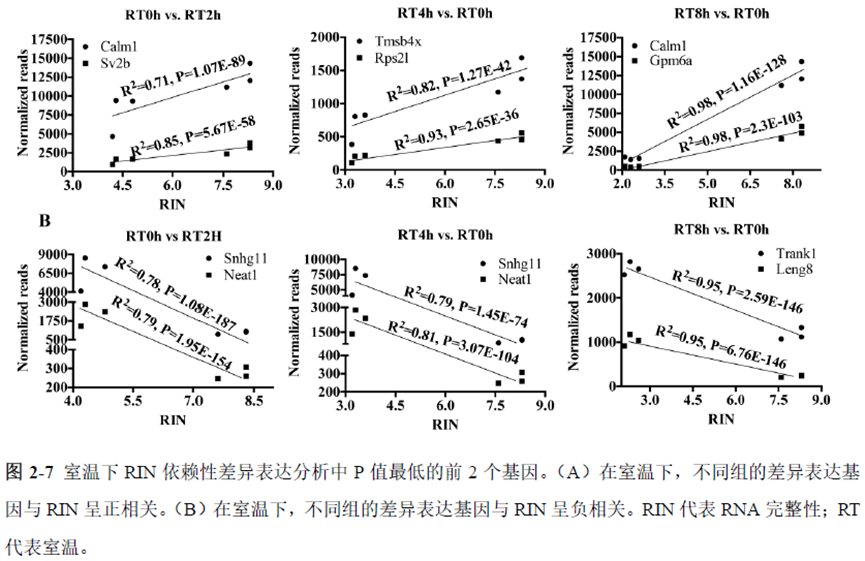
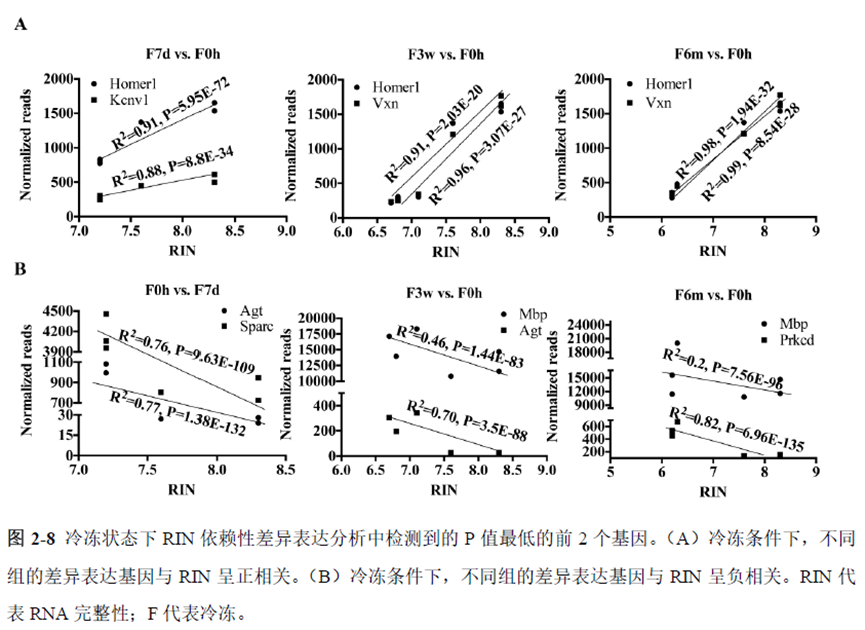
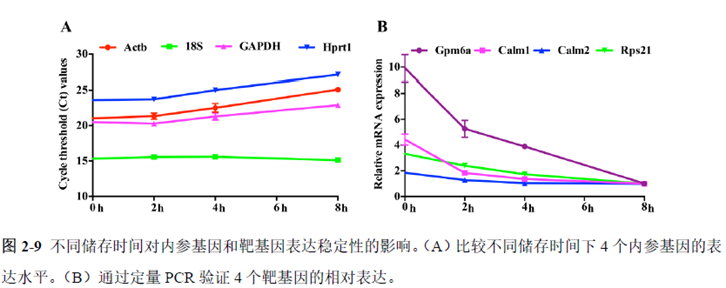
通过实验结果我们可以发现RNA质量的改变影响着基因表达的变化,在样本制备过程中,应尽量缩短储存时间,低温保存来保证RNA质量以确保测序结果的准确性。取样过程中耗时过长,解冻又容易引起RNA的变性,因此作者探索了室温下长时间维持高质量冷冻组织切片的保护方案。文中参考RNAlater等组织保护液的主要成分配制了含有硫酸铵、柠檬酸钠和EDTA 等的冷冻组织切片保护溶液(SRSS 溶液),实验结果显示与现有的商用组织保护液相比,含100%饱和度硫酸铵溶液的SRSS 保护液在室温下维持高质量冷冻组织切片样本的时间更长。
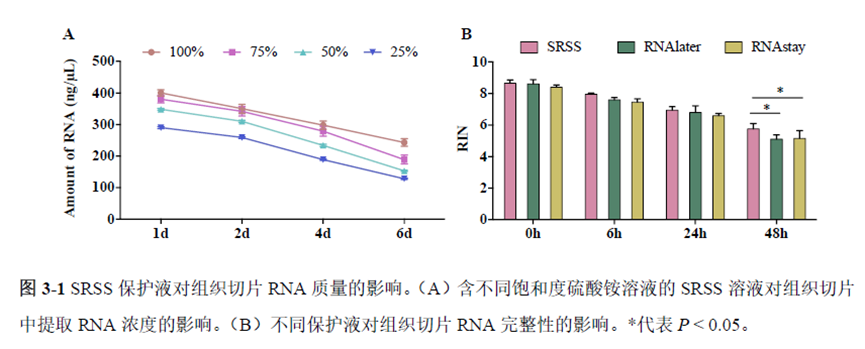
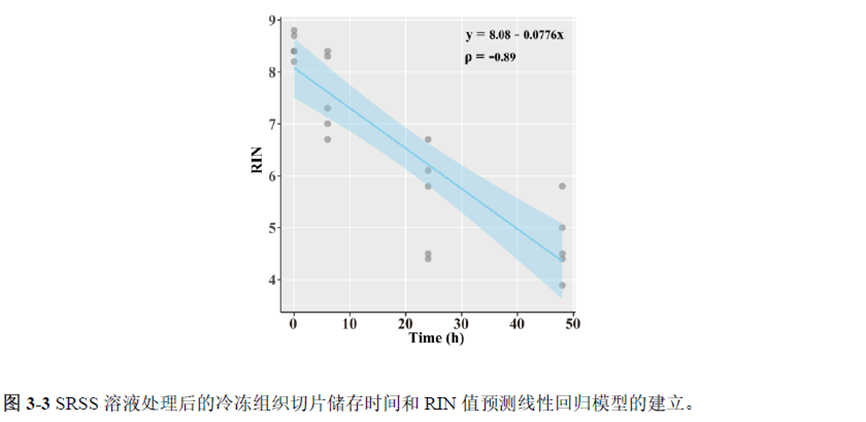
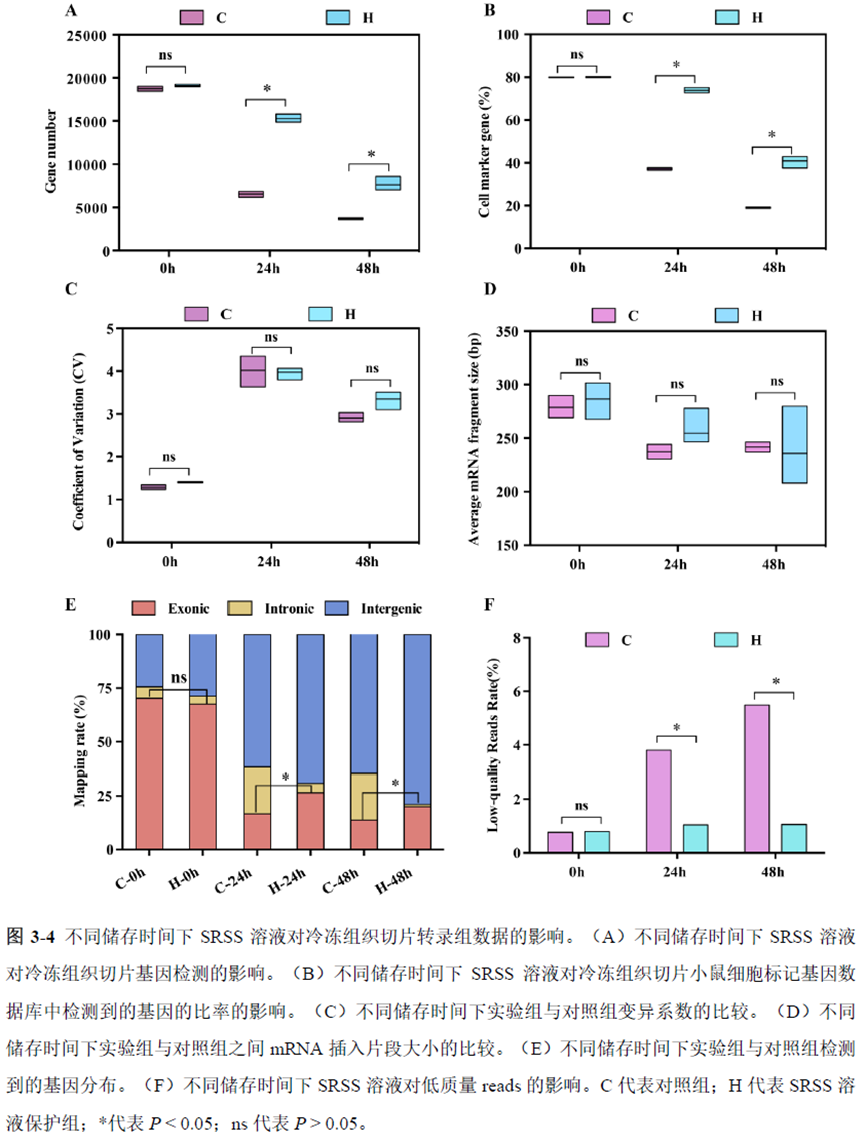
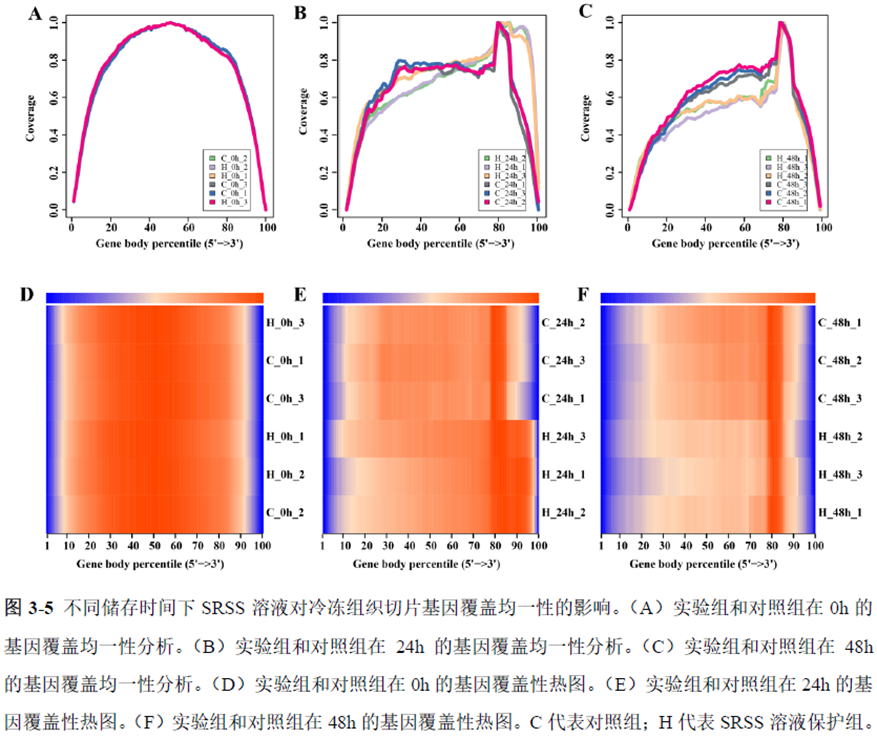
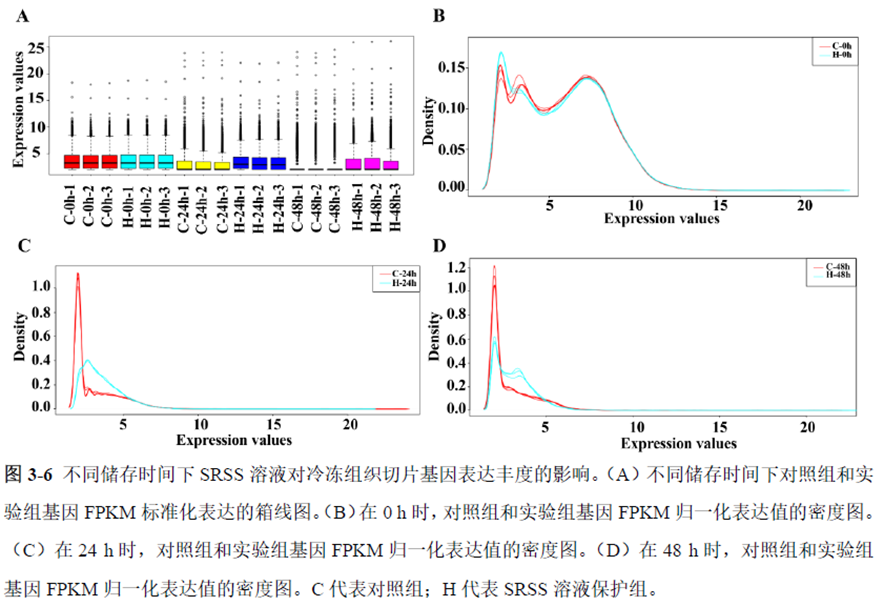
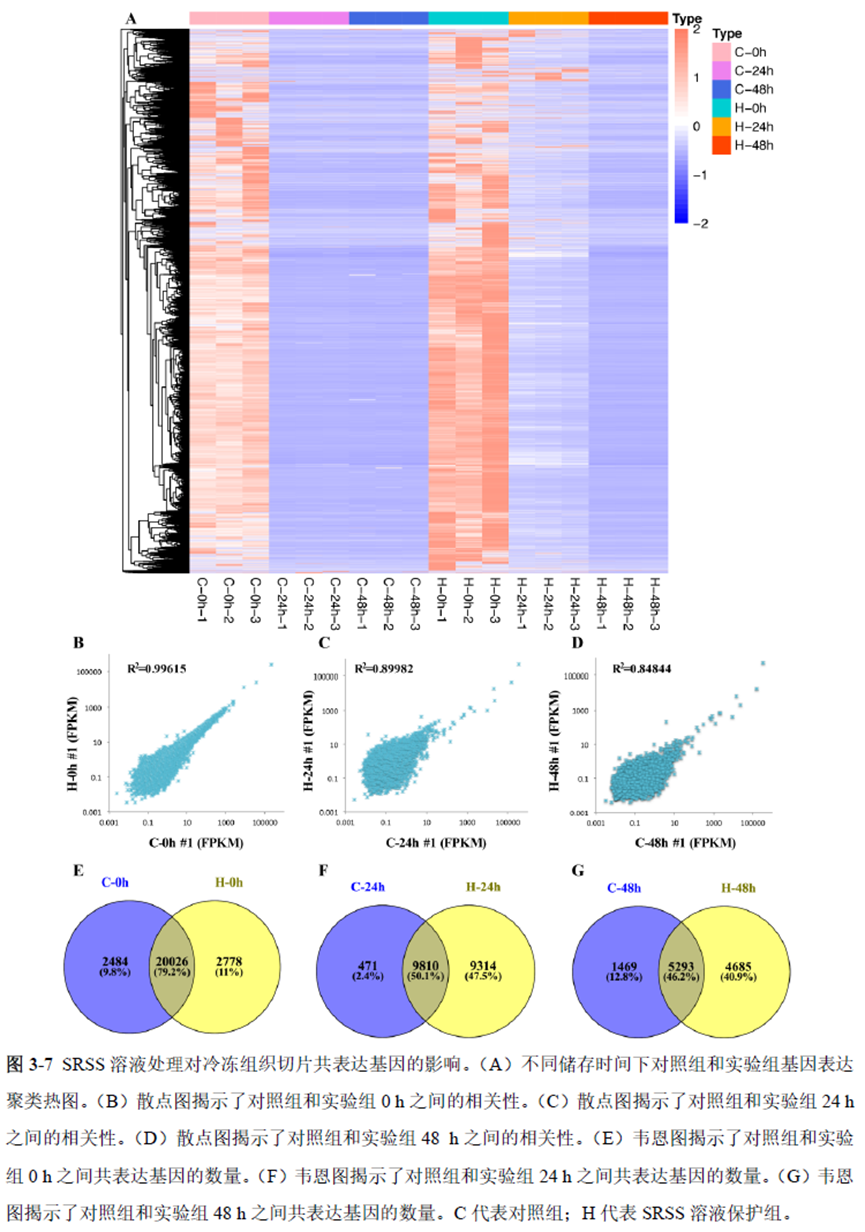
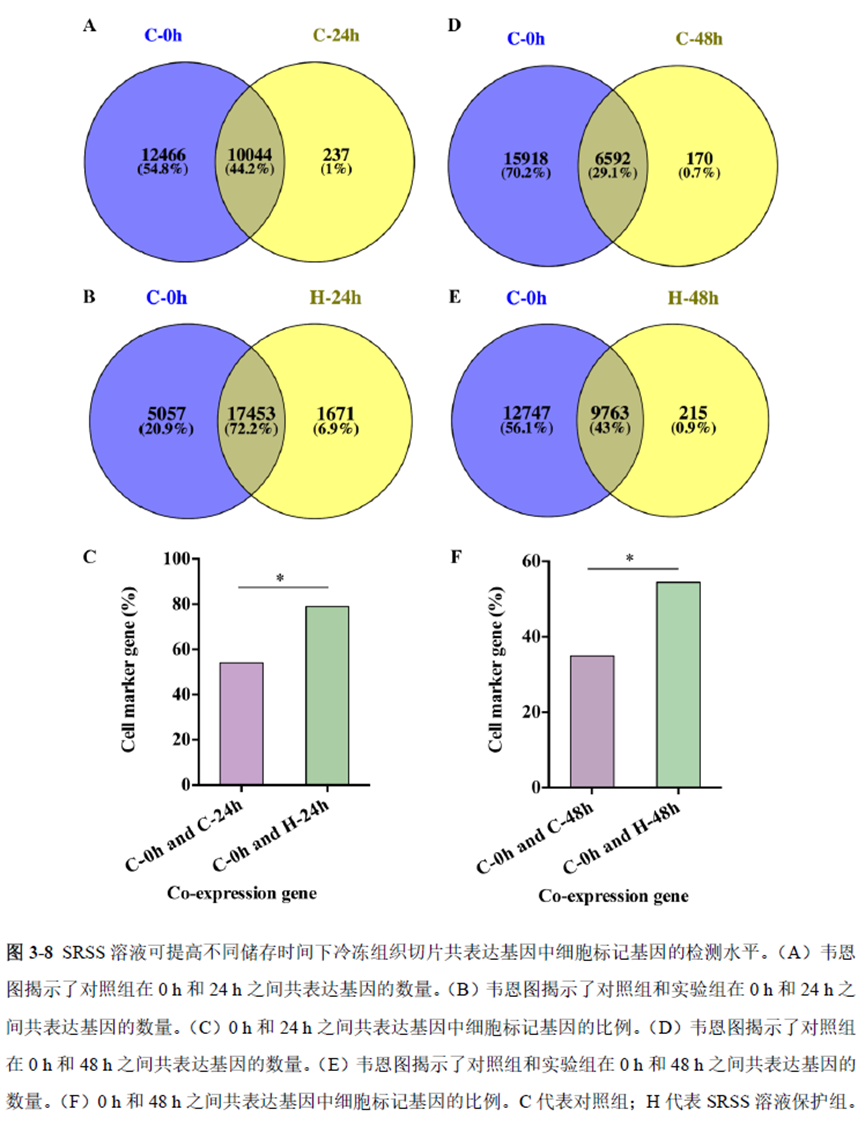
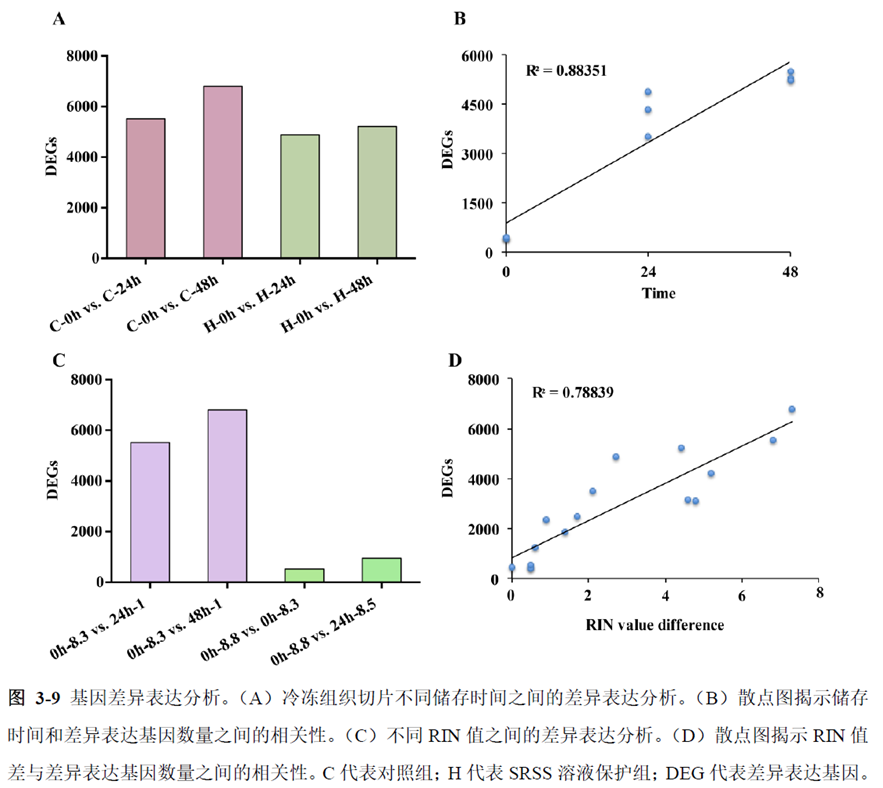
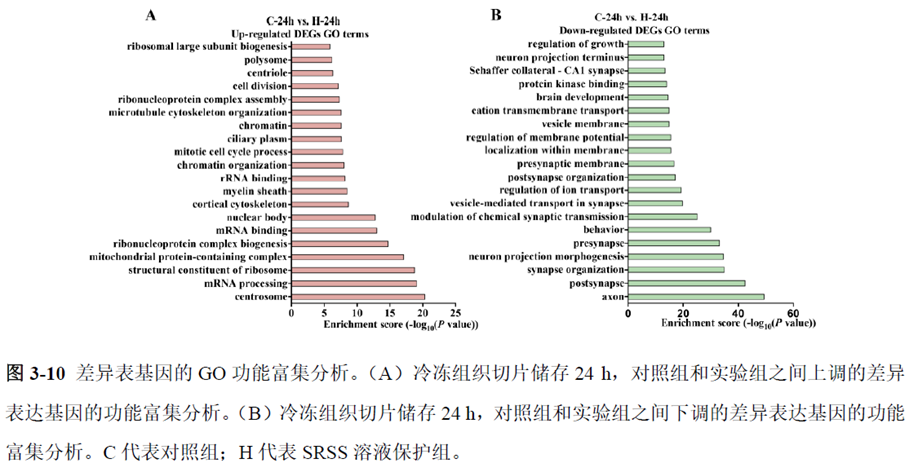
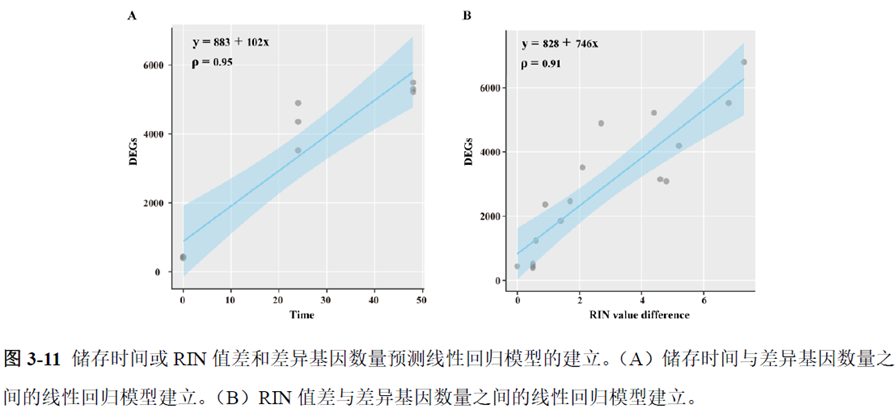
既然样品的制备及保存条件都摸索好了,作者接下来进行了文库制备的条件摸索,想要建立一种高灵敏度、低丰度基因检测能力的文库制备方案以应用于微量样本检测,通过一系列实验,发现通过改进逆转录酶、TSO 序列和RNA 结构进行微量样本转录组文库制备,能够使得0.5 pg 总RNA 样本显示出更高的测序灵敏度。
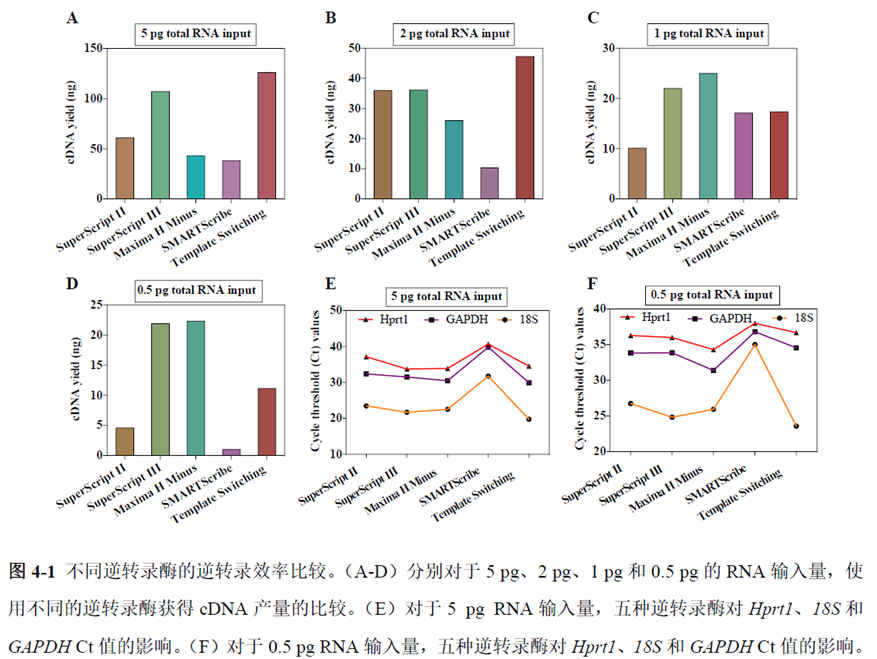
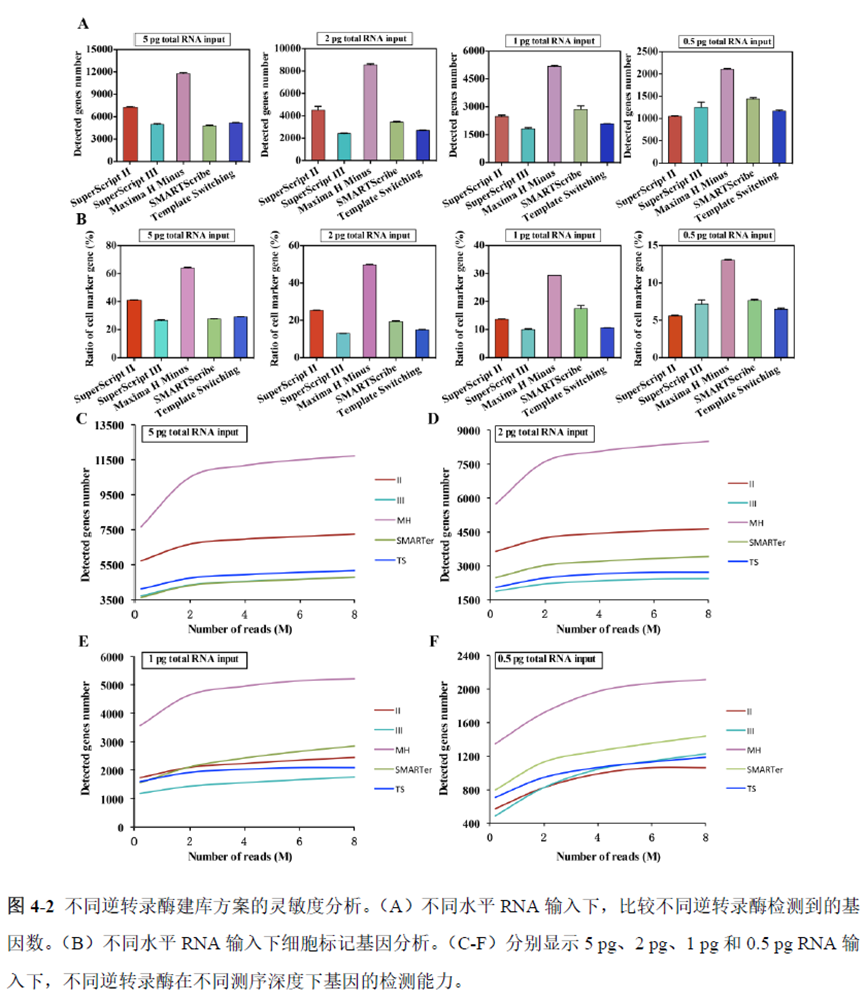
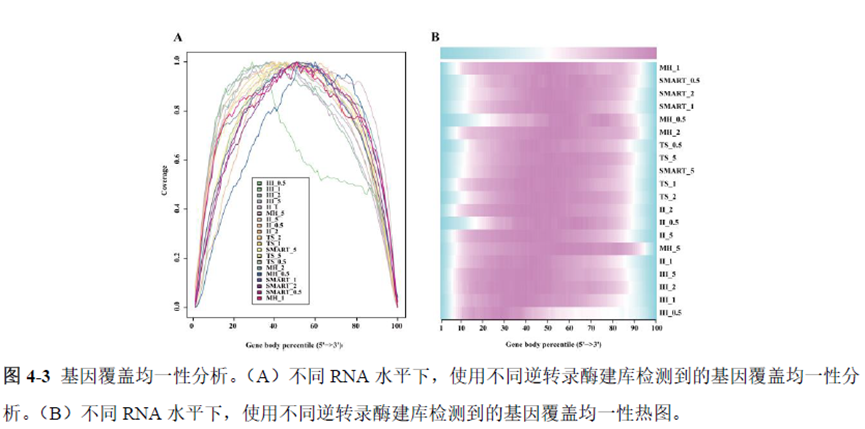

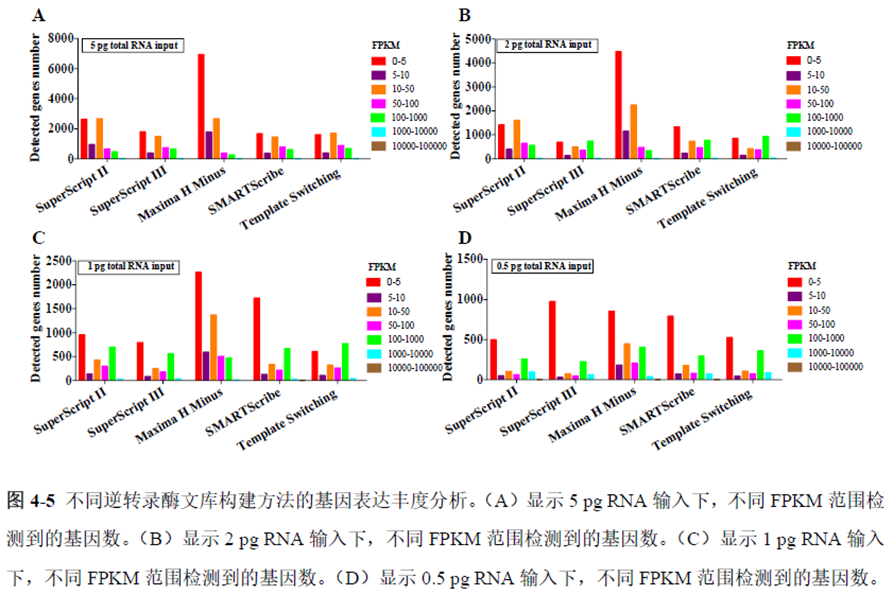
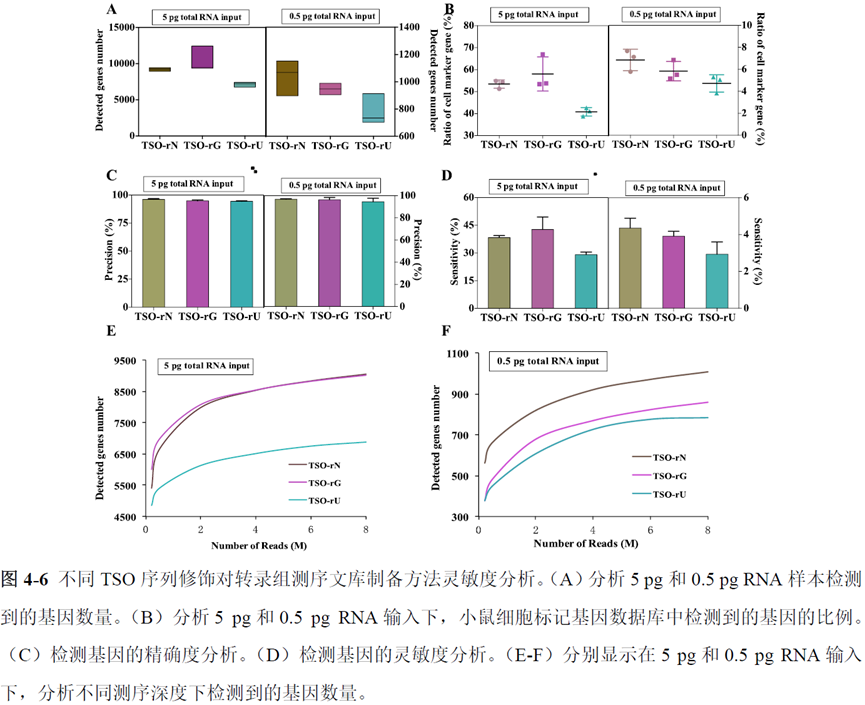

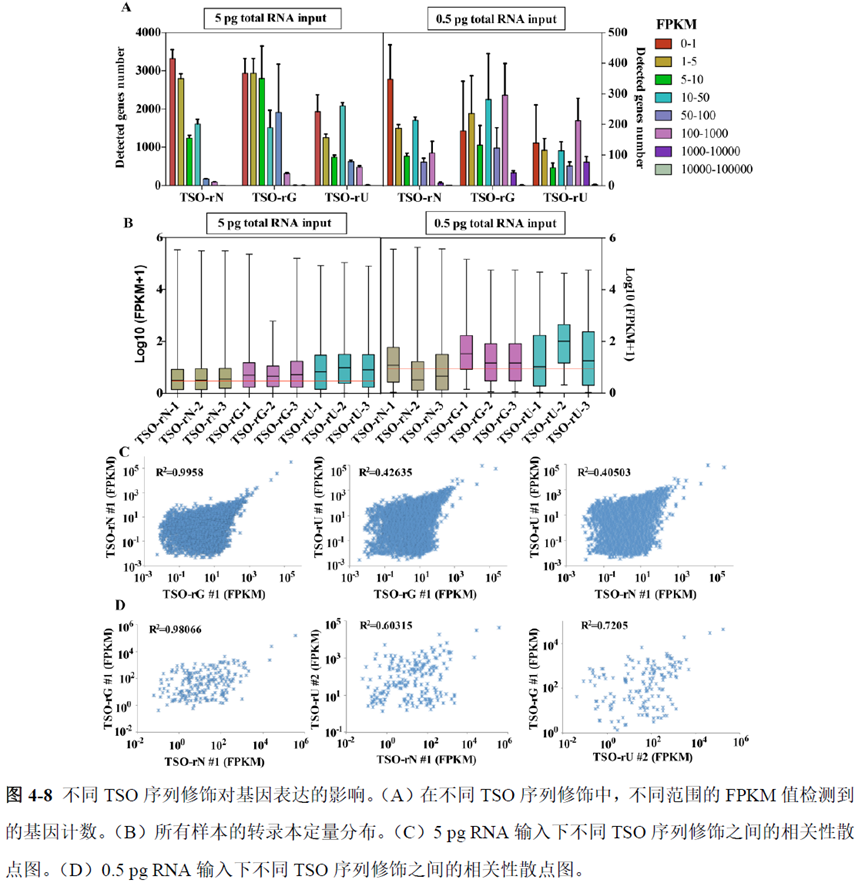
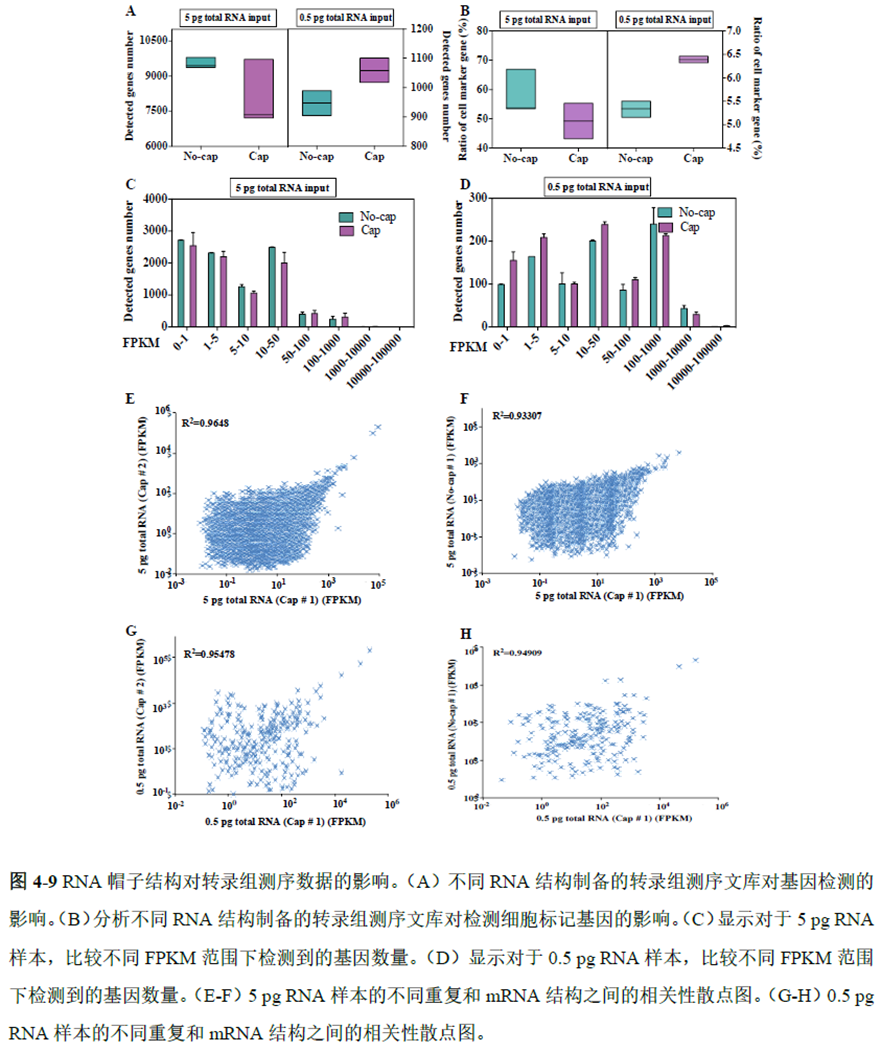
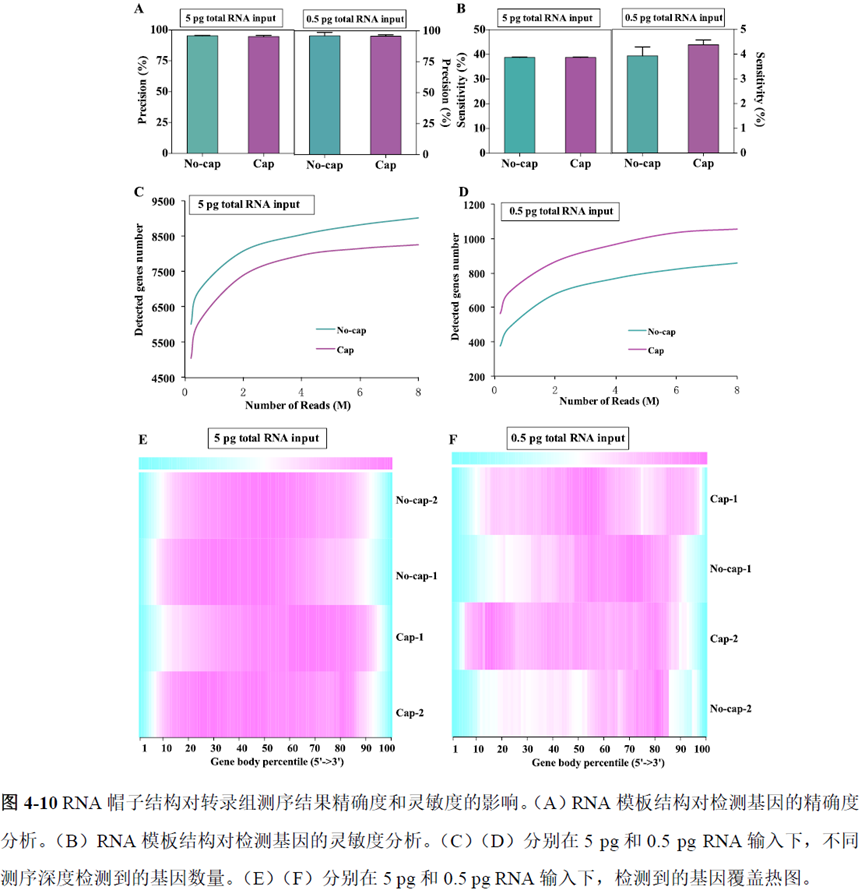
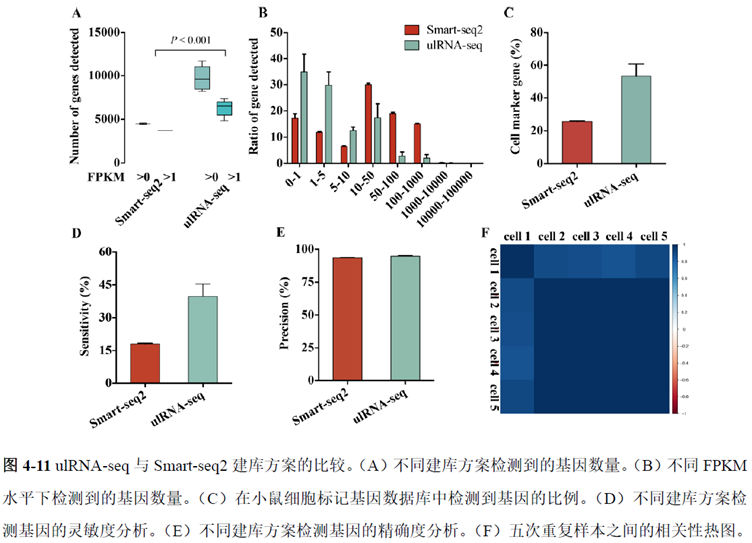
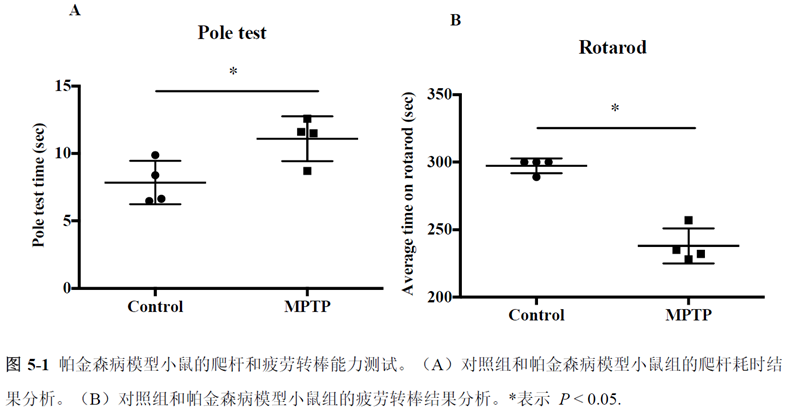
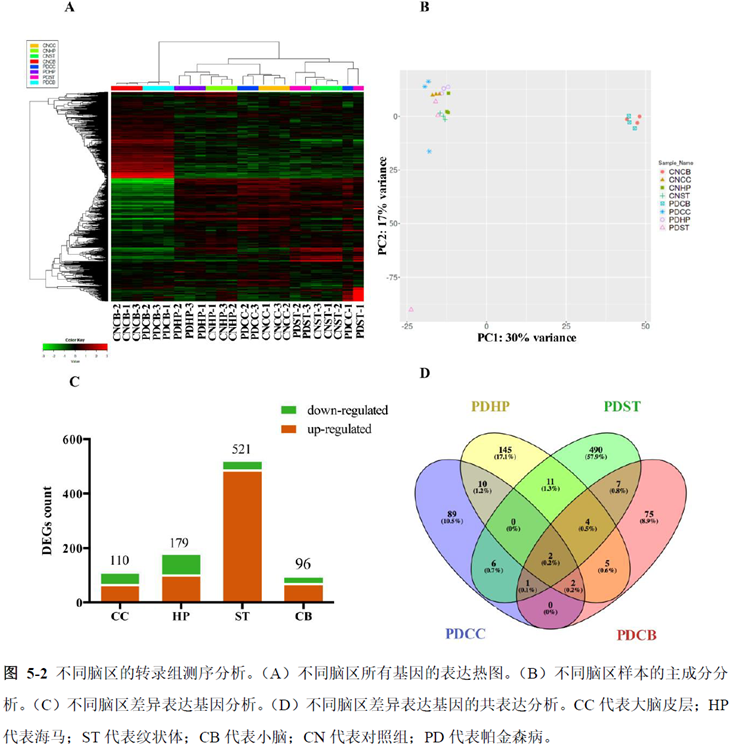
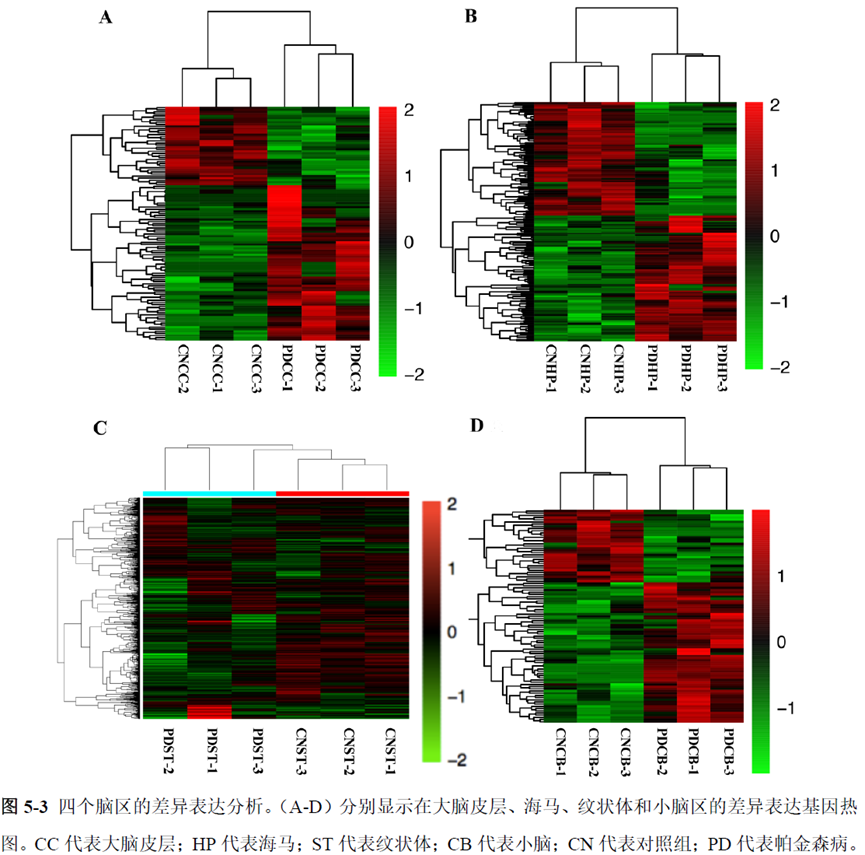
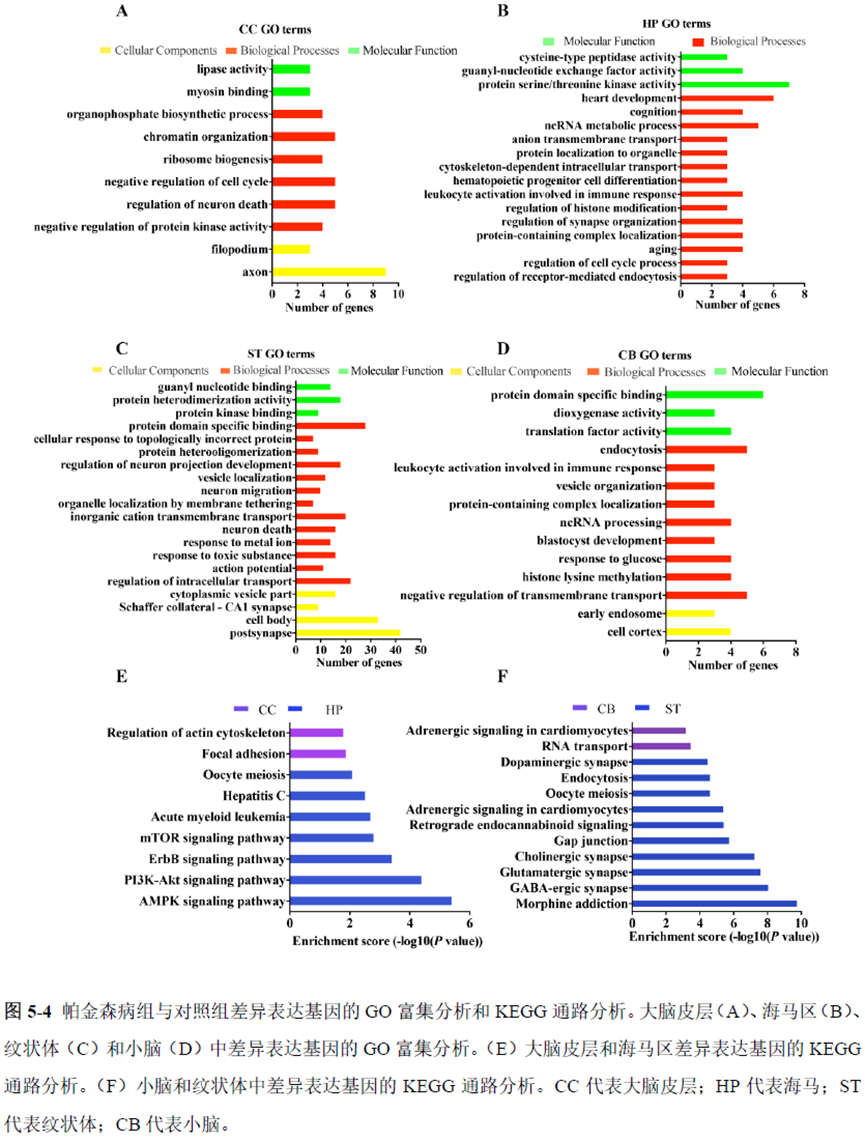
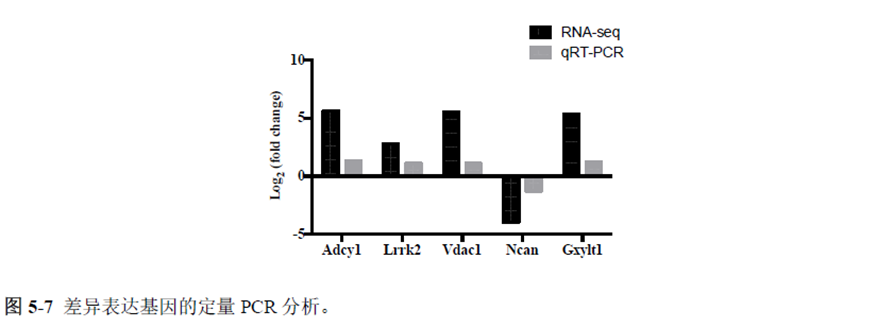
最后一章则是对前文摸索的条件进行了应用,选用帕金森病模型小鼠,进行不同脑区的RNA-seq和单细胞转录测序,来评估不同脑区在疾病发展中的参与程度。RNA-seq测序结果显示帕金森病模型小鼠纹状体和海马区检测出更多的差异表达基因,并且主要参与DNA 甲基化或去甲基化、AMPK 信号通路、PI3K-Akt、突触后和GABA 能突触等生物学功能和信号通路,其中与这些功能相关的差异表达基因有Lrrk2、Drd2、Mtor、Adcy1、Gnai1 和Gnai3等,并对差异基因进行了RT-PCR 验证,证明了测序结果是相对可靠的。
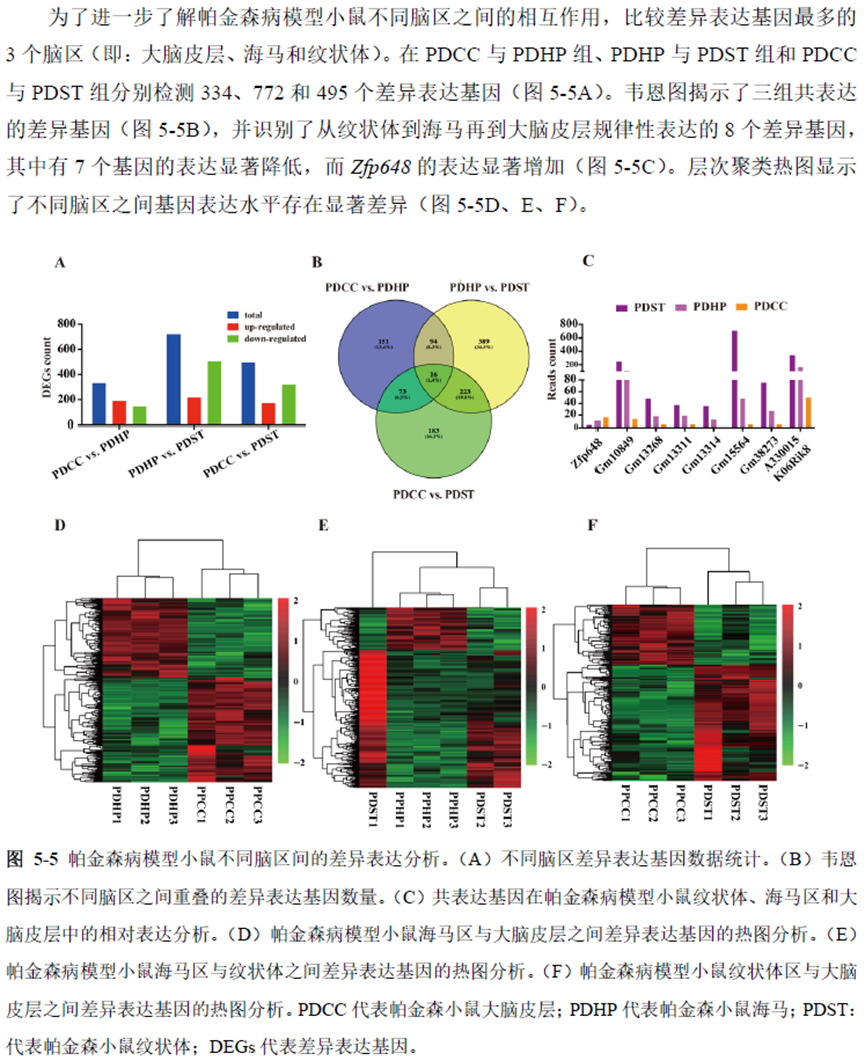
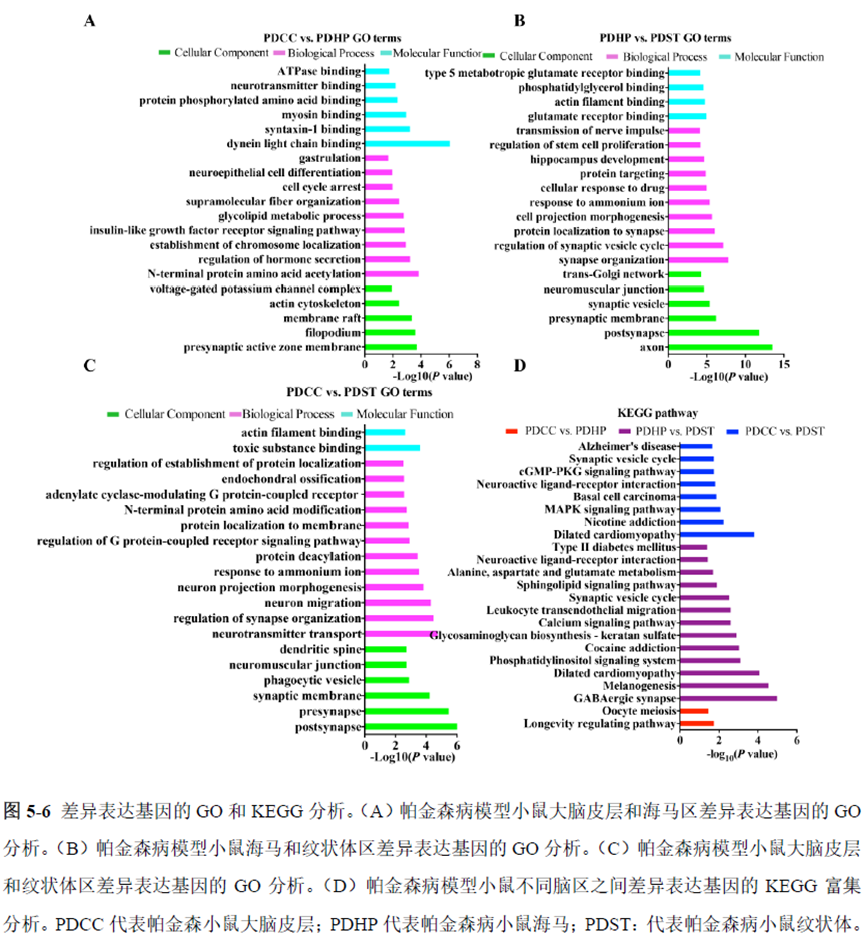
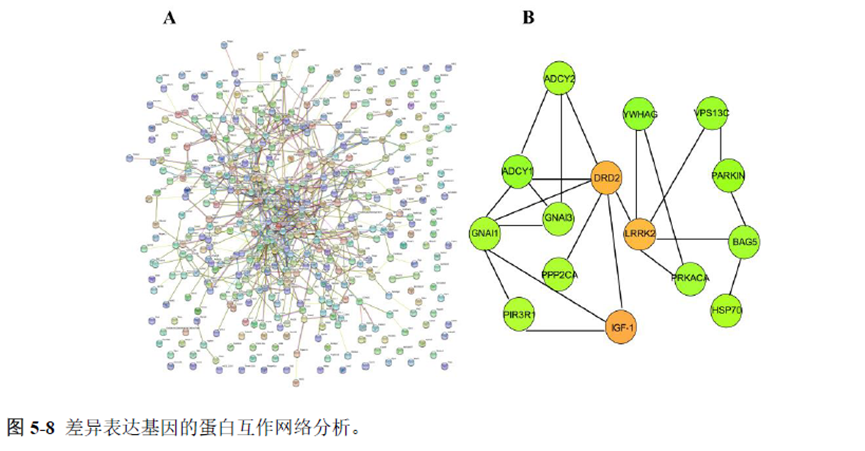
通过单细胞转录组测序,作者发现海马亚区的单细胞微区样本主要属于兴奋性神经元,不同位置单细胞的转录组水平存在较大差异,并且新发现了一些关键基因,其中上调的差异表达基因Tubb2a、Eno1、Atp2b1、Plk2、Map4、Pex5l、Fibcd1 和Pdzd2 主要参与神经元间突触、突触转运、钙离子转运通道以及神经退行性疾病通路,而下调的差异表达基因Sh3gl2、Aldoa、Stxbp6 和Camk2g 主要参与ATP 代谢过程和GnRH信号通路。
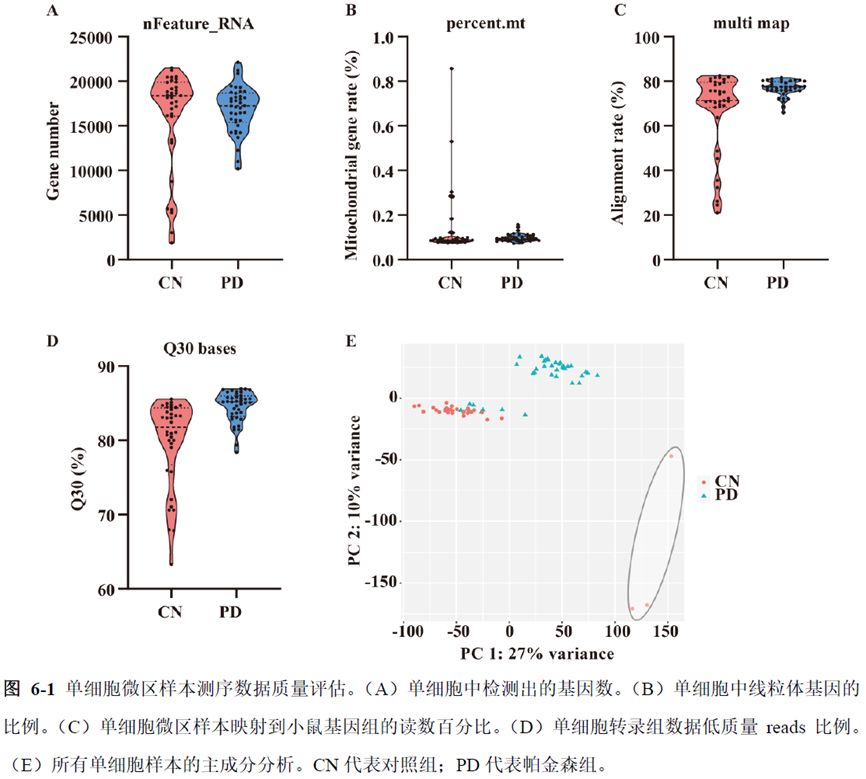
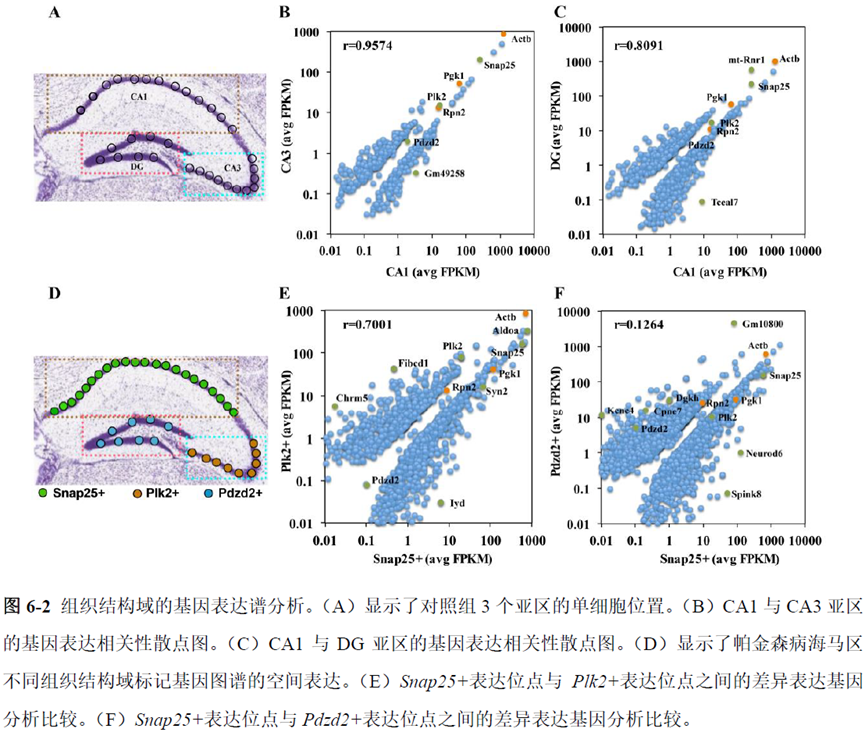
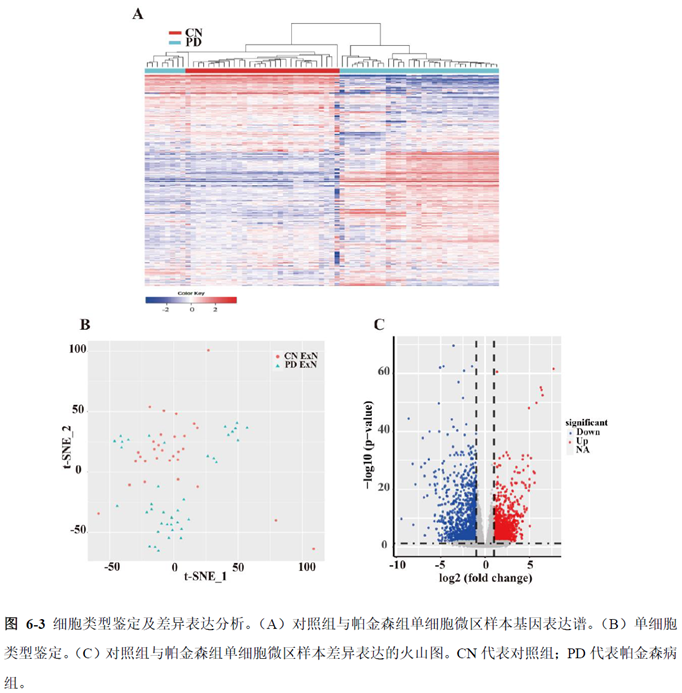
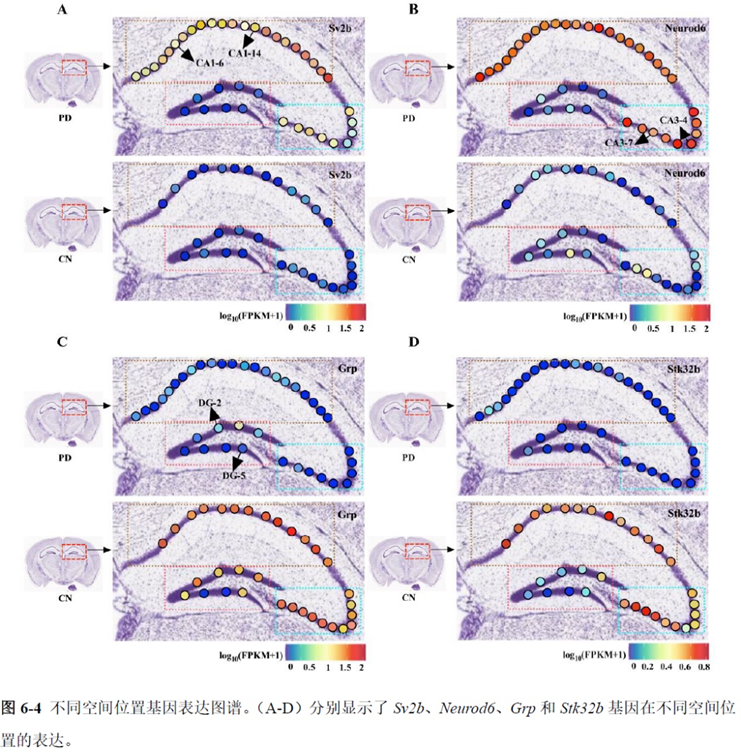
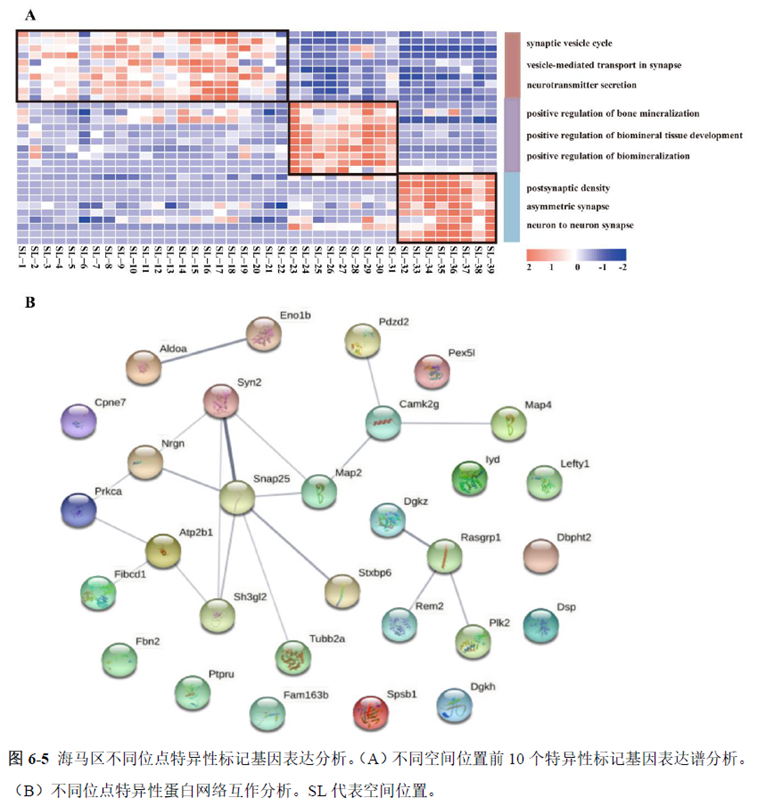
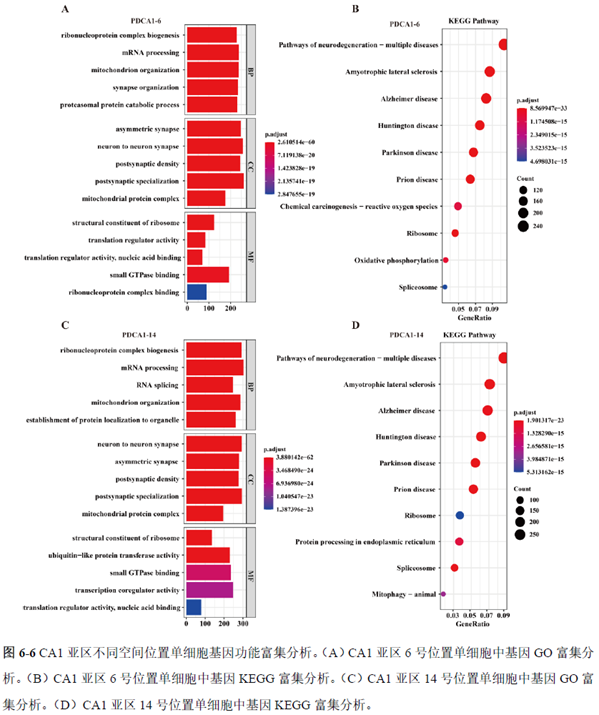
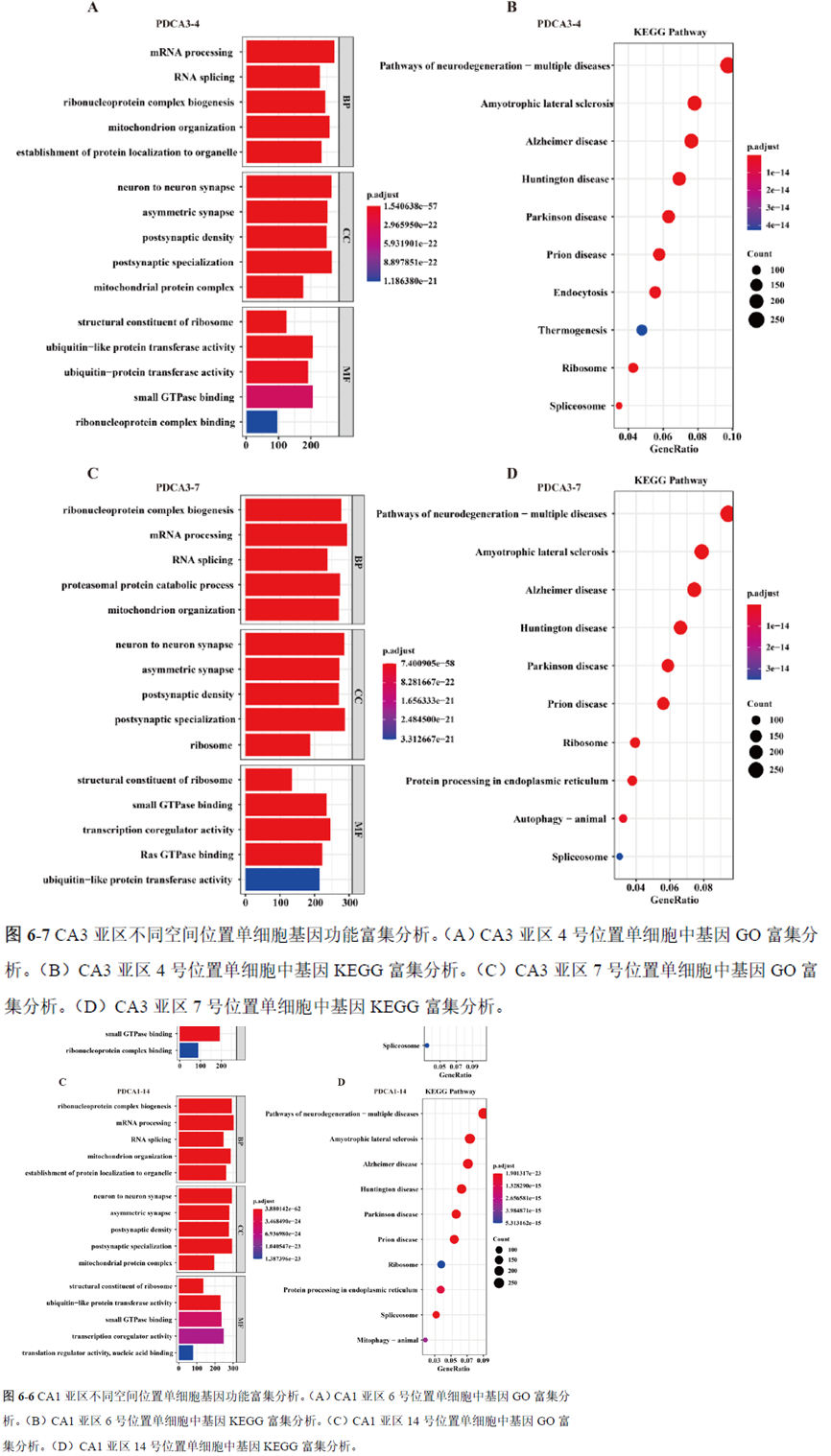
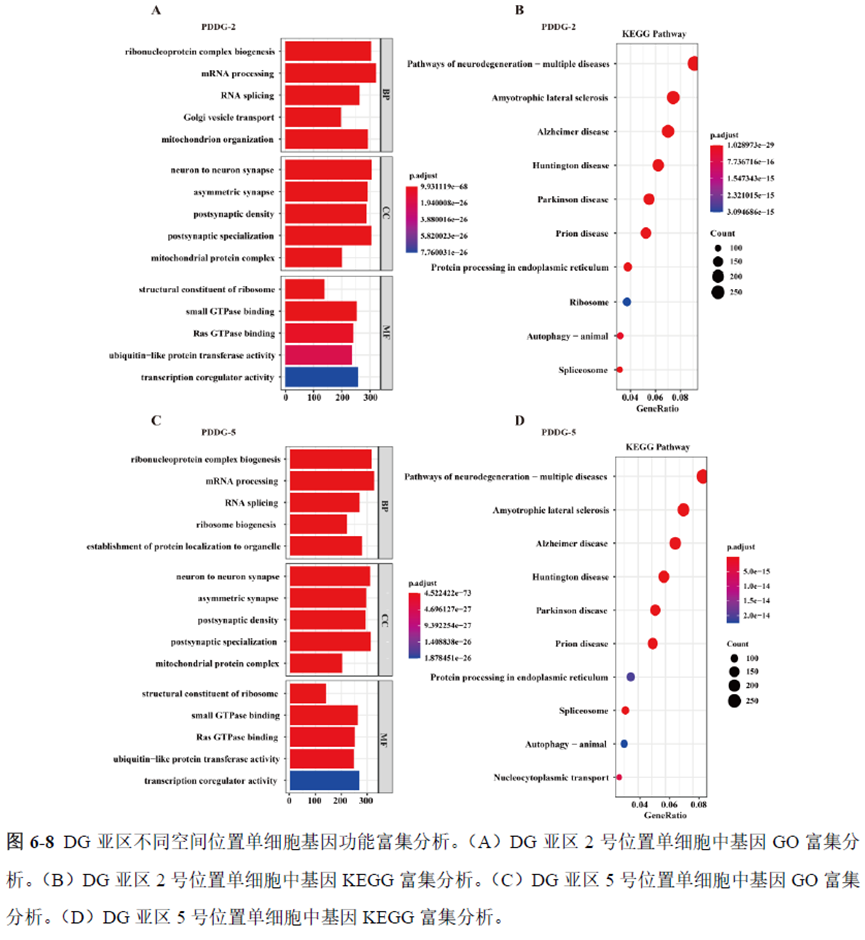
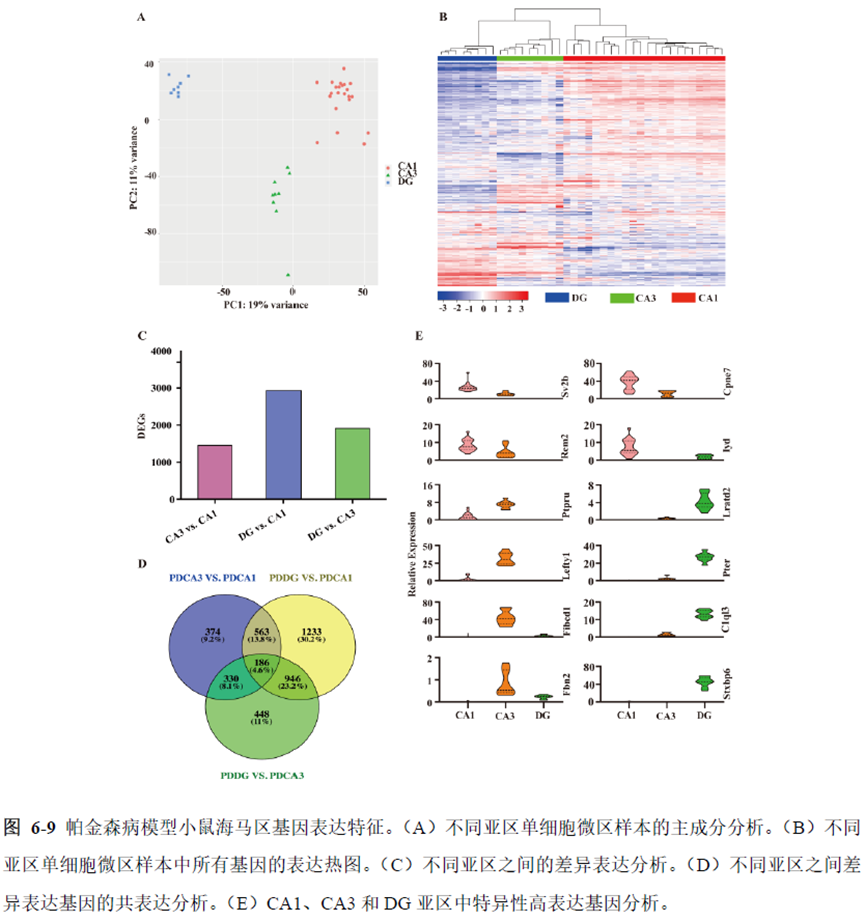
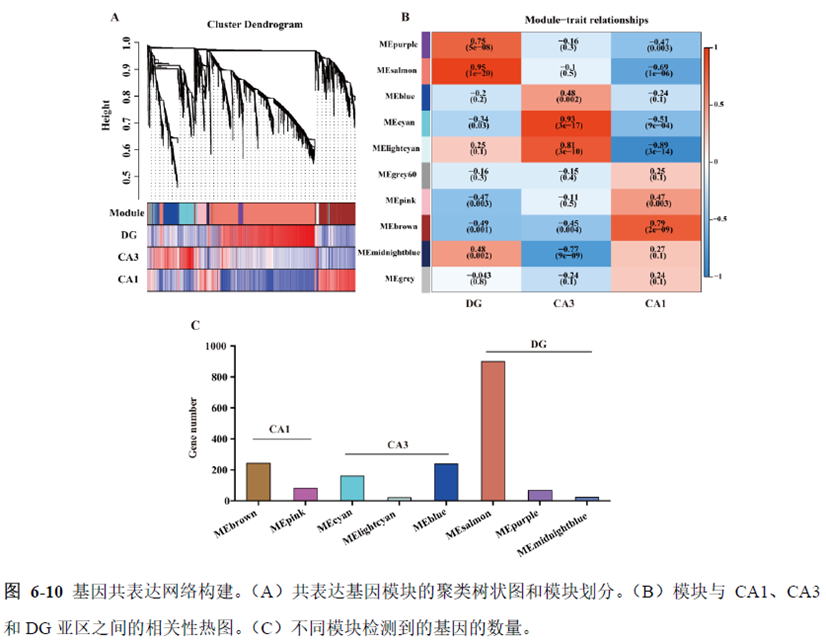
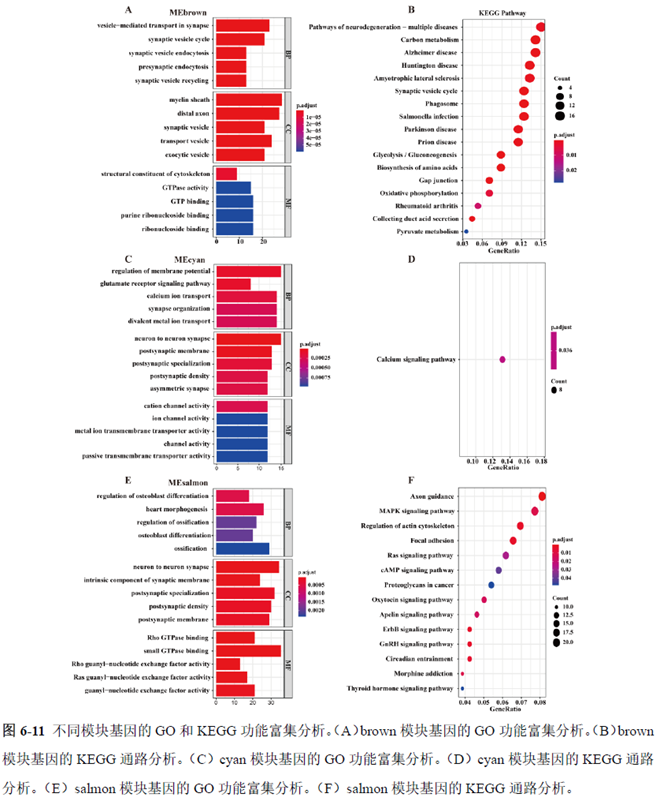
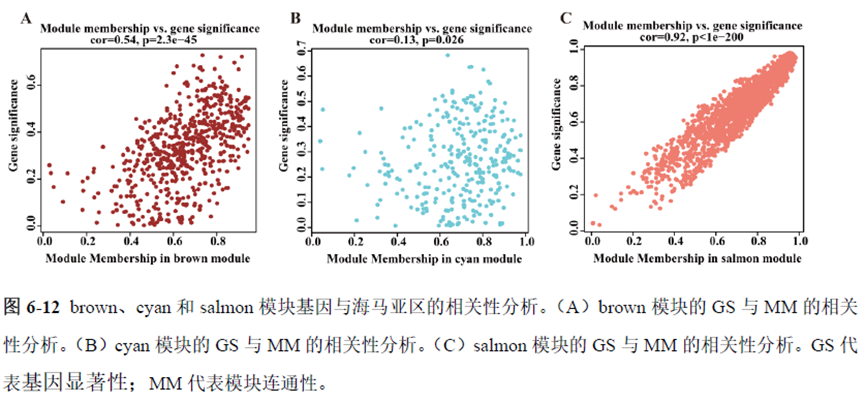
总的来说,这篇论文的内容也十分丰富,作者经过四年的努力工作,完成了空间转录组测序组织切片样本准备方案的建立,包括组织样本的完整性保护和超微量RNA的文库构建以及应用示范,完成度非常高,对后续的研究也有很大的参考意义。
第四篇
接下来这篇是来自中国人民解放军海军军医大学的名为“基于空间转录组技术的结直肠癌肝转移肿瘤内异质性及肿瘤干细胞研究”的文章【4】,作者于2022年5月毕业,论文下载次数共843次,全长100页,掐头去尾(去除目录、声明、致谢、附录等内容)共63页内容。这位博士是外科学的学术博士学位,也是让人羡慕的三年制博士,在学期间以第一作者或共同第一作者共发表了3篇SCI,毕业论文内容投稿在Journalof hematology&Oncology(IF=28.5, Under review)。网站已可以搜索到预印本(Zhou L, Wen R, Yu G, et al. Spatialtranscriptomic revealed intratumor heterogeneity and cancer stem cellenrichment in colorectal cancer metastasis.),接下来我们一起来看看具体内容。
绪论部分我就不展开介绍了,研究内容部分作者选择结直肠癌肝转移同期切除的原发灶及转移灶组织各2块进行空间转录组测序,测序结果先进行聚类分析,再经过Seurat的SCTransform方法进行标准化归一化处理和筛选高变化基因;标记差异基因后,对差异基因集进行GO功能及KEGG pathway分析;并对细胞经"CellCycleScoring"函数计算细胞周期评分和细胞上皮分化状态;"Monocle"工具包进行拟时分析;CellPhoneDB进行细胞间通讯分析。
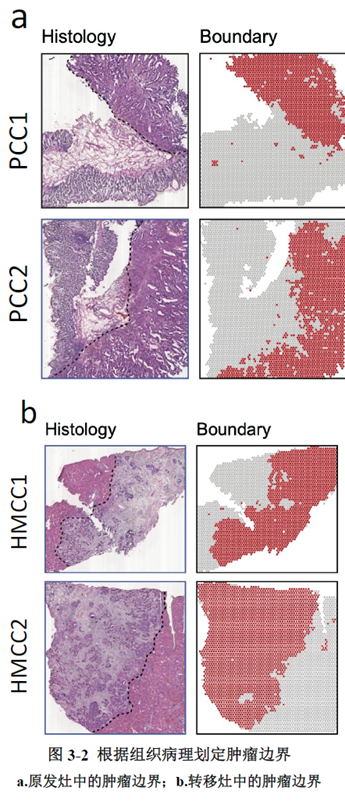
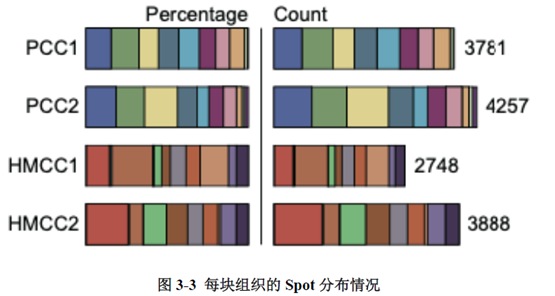
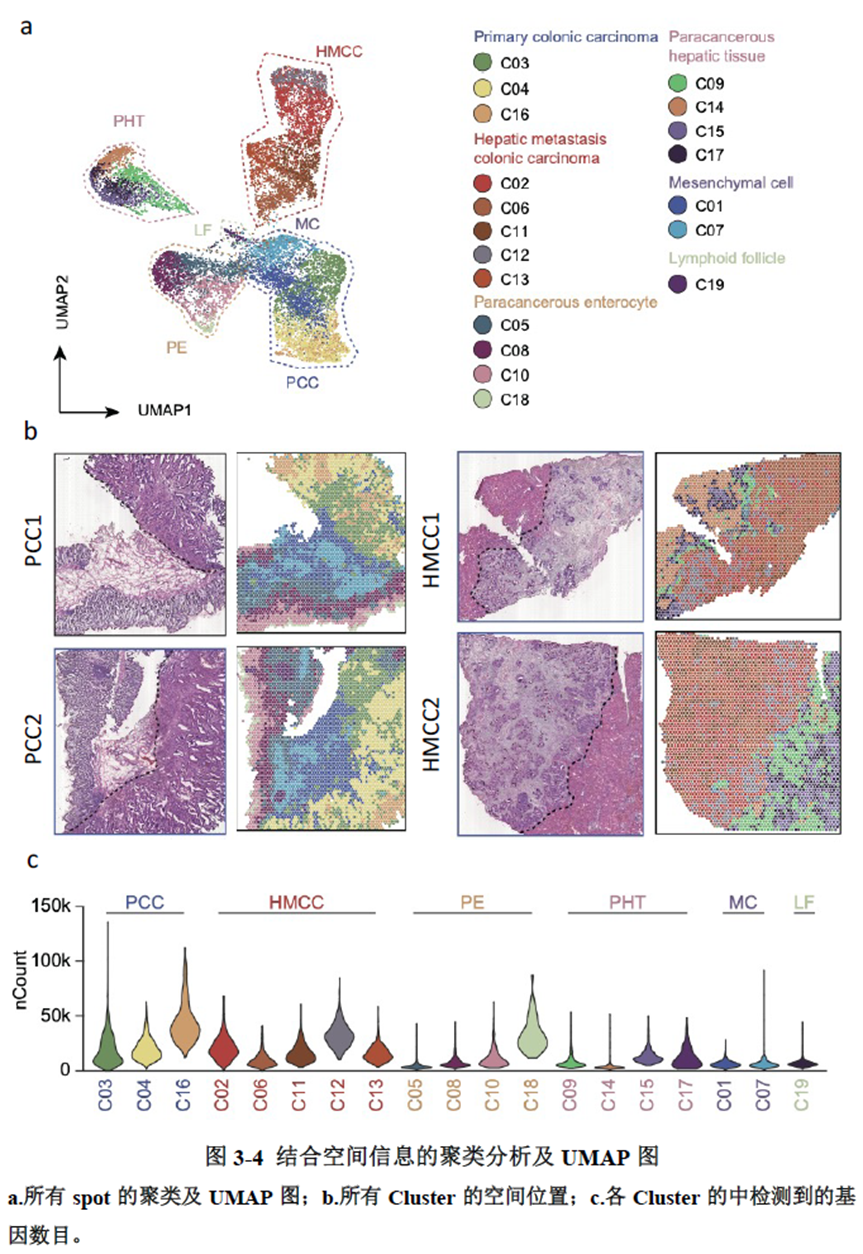
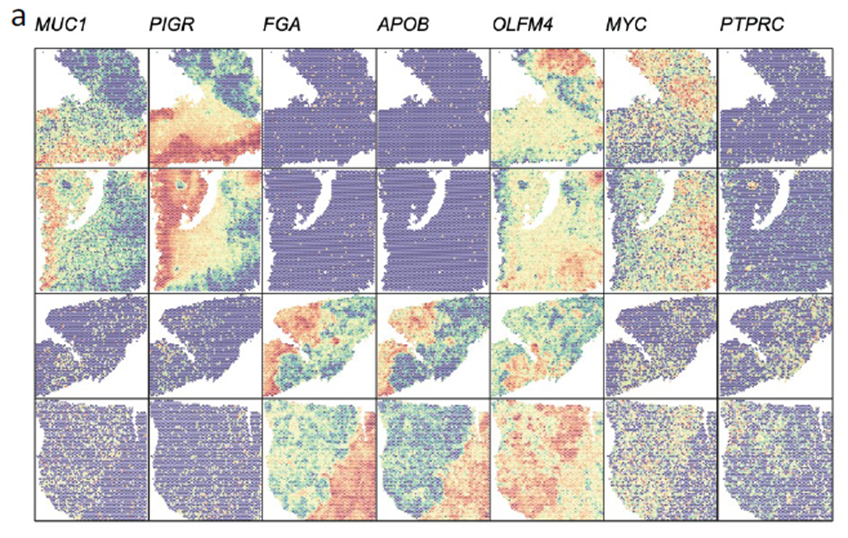

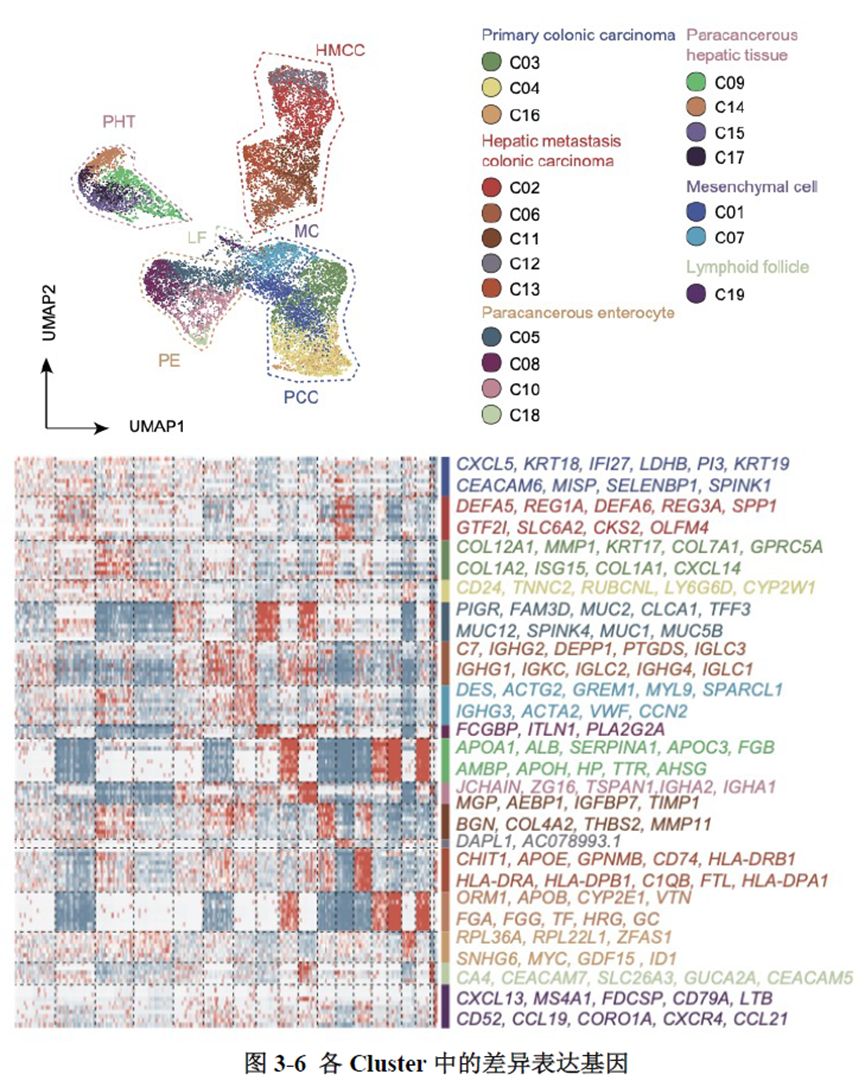
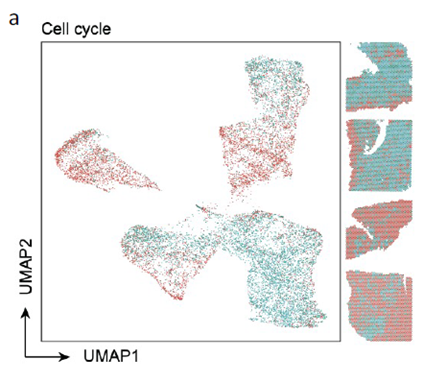
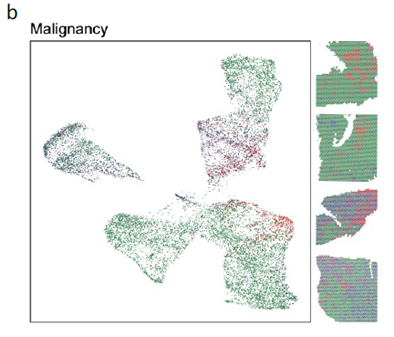
测序分析结果展示了CRC原发灶及肝转移灶的空间基因表达图谱,并进行了每个亚群的基因表达特征分析,进一步对肿瘤转移相关的CSC细胞的标志基因进行分析,结果显示转移灶中存在CSC的富集;并对转移相关上皮间充质转化的状态进行评分,Cluster 中细胞周期评分最高且p-EMT 评分最低被认为含有的肿瘤细胞最多。
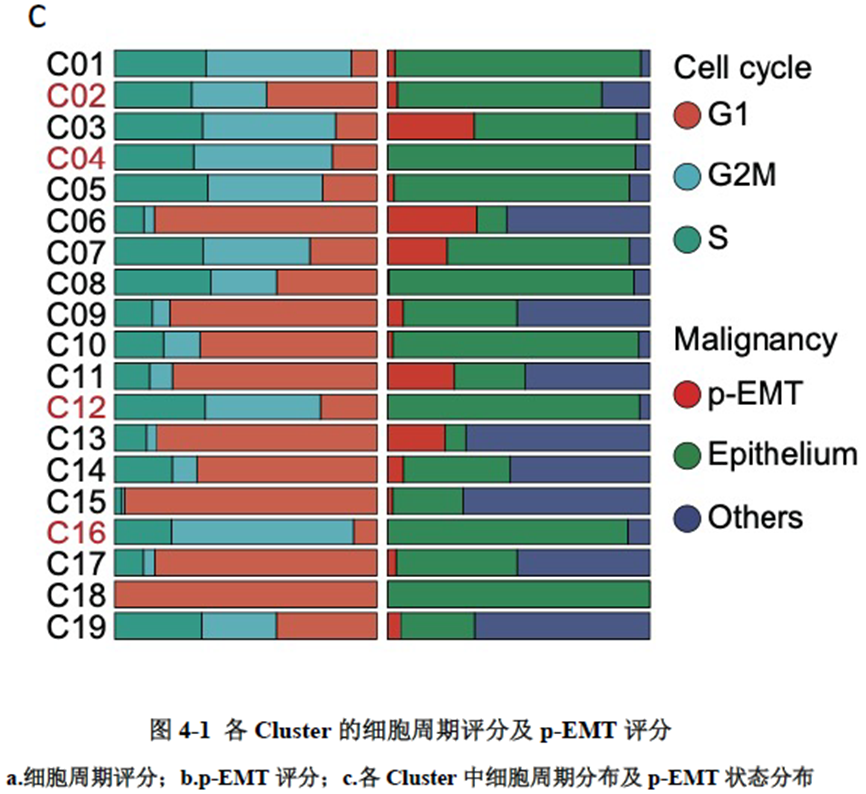
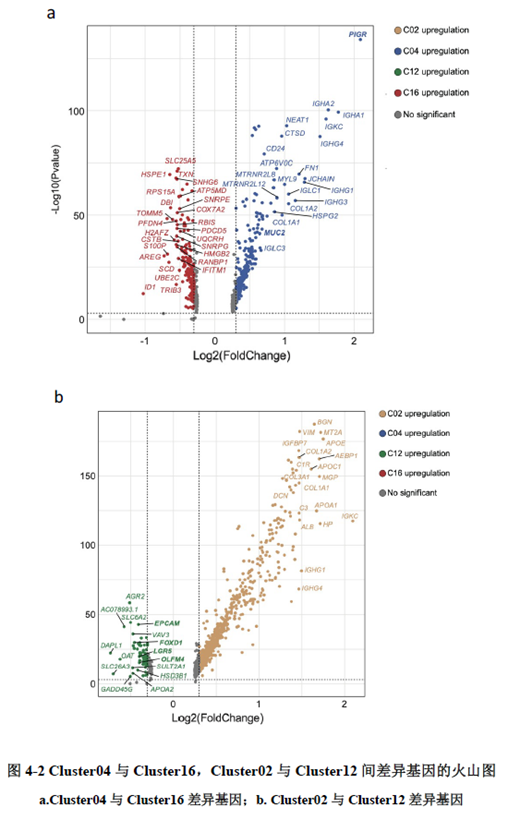
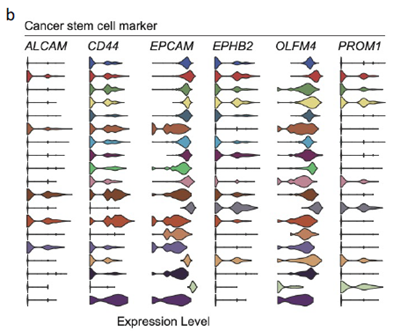
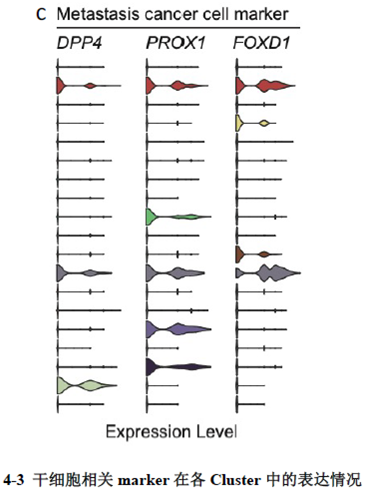
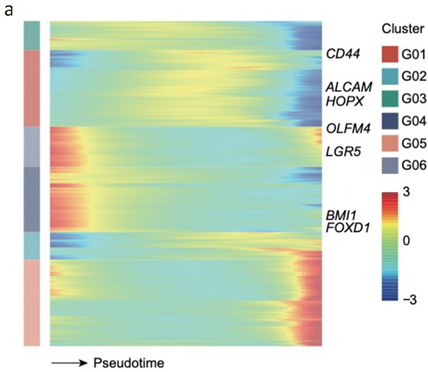
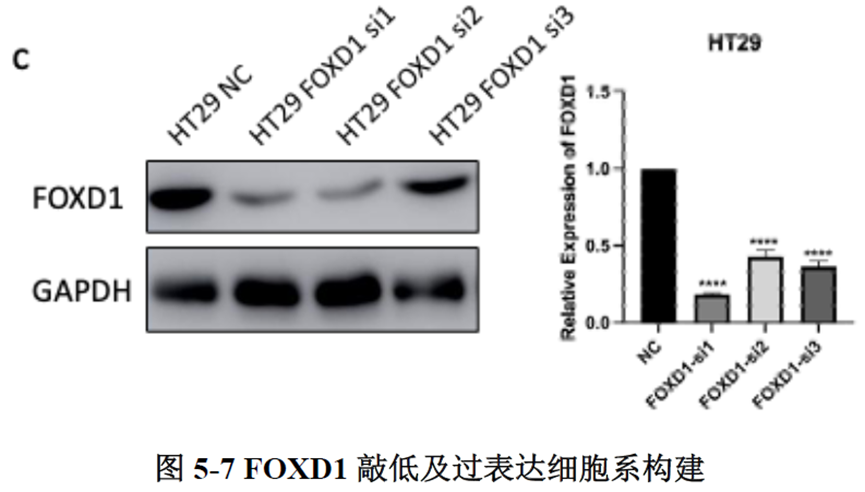
已挑选到的Cluster 进行差异基因分析,作者发现EPCAM、LGR5、OLFM4以及FOXD1等与肿瘤干细胞相关的marker在Cluster12 中有明显的富集。进一步进行肿瘤干细胞相关标志基因的分析,结果显示FOXD1与转移相关基因DPP4和PROX1在各亚群中有相似的表达模式,提示FOXD1很有可能也是转移性肿瘤干细胞的marker。
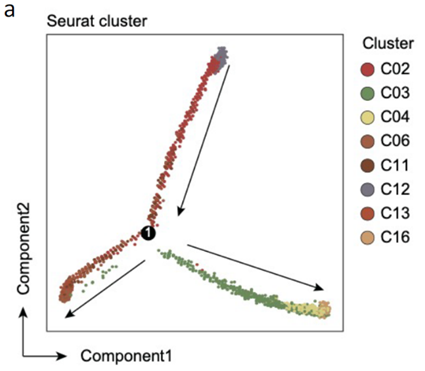
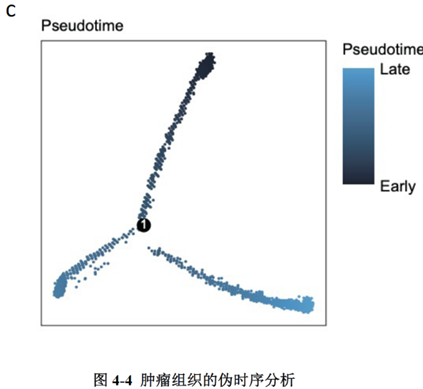
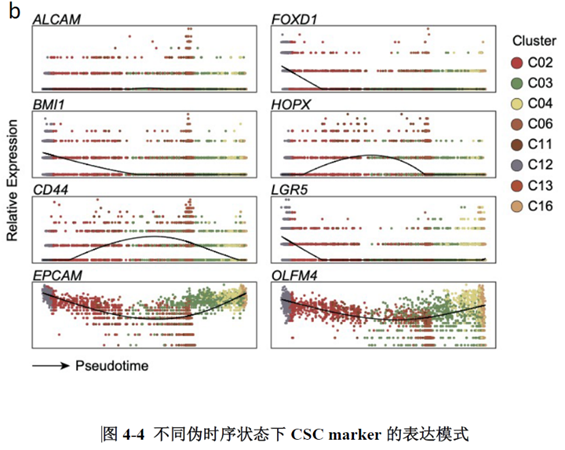
为了进一步分析肿瘤转移发生的机制,作者使用了伪时序和细胞轨迹分析揭示转移形成过程中肿瘤细胞的去分化-再分化过程,结果表明在转移灶形成的过程中,肿瘤细胞先经历去分化形成转移灶,随后在转移灶中经历再分化使其在转移灶中定植,在各种拟时状态下分析细胞标志基因的表达,结果显示FOXD1和肿瘤干细胞中基因LGR5的表达模式是一致的,提示两者可能存在相互作用。

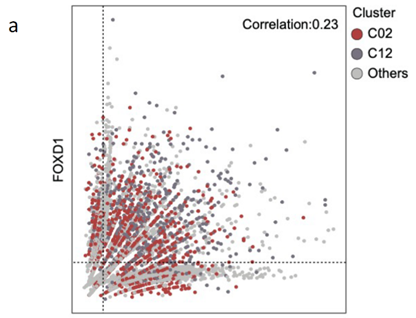
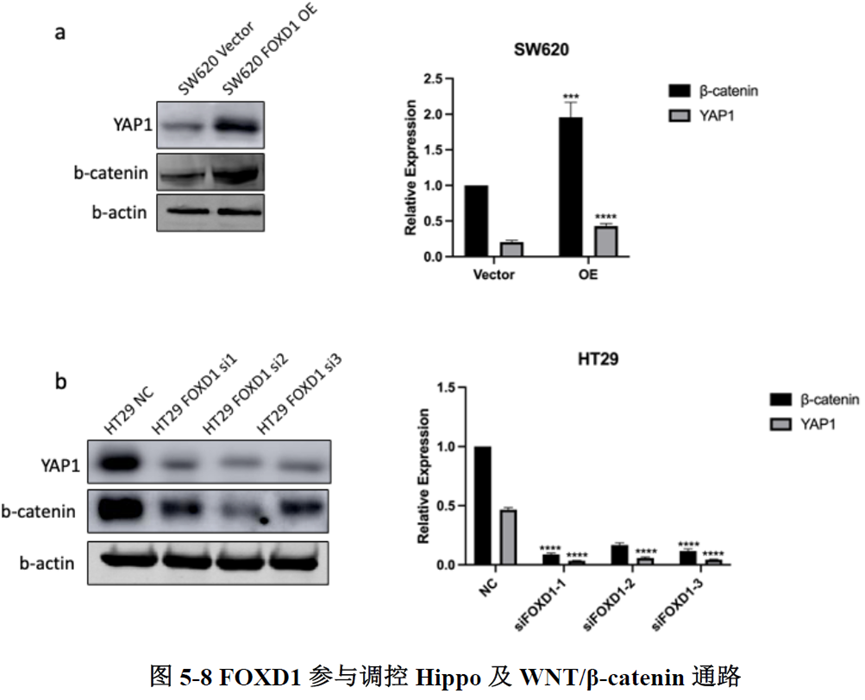
对FOXD1 与LGR5进行相关性分析,发现两者存在正相关的关系。对各亚群中相关信号通路进行分析,结果显示转移灶中Hippo 通路与WNT/β-catenin 均被激活且存在相互作用,细胞间通讯分析发现转移过程中MIF与CD74的相互作用占主要作用。

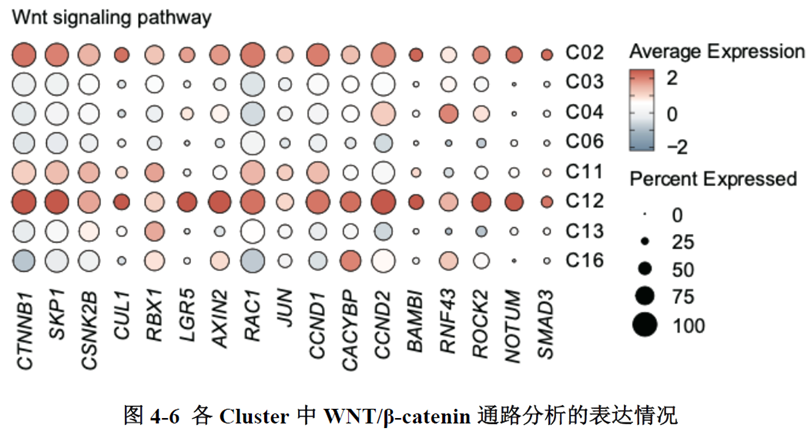
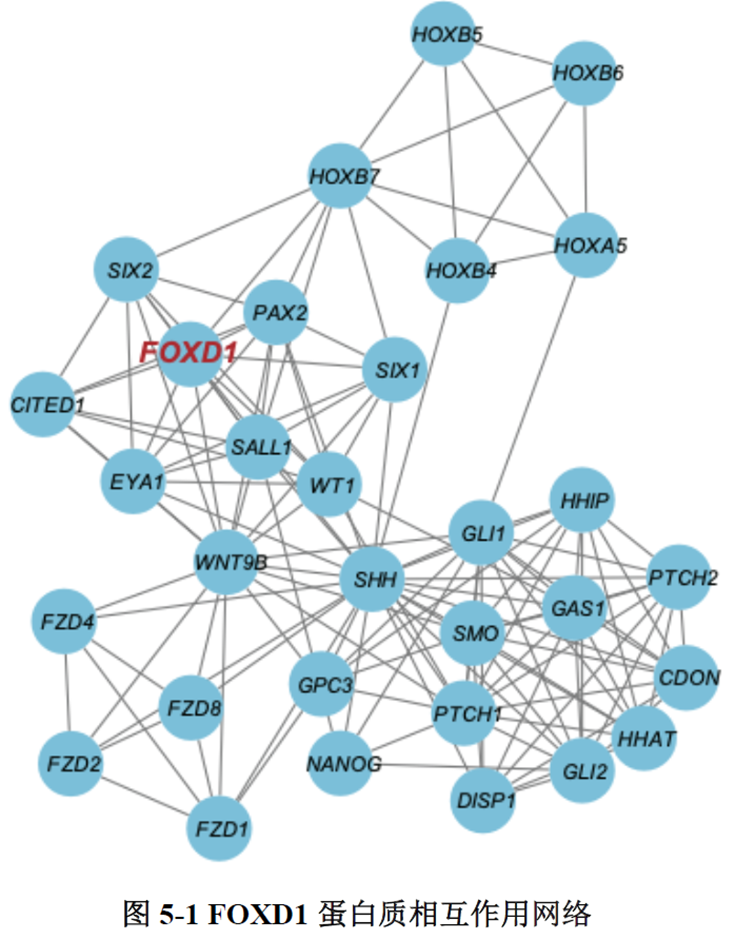
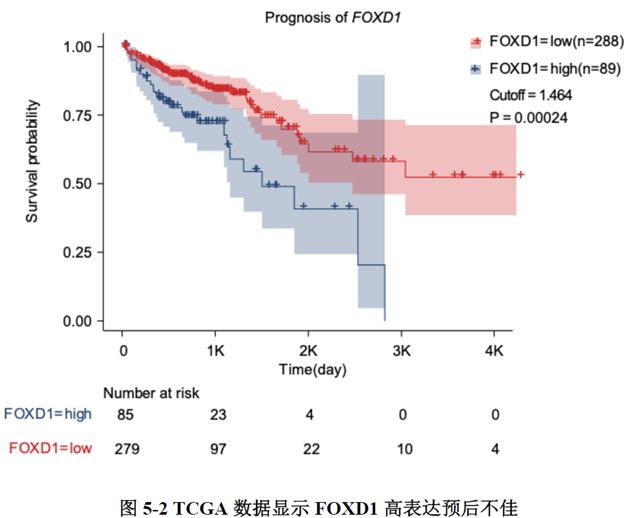
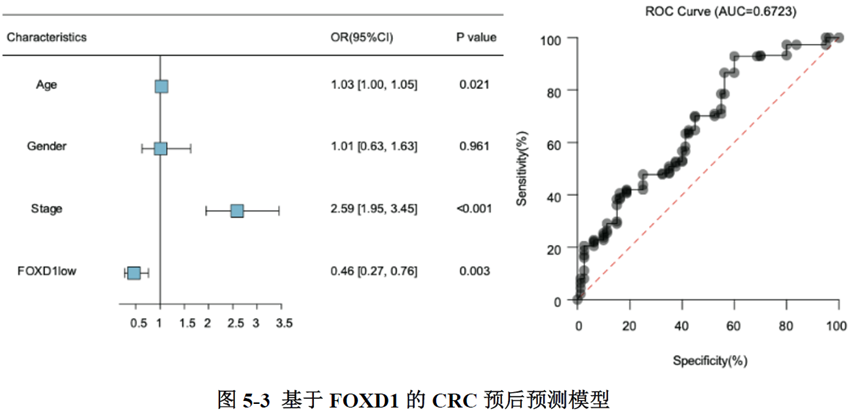
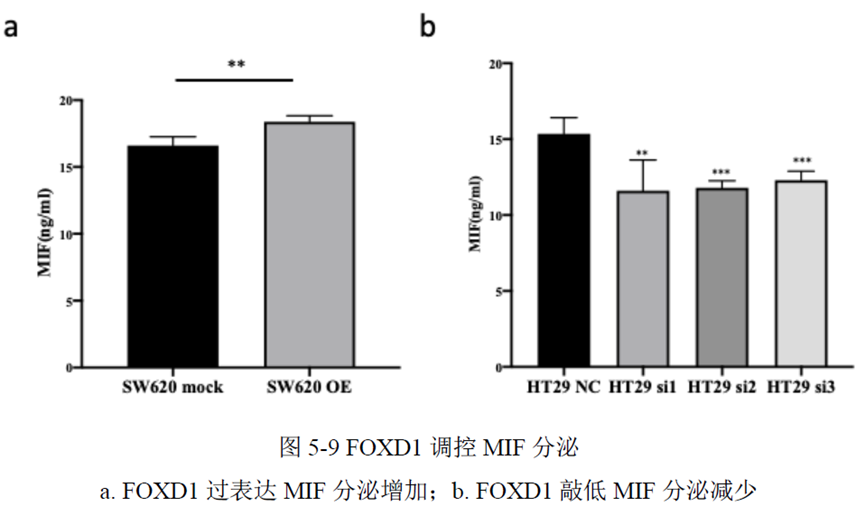
最后一章中,作者对于FOXD1在CRC肝转移中发挥的作用进行了验证,首先蛋白质-蛋白质相互作用(PPI)网络表明FOXD1与Wnt/β-catenin信号通路存在相互作用,其次临床发现FOXD1 表达量高的病人预后较差,选取结直肠癌细胞系进行实验,WB发现FOXD1 过表达后β-catenin 及YAP 的表达量上升,FOXD1 敲低后β-catenin及YAP 的表达量下降,ELISA发现FOXD1 过表达的肿瘤细胞其MIF 分泌增加,总的来说FOXD1的表达能够影响WNT/β-catenin 通路,进而促进CRC肝转移的发生发展。
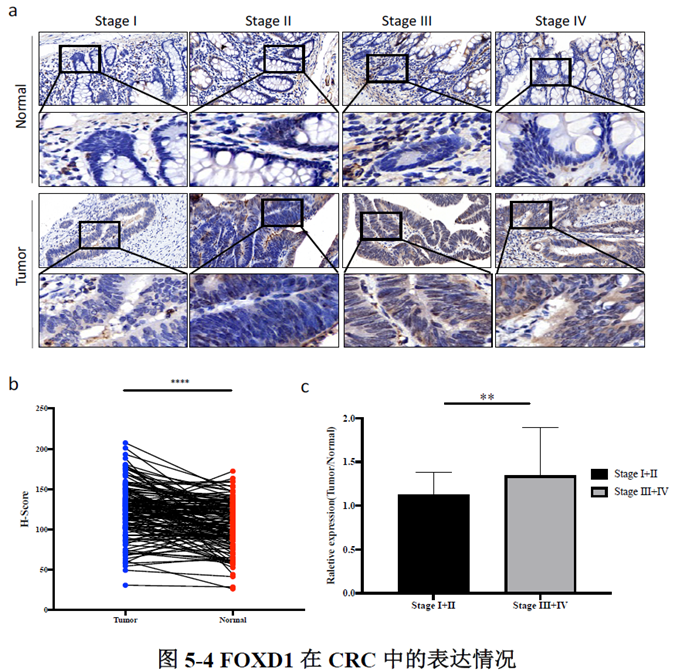
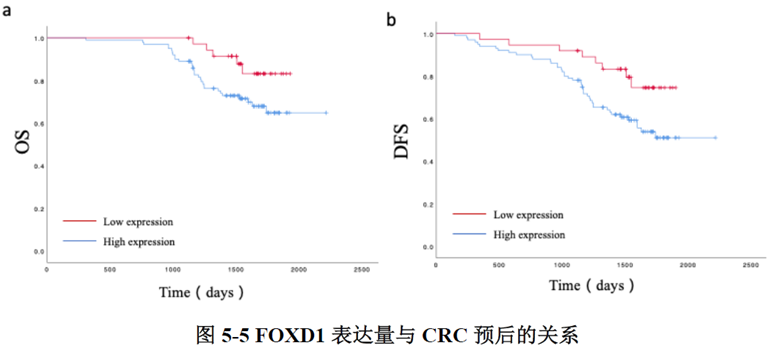
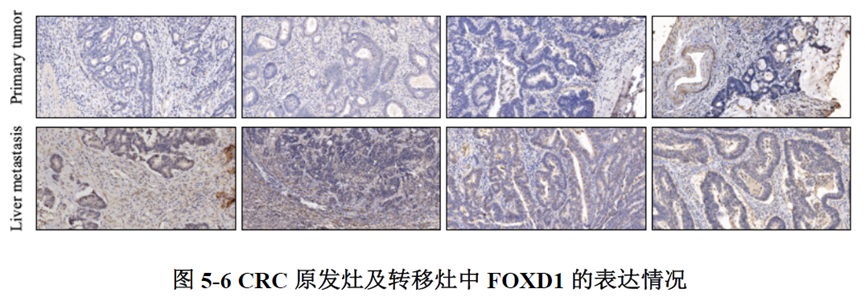
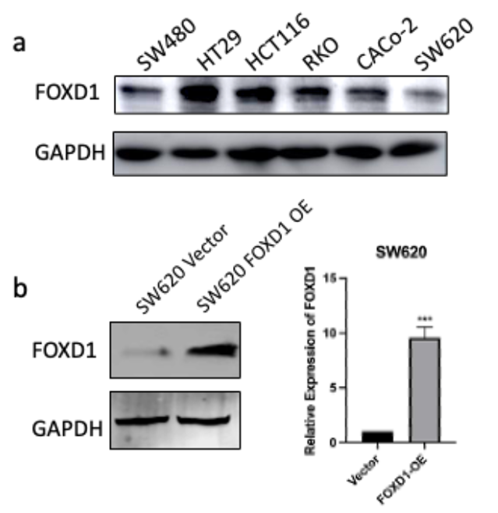
这篇文章主要通过空间转录组学数据分析找到了促进CRC肝转移的FOXD1基因,近而进行了一系列实验对结果进行了验证,为CRC肝转移的研究提供了新的研究方向,数据虽然不太多,但是对于肿瘤转移机制的摸索让测序结果的分析变得更加可靠,后续需要做验证的同学可以参考一下实验思路。
参考文献
【1】伍睿. 基于空间转录组学技术对原发性肝癌空间异质性的研究[D].中国人民解放军海军军医大学,2022.DOI:10.26998/d.cnki.gjuyu.2021.000245.
【2】郭鹏程. 利用时空多组学解析肝脏功能结构及肝再生、肝纤维化分子机制的研究[D].吉林大学,2023.DOI:10.27162/d.cnki.gjlin.2023.000867.
【3】贾二腾. 空间转录组测序样本准备及在帕金森病中的应用研究[D].东南大学,2022.DOI:10.27014/d.cnki.gdnau.2022.003769.
【4】周乐其. 基于空间转录组技术的结直肠癌肝转移肿瘤内异质性及肿瘤干细胞研究[D].中国人民解放军海军军医大学2023.DOI:10.26998/d.cnki.gjuyu.2022.000031.
























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








