一:系统和环境和相
1:系统:被研究的对象
环境:系统之外与其密切相关的部分。
系统可分为三种:
{ 敞开,封闭,隔离}
敞开系统:系统和环境既有物质交换也有能量交换
封闭系统:系统与环境只有能量交换,没有物质交换
隔离系统:系统与环境既没有物质交换也没有能量交换
相:系统中具有相同的物理和化学性质的均匀部分
相界面:相与相之间的面向的分界,超过此界面一定有某种宏观性质发生变化
二:状态和状态函数:
状态:宏观物理量所确定下来的系统的存在形式。
状态函数:确定系统状态的宏观物理量
状态函数的特性:
状态一定,状态函数一定;状态变化,状态函数一定变化;
只与状态函数的始态和终态有关,与变化途径无关
三:化学计量数和反应进度
化学计量数:

反应进度:

ξ与化学计量数有关,而化学计量数和化学方程式有关,所以在讲反应进度的时候要指明反应方程式。
特别的当ξ=1时,称为单位反应进度,也就是整个化学方程完整的进行了一次。
四:过程和途径
过程:当系统发生一个任意状态的变化时,我们就说这个系统经历了一个过程(等温等压等积等)
途径:完成系统状态变化的具体步骤
五:热和功
热:系统环境因为温度不同而传递的能量
功:系统与环境除了热以外传递的其他能量
功包含:体积功和非体积功

关于Q,W的正负
体积增大就是对外做功
体积减小就是外界对内做功

需要注意的是Q,W不是状态函数,而是过程函数,他们与他们变化的具体过程有关,不同的途径有不同的功和热的交换,不能说系统含有多少热或者多少功这类描述状态的词。
六:热力学第一定律
热力学能(U):是系统内所有能量的总和
U是状态函数,ΔU=U末-U初
大于0时,系统能量增加
小于0时,系统能量减少
热力学第一定律:
能量转换与守恒定律:
在封闭系统中能的形式可以相互转化但是不会凭空消失。
系统热力学能的改变值:
ΔU=Q+W
!
!
!
七:热化学和盖斯定律
热化学:是研究化学反应热效应及其规律的科学
化学反应热效应:
在系统不做非体积功的情况下,热力学能的变化总是以热和功的形式表现出来,而以热表现出来的部分就是热效应。也就是ΔU=Q+W中Q的部分。
按照不同的路径又把Q分为

(1)Q(v):
在等温条件下,气体在恒容且不做非体积功的化学反应过程中与环境交换的热。
测量:
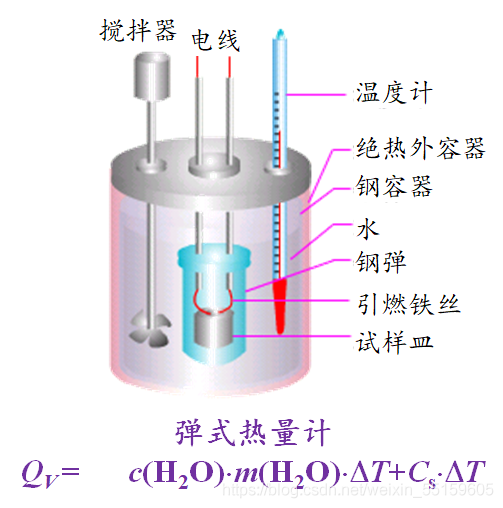
c为液态水比热容:为4.2*103J/kg.oc
比热容公式:C=Q/mT
这个实验装置为密闭容器,所以不受外界影响,体积也是不变的,所以他的Q全都转化为水的热能最后就是呈现的就是水的温度变化,还有其他材质的温度变化。
由于是恒容,所以体积功为0
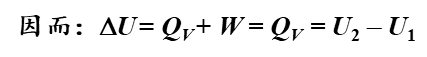
也就是说,在这样的等温等压条件下热力学能的变化全是由于热量的传递造成的。
(2)Q (p)
恒压反应热,与焓变ΔH**
恒压反应热:在等温条件下,系统在恒压不做非体积功的过程中的化学反应热效应。
大多数反应都是在恒压的条件下进行的,所以一般反应热效应不特别注明均为恒压反应热。
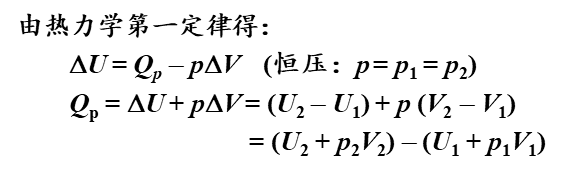
在这样的条件下:
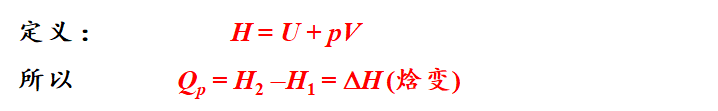
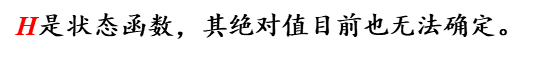
ΔH的物理意义

必须是恒温恒压下!!!

因此就有以下公式:
!!!!!!!!!!!!!!!!!!!!!
非常重要
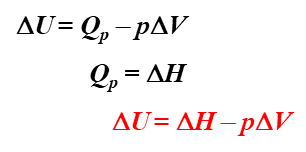
注意:当反应物和生成物都是固态的时候ΔV很小可以忽略不计,所以这时候

对有气体参与的化学反应,ΔV值很大,假设为理想气体那么
!!!!!!!!!!!
很重要
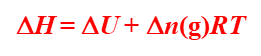
其中的Δn为生成气体物质的量减去反应气体物质的量
(3)盖斯定律
简要内容其实也可以理解为热力学第一定律的延伸
在不做其他功并处于恒容或者恒压得状态下,任一化学反应,不论是分一步还是分几步,其最终化学反应的热效应是相同的。
也就是反应前后的焓的变化是相同的
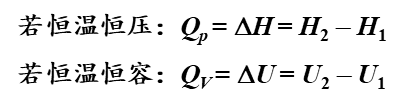
理解就是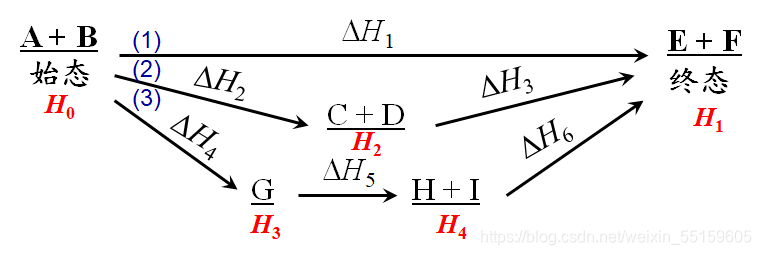
如图 ΔH1 = ΔH2 + ΔH3 = ΔH4 + ΔH5 + ΔH6
八:化学反应焓变的计算
(1)物质的标准状态:

具体物质的标准状态:
纯理想气体的标准状态是该气体处于标准压力下的pθ下的状态:
混合理想气体中任一组分的分压为pθ的状态。
纯液体(纯固体)物质的标准态就是在标准压力pθ的纯液体(纯固体)
溶液的标准态就是在标准压力pθ下,溶质的浓度为Cθ的溶液(C^θ=1mol/l)
(2)标准摩尔反应焓r
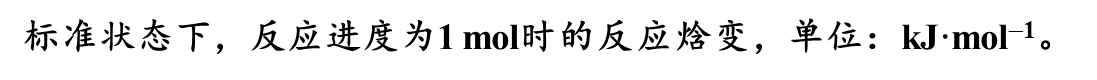
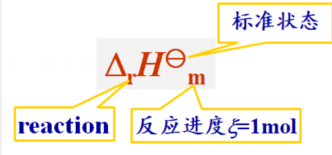
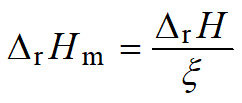

如下
(3)热化学方程式


也就是要完整的进行依次反应,也是反应进度为1mol而不是生成物的量为1mol

(4)标准摩尔生成焓f(其实就是一种反应生成热)
标准摩尔反应焓与其有一定关系,是通过查生成焓的表计算而来,
生成焓是个别的物质的焓变,而反应焓是整个方程式的焓变。


**
标准摩尔生成焓一般可查表获得,查阅的时候还要注意物质的状态是液态还是固态

这个单质是由人主观规定出来的。并规定该单质的,ΔfG°=0 kJ•mol-1、ΔfH°=0 kJ•mol-1。它通常是某元素中能量最低的单质。但也可能是最常用的单质。
(5)标准摩尔反应焓的计算

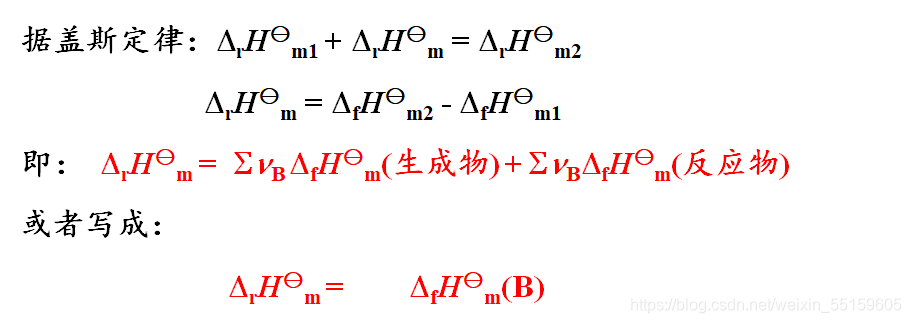

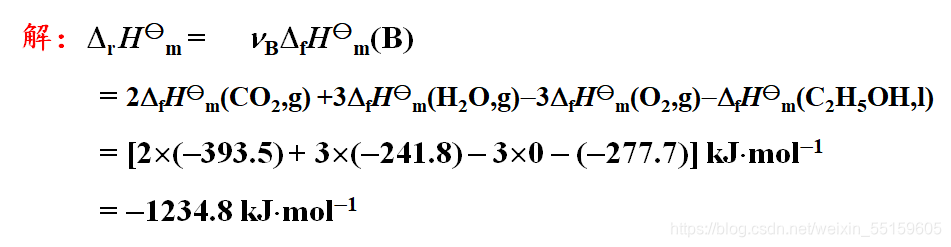
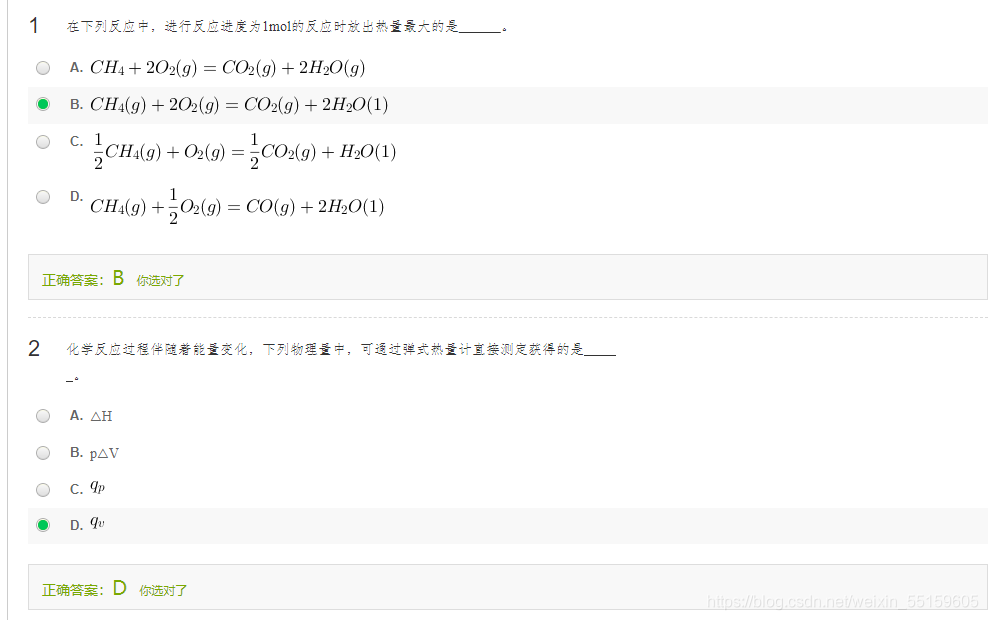
第一题查表即可
第二题概念

第一题液态氯气不稳定
第二题利用ΔH=ΔU+ΔnRT
第三题满足反应物是稳定单质才可以
第四题:要求的就是1mol状态下的标准生成热。






















 988
988











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








