Metabolic engineering of commensal bacteria for gut butyrate delivery and dissection of host-microbe interaction

Research Article,2023-09-17,Metabolic Engineering,[IF 8.4]
DOI:https://doi.org/10.1016/j.ymben.2023.09.008
通讯作者:Yun Yang (杨昀);Guo-Qiang Chen (陈国强)
第一作者:Xu Gong (巩旭);Hongwei Geng (耿洪伟)
合作作者:Shuyi Zhangc (张数一);Zilong He (贺子龙);Yubo Fan (樊瑜波);Fengyi Yin (阴凤怡);Zhifa Zhang (张志发)
主要单位:
北京航空航天大学医学科学与工程学院 (Beijing Advanced Innovation Centre for Biomedical Engineering, Key Laboratory for Biomechanics and Mechanobiology of Ministry of Education, School of Engineering Medicine, Beihang University, Beijing, PR China)
北京航空航天大学工业和信息部大数据精准医疗重点实验室 (Key Laboratory of Big Data-Based Precision Medicine, Ministry of Industry and Information Technology, Beihang University Beijing, PR China)
清华大学药学院 (School of Pharmaceutical Sciences, Tsinghua University, Beijing, PR China
清华大学生命科学学院合成与系统生物学研究中心 (Center for Synthetic and Systems Biology, School of Life Sciences, Tsinghua University, Beijing, PR China)
清华大学化学工程系工业生物催化教育部重点实验室 (MOE Key Lab of Industrial Biocatalysis, Department of Chemical Engineering, Tsinghua University, Beijing, PR China)
清华大学生命科学学院清华-北京生命科学研究中心 (Tsinghua-Peking Center for Life Sciences, School of Life Sciences, Tsinghua University, Beijing, PR China)
- 摘要 -
众多研究报道了产丁酸共生菌丰度减少与多种疾病的相关性。然而,由于缺乏精准调控肠道丁酸含量的有效工具,肠道丁酸与各种疾病的因果关系研究较少,肠道丁酸调节宿主粘膜免疫的具体分子机制尚不清晰。在此,我们构建了一种基因工程改造的兼性厌氧共生菌,靶向肠道有效递送丁酸,在小鼠慢性结肠炎疾病模型中解析了肠道丁酸调节宿主粘膜免疫的分子机制。我们发现,肠道丁酸发挥组蛋白去乙酰化酶HDAC3抑制剂效应,抑制结肠上皮细胞的细胞焦亡执行蛋白消皮素D(GSDMD),从而抑制细胞焦亡并缓解结肠炎和维持肠道粘膜稳态。总之,我们构建了一株高产丁酸的基因工程益生菌,是具有缓解结肠炎功效的潜在活体药,也是研究肠道丁酸与宿主互作因果关系和分子机理的研究工具,为研究肠道菌群代谢物与宿主相互作用提供了新的研究范式。
- 引言 -
短链脂肪酸(SCFAs)是肠道菌群在结直肠中发酵膳食纤维产生的微生物代谢产物,其中丁酸在促进肠道稳态方面发挥重要作用。多种疾病如肠炎、代谢性疾病及神经退行性疾病等,在患者粪便样本中常常观察到丁酸生产菌丰度下降及丁酸含量减少。大量的肠道菌群研究显示了产丁酸共生菌与多种疾病间的紧密相关性。近年来的研究致力于进一步解析肠道微生物代谢产物丁酸与宿主互作的因果关系,这对于理解肠道丁酸如何影响宿主稳态和各种疾病发生发展具有重要意义。
为了从相关性研究过渡到因果关系研究,已有多种工具被应用于调节肠道丁酸水平,从而帮助研究肠道丁酸调节宿主生理功能的因果机制。已有研究通常采用口服膳食纤维、丁酸盐或产丁酸工程菌来增加肠道丁酸水平,并报道了丁酸通过G蛋白偶联受体(GPCR)激动剂或组蛋白去乙酰化酶抑制剂效应,从而促进肠上皮屏障功能、调节宿主代谢、免疫和神经元发育等。然而,受限于这些丁酸递送工具的效率,肠道丁酸调节肠道黏膜免疫甚至远端远端器官的具体分子机制仍不清晰。
膳食纤维经肠道菌群代谢转化为SCFAs,经常被用于提高肠道丁酸水平并研究丁酸对宿主影响。然而,肠道菌群代谢膳食纤维最终产生SCFAs的水平,受到膳食纤维成分及肠道菌群结构的影响。由膳食纤维介导的肠道丁酸调控结果,因肠道菌群结构差异而导致不可控和个体差异。研究肠道丁酸对宿主影响的另一种策略是通过口服、灌胃或灌肠直接给药丁酸,但这种给药途径的丁酸主要在上消化道或灌肠中被吸收,在结直肠中的生物利用度有限。此外,有研究采用口服产丁酸共生菌如丁酸梭菌来靶向肠道递送微生物来源丁酸。然而,多数产丁酸共生菌为严格厌氧菌,具有炎症的肠道中存在的活性氧(ROS)限制了这些产丁酸共生菌的定植;且缺乏产丁酸共生菌的合理实验对照,难以确定丁酸代谢物特异的功能和分子机制。因此,以现有工具来解析肠道丁酸在调节宿主生理和病理中的因果作用仍然是一个挑战。
为了应对这一挑战,我们构建了一种靶向肠道递送丁酸的基因工程共生菌,在此基础上探索肠道菌群与宿主间分子界面的互作机制。在对ROS敏感性更低的兼性厌氧共生菌——大肠杆菌Nissle 1917(EcN)中引入外源丁酸合成途径。野生型EcN无法合成丁酸,而基因工程改造的EcN可在模拟肠道培养条件下生产高达1.4 g/L丁酸。在小鼠慢性结肠炎模型中,产丁酸重组EcN可在含有炎症的结直肠中成功定植并分泌丁酸,肠道丁酸显著缓解结肠炎症状。通过对比野生型EcN和产丁酸重组EcN,我们解析了肠道丁酸缓解结肠炎的具体分子机制:肠道丁酸发挥HDAC3抑制剂效应,抑制结直肠上皮细胞的细胞焦亡执行关键蛋白GSDMD从而缓解结肠炎。我们的工作开发了一种新型、高效的肠道丁酸递送工具,并首次阐明了肠道丁酸通过GSDMD调节肠粘膜免疫、维持肠道稳态的因果效应和分子机制,为利用基因工程活细菌解析肠道菌群代谢物与宿主互作的因果关系和分子机理提供了研究范式。
- 结果 -
在兼性厌氧共生菌底盘中整入丁酸合成途径
Incorporation of a synthetic butyrate synthesis pathway into a facultative anaerobic commensal chassis
构建产丁酸基因工程共生菌的策略为,在兼性厌氧共生菌EcN内引入外源丁酸合成途径,并抑制丁酸合成途径的竞争支路代谢流(图2A)。合成1分子丁酸需要2分子NADH和2分子乙酰辅酶A,而乳酸和乙醇合成均消耗NADH和乙酰辅酶A,是丁酸合成的竞争途径。因此,我们敲除了乳酸脱氢酶 (ldhA) 和乙醇脱氢酶 (adhE) 编码基因,从而增加丁酸合成前体乙酰辅酶A含量,并提高合成丁酸的NADH驱动力。
接着,在∆ldhA∆adhE EcN中引入与EcN能量代谢模式适配的丁酸合成途径。该途径由乙酰辅酶A乙酰转移酶、3-羟基丁基辅酶A脱氢酶、烯酰辅酶A水合酶、反式烯酰辅酶A还原酶和酰基辅酶 A硫酯酶组成。对具有或潜在高酶活的丁酸合成途径各个基因进行了密码子优化,如phaA(来自Cupriavidus necator的乙酰辅酶A乙酰转移酶),hbd-crt(来自Clostridium acetobutylicum的3-羟基丁基辅酶A脱氢酶和S特异性烯酰辅酶A水合酶),hbd-crt(来自C. tyrobutyricum),phaB-phaJ(来自Chromatiurn vinosum的乙酰乙酰辅酶A还原酶,来自Aeromonas caviae的烯酰辅酶A水合酶),ter(来自Treponema denticola的反式烯基辅酶A还原酶)。比较了含有不同基因组合丁酸合成途径的合成效果,phaA、hbd-crt(来自C. acetobutylicum)、ter和tesB(来自E. coli的酰基辅酶A硫酯酶)的组合丁酸产量相对较高,并被整合到∆ldhA∆adhE EcN基因组中。因结直肠是微氧环境,由厌氧诱导启动子PfnrS控制丁酸合成基因表达。该重组EcN菌株M3在M9培养基和微氧条件下可产生0.29 ± 0.02 g/L丁酸 (图2B)。

图1 研究策略及实验流程示意图
优化丁酸合成途径以增加工程菌丁酸产量
Optimization of the butyrate synthesis pathway for enhanced butyrate production
为了提高重组EcN的丁酸产量,我们依次优化了丁酸合成途径的三个模块,模块1——乙酰辅酶A到3-羟基丁酰辅酶A,模块2——3-羟基丁酰辅酶A到丁酰辅酶A,模块3——丁酰辅酶A到丁酸。
通过评价在EcN M3菌株内分别过表达每个模块对丁酸产量的影响,发现了含有Crt和Ter的模块2是丁酸合成途径的限速步骤。因此,我们对模块2进行进一步改造,优化了Crt与Ter的比例及表达强度(图2C),最优模块2含有1拷贝crt和3拷贝ter,丁酸产量显著提高至EcN M3P2的0.67 ± 0.02 g/L。
在成功增加模块2的代谢流后,对含有酰基辅酶A硫酯酶的模块3进一步优化,并测试了丁酰辅酶A特异性较高的E. coli来源的TesB和YciA。采用表达强度更高的核糖体结合位点替换EcN M3P2中tesB的核糖体结合位点,重组EcN M3P2T的丁酸生产能力提升至1.09 ± 0.02 g/L,显著优于模块2中使用YciA的EcN M3P2Y 菌株(图2D)。
最后,为了导向更多的乙酰辅酶A进入丁酸合成途径,我们优化了模块1中乙酰辅酶A乙酰转移酶的酶元件。比较了来自C. necator的PhaA、来自C. acetobutylicum的Thil、来自C. tyrobutyricum的Thl和来自大肠杆菌的AtoB。将EcN M3P2T中的phaA替换为atoB,得到的重组EcN菌株M3P2TA,可生产高达约1.4 g/L 丁酸(图2E)。最终,我们成功构建了一株具有高产丁酸能力的基因工程EcN,在模拟肠道培养条件下的产量高达~1.4 g/L,是目前基因工程EcN研究报道的最高产量。
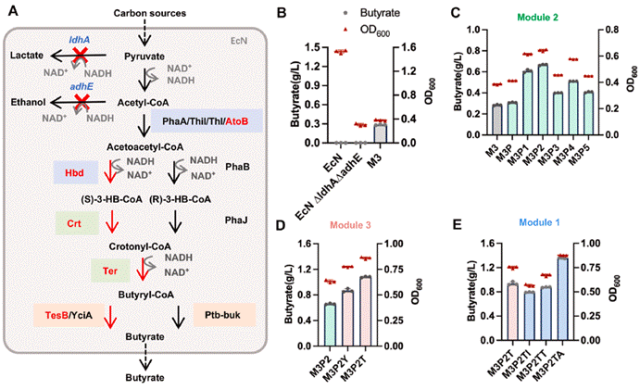
图2 代谢工程改造E. coli Nissle 1917用于在宿主-肠道菌群界面递送丁酸
工程菌EcN M3P2TA可在结肠炎小鼠中定殖并增加肠道丁酸水平
Engineered EcN M3P2TA colonized and increased gut butyrate in colitis mice
以小鼠结肠炎模型为例,我们研究了重组EcN M3P2TA在肠道的定殖情况和丁酸递送效率。在C57BL/6小鼠中,经3个周期的间隔性葡聚糖硫酸钠 (DSS) 处理,成功诱导小鼠慢性结肠炎疾病模型 (图1B)。每两天灌胃含有卡纳霉素抗性基因标记的野生型EcN或工程菌EcN M3P2TA,在灌胃后的一系列时间点,通过检测粪便中的EcN菌株含量来监测其肠道定殖情况(补充材料图3D)。野生型EcN和重组EcN M3P2TA菌株在灌胃后的粪便样本中含量及变化趋势非常相似,均在灌胃后4 h大幅增加并在48 h内减少,表明EcN M3P2TA的肠道定殖活力与野生型EcN相当。值得注意的是,口服EcN M3P2TA 4小时后,小鼠粪便中丁酸水平显著提高,比野生型EcN高2倍以上 (补充材料图3E)。这些结果表明,产丁酸基因工程菌EcN M3P2TA能够在体内具有炎症环境的肠道中定殖并分泌丁酸。
工程菌EcN M3P2TA递送的肠道丁酸可缓解DSS诱导的小鼠慢性肠炎
Gut butyrate delivered by EcN M3P2TA ameliorated DSS-induced murine chronic colitis
在DSS诱导的慢性结肠炎小鼠模型中,研究具有丁酸合成模块的EcN M3P2TA的治疗效果。以健康小鼠口服生理盐水作为对照,结肠炎小鼠分别给药生理盐水、野生型EcN或EcN M3P2TA进行比较研究。与结肠炎小鼠灌胃生理盐水组相比,灌胃野生型EcN组没有显著治疗效果,而给药重组EcN M3P2TA组的结肠炎小鼠,其结肠缩短程度、疾病活动指数 (DAI) 评分和体重减轻程度显著缓解 (图3A-C),表明肠道丁酸可显著抑制结肠炎疾病的发生发展。在结肠炎小鼠中,肠屏障受损、免疫细胞浸润,促炎细胞因子IL-1β、TNFα、IL-6等水平增加。而EcN M3P2TA在肠道递送的丁酸可显著改善肠上皮屏障功能,减少免疫细胞浸润 (图3D),降低这些炎症因子水平 (图3E)。
此外,我们对各组小鼠粪便样本进行了16S rRNA基因测序和菌群结构分析,通过Chao1、ACE、Shannon和inverse Simpson指数评估,DSS诱导结肠炎小鼠的粪便菌群的丰度和α-多样性明显低于健康对照组小鼠。EcN M3P2TA和野生型EcN均可显著恢复结肠炎小鼠菌群的丰度和α-多样性。有趣的是,EcN M3P2TA可显著提高Akkermansia spp.的丰度,该菌株与肠道屏障完整性和抗炎微环境密切相关。这些研究结果表明,重组EcN M3P2TA菌株的丁酸合成功能模块对其改善结肠炎治疗效果至关重要,肠道微生物代谢产物丁酸在抑制肠道炎症及维持肠道稳态方面发挥重要作用。

图3 工程菌EcN M3P2TA在肠道递送丁酸并缓解慢性结肠炎
GSDMD是肠道丁酸影响宿主的潜在关键靶基因
GSDMD was a key candidate gene underlying the efficacy of gut butyrate
为了研究肠道丁酸缓解肠炎的分子机制,对几组小鼠结肠组织进行了RNA测序和转录组分析。主成分分析显示,健康小鼠和结肠炎小鼠的结肠组织转录组间存在明显差异,相比灌胃野生型EcN, 灌胃EcN M3P2TA组结肠炎小鼠的结肠转录谱更接近健康小鼠。火山图分析显示(图4A-B),EcN M3P2TA处理组的结肠转录谱变化范围比野生型EcN处理组更大,上调75个基因并下调636个基因。这些结果表明,EcN M3P2TA递送的肠道丁酸本身而非EcN底盘细胞发挥抑制结肠炎的主导作用。对EcN M3P2TA处理后的差异表达基因进行Gene Ontology分析,免疫相关过程在富集项中排名靠前 (图4C)。将超过20个密切响应EcN M3P2TA治疗的免疫相关基因在热图中显示(图4D),发现了细胞焦亡执行关键蛋白GSDMD与工程菌递送的肠道丁酸具有高度相关性。据报道,该蛋白主要位于结肠上皮,且在炎症性肠病(IBD)患者和DSS诱导的结肠炎小鼠的发病机制中发挥关键作用。
为了进一步验证肠道丁酸与肠上皮细胞GSDMD间的密切关联,采用western blot和免疫荧光测量了四组小鼠结肠样品中GSDMD的蛋白含量 (图4E-F),与RNA-seq结果一致,观察到结肠中全长GSDMD和GSDMD-N蛋白含量在DSS处理下增加,而用产丁酸工程菌治疗后显著降低 (图4E-F)。

图4 筛选肠道丁酸缓解结肠炎的下游关键候选基因
肠道丁酸主要通过抑制GSDMD来缓解小鼠慢性结肠炎
Gut butyrate attenuated murine chronic colitis predominantly via GSDMD inhibition
我们采用结肠外植体实验进一步研究丁酸功效与GSDMD抑制的关联。结肠炎小鼠的结肠外植体与丁酸共孵育24小时后,结肠组织的GSDMD和促炎因子IL-1β、IL-6和TNF-α的表达水平显著降低。与健康对照组相比,在结肠炎小鼠的结肠外植体中观察到由GSDMD膜穿孔介导的促炎因子IL-1β释放到上清液中。经丁酸处理后,炎症结肠外植体IL-1β释放量大幅减少 (图5A-C)。由此推测,肠道丁酸通过抑制GSDMD来减轻结肠炎。使用GSDMD抑制剂双硫仑来验证这一假设。与丁酸处理炎症结肠外植体相比,GSDMD抑制剂双硫仑处理在降低促炎细胞因子表达水平及IL-1β释放方面具有类似效果,而双硫仑和丁酸叠加处理并不能进一步降低促炎细胞因子表达水平和IL-1β释放(图5D-E)。这些结果表明,丁酸可能通过抑制GSDMD来减轻肠道炎症。

图5 丁酸通过抑制GSDMD来缓解结肠炎症
用GSDMD敲除小鼠进一步验证丁酸治疗结肠炎是否依赖GSDMD。DSS处理均使WT和GSDMD-/-小鼠患结肠炎,两组小鼠的体重变化、DAI评分、结肠长度、上皮缺陷和促炎细胞因子的表达水平相似 (图6A-E)。与灌胃生理盐水的GSDMD-/-结肠炎小鼠相比,GSDMD-/-结肠炎小鼠给药产丁酸重组EcN M3P2TA后,疾病症状无显著缓解,这表明GSDMD是产丁酸重组EcN M3P2TA保护宿主免受DSS刺激损伤的必需靶基因 (图6A-E)。这些研究结果证实,肠道丁酸主要通过抑制GSDMD来缓解结肠炎。

图6 GSDMD是肠道丁酸缓解慢性结肠炎的必需靶基因
丁酸盐作为HDAC3i抑制GSDMD的表达
Butyrate acted as an HDAC3i to repress the expression of GSDMD
我们进一步研究了丁酸抑制结肠上皮细胞GSDMD的分子机制。丁酸介导的细胞内反应主要通过激活GPCR或抑制HDAC实现的。为了研究丁酸是否通过激活GPCR来调节GSDMD,采用GPCR抑制剂百日咳毒素(PT)来测试丁酸功能。丁酸处理的炎症结肠外植体中GSDMD表达水平显著下调,同时添加PT和丁酸后GSDMD的抑制程度与单独使用丁酸处理效果相似,表明丁酸对结肠GSDMD的调控不依赖GPCR 信号通路(图7A)。接下来研究丁酸是否通过HDAC来调节GSDMD表达水平。有研究报道,丁酸对I类HDAC具有较高特异性,将四种特异性靶向I类HDAC的抑制剂作为丁酸功能类似物进行测试,即HDAC1-in-5 (HDAC1特异性抑制剂)、santacruzamate A (HDAC2特异性抑制剂)、HDAC3-in-1 (HDAC3特异性抑制剂)和HDAC8-in-1 (HDAC8特异性抑制剂)。通过比较丁酸与各HDAC抑制剂对炎症结肠外植体的治疗效果,发现了HDAC3抑制剂与丁酸功效类似并显著下调GSDMD表达水平,表明丁酸对GSDMD的抑制作用依赖于其HDAC3抑制剂活性 (图7B)。通过western blot实验检测了丁酸、丁酸与GPCR抑制剂共孵育、HDAC3抑制剂处理的炎症结肠样品中GSDMD蛋白水平,证实了丁酸作为HDAC3抑制剂而不是GPCR激动剂来调节GSDMD表达水平 (图7C)。此外,在人源肠上皮细胞系Caco-2中获得了相似的研究结果 (图7D-F)。这些结果表明,丁酸作为HDAC3抑制剂来抑制GSDMD的分子机制在小鼠和人中具有普适性。

图7 丁酸作为HDAC3抑制剂来抑制GSDMD水平
- 结论 -
我们开发了一种靶向肠道高效递送丁酸的基因工程共生菌,该菌株是治疗结直肠炎等疾病的潜在活体药物,作为肠道丁酸递送工具可促进解析肠道丁酸对结肠上皮和宿主病理的调控分子机制。与以往的促进肠道丁酸水平策略相比,基于工程共生菌来肠道递送丁酸,具有递送效率高、递送丁酸水平可控、维持丁酸的肠粘膜生理位置、野生型共生菌对照组排除底盘菌效应等优势。除结肠炎外,该工程共生菌还可被用于研究肠道丁酸在其他多种疾病中的因果作用,以及肠道丁酸介导的肠-肝轴、肠-肺轴、肠-脑轴等分子机制。
参考文献
Gong X, Geng H, Yang Y, Zhang S, He Z, Fan Y, Yin F, Zhang Z, Chen GQ. Metabolic engineering of commensal bacteria for gut butyrate delivery and dissection of host-microbe interaction. Metab Eng.2023 Nov;80:94-106. doi: 10.1016/j.ymben.2023.09.008. Epub 2023 Sep 17. PMID: 37717646.
- 作者简介 -
通讯作者

北京航空航天大学
杨昀
副教授
杨昀,北京航空航天大学医学科学与工程学院,副教授,博导。主要从事产电菌、益生菌的基因编辑及其理性调控研究,研究基于基因工程微生物的药物递送系统、微生物-宿主互作机制及精准医疗活体微生物药物。在合成生物学、生物催化领域期刊如Adv. Mater.、Energ. Environ. Sci.、ACS Catal.、Metab. Eng.、ACS Syn. Biol.等发表SCI论文30余篇,他引1800余次。荣获 “闵恩泽能源化工奖”青年进步奖(中国工程院&中国石化)、北航“医工百人”计划、北航青年拔尖人才等。

清华大学
陈国强
教授
陈国强,清华大学生命科学学院,教授、博导。长期从事微生物合成聚羟基脂肪酸酯(PHA)及下一代工业生物技术研究,在国际权威期刊上共发表生物技术和生物材料相关论文350多篇, H指数72,获得授权专利50多项。北京微构工场生物技术有限公司创始人,荣获国际代谢工程奖(2023)、全国先进科技工作者(2016)、候德傍化工创新奖(2015)、首届闵恩泽能源化工杰出贡献奖(2013)、谈家祯生命科学创新奖(2011)、教育部长江学者特聘教授、自然科学基金委国家杰出青年等。
宏基因组推荐培训/会议
猜你喜欢
iMeta高引文章 fastp 复杂热图 ggtree 绘图imageGP 网络iNAP
iMeta网页工具 代谢组MetOrigin 美吉云乳酸化预测DeepKla
iMeta综述 肠菌菌群 植物菌群 口腔菌群 蛋白质结构预测
10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature
一文读懂:宏基因组 寄生虫益处 进化树 必备技能:提问 搜索 Endnote
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流快速解决科研困难,我们建立了“宏基因组”讨论群,己有国内外6000+ 科研人员加入。请添加主编微信meta-genomics带你入群,务必备注“姓名-单位-研究方向-职称/年级”。高级职称请注明身份,另有海内外微生物PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。
点击阅读原文,跳转最新文章目录阅读
























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








