 点击蓝字↑↑↑“微生态”,轻松关注不迷路
点击蓝字↑↑↑“微生态”,轻松关注不迷路

生科云网址:https://www.bioincloud.tech
编译:微科盟承乐,编辑:微科盟居居、江舜尧。
微科盟原创微文,欢迎转发转载,转载须注明来源《微生态》公众号。
导读
肠道微生物组及其宿主都参与了砷(As)的生物转化,但其在体内的确切作用和机制尚不清楚。在本研究中,as3mt-/-斑马鱼分别用四环素(TET,100 mg/L)和亚砷酸盐(iAsⅢ)暴露处理30天,并分别用益生菌鼠李糖乳杆菌GG(Lactobacillus rhamnosus,LGG,1×108cfu/g)和iAsⅢ暴露处理15天。结构方程模型分析显示,肠道微生物组对总砷(tAs)和无机砷(iAs)代谢的贡献率分别接近44.0%和18.4%。与野生型斑马鱼相比,as3mt-/-斑马鱼的微生物丰富度和结构与tAs和iAs的相关性更显著,更多差异微生物和微生物代谢途径与砷代谢物显著相关(P<0.05)。补充LGG影响了微生物群落,并显著上调了肝脏中As生物转化相关基因(gss和gst)的表达,下调了肠道中氧化应激基因(sod1、sod2和cat)的表达,增加了砷甜菜碱(AsB)的浓度(P<0.05)。因此,当宿主缺乏关键的砷解毒酶时,肠道微生物组促进As转化并缓解As积累,在iAs胁迫下发挥更积极的作用。LGG可以促进As的生物转化,缓解As暴露下的氧化应激。

图文摘要
论文ID
原名:Effects of Intestinal Microbiota on the Biological Transformation of Arsenic in Zebrafish: Contribution and Mechanism
译名:肠道菌群对斑马鱼体内砷生物转化的影响: 贡献与机制
期刊:Environmental Science & Technology
IF:11.4
发表时间:2024.1
通讯作者:郭莲仙,张晶晶
通讯作者单位:广东医科大学公共卫生学院;广东医科大学附属医院
DOI号:10.1021/acs.est.3c08010
实验设计

结果
1 砷的生物积累和生物转化
为了了解As从丰年虾到斑马鱼的营养转移,本研究检测了饲料(丰年虾,图1a)中tAs和As形态的浓度。丰年虾的CtAs为0.84 mg/kg,鉴定到的主要As形态为AsB(62.8%)、DMA(8.4%)、uAs(28.6%)以及少量MMA(0.2%)。
关于CtAs(图1b,c),在WT斑马鱼中,As组和Abx+As组之间存在显著差异(P<0.05)。在as3mt-/-斑马鱼中,As组和Abx+As组的CtAs显著增加(P<0.05)。As组和Abx+As组as3mt-/-斑马鱼的CtAs(肌肉:分别为0.55和0.77 mg/kg;皮肤:分别为0.22和0.35 mg/kg)显著高于WT斑马鱼(肌肉:分别为0.30和0.50 mg/kg;皮肤:分别为0.39和0.52 mg/kg,P<0.05)。
关于As形态(图1d-g),在WT斑马鱼中,与对照组相比,As组肌肉的CiAs显著增加(P<0.05)。在as3mt-/-斑马鱼中,As组和Abx+As组的CiAs均显著增加(P<0.05)。此外,as3mt-/-斑马鱼两个暴露组的肌肉CiAs显著高于WT斑马鱼相应暴露组(P<0.05)。在砷组成方面(图1a,h),主要的砷化合物为AsB,其在WT的As组中增加,但在Abx+As组中下降,而在as3mt-/-斑马鱼的相应组中均下降。在相同的暴露条件下(As处理和Abx+As处理),as3mt-/-斑马鱼的AsB(%)显著低于WT,iAs(%)显著高于WT。
结构方程模型显示(图2a,b),as3mt和肠道微生物对肌肉iAs代谢的贡献率分别为81.6%和18.4%。as3mt和肠道微生物对宿主tAs代谢的贡献率分别约为56.0%和44.0%。
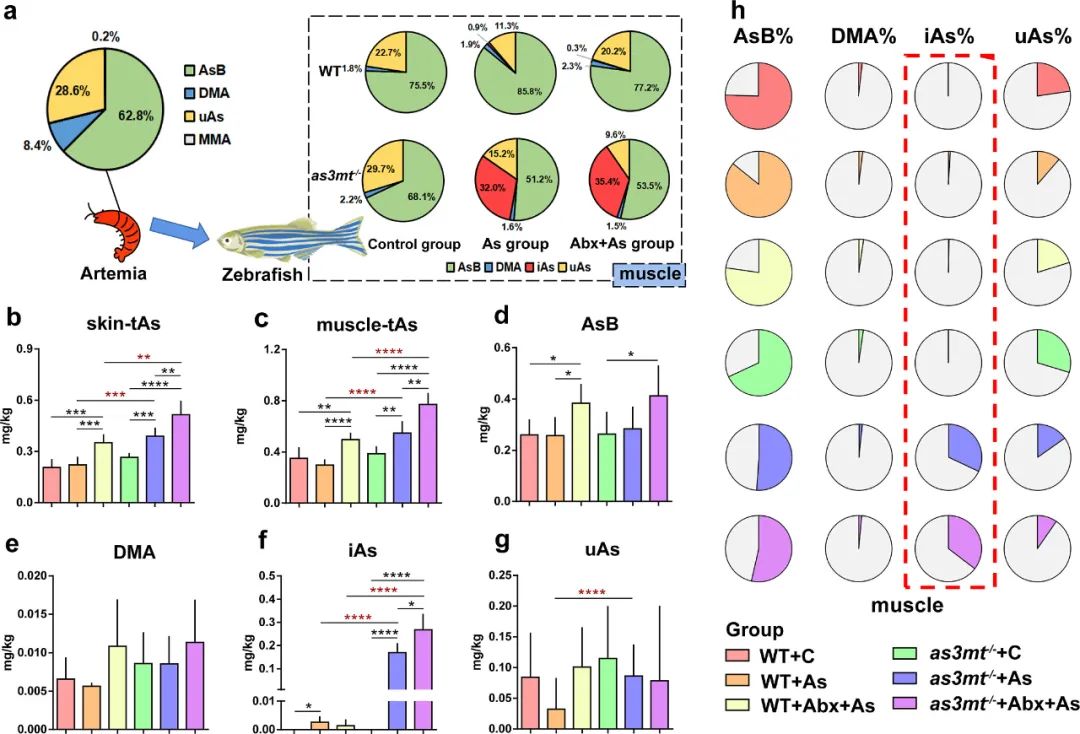
图1.饼状图表明了As从丰年虾到斑马鱼的营养转移(a)。条形图显示了皮肤(b)和肌肉组织(c)中的CtAs,以及肌肉组织中As形态的浓度(d-g)和比例(h)。*P<0.05,**P<0.01,***P<0.001,****P<0.0001,t检验。
2 组织病理学分析
As暴露后,斑马鱼肠道表现出轻微的形态学变化,而Abx+As处理后肠绒毛不完整甚至缺失,并且这种情况在as3mt-/-斑马鱼中更为严重。对于肝脏样本,与WT相比,as3mt-/-+As组发生了可检测到的损伤,而as3mt-/-+Abx+As组表现出更严重的肝细胞坏死(图2c,d)。
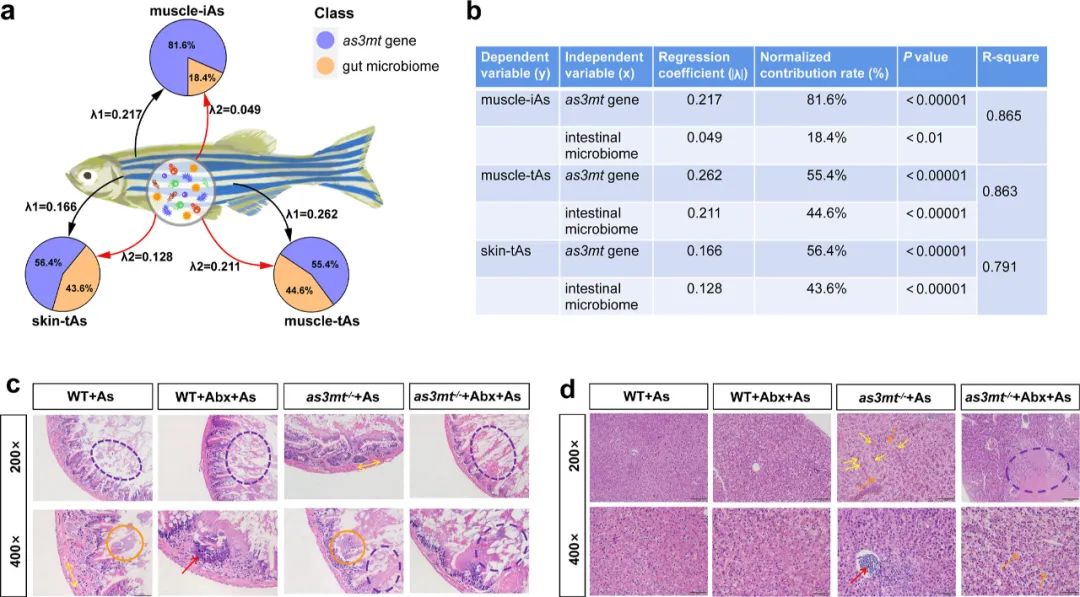
图2.饼状图显示了宿主as3mt基因和肠道微生物组对组织中iAs生物转化和tAs代谢的贡献率(a,b)。黑线表示宿主as3mt基因的贡献,红线表示肠道微生物组的贡献。在不同As暴露条件下(200×和400×),WT和as3mt-/-斑马鱼肠道组织病理学分析(c)。橙色圆圈:肠粘膜上皮细胞脱落。黄色实线箭头:肠道平滑肌增厚。红色实线箭头:部分肠腺上皮细胞的细胞核较大,染色较深。紫色虚线圆圈:小肠绒毛结构不完整,部分肠绒毛消失,细胞坏死。肝脏组织病理学分析(d)。紫色虚线圆圈表示肝细胞坏死,红色箭头表示淋巴细胞增殖,黄色箭头表示Kopfer细胞增殖,橙色箭头表示肝脏中有大量空泡和细胞变性。
3 肠道微生物组的变化
在WT斑马鱼中,不同暴露组之间的α多样性没有显著趋势(图3a-e)。而在as3mt-/-斑马鱼中,Abx+As组的Ace、Chao1和Shannon熵均显著低于对照组和As组。此外,Abx+As组as3mt-/-斑马鱼的Chao1、Ace、Shannon熵和Simpson指数显著低于WT斑马鱼,且优势度显著高于WT(P<0.05)。
在微生物群落方面,As组(包括WT和as3mt-/-斑马鱼)的样本与对照组聚集在一起,并且与Abx+As组明显分离(图3f,g)。主坐标分析(PCoA)表明,相应的对照组和Abx+As组的微生物结构聚集在一起(图3h,j)。三种非参数差异性分析(Adonis、ANOSIM和MRPP)表明,在WT和as3mt-/-斑马鱼中,Abx+As组与其他两组间存在显著差异,并且在As暴露下,WT和as3mt-/-斑马鱼之间存在显著差异(P<0.05)(图3i)。
主要细菌分类群组成在WT和as3mt-/-组之间存在差异。此外,线性判别分析效应大小(LefSe)分析表明,WT斑马鱼的三个组之间共有17个细菌属发生了显著变化,而as3mt-/-斑马鱼的三个组之间共有35个细菌属发生了显著变化。WT和as3mt-/-斑马鱼的微生物代谢功能在对照组和As组之间均无显著差异。然而,与相应的As组相比,它们在两个品系的Abx+As组中发生了显著变化,并且在as3mt-/-斑马鱼的Abx+As组中观察到更多的差异途径。此外,与WT相比,As或Abx+As暴露下as3mt-/-斑马鱼改变的代谢途径数量更高。
微生物网络分析显示,在WT组和as3mt-/-组中,网络稳健性呈现出从对照组到Abx+As组明显下降的趋势(图4)。as3mt-/-斑马鱼各组的稳健性均显著低于WT(P<0.05)。
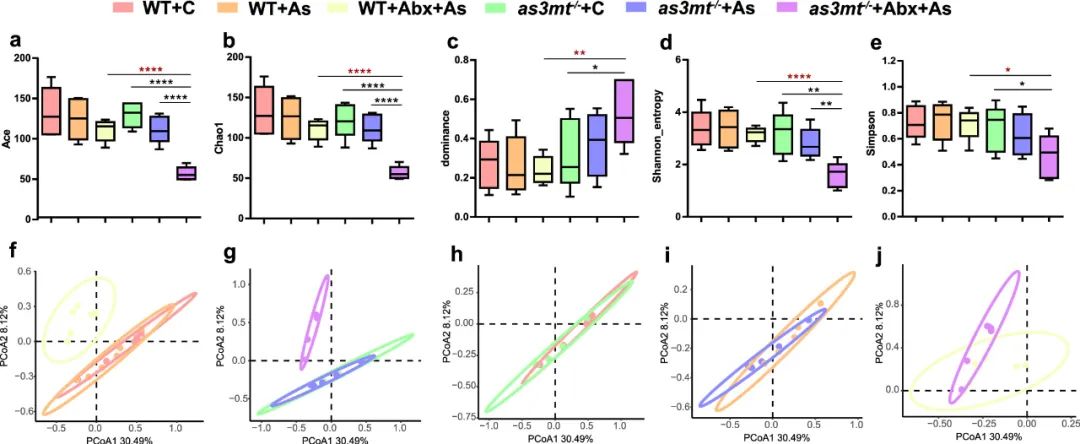
图3.不同处理下WT和as3mt-/-斑马鱼的微生物多样性和结构(n=6)。箱线图表示α多样性指数:Ace(a)、Chao1(b)、优势度指数(c)、Shannon熵(d)和Simpson指数(e),*P<0.05,**P<0.01,****P<0.0001,t检验。基于Bray-Curtis距离的PCoA分析显示了WT斑马鱼(f)和as3mt-/-斑马鱼(g)不同暴露组的微生物群落分布。两种不同斑马鱼相应的对照组(h)、As组(i)和Abx+As组(j)的微生物群落。
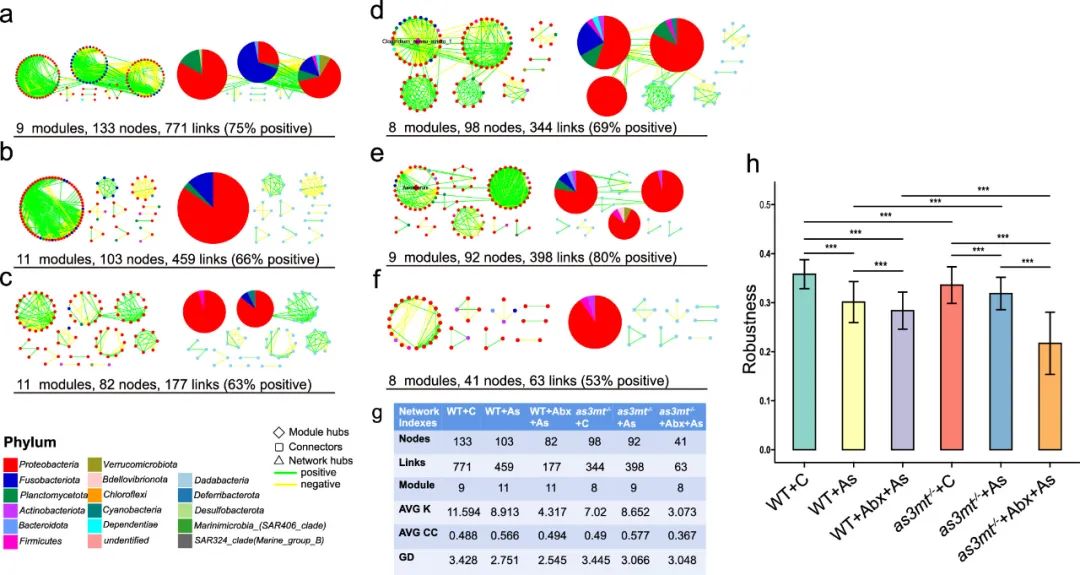
图4. WT和as3mt-/-斑马鱼对照组(a,d)、As组(b,e)和Abx+As组(c,f)的微生物网络。节点的颜色表示不同的主要门。饼状图表示模块的组成。绿线和黄线表示两个节点之间的正协变和负协变。各组相应的网络指标(g)。各组肠道微生物组的鲁棒性指数(h)。***P<0.001,t检验。
4 As和微生物的相关性
在WT斑马鱼中,As和肠道微生物之间的相关性不显著,而在as3mt-/-斑马鱼中,As和肠道微生物之间存在显著相关性(图5)。WT斑马鱼的微生物结构和组织CtAs之间存在显著相关性,而as3mt-/-斑马鱼的微生物群落与组织CtAs和CiAs显著相关。此外,在as3mt-/-斑马鱼中,α多样性指数(包括Chao1、Ace、Shannon熵和Simpson指数)与CtAs呈负相关,而优势度与CtAs呈正相关。Ace指数与iAs(%)呈负相关,而与uAs(%)呈正相关(P<0.05)。
图5e、f描述了WT斑马鱼中As和差异肠道微生物组之间存在29个显著相关性,as3mt-/-斑马鱼中存在124个显著相关性。大多数微生物类群与组织tAs和iAs相关,且负相关远多于正相关。在WT组中,11个细菌属与tAs积累显著相关。在as3mt-/-组中,30个细菌属与As积累显著相关。其中,6个细菌属与iAs(%)呈负相关,4个细菌属与iAs呈正相关(P<0.05)。
本研究发现,肠道微生物的次级功能代谢途径与As具有显著而强烈的相关性,尤其是在as3mt-/-斑马鱼中。其中大多数代谢途径与两种品系斑马鱼的iAs(%)和CtAs呈正相关(P<0.05)。对于三级代谢途径,本研究从肌肉代谢和肠道微生物组的功能预测中筛选出一些一致受影响的途径,分别在WT和as3mt-/-斑马鱼中一致确定了2条和8条差异改变的途径。随后进行了三级代谢途径和As积累之间的相关性分析。在as3mt-/-斑马鱼中,氨基酸代谢(丙氨酸、天冬氨酸和谷氨酸代谢;甘氨酸、丝氨酸和苏氨酸代谢)和丁酸盐代谢与CtAs呈负相关。此外,神经活性配体-受体相互作用、药物代谢-细胞色素P450和脂肪酸生物合成与CtAs呈正相关(P<0.05)。
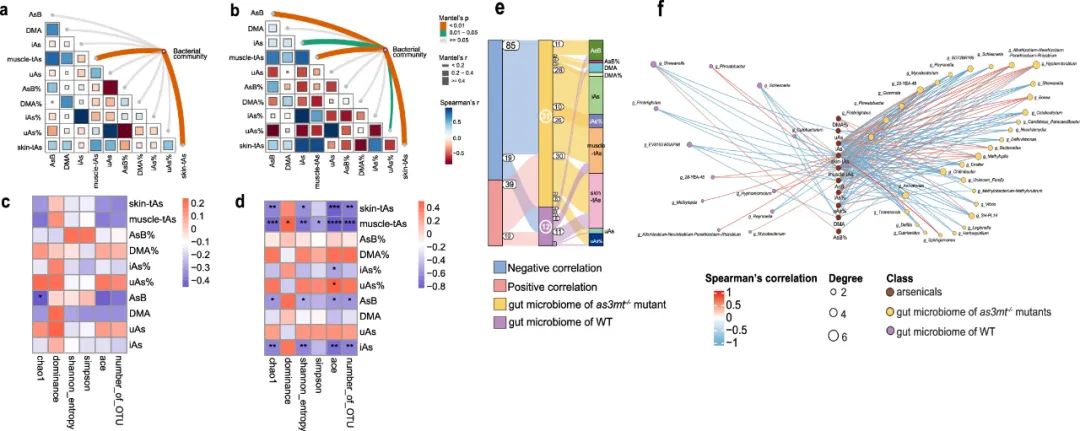
图5.肠道微生物与As的相关性。使用Mantel检验分别将WT和as3mt-/-斑马鱼的细菌群落组成(Bray-Curtis距离)与As进行关联(a,b)。热图分别显示了WT和as3mt-/-斑马鱼α多样性与As之间的相关性(c,d)。桑基图和蝶形图分别显示了WT和as3mt-/-斑马鱼细菌属与As之间的相关性(P<0.05)。节点大小与节点之间的连接数量成正比,即节点级拓扑特征(deg)。
5 补充LGG的结果
为了评估补充LGG的影响,本研究进行了微生物多样性的计算和说明(图6a-d)。在正常情况下,LGG组的Simpson显著较高,而优势度显著较低(P<0.05)。然而,在iAs暴露下,As+LGG组的Simpson降低,而优势度显著增加(P<0.05)。PCoA显示两个LGG组(LGG组和As+LGG组)重叠,并且与对照组和As组分离(图6c,d)。三种非参数差异性分析也表明LGG和无LGG组间的微生物结构存在显著差异(对照组 vs LGG组,As组 vs As+LGG组,P<0.05)。在As组和As+LGG组中分别筛选出13个和17个差异细菌分类群,作为潜在的生物标志物(图6e)。其中,As+LGG组中乳杆菌属(Lactobacillus)显著富集,表明益生菌成功定植。
为了确定在iAs暴露条件下,补充LGG是否影响体内As的生物转化,本研究检测了肌肉和水样本中的砷化合物(图6f,g)。对于斑马鱼肌肉样本,As组和As+LGG组之间的CtAs没有显著差异(P>0.05),而As+LGG组的iAs和AsB积累显著增加(P<0.05)。对于水样品,As组和As+LGG组之间的砷化合物没有显著差异(P>0.05)。
本文研究了与As代谢和氧化应激相关的基因的相对表达水平(图6h,i)。与对照组相比,iAs暴露后mt2的表达水平显著升高(As组和As+LGG组,P<0.05)。此外,与As组相比,As+LGG组肝脏中gss和gst显著上调(P<0.05),而肠道中sod1、sod2和cat显著下调(P<0.05)。中介分析表明,肠道基因(sod1、sod2、cat和mt2)和肝脏基因(gss、gst、cat和sod2)介导某些微生物对As在体内积累和生物转化的影响(P_mediate<0.05,图6j,k)。
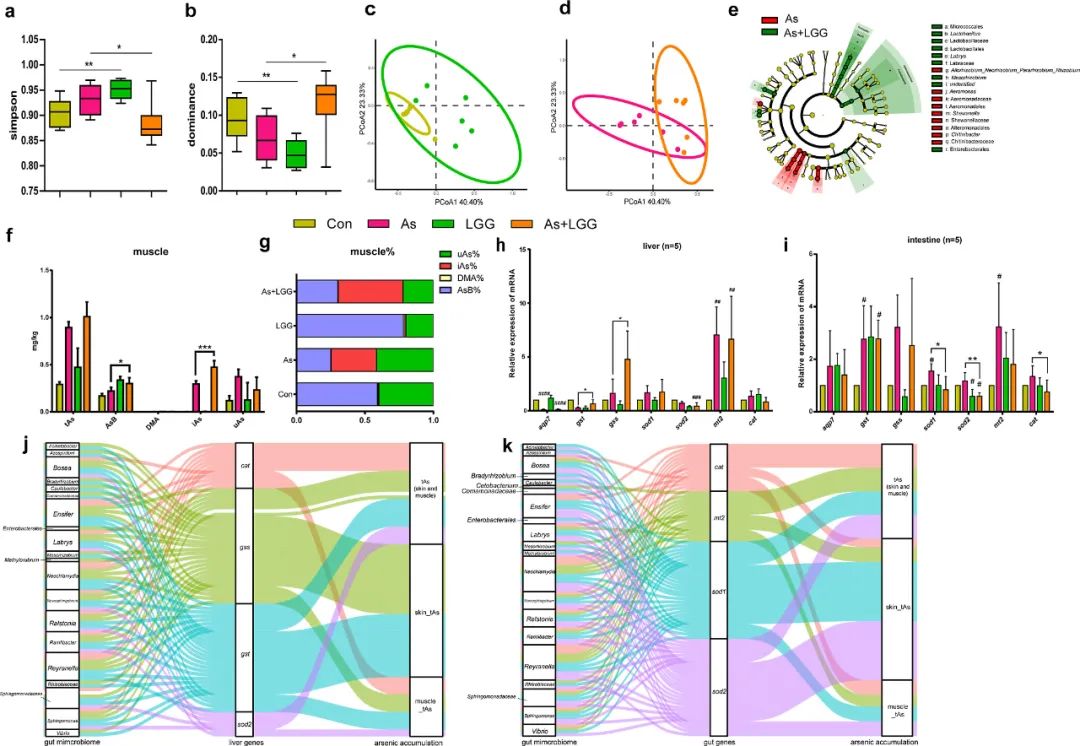
图6. as3mt-/-斑马鱼补充益生菌饲料后,各组(n=6)的肠道微生物多样性,以及宿主As生物转化中mRNA表达水平的可能机制解释。(a,b)各暴露组的α多样性(Simpson和优势度)。(c,d) LGG组和无LGG组肠道样本的PCoA分析(基于Bray-Curtis距离)。从As组和As+LGG组获得的微生物群落的LEfSe进化分支图(e)。(f,g)肌肉组织中tAs和各种As形态的浓度和比例(n=6)。(h,i) as3mt-/-斑马鱼肝脏和肠道中生物转化、解毒和氧化应激相关基因的RT-qPCR分析(n=5)。(j,k)中介分析确定宿主基因(肝脏或肠道)、肠道微生物组和砷化合物积累之间的联系。
讨论
1 斑马鱼肠道微生物组促进As转化并减少As积累
本研究通过斑马鱼模型证实了肠道微生物组在As的体内生物转化中的作用。As3mt的作用已被As3mt-KO小鼠模型明确证明。然而,在As3mt-KO小鼠的组织中仍然发现了一些甲基化的As,表明其他因素可能在体内发挥作用。在最近的一项研究中,在动物和微生物群中都证实了含有As-硫键的硫砷化合物的形成。肠道微生物可能是影响As生物转化的一个重要因素。虽然动物和细菌的As转运和生物转化机制相似,但它们各自对宿主As暴露结果的贡献可能完全不同。特别是,由于砷的不同价态(iAsⅢ和iAsⅤ)和不同的基质背景摄取(饮水、进食和土壤),肠道微生物可能会产生不同的影响,促进或阻碍宿主的砷代谢。迄今为止,还没有关于体内动物实验的报道来解释肠道微生物组对宿主和肠道微生物组之间As代谢的确切贡献。在本研究中,在iAs暴露一个月后,两种品系斑马鱼组织的CtAs在TET暴露下同时显著增加(图1b,c)。结构方程模型表明(图2a,b),肠道微生物组在帮助tAs排出方面几乎与As解毒关键基因相当,显示出超过43%的tAs代谢能力。基于As形态的数据,肌肉样本的CiAs在TET和iAs暴露下显著升高,并且肠道微生物组对肌肉组织中iAs甲基化的能力贡献了近五分之一。此外,病理分析显示TET处理加重了As对肠道和肝脏的损伤。因此,斑马鱼正常肠道微生物组在缓解As积累和促进iAs生物转化方面具有积极作用,并可能在As暴露下发挥保护作用。
抗生素滥用加重了重金属在水产品中积累的风险,并对人类健康构成潜在威胁。在本研究中,TET和iAs共同暴露进一步加剧了斑马鱼中As的积累(图1),这与Li等人的研究结果一致。与单一暴露相比,共同暴露也导致斑马鱼肝脏和肠道的严重病理损伤(图2c,d),并且在氧化损伤方面表现出更显著的毒性作用。随着TET的清除,体内毒性作用逐渐消失。斑马鱼的肠道微生物群和氧防御系统逐渐恢复,对AsⅢ具有解毒作用。此外,抗生素也能增加重金属(Cu和Cd)在斑马鱼体内的生物积累,并导致严重的氧化应激、炎症和脂质消耗。然而,很少有研究涉及抗生素与As在水生系统中的相互作用。由于抗生素在水生环境中的污染是全球性的,未来的研究需要明确抗生素与As的复合污染及其相关机制。
2 外源iAs胁迫下肠道微生物组可调节其结构
在As暴露条件下,肠道微生物组和宿主发生相互作用。它们通过相互之间的共同进化,形成了互利的共生复合体。例如,摄入膳食可溶性纤维后,肠道微生物群可以重塑结肠上皮的稳态,维持肠道上皮屏障及其功能。还可以通过影响代谢性炎症、血清脂多糖、肠道屏障功能以及其他生理功能来调节宿主代谢。在本研究中,在as3mt-/-斑马鱼中,微生物丰富度和结构与As(包括tAs和iAs)的相关性更为显著。更多的差异微生物和微生物代谢途径与As有显著相关性(图5)。因此,当生物失去宿主关键的砷甲基化作用时,肠道菌群会做出积极、快速的反应,改变其结构和功能,积极协助宿主减少剧毒iAs的积累,促进As在体内的转化。基于此,本研究提出肠道微生物组与其宿主之间存在一定的联系。研究表明,肠道微生物与其宿主之间的通讯可能由宿主的内在因素、肠道微生物组的组成和代谢活性或非代谢相互作用(如细胞间直接相互作用或微生物分泌肽)触发。肠道微生物可以调节宿主对代谢物或其他小分子物质的吸收,肠道中的核心微生物群落对宿主生物学也有同样的作用。
在外源iAs暴露下,耐As细菌的增长和有害细菌的减少共同促进As代谢,保护宿主免受体内As毒性,特别是在as3mt-/-斑马鱼中。基于本研究结果,在TET和iAs暴露后,促进As排出和生物转化的细菌属(例如Shewanella、Cetobacterium、Ensifer和Defluviimonas)显著减少,并且其与斑马鱼组织中tAs的积累呈负相关。此外,一些有害菌属(例如Neorhizobium Pararhizobium Rhizobium、Phreatobacter和Mycobacterium)在TET和iAs暴露后显著增加,并与组织中tAs的积累呈正相关(图5f)。在as3mt-/-斑马鱼中,这些细菌属与iAs也有较强且显著的相关性。Shewanella可以促进iAs的生物转化,并且促进铁和As的共沉淀,从而降低As的生物利用度。Cetobacterium可以维持肠道屏障的完整性,并且通过有益的代谢物来预防炎症。Neorhizobium Pararhizobium Rhizobium与As暴露引起的斑块状银屑病有关。Phreatobacter与宿主的免疫应答显著相关,并且在高剂量铅暴露下增加。此外,在as3mt-/-斑马鱼中,更多的差异细菌与CtAs和iAs显著相关。Ensifer可以有效参与AsⅢ的甲基化;气单胞菌属(Aeromonas)有一个As抗性系统,包括ars操纵子,参与调节黏膜防御和免疫的生理活动;Defluviimonas可以产生具有调节硫化物吸附和氧化反应特征的胞外多糖。Mycobacterium与机体代谢、免疫和功能相关基因密切相关,并且对分枝杆菌感染的易感性在As暴露后趋于增加。因此,在外源性iAs胁迫下,当宿主缺乏一种关键的As解毒酶时,耐As微生物会更加积极地发挥作用。
微生物代谢功能也与as3mt-/-斑马鱼体内的As代谢密切相关。在as3mt-/-斑马鱼中,发现更多的三级代谢途径与组织中CtAs和iAs的积累显著相关。基于本研究,微生物功能代谢(例如甘氨酸、丝氨酸和苏氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢,以及丁酸代谢)的上调可以降低组织中的As积累,从而减轻As毒性并减少氧化损伤。此外,药物代谢-细胞色素P450通路的下调可能对受到As应激的宿主具有保护作用。
因此,肠道菌群可以通过更积极地调节其组成和功能代谢途径,同时缺失关键的As代谢功能,从而在As代谢中做出重要贡献。本研究提供了具有As生物转化能力的肠道微生物组的全面和通用的分析,有助于开发新的、潜在的益生菌工具,用于鱼体内As的生物解毒。然而,仍需体外试验以进一步研究WT和as3mt-/-斑马鱼的肠道微生物群在As生物转化方面是否存在差异。
3 补充LGG可促进as3mt-/-斑马鱼体内As生物转化
肠道微生物群的代谢物是介导污染物毒性作用的关键纽带。例如,脯氨酸可以影响As在消化道中的溶解度(促进或抑制As和铁的共沉淀),从而影响As的生物可及性。在早期阶段发现,短链脂肪酸(SCFAs)有利于消化道中As的排泄。本研究通过在as3mt-/-斑马鱼的饲料中添加SCFA产生菌LGG进行As暴露实验,探讨补充LGG是否通过调节微生物微生态和宿主基因影响组织中的As代谢。结果表明,补充LGG显著改变了as3mt-/-斑马鱼的肠道微生物组特征(图6)。此外,在iAs暴露下,LGG转移并成功定植,富集在as3mt-/-斑马鱼的肠道中,从而在As的生物转化中发挥其微生物功能。在iAs暴露后,这些定植的LGG显著上调了iAs和AsB的浓度和比例,表明补充LGG可能在体内促进as3mt-/-斑马鱼将iAs转化成无毒性的AsB。
在外源性iAs胁迫下,益生菌与斑马鱼宿主之间可能发生潜在的串扰。肠道微生物组或其代谢物与宿主相互作用,调节宿主基因表达,并影响系统代谢。在本研究中,当宿主缺乏关键的As转化酶时,LGG主动上调As转化相关基因的表达(gss、gst和mt2),从而促进iAs解毒(图6f-i)。这证实了肠道微生物组(如SCFA产生菌)与宿主之间存在一种对话机制,能积极促进As的转化。此外,肠道微生物群的变化与宿主健康状况的变化密切相关,这对于减轻As的负面影响非常重要。有研究表明,sod1、sod2和cat基因是抗氧化酶基因,可以保护宿主免受活性氧的损害。解毒酶和抗氧化酶表达的相应增加是机体对不利环境的一种适应机制。在本研究中,As组中sod1、sod2和cat基因的表达水平较高,表明iAs暴露引发了肠道氧化应激损伤。另一方面,这些基因在As+LGG组中表达减少,表明LGG可以减轻as3mt-/-斑马鱼在As暴露下的氧化应激损伤,从而恢复肠道微环境的恒定稳态,有利于促进As的生物转化。此外,肠道或肝脏的宿主基因可以介导某些肠道微生物群对As积累的影响,尽管这些肠道微生物群并不直接影响As积累(Pdirect>0.05)。
这些结果表明,当宿主缺乏关键的As甲基转移酶时,补充LGG可以显著改变肠道微生物群的结构,促使肠道细菌与宿主进行“对话”,并显著改变iAs暴露下宿主的基因表达。LGG通过上调肝脏中As生物转化相关基因的表达,将iAs动员到宿主体内,然后转化为无毒的最终产物AsB,从而促进体内iAs的生物转化。LGG还可以通过恢复sod1、sod2、cat基因的表达水平来缓解肠道氧化应激的发生。
未来,肠道微生物组与其宿主之间的相互作用机制有待进一步研究。此外,还需要从斑马鱼的肠道内容物中原位分离培养益生菌乳杆菌属,以进一步验证和准确阐明肠道菌群与金属代谢之间的因果关系。
原文链接:https://pubs.acs.org/doi/abs/10.1021/acs.est.3c08010
获取此篇微文原文pdf请扫描下方二维码联系微科盟多组学老师即可。
微文推荐阅读

获取此文献原文PDF、申请加入学术群,联系您所添加的任一微科盟组学老师即可,如未添加过微科盟组学老师,请联系多组学老师27,无需重复添加。
了解更多菌群知识,请关注“微生态”。
点击阅读原文,直达原文网站,如需原文PDF可联系组学老师获取
























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








