点击蓝字 关注我们
急性、亚急性、慢性期布病免疫特征的改变

研究论文
● 期刊: iMeta (IF 23.7)
● 原文链接DOI: https://doi.org/10.1002/imt2.226
●2024年7月23日,首都儿科研究所王毅团队和北京地坛医院、临汾市第三人名医院团队在iMeta在线联合发表了题为“Single-cell landscape revealed immune characteristics associated with disease phases in brucellosis patients”的研究文章。
● 本研究系统地解读了布鲁氏菌在感染不同阶段的协调免疫反应,这有助于全面了解布鲁氏菌病的免疫发病机制,并可能有助于开发新的有效治疗策略,特别是对慢性感染者。
● 第一作者:王毅、杨思园、韩冰、杜秀芳
● 合作作者:孙华丽、杜宇峰、刘银丽、芦盼盼、狄晋豫等
● 主要单位:首都医科大学附属北京地坛医院、首都儿科研究所实验中心、临汾市第三人民医院
亮 点
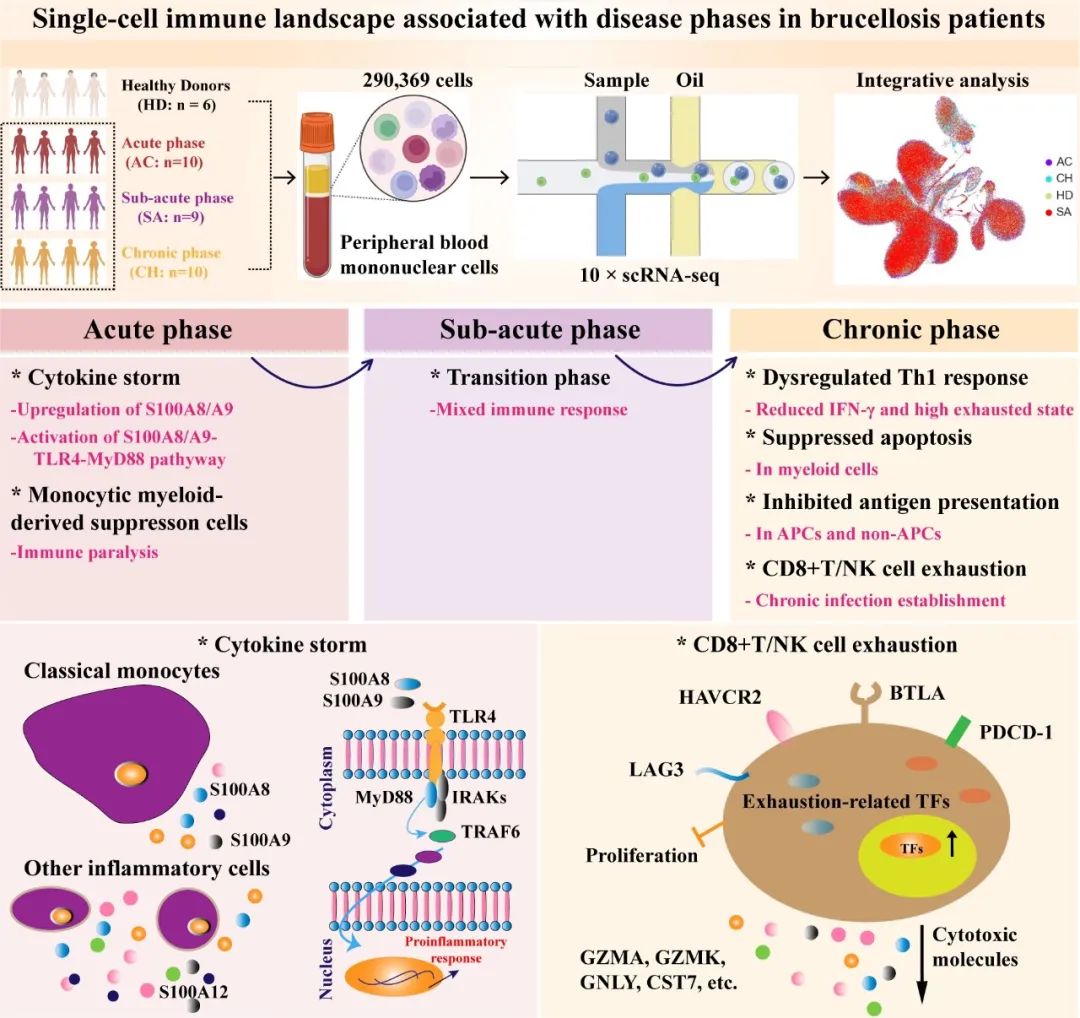
● 首次利用单细胞转录组测序分析揭示了布鲁氏菌感染的急性、亚急性和慢性阶段的不同免疫反应;
● 布病急性感染特征是细胞因子风暴,S100A8/A9-TLR4-MyD88通路激活以及M-MDSCs驱动的免疫抑制介导具有潜在作用;
● 布病慢性期阶段感染特点主要是是Th1免疫反应失调、T细胞和NK细胞普遍衰竭。
摘 要
布鲁氏菌感染的全面免疫特征对于开发布鲁氏菌病的新治疗方法至关重要。本研究中,我们使用35例布病患者的290369个细胞进行了单细胞RNA测序(scRNA-seq),其中包括来自急性期(n=10)、亚急性期(n=9)和慢性期(n=10)的29名布鲁氏菌病患者以及6名健康对照者。布鲁氏菌感染引起外周免疫细胞组成的显著变化,炎症是布鲁氏菌病的一个关键特征。急性患者的特征是由S100A8/A9的系统上调引起的潜在细胞因子风暴,主要是由于经典单核细胞。细胞因子风暴可能通过激活S100A8/A9-TLR4-MyD88信号通路介导。此外,单核细胞来源的骨髓抑制细胞可能是急性患者免疫失衡的原因。慢性期布病患者的特点是Th1反应失调,其特征是IFN-γ和Th1信号的表达减少以及高度衰竭状态。此外,布鲁氏菌感染具有抑制髓系细胞(例如mDC、经典单核细胞)凋亡、抑制专业抗原呈递细胞(APC,例如mDC)和非专业APC(例如单核细胞等)抗原呈递以及诱导CD8+T/NK细胞衰竭的能力,随后潜在地导致慢性感染的建立。综上所述,我们的研究系统地解读了布鲁氏菌在感染不同阶段的协调免疫反应,这有助于全面了解布鲁氏菌病的免疫发病机制,并可能有助于开发新的有效治疗策略,特别是对慢性感染者。
视频解读
Bilibili:https://www.bilibili.com/video/BV1ZE421w74J/
Youtube:https://youtu.be/FiDGClqA3T0
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
布鲁氏菌病(也称为马耳他热)是由布鲁氏菌引起的,不同物种在不同宿主中的亲和力和毒力各不相同。该疾病影响全球牲畜,是人类最重要的人畜共患疾病之一。布鲁氏菌病导致人类发病率和经济损失,并使贫困长期存在。尽管已经作出了广泛努力来控制布鲁氏菌病的传播,但它仍然在世界许多地区流行。在流行地区,人类布鲁氏菌病的发病率仍然很高,估计每年新增感染人数超过50万人。在东亚,中国是布病发病负担最高的国家,发病率逐渐上升(从1993年的0.0281/10万上升到2021年的5.0553/10万),地理范围不断扩大。因此,布鲁氏菌病仍然是一种不容忽视的重要疾病,并持续引起重大的健康、兽医和经济问题。
布鲁氏菌病患者表现为广泛的临床表现,从无症状到轻度/中度疾病,一些患者可发展为涉及多个器官的严重疾病,甚至死亡。布鲁氏菌病根据症状的严重程度和持续时间可分为三个阶段(中国国家卫生健康委员会,WS 269-2019):急性期(最初3个月)、亚急性期(3-6个月)和慢性期(超过6个月)。在急性期,布鲁氏菌病患者经常表现出非特异性和多变的表现,包括发烧、出汗、发冷、体重减轻、不适、关节炎/关节痛、淋巴结病、肝脾肿大和听力损失。在亚急性期,布鲁氏菌病没有明显的体征或症状,血清学检测呈阳性。当症状持续时间超过6个月时,即为慢性期。在慢性布鲁氏菌病阶段,多个器官可能受到影响,导致睾丸炎、肝炎、关节炎、心内膜炎和脑脊髓炎等。特别是,布鲁氏菌感染的再激活和慢性性质,以及病原体隐秘的细胞内生命周期,使这种感染难以根除,需要漫长的抗生素治疗。因此,了解宿主在疾病期间的免疫反应对于更好地为布鲁氏菌病患者设计适当的治疗干预措施是极其重要的。然而,对人类布鲁氏菌病的免疫反应情况的详细调查仍然缺乏。
单细胞转录组测序(scRNA-seq)是一种用于分解宿主免疫反应的强大技术,已用于各种传染病(如新冠肺炎、结核病等),但尚未用于布鲁氏菌病。在这里,我们对35名参与者的队列进行了单细胞转录组测序分析,包括急性期(AC: n=10)、亚急性期(SA: n=9)和慢性期(CH: n=10)的布鲁氏菌病患者,以及健康对照者(HD: n=6)。我们描述了不同疾病阶段外周血免疫细胞的高分辨率转录组学变化,并强调了疾病阶段与宿主免疫反应之间的关系。我们还发现了布鲁氏菌病临床特征的重要变化,并为剖析布鲁氏菌症患者的炎症特征提供了重要资源。总之,本研究数据和发现可能有助于更好地了解布鲁氏菌病的致病性和保护性免疫反应,并对布病控制具有重要意义。
结 果
布鲁氏菌病患者单细胞转录组测序数据
为了深入了解宿主对布鲁氏菌病的免疫反应,我们进行了scRNA-seq,以研究从29名患者和6名健康对照者(HD)获得的PBMC的转录组学特征(图1A)。将29例布鲁氏菌病患者分为3个临床阶段:急性期(n=10)、亚急性期(n=9)和慢性期(n=10)。表S1提供了入选布鲁氏菌病患者的实验室检查结果和临床特征。使用严格的质量控制来确保生成的数据来自单细胞和活细胞(图S1A-C,见方法)。由于中位基因计数、唯一分子标识符(UMI)和细胞数量不足,两个PBMC样品(AC002和SA009)未通过质量控制(图1B)。因此,分析包含33个样本,包括27名布鲁氏菌病患者和6名健康对照。过滤scRNA-seq数据后,共保留290369个细胞转录组,包括来自AC条件的84221个细胞、来自SA条件的67296个细胞、位于CH条件的80589个细胞和来自HD的58263个细胞,用于33名参与者的后续分析(图1B)。每个PBMC样本平均产生约8799个细胞(图1B)。
使用UMAP和标准标记基因表达的无监督聚类确定了九个主要细胞系(图1C-D):B细胞、CD4+T细胞、CD8+T细胞,粘膜相关不变T细胞(MAIT)、γδ T细胞(γδ T)、自然杀伤细胞(NK)、树突状细胞(DC)、单核细胞和巨核细胞。本文鉴定的主要细胞谱系(n=9)包括外周血中的不同细胞簇(图1C,S1D),根据UMAP可以观察到显著差异(图1A)。使用RO/E分析,评估了9个主要细胞系的疾病偏好(图1E,S1E-I)。B和CD4+T细胞的丰度在急性和亚急性患者中降低,但在慢性患者中恢复(图1E,S1E-I)。这与之前的研究结果一致,即与健康对照组相比,布鲁氏菌病患者的CD3+CD4+T淋巴细胞水平显著降低。相反,先天免疫细胞,包括单核细胞、MAIT和γδ T细胞,在急性和亚急性患者中富集,在慢性患者中减少(图1E,S1E-I)。先前的一项研究已经观察到布鲁氏菌病患者PBMC中单核细胞的增加,这支持了我们scRNA-seq分析的准确性。还描述了巨核细胞、CD8+T和NK细胞在不同疾病条件下的偏好,巨核细胞,CD8+T细胞和NK细胞分别在慢性、急性和亚急性患者中富集(图1E,S1E-I)。此外,我们利用方差分析(ANOVA)来检查疾病条件与9个主要细胞谱系的组成变化之间的关系(图1F)。多种免疫细胞谱系(如CD4+T、DC和单核细胞等)与特定的布鲁氏菌病阶段相关,即DC、单核细胞和CD4+T细胞分别与急性、亚急性和慢性患者显著相关。这些发现表明,布鲁氏菌病的每个阶段都可能与独特的免疫特征有关。

图1. 布病患者单细胞转录组测序数据结果概述
(A)概述总体研究设计的图表。从35个人中获得35个样本,包括29名布鲁氏菌病患者(10名急性期患者、9名亚急性期患者和10名慢性期患者)和6名健康对照者。(B)每个样品的log10转化的细胞数。(C)来自35个样本的9种主要细胞类型(右行)的聚类结果(左行)。每个点表示一个单元格,根据单元格类型进行着色。(D) 9种主要细胞类型的点图(列)及其标记基因的表达(行)。(E) 使用RO/E估计的主要细胞簇的疾病偏好。(F)显示细胞组成和疾病类型之间关联的热图。颜色表示方差分析q值。
布病各阶段与免疫细胞组成的关联结果
为了剖析每个细胞谱系的异质性和功能多样性,我们进行了亚聚类分析,以探索9个主要细胞谱系中每个细胞谱系中的细胞亚群(图2A,S2)。鉴定出32种亚型(B细胞和单核细胞各分为5种亚型,CD4+T和CD8+T细胞各分6个细胞亚群,NK细胞分4个亚群,DC细胞分2个亚群),覆盖了外周血中的各种免疫细胞簇。因此,我们的研究结果描绘了布鲁氏菌病的免疫景观,能够以不同的分辨率正确注释和分析这些细胞亚型。
这个信息丰富的数据集使我们能够通过使用RO/E来强调不同疾病阶段对细胞亚群组成的影响(图2B-C)。在多次测试校正后检测到显著关联(图2C)。值得注意的是,大多数B细胞亚群与慢性布鲁氏菌病患者有关,尤其是浆细胞和浆母细胞(图2C)。布鲁氏菌病患者在慢性期血浆B细胞更丰富(图2B)。浆细胞显示编码免疫球蛋白G1(IgG1)、IgG2、IgA1、IgA2和IgM恒定区的基因高表达(图2D),表明它们在产生抗原特异性抗体中具有功能。根据PAGE分析,PBMC中的B_浆细胞似乎来源于活性增殖B细胞(图S3B)。纤溶酶原B细胞显示出高MKI67和TMYS表达,这表明其增殖状态,在所有布鲁氏菌病患者中发现其表达减少(图2B)。记忆B细胞是B_Plasmablast的唯一来源,来源于B_iMemroy(图S3B)。我们还发现了慢性布鲁氏菌病患者记忆B细胞的关联和富集(图2B,C)。这些发现揭示了B细胞簇与疾病分期之间的联系。
在CD4+T细胞亚群中,Th1细胞在赋予针对布鲁氏菌病的有效免疫反应方面具有基本作用,并且在急性和亚急性布鲁氏菌症患者中观察到该亚群(CD4_Th1)的频率增加(图2B),与先前的报告一致。有效消除布鲁氏菌感染依赖于Th1细胞分泌IFN-γ细胞因子。与健康供体相比,布鲁氏菌病患者的IFN-γ表达水平显著升高,急性和亚急性布鲁氏菌症患者的IFN-γ表达水平更高(图2E)。这些发现与先前的观察结果一致,即与急性布病患者相比,慢性布病患者检测到的IFN-γ水平较低。从血浆中获得的Procarta细胞因子结果进一步支持了慢性患者IFN-γ水平较低的观察结果(图2E)。与IFN-γ的表达一致,我们还检测到布鲁氏菌病患者,特别是急性期和亚急性期患者,Th1信号的表达显著上调(图2F)。在CD8+T细胞和NK细胞中也观察到类似的IFN-γ表达模式,这是IFN-γ的额外来源(图S3C)。这些发现表明,与急性和亚急性布鲁氏菌病患者相比,IFN-γ和Th1信号水平的减弱可能与慢性布鲁氏菌症患者对布鲁氏菌感染的免疫反应不足有关。进一步的研究表明,Th1细胞主要来源于CD4+T效应记忆细胞(图S3D),其在慢性布鲁氏菌病患者中富集(图2B)。Th1细胞的减少和其前体的增加进一步表明慢性布鲁氏菌病患者的Th1反应异常。
骨髓细胞的进一步聚集产生了8个亚群,大多数单核细胞簇在急性患者中富集(图2B)。进一步的研究表明,髓细胞亚群与每个疾病阶段都表现出不同的相关性(图2C),即DC亚群与慢性患者表现出显著的相关性,而中间单核细胞与急性患者表现出相关性。在髓系细胞亚型中,我们鉴定了一种髓系衍生抑制细胞(MDSC)亚型,其表型为CD14+HAL-DR-/lo和高表达钙卫蛋白(例如S100A8/9/12)。MDSCs来源于单核细胞Mono_CD14,证实该簇为单核细胞MDSCs(图2H、S2和S3E)。MDSCs作为一组异质性的未成熟髓系细胞,在炎症过程中增加,并具有抑制T细胞反应的能力。我们发现Mono_MDSC簇在急性患者中更富集(图2B,S3G),这意味着急性患者中的单核细胞与MDSCs高度相似。这一发现表明,MDSCs(Mono_MDSC)可能潜在地导致急性患者的免疫瘫痪。除了单核细胞MDSCs,我们还鉴定了单核细胞亚群Mono_C1QA,其具有高表达的C1QA/B/C(图2A,S2),并且在急性和亚急性患者中增加。进一步的研究证实,该亚群是C1补体主要贡献者(图2I)。在急性布鲁氏菌病患者中,与亚急性期和慢性期患者以及健康个体相比,编码C1补体成分(C1QA/B/C)的基因表达显著升高(图S3I)。这表明了这些成分在急性病例中的潜在诊断价值。Mono_CD14是单核细胞的主要亚型(图S3I),布鲁氏菌病患者和健康对照者之间该簇的不同UMAP投影模式表明转录组特征紊乱(图2J),尤其是对于急性期患者。

图2. 布病患者急性、亚急性和慢性期外周血PBMC特征
(A)UMAP投影显示了从35个样本中鉴定的32种细胞亚型。每个点表示一个单元格,而颜色表示单元格的子类型。(B)使用RO/E计算的32种细胞亚型中每一种的疾病偏好。(C)来自疾病阶段之间细胞亚型组成差异的ANOVA分析的p值。疾病阶段:HD、AC、SA和CH。(D)布鲁氏菌病患者浆细胞的重链类别。(E)不同组之间CD4_Th1细胞中IFNG的表达,方框图(右)显示不同阶段的血浆IFN-γ水平。(F)不同组之间CD4_Th1细胞中Th1特征表达的条形图。(G)PAGA分析CD8+T细胞伪时间:列出相关细胞类型和相应状态。(H)不同组之间Mono_MDSC中S100A8/A9/A12和HLA-DRA/B1/B5的表达。(I)每个细胞亚型对C1补体成分的相对贡献。(J)不同组的Mono_CD14细胞的UMAP投影密度图。
单核细胞是布病急性期细胞因子风暴重要潜在来源
由于炎症是布鲁氏菌病的典型标志,我们研究了布鲁氏菌症中细胞因子产生的可能来源。基于细胞因子和炎症基因的表达(表S3),我们将细胞因子评分和炎症评分分别分配给每个细胞亚群(图S4),并利用这两个相互关联的评分作为衡量布鲁氏菌病中每个细胞对炎症反应的潜在贡献的指标。我们观察到,与健康供体相比,布鲁氏菌病患者的细胞因子和炎症基因表达显著增加(图3A-B),证实布鲁氏菌感染会引发促炎反应。特别是,亚急性和慢性患者的细胞因子和炎症基因表达没有降低到健康供体中观察到的水平(图3A-B),这意味着这些患者可能患有长期炎症。布鲁氏菌病急性期患者的细胞因子和炎症基因表达最高,显著高于亚急性期和慢性期患者以及健康对照组(图3A-B)。这表明这些患者可能出现高级别炎症或潜在的炎症细胞因子风暴。
根据我们的scRNA-seq数据,14个细胞亚群,包括4个单核细胞、6个T细胞和4个NK细胞,表现出显著升高的细胞因子和炎症评分(图S4A),表明这些细胞亚群处于高度炎症状态。在这些高度炎症的细胞簇中,7个细胞簇,包括3个CD8+T簇和4个单核细胞簇,在急性患者中检测到的细胞因子和炎症溃疡明显高于亚急性和慢性期患者以及健康供体(图3B,S4B)。这表明这些细胞簇可能是急性布鲁氏菌病潜在炎症风暴的主要来源。然后,我们检查了布鲁氏菌病患者七种细胞亚群中每一种的相对丰度,并观察到这些炎症细胞亚群在急性期患者中显著升高(图2B,S5A)。
我们的进一步分析证实,Mono_CD14和Mono_MDSC是急性布鲁氏菌病患者潜在炎症风暴的主要原因(图3C)。与此一致,表达CD14的单核细胞已被证实为其他传染病(如结核病和新冠肺炎)炎症风暴的主要来源。接下来,我们分析了每个已鉴定的炎症细胞簇的炎症特征,并观察到每个炎症细胞簇中独特的促炎细胞因子基因表达(图3D),如S100A8/912、TNF、CSF1、CCL5、CXCL8、IL6、CCL2和CCL8等。此外,我们还检测到布鲁氏菌病患者在急性期中典型炎症细胞因子(如S100A8-9/12、IL1B、IL6,CXCL8,CCL2、CXCL10等)的高表达(图S5B)。这些发现表明,急性患者潜在的炎症风暴可能是由不同的机制驱动的。两种炎症细胞亚群,包括Mono_CD14和Mono_MDSC,在很大程度上表达了更多细胞类型特异性的促炎细胞因子(图3D),进一步验证了它们在驱动急性患者潜在炎症风暴中的核心作用。
10种促炎细胞因子,包括S100A8/9/12、MIF、PF4、TNF、TNFSF12、CXCL2、HBEGF和IL18,可能是潜在炎症风暴的主要因素,因为这些细胞因子对急性患者>99%的细胞因子评分有贡献(图3E)。有趣的是,进一步的研究发现,这10种最高表达的促炎细胞因子主要在Mono_CD14和Mono_MDSC中表达(图S5C)。在这十大促炎细胞因子中,S100A8/A9主要由Mono_CD14和Mono_MDSC分泌(图S5D),可能在推动炎症风暴中发挥核心作用,因为它们对细胞因子评分的贡献率约为98%(图3E)。值得注意的是,布鲁氏菌病患者急性期S100A8/A9基因的表达显著增加(图3F),为我们的假设提供了进一步的证据。对于该队列,我们还测量了血浆中的细胞因子水平,这支持了我们的观察,即急性患者具有更高水平的S100A8/A9复合物(图3G)。这进一步证实了我们的scRNA-seq分析的准确性和可靠性。这些数据强调了炎症性高的Mono_CD14和Mono_MDSC簇以及S100A8/A9对于开发潜在的治疗干预措施以改善急性布鲁氏菌患者的免疫发病机制的重要性。
S100A8/A9分子主要由单核细胞、中性粒细胞和巨噬细胞在感染过程中释放,可通过诱导促炎细胞因子调节炎症。单核细胞,特别是Mono_CD14和Mono_MDSC,是急性布鲁氏菌病患者外周血中S100A8/A9蛋白的主要来源(图S5D)。S100A8/A9分子与toll样受体4(TLR4)结合并触发MyD88依赖性信号通路,这对炎症至关重要。与健康对照组、亚急性期和慢性期患者相比,急性患者的TLR4表达显著升高,尤其是在炎症性Mono_CD14和Mono_MDSC细胞中(图3H)。S100A8/A9-TLR4信号通过诱导MyD88的易位、IRAK的过度磷酸化和TRAF6的激活来启动MyD88依赖性途径,导致促炎反应增强和广泛的组织损伤(图3H)。我们发现,MyD88依赖性信号通路中的关键基因在急性患者中显著增加(图3I),特别是在炎性单核细胞中(图S5F)。这些结果表明,布鲁氏菌病患者在急性期表现出S100A8/A9-TLR4炎症特征,突出了S100A8/A9对开发有效的治疗方法以减轻急性布鲁氏菌症患者免疫发病的意义。
布鲁氏菌病潜在的炎症风暴可能通过释放大量细胞因子与高炎症细胞亚群之间的细胞串扰有关。因此,我们研究了来自急性布鲁氏菌病患者的七个高炎症细胞亚群的配体-受体配对模式(图3J-K,S5G-H)。在七个高炎症亚群中检测到几个显著的配体-受体相互作用(图3J)。与表达CD8的细胞相比,表达CD14的单核细胞表现出更多的相互作用(图3I)。两个核心炎症细胞亚群,包括Mono_CD14和Mono_MDSC,表达多种受体(如CCR1、CCR2、CCR3、CCR5、CXCR3、CCR10、CXCR1、CXCR2等),表明这两个细胞亚群具有对其他细胞分泌的多种细胞因子作出反应的能力(图3I-J,S5G-H)。我们的数据证实了Mono_CD14/Mono_MDSC和其他炎症细胞簇之间的相互作用可能主要取决于趋化因子及其受体(图3I-J,S5G-H)。总之,这些结果揭示了急性患者高炎症细胞亚群之间相互作用的潜在分子机制。

图3. S100A8/A9对急性患者潜在细胞因子风暴的贡献
(A) 不同组的细胞因子评分和炎症评分。(B)PBMC的UMAP投影。根据9种主要细胞类型(左上)、7种高炎症细胞亚型(右上)、细胞因子(中)和炎症评分(下)。(C)每种炎症细胞亚型对细胞因子和炎症评分的相对贡献。(D) 鉴定的每种高炎症细胞亚型中细胞因子的表达。(E)前10种细胞因子在急性布鲁氏菌病患者中的相对贡献。(F)不同组间S100A8和S100A9表达的方框图。(G)不同组间S100A8/A9复合物的血浆图谱。(H) S100A8/A9-TLR4-MyD88通路的表达分析。(I)选定基因在不同群体中的表达。(J)7种高炎症细胞亚型之间显著相互作用的总和热图。(K)描述Mono_CD14和7种高炎症细胞亚型之间配体-受体对相互作用的Circos图。
慢性布鲁氏菌病患者Th1反应失调
共鉴定出六种CD4+T细胞亚型(图2,S2)。通过PAGA轨迹分析证实了CD4+T细胞的两种不同命运,CD4_Th1和CD4_Memory是不同的末端(图S3D)。发现发育轨迹与不同细胞亚型的功能状态相关(图S6A)。通过研究先前报道的特征基因,我们发现每个CD4+T细胞亚型的功能状态不同,CD4_Naive亚型的幼稚评分最高。Th1、Treg和效应记忆亚群的炎症评分最高,而CD4_Th1亚型的细胞毒性和耗竭评分最高(图S6A)。进一步分析发现,Th1细胞在布鲁氏菌病患者中具有最高的衰竭评分(图4A),并高度表达多种抑制性受体(如LAG3、CD160、CTLA4等)(图4B)。这些结果表明布鲁氏菌病中的Th1细胞耗竭,尤其是对于那些处于慢性期的患者。这可能与持续性布鲁氏菌感染控制不力有关。
疾病偏好分析显示,CD4_Th1在急性期和亚急性期增加,而其余五个CD4簇,包括Treg细胞,主要在慢性期发现(图2B,4C)。特别是,对CD4_Treg细胞不同阶段的调节效应器评分的分析显示,慢性患者具有高水平的调节效应物功能(图4C,S6B)。Treg细胞产生TGF-β,导致CD4+T细胞反应的抑制、T细胞细胞因子的产生的抑制和效应免疫反应的下调。Treg细胞在慢性患者中高度表达TGF-β(图4C)。这些结果表明,Treg细胞(的免疫调节也可能与慢性患者的免疫耐受和布鲁氏菌持续存在有关。
利用凋亡评分系统,我们发现相对于健康供体,布鲁氏菌病患者的CD4+T细胞可能发生凋亡(图4D),这与布鲁氏菌可诱导人类T淋巴细胞凋亡的先前发现一致。四个CD4+T细胞亚群,包括CD4_eMemory、CD4_Treg、CD4_Th2和CD4_Th1,可能发生了细胞凋亡(图S6C)。参与颗粒酶/穿孔素、FAS、TNF和XAF1凋亡途径的基因显著上调(如GZMB、CASP3、FAS、XAF1、TNFSF12等)(图4E),表明CD4+T细胞的凋亡可能是由颗粒酶/过孔素、FAS、TNF和XAF1凋亡途径引起的。与我们在细胞凋亡方面的发现类似,在布鲁氏菌病患者中也观察到CD4+T细胞中细胞迁移途径的显著激活,CD4_eMemory、CD4_Treg、CD4_Th1、CD4_Th2和CD4_Memory的迁移得分较高(图4D,S6C)。
对布鲁氏菌病患者的CD4+T细胞进行了转录组分析。与健康个体相比,我们在急性、亚急性和慢性患者中分别发现334、345和346个上调的差异表达基因(DEG),其中166个DEG是常见的(图4F和表S4)。基因本体论(GO)分析显示,通常上调的基因参与“IFN-γ反应”(图4F)。这与IFN-γ反应对布鲁氏菌感染的免疫反应至关重要的概念一致。一致地,这些与“IFN-γ反应”相关的基因(如IFNG、IRF1、SOCS1等)也在布鲁氏菌病患者中富集(图S6D)。然而,对CD4+T细胞中IFN-γ反应评分的分析表明,与慢性患者相比,急性和亚急性患者的IFN-γ响应功能水平更高(图4G),这意味着IFN-γ应答降低也可能与慢性患者的布鲁氏菌持续存在有关。

图4. 布病患者CD4+T细胞亚群的免疫学特征
(A)不同组CD4_Th1细胞亚型衰竭评分的方框图。(B)CD4_Th1细胞亚型中选定耗竭基因在不同组间表达。(C)不同组CD4_Treg细胞亚型的相对百分比(左)、调节评分(中)和TGF-β表达。(D)来自不同组的CD4+T细胞的凋亡和迁移得分。(E)不同群体中细胞凋亡相关基因的表达。(F)CD4+T细胞中上调基因的数量,以及不同条件下CD4+T GO项的方框图。(G)CD4+T细胞指示功能评分(IFN-γ反应评分)。
慢性期布鲁氏菌病患者CD8反应失调
MAIT和γδT细胞的CD8A基因表达较低(图1D),将其归类为CD8+T细胞进行转录组分析。CD8+T细胞进一步聚集成9个亚群(图2A),包括幼稚CD8_Naive、CD8_effector_GNL、CD8_Effect 、GNLY_GZMK和 CD8_effector_GZMK、CD8_eMemory、CD8_memory、MAIT、γδT和增殖亚型(CD8_Pro)。每种CD8+T亚型都表现出不同的疾病偏好:幼稚簇在健康供体中富集,而其余主要在急性和亚急性患者中发现(图2B)。这些数据表明,慢性患者细胞毒性T细胞频率的降低可能与布鲁氏菌的持久性有关。
我们比较了患者和健康供体之间每个簇的转录特征。在布鲁氏菌病患者中发现了一系列常见的上调基因,其中7个基因/转录因子(RGS1、DUSP1、FOS、PPP1R15A、TNFAIP3、HLA-E和ZFP36)最常见(9个簇中有9次)(图5A,7SA)。据报道,这些通常上调的基因主要参与T细胞耗竭(如RGS1)、免疫抑制(如DUSP1、PPP1R15A)和细胞凋亡(如FOS、TNFAIP3),这表明可能导致布鲁氏菌持续存在的多种机制。需要进一步的研究来阐明其他常见上调基因的意义。
上调的RGS1(图5A,S7A)介导T细胞滞留,导致持续的抗原刺激并导致T细胞耗竭。众所周知,耗尽的T细胞参与免疫系统的负调控,导致免疫逃逸。在这里,我们接下来确定了布鲁氏菌病患者的CD8+T细胞亚类的耗竭状态,并发现与健康个体相比,布鲁氏菌症患者的CD8+T细胞具有显著更高的耗竭状态(图5B)。与其他集群相比,六种亚型,包括CD8_Pro、CD8_eMemory、CD8_Effector_GZMK、CD8_Eeffector_GNLY、CD8_EEffector_GNLY_GZMK和γδT,表现出更高的衰竭评分(图S7B)。这意味着这些亚型可能是主要耗尽的CD8+T细胞。在这些耗竭亚类中,在健康个体中观察到最低的疲惫评分,而布鲁氏菌病患者表现出更高的耗竭水平(图5C)。然后,我们检查了每个耗竭细胞亚群的耗竭特征,发现CD8+T细胞亚群都表达了不同的抑制分子(图5D),如PD-1、LAG3、HAVCR2、BTLA等。这表明可能存在多种机制导致布鲁氏菌感染患者的CD8+T细胞耗竭。
细胞毒性T细胞通过释放效应分子(如颗粒酶)在控制细胞内感染方面发挥着至关重要的作用。因此,我们检测了CD8+T细胞的细胞毒性状态,发现急性患者的细胞毒性得分最高。相反,慢性患者的细胞毒性评分相对较低(图5E),这可能部分影响细胞毒性T细胞控制这些患者布鲁氏菌病的能力。四个亚类,包括三个效应CD8+T细胞亚群(CD8_eMemory、CD8_effector_GNLY和CD8_effector_GNLY_GZMK)和γδT,可能是消除布鲁氏菌病患者中受感染宿主细胞的主要贡献者(图S7B),因为它们同时表达多种效应分子(如GZMA、GZMK、GNLY、CST7等),尤其是对于急性期患者(图S7C)。有趣的是,这些表现出高细胞毒性的CD8+T细胞也被表征为耗竭细胞(图5)。这一发现与早期对耗尽的CD8+T细胞的功能研究一致,这些研究已经证实,与它们的增殖能力和细胞因子产生减少相反,它们的细胞毒性状态仍然不受影响。
细胞毒性T细胞除了在直接杀死感染靶点方面发挥作用外,还通过颗粒酶/穿孔素或Fas-Fas配体介导细胞凋亡。细胞凋亡评分系统显示,与健康供体相比,布鲁氏菌病患者的CD8+T细胞显示出更高的细胞凋亡评分(图5F),这表明布鲁氏菌感染可以诱导人CD8+T淋巴细胞凋亡,这与上述转录谱一致(图5A)。急性患者的CD8+T细胞凋亡得分最高,更容易发生凋亡(图5F)。凋亡趋势在七种CD8+T细胞亚型中进一步明显(例如,CD8_Pro、MAIT、CD8_Effector_GNLY等)(图S7D)。我们进一步分析了与凋亡相关的颗粒酶/穿孔素、TNF、XAF1和FAS通路中基因的表达,发现在CD8+T细胞中,大多数颗粒酶/穿着孔素、TNF-XAF1和FAS通路成员(如GZMB/H、XAF1、TNFRSF10B、IRF1、FAS和CASP3/8等)在布鲁氏菌病患者中表现出上调趋势(图5G),尤其是急性期患者。颗粒酶/穿孔素、TNF、XAF1和FAS凋亡途径中上调的基因可能导致布鲁氏菌病患者CD8+T细胞凋亡升高,从而直接抑制CD8+T介导的反应。
为了进一步研究布鲁氏菌病患者CD8+T细胞的变化,我们进行了DEG和GO分析。我们的分析显示,与健康供体相比,急性、亚急性和慢性患者的DEG上调分别为347、250和214(图5H),表S5),共有139个DEG。GO分析的结果证实,根据上述分析(图5E-G),这些上调的基因与“细胞凋亡过程”和“T细胞介导的细胞毒性”有关(图5H)。有趣的是,与我们在CD4+T细胞中的发现类似,CD8+T细胞的常见上调基因在“干扰素反应”途径中也表现出显著富集,特别是与“干扰素-γ反应”有关(图5H)。与此一致,在布鲁氏菌病患者中也一致观察到与“干扰素-γ反应”途径相关的基因富集(如STAT1、IFNG、IRF1、B2M、GAPDH等)(图S7E)。尽管如此,与慢性患者相比,急性和亚急性患者表现出更高水平的IFN-γ应答功能(图5I),这表明CD8+T细胞中IFN-γ反应的减弱也可能有助于布鲁氏菌在慢性患者中的持续存在。

图5. 布鲁氏菌患者CD8+T细胞亚群的免疫学特征
(A)计算每个CD8+T细胞簇的最高上调基因,并显示具有高频率的基因。(B) 显示不同组CD8+T细胞耗竭评分的方框图。(C)方框图显示了来自不同组的效应CD8+T细胞的耗竭评分。(D)描绘效应CD8+T细胞中耗竭相关基因表达。(E)CD8+T细胞细胞毒性评分的UMAP预测。(F)CD8+T细胞凋亡评分。(G)CD8+T细胞中凋亡相关基因的表达。(H) CD8+T细胞中上调基因的数量,以及不同条件下CD8+T的共享GO项的方框图(右)。(I) 来自不同细胞的CD8+T细胞的IFN-γ反应得分。
布鲁氏菌病患者的NK细胞耗竭
NK细胞的进一步聚集导致细分为4种不同的亚型,包括幼稚型(NK_Naive)、记忆型(NK_memory)和效应型NK(NK_CD56(bri)和NK_CD55(dim))(图2,S2)。发现多种激活标记物,如CD69、MKI67、CCL5、CTLA4、IFNG和GZMB等,在布鲁氏菌病患者的NK细胞中富集,表明激活的NK细胞反应是布鲁氏菌症患者的一个显著特征,尤其是急性期患者(图6A,S8A)。CD56bri NK亚群(NK_CD56(bri))是抗布鲁氏菌相关细胞因子(如IFN-γ)的有效来源。与我们在CD4_Th1细胞中的观察结果类似,与健康个体相比,布鲁氏菌病患者的NK_CD56(bri)簇显示出IFN-γ的显著升高(图6B)。与其他组相比,CD160 NK亚群(NK_CD56(dim))通过细胞介导的细胞毒性有助于宿主防御布鲁氏菌,在急性患者中具有显著更高的细胞毒性状态(图6C,S8B)。此外,急性患者的NK_CD56(dim)亚型显示出多种细胞毒性基因的表达升高,如PRF1、GNLY、NKG7、GZMA、CST7、CTSW、KLRD1等(图6D)。急性患者中NK_CD56(dim)亚群的细胞毒性状态升高可能导致与CD8+T细胞中观察到的免疫病理学相当的免疫病理。
为了进一步了解NK细胞亚群的转录组变化,我们检测了活动性布鲁氏菌病患者不同NK细胞亚组的耗竭、凋亡和迁移状态。在整体水平上,与健康供体相比,布鲁氏菌病患者的NK细胞具有更高的耗竭状态,在急性患者中观察到的耗竭水平最高(图6E)。在这些NK亚群中,细胞毒性NK簇(NK_CD56(dim))被鉴定为衰竭评分较高的衰竭NK细胞(图S8C)。与健康供体相比,耗尽的NK细胞(NK_CD56(dim))在布鲁氏菌病患者中高度表达多种抑制分子(如LAG3、CD244、CTLA4等)(图6F)。特别是,布鲁氏菌在慢性病患者中的持续存在也可归因于耗尽的NK_CD56(dim)。我们发现,布鲁氏菌病患者的NK细胞,特别是NK_Naive、NK_Memory和NK_CD56(dim),可能会发生迁移(图6G,S8D),其中几个迁移相关基因高度表达,如CCL4、CXCR5、CCL18、CXCL2等(图6G)。同样,布鲁氏菌病患者的NK细胞易于凋亡(图6H),特别是在NK_Naive、NK_Memory和NK_CD56(dim)中(图S8E)。进一步分析发现,颗粒酶/穿孔素、TNF、XAF1和FAS凋亡途径可能有助于布鲁氏菌病患者NK细胞的凋亡,可能对NK细胞介导的反应产生直接抑制作用。
与健康对照组相比,我们观察到布鲁氏菌感染者中编码HLA II类分子的基因表达明显增加(图6I)。在急性个体中观察到HLA II类分子的更高程度上调(图S8F)。HLA II类分子的上调反映在差异升高的基因通路中(例如,增强的DC和NK细胞之间的串扰)。类似地,相对于其他疾病,包括典型的HLA-I基因HLA-A/B和非典型的HLA-Ⅰ基因HLA-E/F,在布鲁氏菌病患者中观察到HLA-I分子的表达升高(图S8G)。

图6. 布鲁氏菌患者NK细胞亚群的免疫学特征
(A)不同条件下效应NK细胞中激活相关基因的表达。(B)不同组之间NK_CD56(Bri)细胞中IFN-γ表达。(C)不同组NK_CD56(Dim)细胞的细胞毒性评分。(D)NK_CD56(Dim)细胞在不同条件下细胞毒性相关基因表达。(E)方不同组NK细胞的衰竭评分。(F)描绘不同条件下NK_CD56(Dim)细胞中衰竭相关基因表达。(G)不同组NK细胞中的迁移得分,不同条件下NK细胞中迁移相关基因的表达。(H) 不同组NK细胞的凋亡评分,显示不同条件下NK细胞中凋亡相关基因的表达。(I) 在不同条件下NK细胞中所选基因的表达。
布鲁氏菌病患者骨髓细胞免疫反应失调
对布鲁氏菌的防御需要激活抗原呈递细胞(APC)(如DC和巨噬细胞)中的杀菌机制。专门从事抗原处理的经典DC(mDC)在识别微生物、启动先天免疫反应和诱导强大的适应性免疫反应方面发挥着关键作用。有鉴于此,我们研究了mDC对布鲁氏菌感染的吞噬作用和抗原呈递能力。只有急性患者表现出明显高于健康供体的吞噬能力(图7A)。有效的抗原呈递依赖于主要组织相容性复合体(MHC)II类(HLA-DR)分子的参与。与健康个体相比,在布鲁氏菌病患者中没有观察到HLA-II分子的显著上调,在急性患者中发现了显著下调(图S9A)。与此一致的是,布鲁氏菌病患者的吞噬作用和抗原呈递相关基因(如CIITA、RFX5、HLA-DPA1、WASF2等)的表达水平降低(图S9B)。此外,亚急性和慢性患者可能不会触发mDCs凋亡,从而提供对与布鲁氏菌相关的免疫攻击的保护,并使病原体在mDCs内最佳繁殖(图7A)。这些数据表明,布鲁氏菌可能干扰mDCs的吞噬作用、抗原呈递和细胞凋亡,从而建立慢性感染。在非专业抗原呈递细胞(APC)如B细胞和单核细胞的情况下,我们观察到与急性患者相比,慢性患者的吞噬作用、抗原呈递和细胞凋亡能力显著下降(图S9C-D)。
在骨髓细胞中,单核细胞簇(Mono_MDSC)与急性和慢性患者表现出强烈的相关性(图2C,S2)。为了进行更详细的分析,与其他单核细胞相比,Mono_MDSC的特征是炎症分子(如S100A8/A12)的表达更高,HLA基因的表达更低,包括HLA-I(如HLA-a、HLA-B等)和HLA-II(如HLA-DRB1、HLA-DPB1、HLA-DMA等)分子(图7B,S9E)。特别是,HLA-DR的低表达是公认的单核细胞功能障碍的替代标志物(图7C),导致对微生物刺激的反应性降低,这表明Mono_MDSC簇是功能失调的单核细胞核。与这些发现一致,Mono_MDSC 中下调的271个基因(图7B)在“干扰素-γ反应”、“抗原处理和呈递”和“T细胞介导的免疫负调控”(图S9F)中表现出显著富集,这进一步支持了将该簇定性为功能失调的单核细胞。
经典单核细胞(Mono_CD14)是PBMC中主要的髓系细胞类型(图S2I),如布鲁氏菌病和对照组之间该簇的UMAP投影模式所示,受到布鲁氏菌菌病的影响,并在急性患者中富集(图S9G,2B)。在Mono_CD14中的DEG中,我们发现与健康供体相比,急性、亚急性和慢性患者中有640、337和389个基因上调(图7D和表S6)。大量上调的DEG表明布鲁氏菌病患者和健康供体之间存在显著差异。相反,与对照组相比,我们仅在布鲁氏菌病患者中检测到少量下调的DEG(图S10A)。使用上调DEG的GO分析显示,所有布鲁氏菌病患者都有“对IFN-γ的反应”、“对IFN-I的反应”和“炎症反应”这三个术语(图7D)。对与这些GO术语相关的DEG进行了进一步调查。在布鲁氏菌病患者中,许多典型的IFN-γ/IFN-I应答基因的表达水平,包括IFITM3、B2M、GBP1、IRF1、IFI30、IFNGR2等,均高于对照组(图S10B)。然而,急性患者表现出最高水平的IFN-γ应答功能,这意味着经典单核细胞中IFN-γ反应的减少可能与慢性患者中布鲁氏菌的长期存在有关(图7E)。与本研究先前的炎症分析一致(图3),GO术语:“炎症反应”和“炎症反应的积极调节”在所有布鲁氏菌病患者中都很丰富(图7D)。这意味着经典的单核细胞可能有助于布鲁氏菌病的长期促炎反应,从而介导组织损伤。作为潜在炎症风暴的主要因素(图3),许多炎症反应基因(如ITGB2、OSM、FPR1、CEBPB、NINJ1等)和典型的促炎细胞因子(如CXCL8、CCL3、CCL4、TNF、IL1B、S100A12等)在布鲁氏菌病患者中的表达水平高于健康供体(图7F、S10C)。从这些个体的血浆中进行的Procarta细胞因子分析(图7G)支持布鲁氏菌病患者,尤其是急性患者,具有更高水平的多种促炎细胞因子,如CXCL8/IL8、CCL3/MIP-α、CCL4/MIP-β、TNF-TNF-α、IL1B/IL1-β(图7G)。
此外,“细胞凋亡过程的负调控”和“程序性细胞死亡的负调节”,也在经典单核细胞中富集(图7D),表明布鲁氏菌感染对单核细胞凋亡的潜在影响。布鲁氏菌病患者中参与“细胞凋亡过程的负调控”的多个基因(如PIM1、PIM3、KLF4)的表达水平高于对照组(图S10D)。例如,PIM1通过磷酸化和抑制促凋亡蛋白来促进细胞存活(图7H)。PIM3具有防止细胞凋亡、促进细胞存活和增强蛋白质翻译的能力(图7H)。KLF4通过p53-KLF4-p21-cyclinD1轴抑制细胞凋亡(图7H)。这些发现表明,布鲁氏菌感染能够通过多种机制抑制单核细胞凋亡,可能导致慢性感染的发展。这些基因可能是慢性感染的潜在治疗靶点。

图7. 布鲁氏菌病患者骨髓亚群的免疫学特征
(A)不同组mDCs的吞噬作用(左)、抗原呈递(中)和凋亡评分(右)。(B) Mono_MDSC中上调基因(左)和下调基因的数量。(C) HLA-DRA/B5/B1在单核细胞亚群中的表达。(D) 经典单核细胞中上调基因的数量(左),为经典单核细胞核中上调的基因选择的富集GO项(右)。(E)不同组临床单核细胞的IFN反应。(F)显示不同组临床单核细胞中典型炎性细胞因子的表达。(G) 不同组的MIP-α、MIP-1-β、IL1-β、TNF-α和IL-8血浆图谱。(H) 不同组临床单核细胞中PIM1、PIM3和KLF4的表达。
方 法
伦理审批
本研究获得了首都医科大学北京地坛医院伦理委员会的伦理批准(伦理批准号:DTEC-KY2023-019-01),并按照《赫尔辛基宣言》进行了涉及人类受试者的医学研究。每位受试者均签署了知情同意书。
研究设计和参与受试者标准
2023年6月,在中国山西省临汾市第三人民医院招募了29名诊断为布鲁氏菌病的患者,并采集了外周静脉血样(表S1)。对于29例布鲁氏菌病病例,纳入标准为:(1)根据《人类布鲁氏菌症诊断指南》(中国国家卫生健康委员会,WS 269-2019)进行的培养和/或血清学检测呈阳性[9];(2) ≥18岁。排除标准为:(1)怀孕;(2) 患有自身免疫性疾病;(3) 患有恶性肿瘤;(4) 接受免疫抑制治疗。对于6名健康对照组,纳入标准为:(1)无布鲁氏菌病病史;(2) 阴性血清凝集试验(SAT)。
布鲁氏菌病分期标准
布鲁氏菌病的分期是基于《人类布鲁氏菌疾病诊断》(中国国家卫生健康委员会,WS 269-2019):(1)急性期是指3个月内出现布鲁氏菌症症状,并经血清学检测呈阳性的患者。(2)亚急性期是指布鲁氏菌病症状持续4至6个月,并经血清学检测呈阳性的患者。(3)慢性期是指布鲁氏菌病症状持续6个月以上,并经血清学检测呈阳性的患者。用于确定疾病分期的临床特征和实验室结果见补充表1。
单细胞RNA测序和数据分析
使用标准密度梯度离心法从新鲜血液样本(n=35)中分离出PBMCs(外周血单核细胞),经Countstar细胞存活率试剂盒证实,其细胞存活率>90%。根据制造商的说明,使用Chromium单细胞5'试剂盒v2(10x基因组学;PN-1000263)制备5'文库,并使用Illumina Novaseq 6000测序仪(2x150bp)进行单细胞RNA测序。
如前所述进行scRNA-seq数据处理和分析。通过使用kallisto/bustools(kb v0.24.4)和anndata(ad)中的ad.concat函数(v0.7.6),生成了35个样本的合并过滤基因表达矩阵。使用Scanpy(sc)(v1.9.2),然后消除双链/低质量细胞,将文库大小归一化为每个细胞10000次读取,并确定了具有大量细胞间变异的前1500个高变异基因(HVG)的共识集。在数据集集成过程中,使用主成分分析(PCA)将维度减少到20个PCA分量。然后,我们应用Harmony算法进行批处理效应校正,并应用Louvain算法对单细胞数据进行无监督聚类。
细胞聚类和注释
sc.tl.louvain函数用于基于细胞的邻域关系进行两轮无监督细胞聚类。在第一轮分析中(Louvain分辨率为2.0),我们确定了九种主要细胞类型:CD4+T细胞、CD8+T细胞、B细胞、MAIT细胞、γδT细胞、NK细胞、巨核细胞、单核细胞和树突状细胞。然后使用规范标记基因手动确认每种主要细胞类型内的亚群,这些亚群代表不同的免疫细胞谱系(表S2)。然后,通过使用sc.tl.rank_genes_groups函数,我们确定了簇特异性的特征基因,并将其与用于簇注释的规范标记基因进行了手动比较(表S2)。
免疫细胞比例变化的识别
计算各种疾病条件下每种免疫细胞类型/亚型的比例,并使用带有Bonferroni校正的Kruskal-Wallis检验确认其统计学意义。我们还使用多元方差分析来研究不同疾病阶段及其潜在相互作用对每种细胞类型/亚型比例的影响。使用RO/E比率(观察到的细胞数量与随机预期的细胞数量的比率),我们进一步计算了每种细胞类型/亚型的疾病偏好,从而深入了解了它们与特定疾病阶段的关联。
确定细胞状态评分
使用预定义的基因集来比较不同细胞类型/亚型的整体激活水平或生理活性。与促炎细胞因子和炎症反应相关的基因集来自已发表的文献(表S3)。同样,从之前的报告中收集了与Th1特征、幼稚状态、耗竭状态、细胞毒性状态、调节效应器和IFN-反应相关的基因集(表S3)。使用sc.tl.score_genes函数,我们确定了细胞状态得分,其定义为预定义基因集的平均基因表达除以参考基因。进行了带有Bonferroni校正的Kruskal-Wallis检验,以检验比较不同疾病阶段时每种细胞状态评分的统计学意义。
血浆细胞因子浓度检测
按照制造商的说明和之前报告中描述的方法,使用Th1/Th2 34-plex人ProcartaPlex试剂盒(赛默飞世尔科技公司)测量血浆细胞因子水平。
统计分析方法
所有统计分析和数据可视化均使用Python和R进行。在每个图中,我们使用以下符号表示统计显著性:ns(p>0.05);*:p≤0.05;**:p≤0.01;***:p≤0.001;****:p≤0.0001。
讨 论
布鲁氏菌病是全球最常见的细菌性人畜共患感染,每年影响50多万人。然而,目前还没有对不同疾病阶段的抗布鲁氏菌或致病性免疫反应进行全面的全球表征。为了公正全面地了解布鲁氏菌感染患者的免疫特征及其与疾病状态的关系,我们利用scRNA-seq构建了布鲁氏菌病急性期、亚急性期和慢性期三个阶段PBMCs的全面免疫图谱。这些结果不仅将为人类布鲁氏菌感染不同阶段的发病机制提供有价值的见解,而且有助于确定潜在的免疫靶点,并开发新的治疗策略,以有效治疗布鲁氏菌病,特别是慢性阶段的布鲁氏菌。
布鲁氏菌感染的主要防御机制依赖于细胞介导的免疫,包括激活APC(如mDCs、B细胞)和随后扩增抗原特异性T细胞克隆,随后杀除布鲁氏杆菌。与之前的发现一致,本研究中观察到急性布鲁氏菌病患者外周血单个核细胞中CD8+T细胞的扩增(图1E)。相比之下,急性和亚急性患者的CD4+T细胞丰度有所减少(图1E)。该报告观察到与健康供体相比,布鲁氏菌病患者的CD3+CD4+T淋巴细胞水平显著降低这与早期的报告一致。先天免疫细胞亚群(如单核细胞、MAIT和γδ T细胞)在急性和亚急性患者中较高,但在慢性患者中较低。这与早期的一项研究一致,该研究记录了布鲁氏菌病患者外周免疫细胞中单核细胞的增加。有趣的是,之前的报告也提供了支持我们研究中发现的外周免疫细胞比例变化的证据。这进一步验证了我们的scRNA-seq分析,即布鲁氏菌感染导致不同免疫细胞类型比例的变化。总体而言,布鲁氏菌感染对不同免疫细胞类型的比例有影响。
炎症是布鲁氏菌病的一个特征,但目前仍缺乏对布鲁氏菌症炎症反应的全面系统研究。我们探索布鲁氏菌病中细胞因子产生的潜在来源。我们的结果表明,所有布鲁氏菌病患者的炎症水平均显著高于健康供体(图3),急性患者的炎症状态最高。因此,急性布鲁氏菌病患者可能会导致危及生命的并发症,其中可能包括细胞因子风暴综合征。这与早期的研究一致,即人畜共患细菌感染(如布鲁氏菌属和分枝杆菌属)与炎性细胞因子风暴的发展有关。我们进一步确定,急性患者细胞因子风暴的主要来源主要是由于两种不同的细胞亚型:Mono_CD14和Mono_MDCS(图3)。尽管急性患者中各种促炎细胞因子(如TNFSF13B、S100A8/A9/A12、CXCL2、CCL8、CXCL8和IL6等)增加,但主要由Mono_CD14细胞释放的S100A8/A9可能是引发细胞因子风暴综合征的核心因素(图3)。根据早期的一份报告,在症状相对严重的结核病患者中,经典单核细胞(Mono_CD14)表现出明显更高水平的S100家族炎症基因。多种炎症细胞(如经典单核细胞和粒细胞)显示出S100A8/A9的过度表达,并且在其他传染病(如新冠肺炎)中观察到这些分子的血清水平升高。一致地,我们还发现S100A8/A9在急性布鲁氏菌病患者中明显过表达(图3)。有趣的是,来自血浆的细胞因子检测数据支持我们的scRNA-seq分析,即急性布鲁氏菌病患者表现出S100A8/A9复合物水平升高(图3)。已知S100A8/A9复合物通过TLR4-MyD88信号通路触发促炎反应。正如预期的那样,我们发现急性患者中参与TLR4-MyD88信号通路的基因显著上调,特别是在炎性单核细胞(如Mono_CD14和Mono_MDCS)中(图3,S5)。因此,阻断S100A8/A9与TLR4的结合可能会抑制下游的促炎信号,使其成为设计有效治疗急性布鲁氏菌病的有前景的策略。在急性布鲁氏菌病阶段使用抗S100A8/A9治疗可能会调节这些分子的产生,从而减轻细胞因子风暴综合征。此外,慢性患者的炎症没有恢复到健康供体的水平,这表明慢性患者经历了长期的炎症状况。
布鲁氏菌抗原在人体内引发Th1细胞因子的产生,因此Th1免疫反应对于根除布鲁氏菌感染是必不可少的。为了对抗布鲁氏菌感染,Th1免疫反应导致抗原特异性CD4+T淋巴细胞(CD4_Th1)分泌IFN-γ。本研究观察到,与急性和亚急性患者相比,慢性患者CD4_Th1细胞中IFN-γ的表达水平显著降低(图2)。这一结果得到了血浆Procarta细胞因子分析的支持(图2),并与之前的研究一致,其中发现慢性布鲁氏菌病患者的IFN-γ较低。IFN-γ对激活巨噬细胞的杀菌功能很重要,同时也刺激CD8+T介导的细胞毒性,增强感染巨噬细胞的凋亡死亡。有趣的是,在布鲁氏菌病患者中也观察到Th1特征的表达显著升高(图2)。然而,与IFN-γ表达一致,与急性期和亚急性期患者相比,慢性患者的Th1特征水平显著下降。在此,Th1反应失调,包括IFN-γ和Th1特征水平降低,可能是慢性患者对布鲁氏菌感染免疫反应受损的一个因素。
布鲁氏菌能够寄生在人类APC(如mDCs)内,这会影响各种细胞功能,包括吞噬作用、吞噬溶酶体融合、抗原呈递、细胞因子分泌和凋亡。我们的数据表明,与健康对照组相比,APC仅在急性疾病患者中显示出明显更高的吞噬作用和抗原呈递能力(图7,S9)。因此,可以假设在感染的初始阶段(急性期),布鲁氏菌激活APC(如mDCs)并启动Th1反应。然而,在后期(例如亚急性期和慢性期),布鲁氏菌可能通过不同的逃避机制逃避这些Th1反应,从而建立慢性感染,例如下调APC中HLA-II的表达。与这一假设一致,我们没有发现布鲁氏菌病患者mDCs中HLA-II分子的表达显著增加(图S9)。此外,我们还发现布鲁氏菌感染可能抑制亚急性和慢性患者APC的凋亡(图7,S9)。通过操纵APC的凋亡,布鲁氏菌可以避免被宿主免疫系统检测到,从而逃避免疫细胞的杀菌功能。这里的研究结果表明,布鲁氏菌可能会破坏mDCs的吞噬作用、抗原呈递和凋亡,从而有助于建立慢性感染。
单核细胞MDSC是一种特定的髓系细胞群,其特征是HLA-II表达降低,与中性粒细胞活化相关的基因表达升高(如S100A8/A12),在急性患者中发现其升高(图2,S2)。MDSCs的扩增是各种炎症条件下的特征性反应。作为未成熟单核细胞的异质群体,MDSC通过表达PDL-1等抑制性受体在抑制T细胞方面发挥着重要作用。此外,HLA-DR表达的降低是一种已知的替代标志物,表明单核细胞功能障碍,导致对微生物刺激的反应性降低。因此,我们假设这些MDSC抑制宿主免疫反应,可能加剧布鲁氏菌病的发病机制,特别是对于急性患者。有趣的是,最近发表了几项针对新冠肺炎和结核病患者的独立研究,并发表了类似的观察结果,进一步支持了我们的假设。因此,我们scRNA-seq分析的这些发现共同表明,单核细胞MDSC可能有助于抑制布鲁氏菌病患者的宿主免疫反应。
对这项研究的解释可能受到几个重要局限性的限制。我们的研究提供了布鲁氏菌病不同阶段免疫反应的横断面图,但缺乏连续的时间数据。随着时间的推移,跟踪同一个人的纵向研究将为感染过程中免疫反应的动态变化提供更详细的见解。此外,我们的分析仅限于外周血单核细胞(PBMCs),这可能无法完全代表感染组织内的免疫环境。未来的研究应包括组织特异性免疫反应,以更全面地了解宿主与病原体的相互作用。
综上所述,我们的研究系统地描述了布鲁氏菌感染不同阶段外周免疫细胞的全面免疫格局,为布鲁氏菌病提供了许多以前未被发现的免疫特征。我们的发现揭示了免疫细胞比例和功能的显著变化,突出了细胞介导免疫在对抗布鲁氏菌中的关键作用。这些数据为更深入地了解布鲁氏菌病的免疫反应提供了丰富的资源,并可能为制定有效的治疗策略提供有价值的见解。
代码和数据可用性
本研究结果的数据可在中国国家生物信息中心公开获取,网址为https://ngdc.cncb.ac.cn/omix/release/OMIX006680; 参考号OMIX006680。本文报告的数据已保存在OMIX,中国国家生物信息中心/中国科学院北京基因组研究所(https://ngdc.cncb.ac.cn/omix; 登录号OMIX006680)。补充材料(图、表、图形摘要、幻灯片、视频、中文翻译版本和更新材料)可以在在线DOI或iMeta Science上找到http://www.imeta.science/。
引文格式:
Wang, Yi, Siyuan Yang, Bing Han, Xiufang Du, Huali Sun, Yufeng Du, Yinli Liu, et al. 2024. “Single-cell Landscape Revealed Immune Characteristics Associated With Disease Phases in Brucellosis Patients.” iMeta e226. https://doi.org/10.1002/imt2.226
作者简介

杨思园(第一作者)
● 首都医科大学附属北京地坛医院传染病学研究所、新发突发传染病研究北京市重点实验室,硕士研究生。
● 主要从事感染性疾病、各类新发突发传染病的研究工作。相关学术成果已发表于iMeta、Nature Metabolism、Clinical Infectious Diseases、Innovation等期刊。

杜秀芳(第一作者)
● 临汾市第三人民医院感染性疾病科主任,主任医师。
● 临汾市医学会感染病学专业委员会主任委员、山西省百千万卫生人才培养工程骨干精英人才、全国疑难及重症肝病攻关协作组委员。主要专业特长:各种发热、出疹性疾病的诊治;布氏杆菌病及其它动物源性传染病、旅游相关性疾病的诊治;各型肝炎、肝硬化及其并发症的诊治中枢神经系统感染等的诊治。
更多推荐
(▼ 点击跳转)
iMeta | 引用13000+,海普洛斯陈实富发布新版fastp,更快更好地处理FASTQ数据
iMeta | 德国国家肿瘤中心顾祖光发表复杂热图(ComplexHeatmap)可视化方法
1卷1期
1卷2期
1卷3期
1卷4期
2卷1期
2卷2期
2卷3期
2卷4期
3卷1期
2卷2期封底
2卷4期封底
3卷2期
3卷3期
3卷3期封底
期刊简介
“iMeta” 是由威立、肠菌分会和本领域数百千华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表所有领域高影响力的研究、方法和综述,重点关注微生物组、生物信息、大数据和多组学等。目标是发表前10%(IF > 20)的高影响力论文。期刊特色包括视频投稿、可重复分析、图片打磨、青年编委、前3年免出版费、50万用户的社交媒体宣传等。2022年2月正式创刊发行!发行后相继被Google Scholar、ESCI、PubMed、DOAJ、Scopus等数据库收录!2024年6月获得首个影响因子23.7,位列全球SCI期刊前千分之五(107/21848),微生物学科2/161,仅低于Nature Reviews,同学科研究类期刊全球第一,中国大陆11/514!
“iMetaOmics” 是“iMeta” 子刊,主编由中国科学院北京生命科学研究院赵方庆研究员和香港中文大学于君教授担任,是定位IF>10的高水平综合期刊,欢迎投稿!
联系我们
iMeta主页:
http://www.imeta.science
姊妹刊iMetaOmics主页:
http://www.imeta.science/imetaomics/
出版社iMeta主页:
https://onlinelibrary.wiley.com/journal/2770596x
出版社iMetaOmics主页:
https://onlinelibrary.wiley.com/journal/29969514
iMeta投稿:
https://wiley.atyponrex.com/journal/IMT2
iMetaOmics投稿:
https://wiley.atyponrex.com/journal/IMO2
邮箱:
office@imeta.science








































 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








