点击蓝字 关注我们
炎症性消化系统疾病中的肠道微生物组:当前的挑战与治疗机遇

iMeta主页:http://www.imeta.science
综 述
● 原文: iMeta (IF 23.8)
● 原文链接DOI: https://doi.org/10.1002/imt2.265
● 2024年12月31日,中国科学技术大学段屹和首都医科大学陈汉清团队在iMeta在线联合发表了题为“Gut microbiota in treating inflammatory digestive diseases: current challenges and therapeutic opportunities”的文章。
● 本文综述了肠道菌群在炎症性消化系统疾病研究领域面临的挑战、最新进展以及潜在的解决方案,并总结了以肠道菌群为靶点的疾病治疗策略和新兴技术,旨在为肠道菌群与炎症性消化系统疾病的基础研究和临床诊治提供新见解。
● 第一作者:石永鹏、陈泽冉、方庭昱
● 通讯作者:段屹(yduan@ustc.edu.cn)、陈汉清(chenhq@ccmu.edu.cn)
● 合作作者:陈星耀、邓友鹏、覃好、连敏、沈俊涛、宗芋茹、楚慧款、Constanze Hoebinger、郭浩、袁中尚、郑捷、周永健、潘越、Beatriz G Mendes、Sonja Lang、Tim Hendrikx、曾素玲、曹海龙、杨玲、陈连民、陈鹏、戴磊、王华、殷实、朱书、马雄、Bernd Schnabl
● 主要单位:中国科学技术大学生命科学与医学部、首都医科大学公共卫生学院
亮 点
● 肠道菌群在炎症性消化系统疾病的发生和发展中起着至关重要的作用,探索肠道菌群的生态位变化为理解其发病机制提供了新见解;
● 由于多种混杂变量的影响,微生物数据的异质性仍然是炎症性消化系统疾病人群队列研究中主要的挑战;
● 基于肠道菌群的干预策略促进了炎症性消化系统疾病的临床治疗,新兴技术和人工智能(AI)正在为微生物相关治疗注入新活力。
摘 要
大量研究表明,肠道菌群繁杂地参与了人类疾病的发生和发展,形成了一个以菌群为中心的多向调控轴。本文以例证的形式阐述了肠道微生物在炎症性消化系统疾病研究领域面临的挑战,如代谢功能障碍相关的脂肪变性肝病(MASLD)和炎症性肠病(IBD)。同时,总结了当前以微生物群为中心的治疗策略(包括益生菌、益生元、合生元、粪便微生物移植和噬菌体疗法)、新兴技术(肠道微生物组芯片和人工智能)以及未来可能的研究方向。总体而言,这些治疗策略和技术机遇与挑战并存,需要研究人员和临床医生在持续的实践中检验各种治疗方式的合理性与可行性。
视频解读
Bilibili:https://www.bilibili.com/video/BV1H96BYQEP4/
Youtube:https://youtu.be/ztxQd3tcVTs
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
人体胃肠道栖息了多种微生物,包括细菌、真菌、病毒和古细菌,它们通过产生脂多糖(LPS)、三甲胺、多糖、内源性酒精、短链脂肪酸(SCFAs)和次级胆汁酸等活性物质,共同调节宿主的代谢、免疫反应、氧化还原稳态和疾病进展。大量临床前和临床研究表明,肠道微生物及其代谢物在炎症性消化系统疾病的发生和发展中扮演重要作用。这些研究深化了我们对疾病病因的理解,并为肠道微生物群靶向疗法的研发提供了基础。然而,肠道微生物在炎症性消化系统疾病中作用的研究机遇和挑战并存,有几个阻碍该领域进展的关键问题值得关注。
在本文中,我们以例证的形式阐述了探索肠道微生物群在炎症性消化系统疾病中的作用所面临的挑战,如MASLD和IBD,并总结了现有的以微生物群为中心的治疗策略、新兴技术以及未来可能的研究方向。
炎症性消化系统疾病中肠道微生物组研究面临的挑战
微生物数据的异质性
微生物组非培养技术和多组学测序技术的发展加深了我们对肠道微生物群如何影响健康和疾病的理解。大量研究表明,疾病患者的肠道微生物与健康个体存在显著差异,这些差异跨越各个分类水平。在门水平的微生物群的结构特征已经达成一些共识,但在更细致的分类学层面,患者肠道微生物的组成表现出相当大的异质性和相互矛盾的研究结果,这对当前微生物群和炎症性消化系统疾病的研究带来了重大挑战。造成这一现象的原因是多方面的,包括测序平台和区域的差异、统计偏差、样品采集时间变化和粪便微生物密度等因素,详细的说明见表1。解决数据异质性的有效策略是收集多中心的大样本队列,并在实验设计中充分考虑表1中提到的混杂变量。此外,应建立微生物实验设计、临床样本收集和测序分析的最低质量控制标准,以便在标准化的框架内实现有效的数据整合。
表1. 同一疾病微生物的组成在不同研究中呈现异质性的潜在原因总结

微生物介导的肠道代谢组学数据不完整
肠道微生物衍生的代谢物是微生物与宿主相互作用的关键介质,参与调节宿主免疫成熟、免疫稳态和黏膜完整性。质谱分析、临床数据和临床前研究的进展揭示了微生物代谢物如何促进炎症性消化系统疾病的发病机制。然而,代谢组学数据的不完整仍然是主要挑战,这不仅体现在像原发性硬化性胆管炎(PSC)和急性胰腺炎(AP)等疾病的临床代谢组学数据的匮乏,而且体现在肠道代谢物功能的不确定性。例如,尽管SCFAs通常被认为对多种疾病有益,但Wang等人最近证明丁酸盐和丙酸盐是细菌来源的危险信号,可以通过表观遗传调控激活人巨噬细胞中的核苷酸结合寡聚结构域(NOD)、富亮氨酸重复序列(LRR)和含pyrin结构域蛋白3(NLRP3),进而促进白细胞介素-1β(IL-1β)的释放。收集大型的跨国队列可能有助于提供更多关于微生物衍生的代谢物如何影响疾病表型的信息。同时,需要进一步开发创新方法以检测未知化合物,特别是粪便样本中低浓度的代谢物,从而突破已有知识框架的局限,推动微生物代谢物研究向未知领域发展。
关于疾病中肠道真菌组和病毒组的认识不足
人类胃肠道中栖息着丰富多样的微生物,包括细菌、真菌、病毒、古细菌和原生动物。目前,大多数研究都集中在肠道细菌在炎症性消化系统疾病中的变化及其对疾病进展的影响方面,而肠道真菌组和病毒组的作用常被忽视,通常被视为“暗物质”。实际上,肠道真菌作为真核生物,其基因组比细菌大100倍左右,具有更大的生物复杂度,可能在影响健康和疾病方面发挥重要的作用。同样,肠道中的病毒,特别是噬菌体,作为细菌的天然捕食者,在维持细菌生态群落方面也起着关键作用。因此,未来的研究应加强对这两类重要“暗物质”在疾病中的作用研究,尤其是它们的进化生物学和综合数据库的建设。
微生物相互作用生态网络的模糊性
微生物之间的代谢活动产生的资源竞争和选择压力,不仅在细菌内部,而且在细菌与真菌或病毒之间产生了复杂生态相互作用。这些相互作用如何影响炎症性消化系统疾病的发展是一个值得深入探讨的领域。最近的研究发现,Bacteroides uniformis产生的管腔限制性胆酸——3-琥珀酰化胆酸(3-sucCA)可以通过促进益生菌Akkermansia muciniphila的生长来缓解MASLD,展示了一种典型的细菌交叉喂养模式。细菌交叉喂养资源的减少或缺乏可能导致MASLD的恶化,但这只是众多相互作用途径中的一条“贸易路线”。因此,重建细菌相互作用的复杂生态网络可能成为治疗或改善疾病的关键。这一原则广泛适用于所有与肠道微生物组相关的疾病。然而,目前我们对微生物在疾病中相互作用的理解仍然有限,主要集中在没有实验验证的关联分析,因此这一领域亟需进一步加强研究。
基于微生物的生物标志物的诊断和预测效能有限
鉴定可靠且创新型的生物标志物对于炎症性消化系统疾病的诊断和治疗具有重要意义。例如,与目前诊断IBD的金标准侵入性结肠镜检查相比,生物标志物的鉴定可以实现早期发现、预测、促进及时干预并降低并发症的风险。然而,微生物数据的异质性削弱了肠道菌群作为诊断生物标志物的可靠性和复现性。令人鼓舞的是,最近的人群队列研究提供了有前景的解决方案。Zheng等人发现,由多种细菌组合的生物标志物能够有效区分不同地区和种族的IBD和非IBD,以及克罗恩病(CD)和溃疡性结肠炎(UC),并呈现出优异的诊断性能。这种方法有效地减轻了队列选择偏差和其他妨碍横断面研究的混杂变量带来的影响。此外,考虑到肠道微生物、宿主代谢状态和遗传学之间的关系,作者建议整合代谢组学和宏基因组学数据,利用大规模数据集鉴定更加可靠的生物标志物。需要特别强调的是,任何新的生物标志物都应优于现有的临床生物标志物,并且在独立队列中保持稳健的复现性。
治疗机会和未来前景
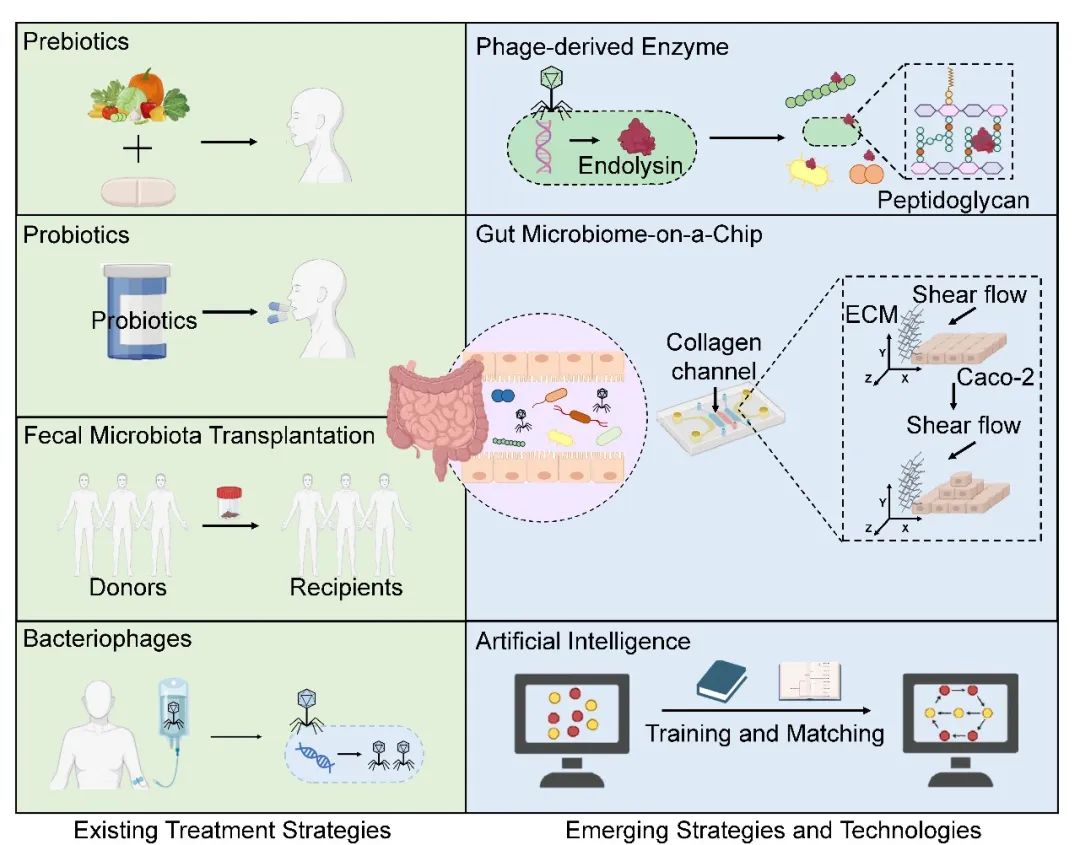
越来越多的临床前和临床研究表明,肠道微生物的失调与炎症性消化系统疾病的发生和进展密切有关。操控肠道微生物已成为治疗肠源性疾病的新策略,主要是通过补充抗炎细菌及其代谢物,消除致病菌并恢复肠道生态平衡。目前的治疗策略主要包括益生菌、益生元、合生元、粪便微生物移植(FMT)和噬菌体(图1)。例如,最近的一项随机临床试验表明,FMT可以通过改善肠道微生物失衡来显著缓解非酒精性脂肪性肝病(NAFLD,MASLD的前称)患者的疾病表型,并且FMT在瘦型NAFLD患者中的临床疗效高于肥胖型NAFLD患者。这一发现强调了FMT作为NAFLD治疗策略的潜力,并且表明FMT的有效性可能因疾病亚型而异。然而,目前对FMT的研究仍然有限,只有少数盲法随机对照试验。这在很大程度上归因于FMT的广泛性和非特异性,并且关于FMT对个人长期影响的信息很少,引起了对其安全性的担忧。在利用FMT治疗疾病时,要像血型和器官的配型一样,严格执行供体和受体的精准匹配原则,以确保获得最有利的结果。此外,重塑肠道微生物稳态治疗疾病的效果因人而异,可能受到基线微生物的特性、条件致病菌的丰度、功能冗余程度和疾病所处阶段的影响。定植抗性,即天然肠道菌群定植于宿主组织以排除潜在病原体的(无论是常驻病原体还是入侵病原体)感染,也是影响肠道菌群重塑的关键因素。
近年来,利用噬菌体特异性靶向致病菌作为一种精准医疗的方法,受到了广泛关注。噬菌体是细菌的天敌,在细菌存在的环境中大量生长。肠道中病毒颗粒的数量远远超过细菌,其中90%以上是噬菌体。健康成人的肠道噬菌体高度特异且多样,其中crAss样和微病毒科噬菌体是最稳定的定植者,可能通过影响肠道微生物来影响人体健康。Cornuault JK等人发现,与健康个体相比,IBD患者中的Faecalibacterium prausnii数量减少,而靶向这些细菌的温和噬菌体在粪便样本中的丰度明显更高。这种内源性的靶向作用为“后抗生素时代”微生物群介导的疾病治疗提供了新的途径。因噬菌体具有狭窄的宿主范围,可以在不干扰周围微生物群的情况下特异性地降低某些致病菌的水平。
在此理论框架下,研究人员根据患者的主要致病菌特征,开发了针对常见的炎症性消化系统疾病的噬菌体合剂,如IBD、酒精性肝病(ALD)、MASLD和PSC。这些合剂在动物研究和小型人群队列中显示出功效。然而,需要注意,噬菌体疗法仍处于早期阶段。除了缺乏全面的法律法规外,理论框架内的几个问题需要得到解决,如噬菌体的剂量,细菌裂解后诱导的局部炎症,以及对药代动力学和药效学性质的了解。更多的基础和临床前研究以及精心设计的随机、盲法、安慰剂对照的临床试验是推动该领域发展的必要条件。此外,噬菌体疗法的复苏促进了噬菌体相关治疗策略的发展。噬菌体内溶素被认为是一种具有巨大潜力的新型候选药物,这是一种在噬菌体复制后期阶段编码的细胞壁水解酶。这些酶靶向细菌细胞壁中的肽聚糖,导致细胞壁破裂,进而引起细菌死亡。最近的研究表明,噬菌体内溶素不仅能精确靶向肠道致病菌,还能清除细菌的生物膜,有效解决了长期以来抗生素难以清除致病细菌生物膜的难题。因此,利用计算生物学、生物信息学和合成生物学开发噬菌体的内溶素可能会为疾病治疗带来新的曙光。
技术的创新和突破也为炎症性消化系统疾病的诊断和治疗带来了新的视野(图1)。例如,Lee等人最近提出了一种可扩展的肠道微生物组芯片(GMoC),该芯片具有源自Caco-2细胞的可重复的3D分层肠道上皮,可以通过高倍成像可视化肠道微生物群的行为和相互作用,以及它们对肠道健康和疾病的共同影响。这项新技术为培养肠道微生物和研究其对肠道的影响提供了一种高效的仿生支架,并有助于发现微生物诱导疾病机制的新靶点和促进有效微生物治疗策略的发展。此外,AI在机器学习、深度学习模型、神经网络、深度生成模型、图形处理单元和可解释模型等前沿算法的驱动下,正在彻底改变疾病的诊断和治疗。人类微生物群是一个以高度动态和复杂的微生物与微生物、宿主与微生物以及微生物与环境相互作用为特征的生态系统。集成多个人工智能模型可以有效地管理和解释大型数据集,包括多组学测序数据,并能够识别和分析肠道生态网络内的时空相互作用。这有助于疾病的早期诊断,治疗反应的预测,以及疾病活动、进展和复发的监测。然而,值得注意的是,人工智能的临床应用仍然面临着一些挑战,包括与数据质量、可重复性、普适性以及围绕其使用的伦理、法律和监管相关的问题。随着人工智能在基础研究和临床实践交叉点上的不断发展,必须进行严格的试验来评估其临床疗效并确保其益处。
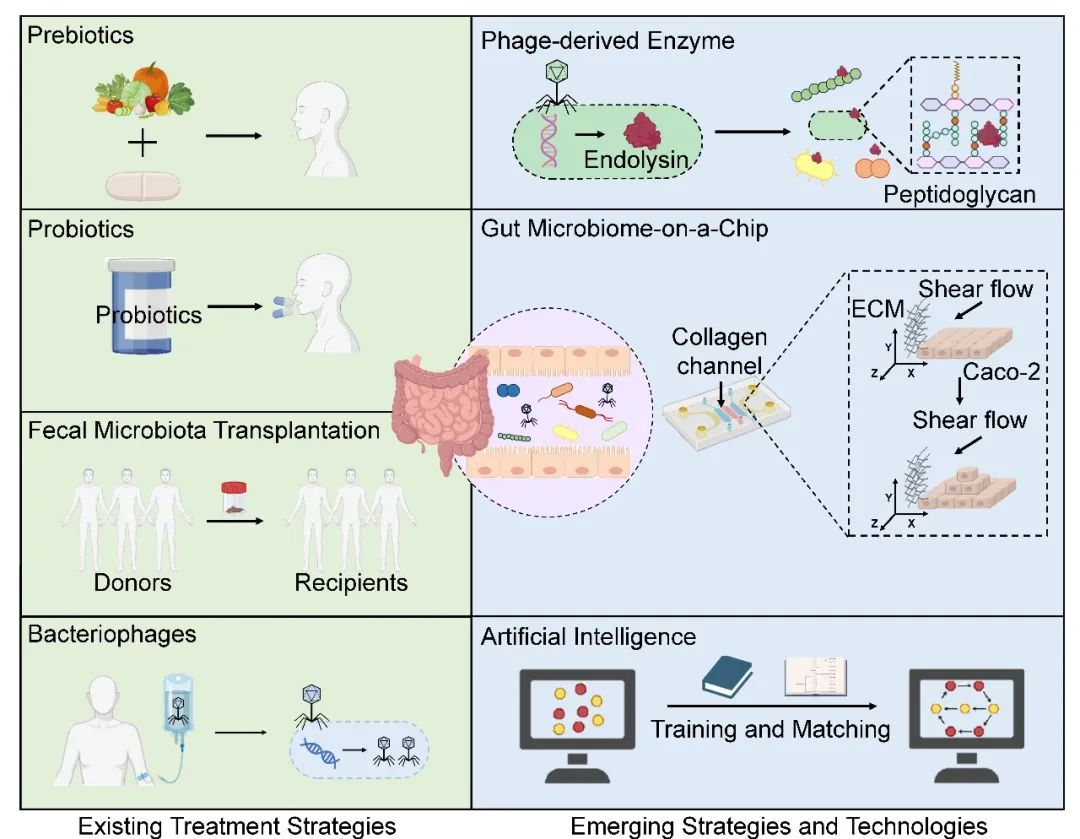
图1. 以肠道菌群为基础的炎症性消化系统疾病的干预和治疗策略
左侧面板:现有治疗策略;右侧面板:新兴策略和技术。ECM:细胞外基质。
结 论
探索肠道微生物群的生态位变化为理解人类炎症性消化系统疾病提供了新的见解。然而,受多种混杂变量影响引起的微生物数据的异质性,仍是人群队列研究中的一大挑战。虽然收集大型多中心的临床队列可能有助于解决这一困境,但对于一些罕见疾病(如PSC),依靠样本量的优势将变得困难。同时,建立微生物实验设计和人群队列样本采集的最低质量控制标准,并加强多组学整合分析在微生物研究中的应用,有助于更好地发现疾病的联合生物标志物并阐明微生物的相互作用在疾病调控中的机制。此外,基于微生物的治疗策略和技术机遇与挑战并存,需要研究人员和临床医生在实践中不断检验不同治疗方式的合理性和可行性。
引文格式:
Shi Yongpeng, Zeran Chen, Tingyu Fang, Xingyao Chen, Youpeng Deng, Hao Qin, Min Lian, et al. 2024. “Gut microbiota in treating inflammatory digestive diseases: current challenges and therapeutic opportunities.” iMeta 4. e265. https://doi.org/10.1002/imt2.265.
作者简介

石永鹏(第一作者)
● 中国科学技术大学生命科学与医学部博士后。
● 研究方向为肠道菌群在代谢性肝病中的作用与机制,获得2023年度国家资助博士后研究人员计划资助,主持中国博士后科学基金面上项目和中国科学技术大学青年创新基金项目。以第一作者(含共同)在iMeta、Chemico-Biological Interactions、Integrative Zoology、Toxicology等期刊发表SCI论文6篇。

陈泽冉(第一作者)
● 首都医科大学公共卫生学院营养与食品卫生学系在读硕士研究生。
● 研究方向是消化道肿瘤转移的分子机制及干预新技术。以第一作者(含共同)在iMeta、广州医药等期刊发表论文2篇。

方庭昱(第一作者)
● 中国科学技术大学生命科学与医学部博士研究生。
● 研究方向为肠道微生物与代谢性肝病。在iMeta、Journal of Clinical Investigation、International Journal of Biological Sciences等期刊发表SCI论文6篇。

段屹(通讯作者)
● 中国科学技术大学生命科学与医学部教授,博士生导师。
● 研究方向为肠道微生物对代谢性及免疫性疾病,尤其是慢性肝病的影响及其具体分子机制、微生物相关生物疗法,特别是噬菌体疗法的开发及应用等。入选国家海外高层次人才引进计划,主持国家自然科学基金优秀青年基金项目(海外)、中国科学院人才计划青年项目、中国科学院战略性先导科技专项资助、2023欧亚太平洋学术协会(EPU)联合项目等科研项目多项。学术成果以第一或通讯作者身份发表于Nature、Nature Communications、Nature Reviews Gastroenterology & Hepatology、Journal of Hepatology、Gut、iMeta等高影响力期刊,申请发明专利1项。担任iMeta期刊执行副主编,mLife期刊编辑和Nature Communications,Science Advances等期刊的审稿人,同时担任中国生物工程学会噬菌体专业技术委员会首任委员。

陈汉清(通讯作者)
● 首都医科大学公共卫生学院营养与食品卫生学系教授,博士生导师。
● 主要研究方向为消化系统衰老的危险因素及疾病干预策略。北京市海外高层次人才海聚工程青年项目,广州市高层次人才等,入选全球前2%顶尖科学家榜单。以第一/通讯作者(含共同)在iMeta、Hepatology、ACS Nano、Small等发表论文40余篇。申请专利8项,授权2项。任iMeta执行副主编,JCTH和广州医药编委等。担任中国转化医学联盟理事,北京市营养学会理事,中国营养学会蛋白质营养与健康专业委员会常委,北京市营养学会老年营养分会常委,中国毒理学会青年委员会常委等。
更多推荐
(▼ 点击跳转)
iMeta | 引用15000+,海普洛斯陈实富发布新版fastp,更快更好地处理FASTQ数据
iMeta | 兰大张东组:使用PhyloSuite进行分子系统发育及系统发育树的统计分析
iMeta | 唐海宝/张兴坦-用于比较基因组学分析的多功能分析套件JCVI
1卷1期
1卷2期
1卷3期
1卷4期
2卷1期
2卷2期
2卷3期
2卷4期
3卷1期
3卷2期
3卷3期
3卷4期
3卷5期
3卷6期
1卷1期
1卷2期
期刊简介
“iMeta” 是由威立、宏科学和本领域数千名华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表所有领域高影响力的研究、方法和综述,重点关注微生物组、生物信息、大数据和多组学等前沿交叉学科。目标是发表前10%(IF > 20)的高影响力论文。期刊特色包括中英双语图文、双语视频、可重复分析、图片打磨、60万用户的社交媒体宣传等。2022年2月正式创刊!相继被Google Scholar、PubMed、SCIE、ESI、DOAJ、Scopus等数据库收录!2024年6月获得首个影响因子23.8,位列全球SCI期刊前千分之五(107/21848),微生物学科2/161,仅低于Nature Reviews,学科研究类期刊全球第一,中国大陆11/514!
“iMetaOmics” 是“iMeta” 子刊,主编由中国科学院北京生命科学研究院赵方庆研究员和香港中文大学于君教授担任,是定位IF>10的高水平综合期刊,欢迎投稿!
iMeta主页:
http://www.imeta.science
姊妹刊iMetaOmics主页:
http://www.imeta.science/imetaomics/
出版社iMeta主页:
https://onlinelibrary.wiley.com/journal/2770596x
出版社iMetaOmics主页:
https://onlinelibrary.wiley.com/journal/29969514
iMeta投稿:
https://wiley.atyponrex.com/journal/IMT2
iMetaOmics投稿:
https://wiley.atyponrex.com/journal/IMO2
邮箱:
office@imeta.science










































 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








