点击蓝字 关注我们
胆固醇胆结石患者的肠道微生物组和代谢组特征提示益生元的预防潜力

iMeta主页:http://www.imeta.science
研究论文
● 原文: iMeta (IF 23.8)
● 原文链接DOI: https://doi.org/10.1002/imt2.70000
● 2025年2月21日,北京医院崔红元、肖飞和中国科学院赵方庆等在iMeta在线发表了题为“Gut microbiome and metabolome characteristics of patients with cholesterol gallstones suggest the preventive potential of prebiotics”的文章。
● 本研究使用临床生物样本的微生物组和代谢组数据,系统评估了胆结石患者的潜在生物标志物,并以微生物组为靶点,在小鼠模型中验证干预效果。为开发创新的基于微生物的非侵入治疗方法提供了重要参考。
● 第一作者:刘晔
● 通讯作者:崔红元(cuihongyuan3921@bjhmoh.cn)、赵方庆(zhfq@biols.ac.cn)、肖飞(xiaofei3965@bjhmoh.cn)
● 合作作者:李贺鑫、孙天罕、孙高远、蒋伯岳、刘美兰、王晴、李童、曹健夫、赵莉
● 主要单位:北京医院&国家老年医学中心、中国科学院杭州高等研究院,中国科学院动物研究所
亮 点

● 氨基酸、脂肪酸和烟酸等代谢物可能通过影响胆固醇的合成、运输或代谢,进而对胆结石的形成产生影响;
● 解甘草酸梭菌(C. glycyrrhizinilyticum)可加重小鼠胆结石形成;
● 低聚果糖或可作为一种经济实惠的、靶向微生物群的胆固醇结石治疗方案。
摘 要
胆固醇胆结石(CGS)目前仍没有有效的非侵入性治疗方法,其病因机制研究相对有限。本横断面研究旨在多角度探索胆结石患者的潜在生物标志物,并以微生物组为靶点,在小鼠模型中验证干预效果。研究通过16S rRNA V3-V4测序对191份样本进行微生物组成分析。随后,选取60份样本(30例CGS患者和年龄,性别匹配的30例健康对照)进行宏基因组测序及基于液相色谱-质谱(LC-MS)的粪便代谢组分析。通过微生物组和代谢组特征分析,鉴定了CGS相关的潜在生物标志物。使用8周龄雄性C57BL/6J小鼠,高胆固醇高胆酸饲料喂养8周构建胆结石模型。对抗生素处理后的小鼠进行单菌移植,验证筛选菌种在胆结石形成中的作用。此外,我们使用短链脂肪酸(SCFAs)如丁酸钠、乙酸钠(NaA)、丙酸钠和低聚果糖(FOS)进行干预,探索是否对胆结石的形成产生影响。研究发现,CGS患者的肠道微生物组和代谢组具有显著改变,识别的生物标志物在区分CGS患者与健康对照组(HCs)方面具有良好的诊断性能。多组学分析显示,CGS与丁酸盐和丙酸盐代谢、牛磺酸和亚牛磺酸代谢、脂肪酸合成与降解途径以及乙醛酸和二羧酸代谢等通路相关。在动物实验中,与对照组相比,Clostridium glycyrrhizinilyticum组的胆结石发生率显著升高,其存在可加重小鼠胆结石的形成。此外,与对照组相比,接受NaA和FOS干预的小鼠胆结石严重程度显著降低,FOS甚至可完全抑制胆结石的形成。膳食添加FOS通过调节肠道微生物群的组成和功能或可成为预防胆结石发生的潜在有效手段。
视频解读
Bilibili:https://www.bilibili.com/video/BV1YZPAevEpk/
Youtube:https://youtu.be/0pH13PV_32c
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
胆结石是一种发病率较高的常见病,大约10%–15%的成年人患有胆结石,给患者带来极大的痛苦。其中,85%–90%的胆结石为胆固醇结石(CGS)。胆结石的形成通常与胆固醇过饱和和胆汁酸池的变化有关,受环境和遗传因素影响。近年来,越来越多的研究表明肠道微生物群失调参与多种疾病的发生发展。肠道微生物群通过产生胆汁酸水解酶、胆汁酸羟化酶和3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)等,帮助调节胆汁酸和胆固醇的代谢。已有少数研究者使用单菌移植技术分析了肠道微生物群与胆结石疾病的关联。研究发现,脱硫弧菌目(Desulfovibrionales)在胆结石患者的肠道中丰度较高。脱硫弧菌的代谢产物H2S水平升高,可激活肝脏的法尼醇X受体(FXR)并抑制CYP7A1的表达。另外,有研究报道乳酸菌(如L. reuteri和L. plantarum)可能通过FXR信号通路缓解CGS。迄今为止,胆囊切除术仍是治疗胆囊结石最有效的方法。熊去氧胆酸(UDCA)曾用于溶解特定患者的胆结石,但由于其高复发率,该疗法已逐渐失去青睐。目前,尚无推荐用于CGS预防和治疗的药物选择,手术治疗的并发症发生率较高。因此,许多研究人员致力于寻找预防和治疗CGS的有效非侵入方法。
短链脂肪酸(SCFAs),即乙酸、丁酸和丙酸,是膳食纤维摄入后细菌发酵的主要代谢产物。产SCFAs细菌的富集可调节肠道炎症和宿主免疫以抑制疾病进展,并影响胰岛素敏感性和能量代谢。因此,肠道微生物群及其衍生的代谢产物(如SCFAs)可能成为胆结石的新治疗靶点。低聚果糖(FOS)是一种膳食纤维,可通过调节有益肠道菌的组成和活性,对宿主产生有益的生理效应。据报道,FOS可通过增加3-羟基十八碳烯酸的浓度,预防结肠炎症。此外,FOS可通过增加肠道中产SCFAs细菌的丰度,调节肠道免疫稳态,缓解葡萄糖和脂质代谢紊乱。然而,关于FOS在胆结石形成中的作用的研究尚少。
目前,肠道微生物群在胆结石发病机制中的作用仍不明确,非手术治疗胆结石的探索尚未取得显著突破。在胆结石人群中,肠道和胆道微生物群及其代谢产物的表型和诊断特征尚未通过大样本多组学研究得到充分探索。本研究通过分析CGS和健康对照的肠道微生物组、代谢物以及菌群基因特征,确定了可能的生物标志物,进而对特定菌株、SCFAs和FOS在胆结石模型小鼠中的作用进行了验证。
结 果
研究对象微生物群特征
本研究从2020年4月至2021年6月,共纳入66名临床诊断为CGS的患者(平均年龄56.29 ± 14.18岁;男女比例30:36)和53名健康对照(中位年龄39岁;男女比例22:31),详细研究流程见图1A。CGS组与HCs相比,γ-谷氨酰转肽酶(GGT)、高密度脂蛋白胆固醇(HDL-C)、淋巴细胞、单核细胞、血小板、白细胞(WBCs)和红细胞(RBCs)水平降低,而总胆红素(TB)水平升高(均p < 0.05)。性别和年龄匹配后,组间的临床变量平衡,仅葡萄糖、中性粒细胞计数和HDL-C存在差异(表1)。
从所有的胆汁、结石和粪便样本中,我们共鉴定出3064个扩增子序列变异(ASVs),具体分布如下:胆汁样本中ASVs为1016,胆结石中ASVs为1955,患者粪便中有747个ASVs,正常粪便中有683个ASVs(图S1A)。维恩图显示172个ASVs在所有组中共有,而1974个ASVs是胆道菌群特有。进一步的宏基因组分析显示,胆汁样本中检测到207种物种,患者粪便中检测到5905种物种,正常粪便中检测到6535种物种(图S1B)。在门水平上,拟杆菌门(Bacteroidota)和厚壁菌门(Firmicutes)在肠道中占比较高,而变形菌门(Proteobacteria)在胆道微生物群中占50%–60%(图1B)。图1C展示了各组之间菌属的相对丰度,前20位菌种的相对丰度见图S1C。Escherichia coli、Salmonella enterica、Streptococcus pneumoniae、Klebsiella aerogenes和Chlamydia trachomatis在胆汁中占比较高。F. prausnitzii、Escherichia coli和Bacteroides vulgatus在肠道中相对丰度较高。
肠道微生物群Chao1指数显著低于胆道(p < 0.05)(图1D)。此外,与健康对照组粪便样本相比,胆囊结石患者粪便样本的ACE指数显著降低;胆汁样本中的ACE指数也显著低于结石样本(p < 0.05)(图1E及表S1)。对丰度较高的前20种菌属进行聚类,将191个样本划分为三个不同的簇(A–C),分别对应于肠道微生物群、肠道与胆道微生物群的交叉群体以及胆道微生物群(图1F)。

图1. CGS与HCs组肠道胆道微生物组多样性与组成
(A)研究设计和流程图。经过严格的纳入和排除标准,共采集3种类型191个样本,包括119个粪便样本、47个胆汁样本和25个结石样本。采用UHPLC-MS/MS检测胆汁和粪便样本以测定代谢物;(B-C)两组细菌群落在门(B)和属(C)水平上的相对丰度;(D-E)各组间ASVs的Alpha多样性指数、Chao1(D)和 ACE(E)指数;(F)两组中每个样本前20个属的相对丰度热图。HCs,健康对照;CGS,胆固醇结石患者;ASVs,扩增子序列变异。LD,致石饮食;SCFAs,短链脂肪酸;UHPLC-MS/MS,超高效液相色谱-质谱/质谱法。
CGS组与HCs组间的群落组成差异
为了进一步探讨CGS组与HCs组之间细菌群落的差异,对30名CGS患者和30名年龄、性别匹配的HCs的粪便样本进行了16S rRNA测序分析。与HCs相比,CGS粪便样本的ACE指数显著降低(p < 0.05)(图S2A,表S2)。主坐标分析(PCoA)和ANOSIM检验表明,两组之间的微生物群组成存在显著差异(Bray-Curtis距离,p = 0.001)(图S2B,表S3)。在属水平上,共有22个菌属的在两组之间存在显著差异,其中12个菌属的相对丰度在CGS组中降低(p < 0.05,图S2C,表S4)。LEfSe分析在不同分类学水平上鉴定出49个显著特征(LDA > 2,p < 0.05,图S2D-E)。线性判别分析结果显示,CGS组中Patescibacteria、Pseudomonadaceae、Morganellaceae、Saccharimonadaceae、Vibrionaceae和Staphylococcaceae丰度增加。在属水平上Pseudomonas、Morganella、Ruminobacter、Faecalibaculum、Turicibacter、Haemophilus和Ruminococcus可能作为潜在的关键的生物标志物,用于区分胆囊结石患者和健康个体。在这些显著差异菌属中,有10种菌属与不同代谢物相关(图S2F和表S5)。例如,Marvinbryantia的相对丰度与L-抗坏血酸2-硫酸酯呈负相关。
对匹配后的样本进行组间比较,以更深入探讨细菌物种的差异并鉴定不同的KO基因和功能。结果显示,CGS粪便样本的ACE指数显著低于HCs(p < 0.05)(图2A)。在CGS样本中,33种菌种包括Clostridium perfringens、R. gnavus和C. glycyrrhizinilyticum等的相对丰度增加;23种菌种,包括F. prausnitzii、Thermodesulfovibrio thiophilus和L. rogosae的相对丰度较HCs组减少(表S6),代表性差异菌种见图2B。
LEfSe分析结果发现,在种水平上共有13个关键特征(LDA > 2,p < 0.05),包括几种机会性病原体,如E. coli、Shigella sonnei、R. gnavus、Salmonella enterica和C. perfringens,它们在CGS患者中显著升高(LDA(1og10)≥ 2),而F. prausnitzii在HCs中贡献较大(LDA(1og10)> 4)(图2C)。对于上述结果发现的重点差异菌种,结合生物学意义,对于可培养的3种菌种进行了ROC分析,发现其在区分CGS与HCs时,F. prausnitzii的灵敏度为0.633,特异度为0.667(AUC = 0.650);R. gnavus的灵敏度为0.767,特异度为0.567(AUC = 0.664);C. glycyrrhizinilyticum的灵敏度为0.833,特异度为0.500(AUC = 0.673)(图2D)。线性回归分析表明多种不同细菌物种显著解释了与肝功能相关的生化特征的变异(如F. prausnitzii对TC变异的解释度为4.5%,C. glycyrrhizinilyticum对ALT变异的解释度为6.3%)(图2E和表S7)。
基于宏基因组测序数据,我们进一步对功能通路进行富集,共鉴定出36个KEGG通路三级分类水平具有显著差异(表S8)。在CGS组中,脂质代谢通路相关活性显著增加,包括亚油酸、花生四烯酸、α-亚麻酸和醚脂代谢通路(图2F)。对于注释到的KO基因进行差异分析,共得到1264个KO基因与HCs相比存在显著差异(p < 0.05)。这些显著差异的KO基因分布于若干代表性途径(图2G),其中大多数差异KO基因富集于丁酸盐和丙酸盐代谢、脂肪酸降解以及乙醛酸和二羧酸代谢。

图2. 基于宏基因组数据,配对样本CGS和HCs中肠道微生物群的差异
(A) 组间物种的Alpha多样性ACE指数;(B) CGS和HCs中肠道微生物群差异菌种的相对丰度。绿色和蓝色分别代表健康对照 (n = 30) 和胆结石患者 (n = 30)。Wilcoxon秩和检验计算p值;(C) LefSe分析种水平特征。绿色条表示分类群在 HCs中富集,蓝色条表示分类群在CGS中富集;(D) 基于要验证的菌株 (C. glycyrrhizinilyticum、R. gnavus和F. prausnitzii) 的ROC分析以区分CGS和HCs;(E) 不同菌种解释的生化指标比例。每个条形的高度代表使用单变量线性回归计算的解释方差。条形表示差异具有显著性(p < 0.05);(F) 差异显著的KEGG功能通路(3级分类水平);(G) 差异KO基因相关的代表性代谢通路。圆圈大小代表差异KO基因的数量。CGS,胆固醇胆结石患者;HCs,健康对照。
非靶向代谢组结果
PLS-DA和OPLS-DA结果显示,CGS与HCs之间代谢组成显著不同(图3A-B)。差异分析显示CGS组中有76种代谢物(如吲哚、PC (18:3e/6:0)和LPA 16:0)升高,而45种代谢物(包括烟酸、4-羟基异亮氨酸和D-α-羟基戊二酸)减少(表S9)。代表性差异代谢物的相对丰度改变在图3C中列出,主要包括氨基酸、碳水化合物、羟基肉桂酸、吡啶羧酸、脂类、蝶呤及其衍生物和苯类化合物。对差异代谢物进行功能富集,显著富集的前25个代谢通路(图3D和表S10),包括组氨酸代谢、牛磺酸和亚牛磺酸代谢、丁酸代谢和α-亚麻酸代谢。
综合差异菌属,差异菌种以及差异代谢物结果,我们进一步分析了微生物群和代谢物在区分CGS与HCs中的单独诊断性能,不同细菌和代谢物的AUC值均在0.6到0.8之间。依据AUC值的大小,最终选择了12种差异菌属(AUC > 0.7),8种差异菌种(AUC > 0.68)和13种差异代谢物(AUC > 0.68)纳入回归模型,分析联合诊断性能(表 S11)。研究表明这些候选的菌属,菌种以及代谢物能够区分CGS患者与健康对照,AUC值分别为96.7%,86.8%和98.1%(图3E)。为了进一步筛选潜在的生物标志物,结果发现多种代谢物显著解释了HDL-C、LDL-C、TC、TG、ALT和AST水平的变异。例如,4-氨基苯甲酸和L-谷氨酸分别解释了HDL-C变异的11.0%和14.2%(图3F和表S12)。
采用Spearman相关分析评估了124种差异菌种与33种有生物学意义的差异代谢物之间的相关性(表S13)。其中可作为潜在生物标志物的差异代谢物与差异菌种的相关性结果如图3G所示。大部分显著相关的菌种属于Bifidobacterium, Clostridium、Shigella和Enterococcus菌属,这些菌属的细菌能够编码胆盐水解酶(BSH)。一些菌种与烟酸,PC (18:3e/6:0) 和吲哚显著相关,这些物质可能来源于饮食或通过内源性产生。烟酸与某些在CGS患者中富集的菌种呈负相关,而与健康样本中富集的菌种(如F. prausnitzii)呈正相关,这表明烟酸可能是与CGS和HCs差异相关的潜在生物标志物。菌种如Desulfitobacterium chlororespirans、Clostridium sp. CAG:451和Actinobacteria bacterium 66_15的丰度与PC (18:3e/6:0)水平呈正相关。此外,C. glycyrrhizinilyticum的丰度与吲哚水平呈正相关,但与D-α-羟基戊二酸(D-α-Hydroxyglutaric acid)水平呈负相关(图3G)。与候选验证菌种相关的差异代谢物如吲哚,D-α-羟基戊二酸和烟酸的丰度组间比较如图3H所示。
在胆汁样本中,共鉴定921种化合物,269种化合物可对应至KEGG数据库。脂类和类脂分子(57种代谢物)、有机酸及其衍生物(54种代谢物)以及有机杂环化合物(23种代谢物)可分类至HMDB数据库(图S3A)。对所有代谢物进行功能富集,结果显示相关代谢通路包括类固醇激素生物合成,嘌呤代谢等(图S3B)。为了进一步比较胆结石患者胆汁和粪便样本中菌群的不同,我们得到了17种胆汁中检测到但粪便未检测到的菌种(图S3C)。随后,对这17种菌种与胆汁代谢物进行相关性分析。研究发现,Neisseria subflava的相对丰度与胆酸和7-酮胆酸的水平呈负相关。类似地,脱氧胆酸的水平与多种细菌呈负相关,包括Staphylococcus saccharolyticus、Pseudomonas sp. 2822-17,N. subflava,Neisseria polysaccharea、Conexibacter woesei和Achromatium sp. WMS1(图S3D和表S14)。

图3. CGS和HCs粪便样本代谢组差异分析
(A-B)偏最小二乘判别分析(PLS-DA)和正交偏最小二乘判别分析(OPLS-DA);(C)组间差异代谢物,蓝色和红色圆圈分别表示CGS减少和CGS富集的代谢物;(D)MetaboAnalyst3.0中121种差异代谢物的功能通路富集,显著富集的通路通过气泡图显示(p < 0.05,Fisher精确检验);(E)受试者工作特征曲线 (ROC) 分析,根据菌种(橙色)、属(蓝色)或代谢物(红色)分别区分CGS和 HCs;(F)差异代谢物解释的生化指标比例。每个条形的高度表示使用单变量线性回归计算的解释方差。条形表示显著关联(p < 0.05)。颜色标记潜在的生物标志物,红色字体:增加。蓝色字体:减少;(G)差异菌种和代谢物相关性分析。彩色条表示分组,白色加号表示显著相关(+p < 0.1;++p < 0.05,Student’s t-test(双侧),Benjamini-Hochberg多重比较校正,校正后p值见表S13);(H)与候选验证菌种相关的差异代谢物水平组间比较。CGS,胆固醇胆结石患者;HCs,健康对照;FC,差异倍数。
整合代谢组和微生物组揭示相关功能通路特征
如图4A所示,观察到多种代谢物,包括13(S)-HOTrE、烟酸、烟酰胺、L-谷氨酸、N-氨基甲酰-L-天冬氨酸、L-aspartate、L-asparagine和1-甲基组氨酸参与α-亚麻酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢、烟酸和烟酰胺代谢以及组氨酸代谢,与这些通路相关的差异基因见表S15。多个差异KO基因多集中于丁酸和丙酸代谢、牛磺酸和亚牛磺酸代谢、脂肪酸合成与降解通路,以及乙醛酸和二羧酸代谢通路,这些通路均与CGS相关。
在α-亚麻酸代谢中,水解磷脂生成2-酰基-溶血磷脂和脂肪酸的磷脂酶A1(pldA)基因在CGS中显著升高(图S4)。涉及α-亚麻酸代谢、烟酸和烟酰胺代谢以及组氨酸生物合成的基因在CGS中显著升高(p < 0.05)。参与乙酸吸收/异化反应的磷酸乙酰转移酶(pta)在CGS中显著减少,提示其与丙酸代谢以及牛磺酸和亚牛磺酸代谢有关(p < 0.05)。

图4. 通路整合和动物实验设计
(A)CGS相关的KEGG通路模块和相关不同代谢物的变化。KEGG通路图包括“α-亚麻酸代谢”、“烟酸和烟酰胺代谢”、“丙氨酸、天冬氨酸和谷氨酸代谢”、“丁酸代谢”、“丙酸代谢”、“脂肪酸代谢”和“乙醛酸和二羧酸代谢”。每种代谢物黄色标记表示升高,灰色标记表示降低;(B)动物实验示意图。
动物实验验证
针对筛选出的菌种,结合生物学意义以及确保菌种可培养,最终对3种细菌进行验证,包括C. glycyrrhizinilyticum、R. gnavus和F. prausnitzii,筛选流程如图4B所示。随后,对经抗生素清扫的伪无菌小鼠进行单菌移植实验,干预总时长为8周,以评估这些细菌对胆结石形成的影响(图5A)。研究结果显示,对照组胆结石的发生率较低(12.5%),C. glycyrrhizinilyticum的存在显著促进了胆结石的形成(87.5%,p = 0.010),在胆囊中可见明显的叶状晶体或胆固醇颗粒(图5B)。R. gnavus组中也观察到胆结石发生率升高(50%,4/8),但差异无统计学意义。接受F. prausnitzii灌胃的小鼠,胆结石形成率为(62.5%,5/8),亦高于对照组。qPCR结果显示,与对照组相比,灌胃后C. glycyrrhizinilyticum和R. gnavus的丰度显著增加(图5C和表S16)。
进一步的组织学分析结果显示,与对照组相比,C. glycyrrhizinilyticum和R. gnavus组的小鼠肝组织损伤显著增加(5D)。油红O染色结果显示,在C. glycyrrhizinilyticum和R. gnavus组的小鼠肝实质中,脂滴含量明显增多(图5E)。R. gnavus组的小鼠肝脏重量与体重比显著升高(p < 0.05)(图5F)。尽管R. gnavus组的小鼠血清葡萄糖和总胆汁酸(TBA)水平有所升高,但差异无统计学意义(图5G-H)。ALT、AST及TG水平在各组间未见显著差异。然而,与对照组相比,所有实验组的血清TC水平均显著降低(图5I-L和表S17)。
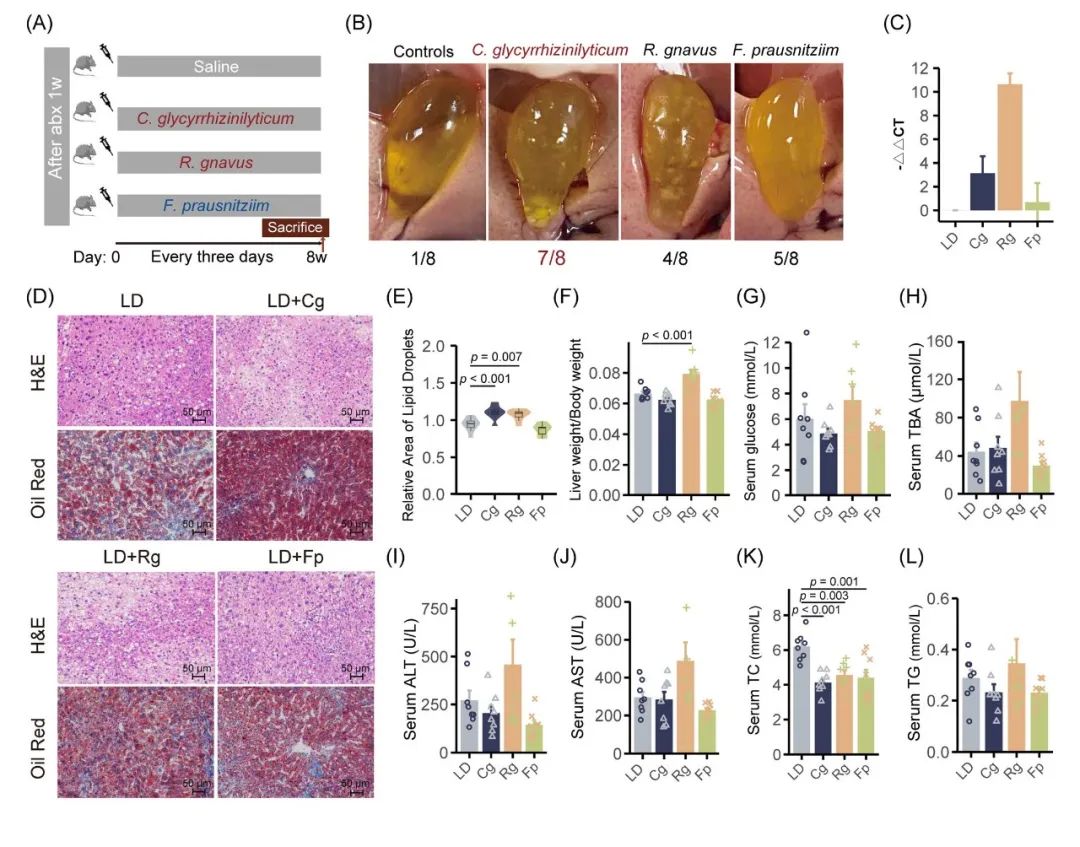
图5. 单菌移植对LD诱导的小鼠胆结石的影响
(A)单菌移植示意图;(B)不同组小鼠胆囊和胆结石的大体外观;(C)通过特异性引物的qPCR定量;(D)不同组H&E染色和油红染色肝脏切片的代表性图像(× 200);(E)每组的相对脂质含量。每个框以中位数为中心,下限和上限分别代表第一和第三四分位数(第25和第75百分位数);(F)不同组肝脏重量与体重的比;(G-H)血清葡萄糖和血清TBA水平;(I-L)血清ALT、AST、TC和TG水平。TC,总胆固醇;TG,甘油三酯;ALT,丙氨酸氨基转移酶;AST,天冬氨酸氨基转移酶;TBA,总胆汁酸;Cg,C. glycyrrhizinilyticum;Rg,R. gnavus;Fp,F. prausnitzii。使用单因素方差分析和Dunnett事后检验计算p值。
基于差异基因富集的丁酸盐和丙酸盐代谢通路,提示我们SCFAs水平的改变或许可影响胆结石的形成(图2G)。参与丁酸盐和丙酸盐代谢通路的差异KO基因的相对丰度见图6A所示。对照组C57BL/6J小鼠饲喂LD饲料8周后,全部小鼠均形成胆结石,发生率达到100%。分别使用丁酸钠(NaB)、丙酸钠(NaP)或乙酸钠(NaA)干预后,研究结果发现小鼠胆囊中仍有胆固醇颗粒,但与对照组相比,胆囊内叶状晶体或分层晶体有所减少。特别是使用FOS干预后的小鼠其胆囊中均未观察到可见的叶状晶体或胆固醇颗粒(0/12)(图6B-C)。组织学结果表明,各实验组均对肝组织损伤具有保护作用,与对照组相比显著减少了肝实质的脂质积累(图6D)。NaA治疗显著降低了肝脏相对脂质含量(p < 0.05)(图6E)。对小鼠胆结石的严重程度进行评估,结果显示与对照组相比,NaA和FOS干预后的小鼠胆结石分级评分显著降低(图6F)。
此外,与对照组相比,所有干预组的小鼠肝重与体重比显著降低,FOS组降低的较为明显(p < 0.05)。NaP和NaA组显著提高了小鼠血清葡萄糖水平(p < 0.05)。所有干预均显著降低了TC和TBA水平(p < 0.05)。此外,与对照组相比,NaB、NaP和FOS干预后显著降低了血清ALT水平(p < 0.05)。接受FOS干预的小鼠TG水平显著升高(p < 0.05),各组间血清AST未观察到显著差异(图6G-M和表S18)。
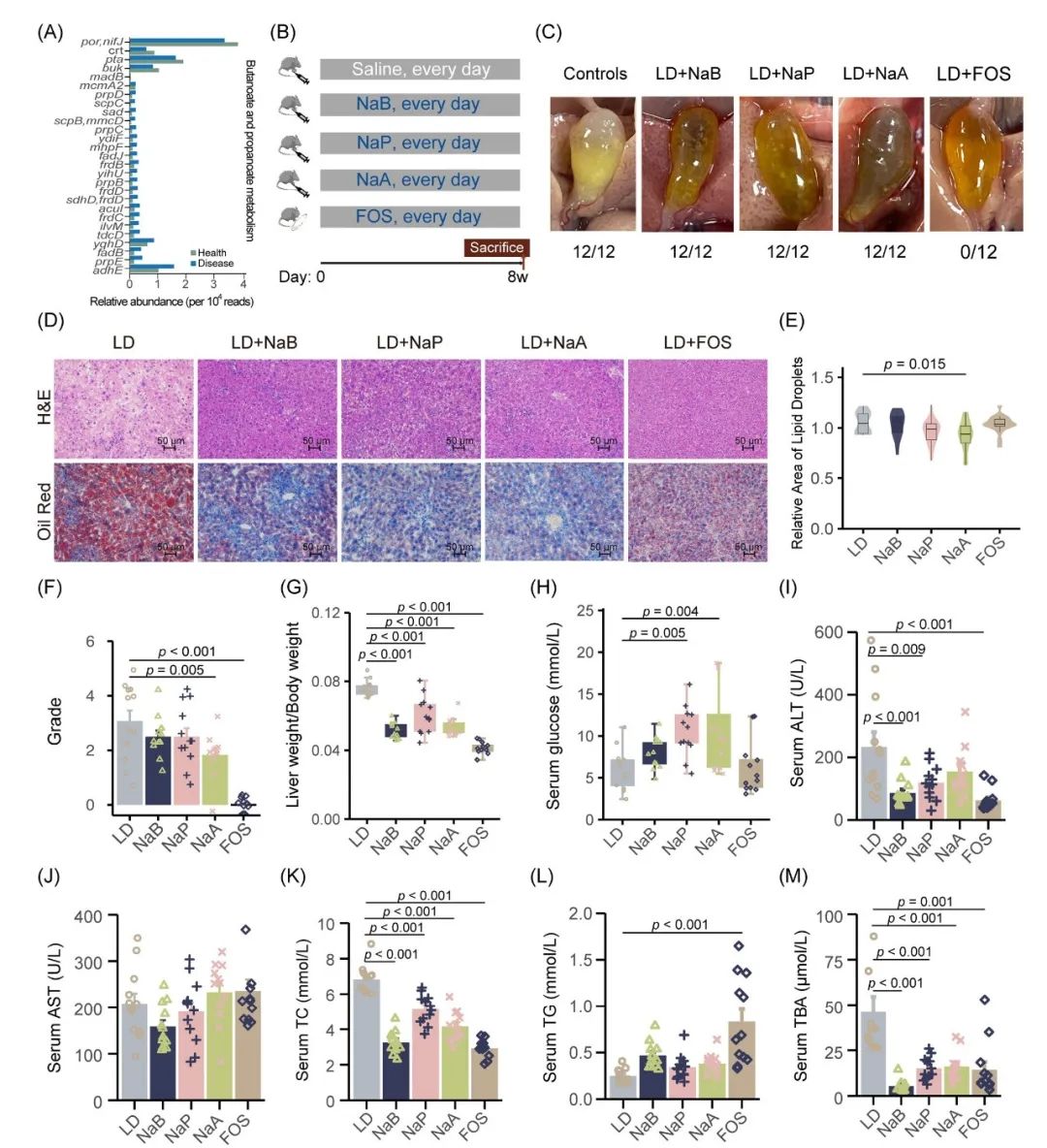
图6. FOS和SCFAs对LD诱导的小鼠胆结石的影响
(A) 参与丁酸和丙酸代谢途径的差异基因的相对丰度;(B) 动物实验干预示意图;(C) 不同组小鼠胆囊和胆结石的大体外观;(D) 不同组H&E染色和油红染色肝脏切片的代表性图像(× 200);(E) 各组的相对脂质含量;(F) 基于观察到的胆结石,其严重程度等级;(G) 不同组的肝重与体重之比;(H) 血糖水平;(I-M)血清 ALT、AST、TC、TG和TBA水平。TC,总胆固醇;TG,甘油三酯;ALT,丙氨酸氨基转移酶;AST,天冬氨酸氨基转移酶;TBA,总胆汁酸;NaB,丁酸钠;NaP,丙酸钠;NaA,乙酸钠;FOS,低聚果糖;SCFA,短链脂肪酸。使用单因素方差分析和Dunnett事后检验计算p值。
讨 论
胆结石的非侵入性治疗仍然是一个临床难题。研究表明,肠道菌群通过影响代谢与宿主相互作用,进而影响人类健康。多组学研究从多个角度揭示了与胆结石形成相关的潜在靶点。值得注意的是,F. prausnitzii、C. glycyrrhizinilyticum和R. gnavus等几个关键菌株因其与肠道健康和代谢疾病的关联脱颖而出。通过实验我们发现C. glycyrrhizinilyticum可加重胆结石的形成。此外,为评估有效的干预措施,我们开展了针对SCFAs的实验,首次发现补充FOS能够完全抑制由促结石饮食(LD)诱导的小鼠胆结石形成。本研究结果通过分析微生物组和代谢组数据,提供了潜在的治疗靶点,为CGS的治疗开辟了新思路。
目前,用于检测胆结石的方法包括腹部超声、CT扫描、磁共振胰胆管造影(MRCP)和内镜逆行胰胆管造影(ERCP)。腹部超声简单、经济且无创,是首选方法;但对小结石和肥胖患者的敏感性较低。CT扫描昂贵且有辐射暴露,MRCP敏感性高但成本较高,需要使用造影剂,并不适合所有患者;ERCP为侵入性检查,存在并发症风险。有研究显示,CGS患者和健康对照之间的肠道微生物存在差异。然而,类似研究仍存在样本量小、年龄和性别等混杂因素控制不足的局限。此外,由于宏基因组测序成本较高,大多数研究依赖于16S rRNA测序,该方法在区分物种水平和探索基因功能方面具有局限性。胆结石代谢物标志物的研究主要集中于血液和胆汁样本,针对粪便代谢物的大规模研究较少。为填补这些空白,我们系统分析并比较了物种水平的粪便微生物多样性,并探索其与临床指标的相关性,以识别肠道微生物和代谢物潜在的生物标志物。
与其他研究报道的与胆结石相关的磷脂酶基因变化一致,我们也发现CGS 患者中pldA基因丰度显著增加。磷脂酶A通过水解胆汁中重要的磷脂,破坏其平衡,从而促进胆固醇和其他胆结石成分的沉淀。富集分析显示,在所有CGS中,α-亚麻酸代谢相关基因(pldA、fadA)、烟酸和烟酰胺代谢相关基因(sthA、mazG)以及组氨酸生物合成相关基因(hisG、hisI)均上调。而脂肪酸生物合成相关基因(FabG、ACSL)以及丁酸盐和丙酸盐代谢基因(madB、buk、OXCT、crt、PCCA、pta)在CGS中均下调。参与乙酸同化/异化反应的磷酸乙酰转移酶(pta)在CGS中显著减少,同时也参与牛磺酸和亚牛磺酸代谢。这些代谢差异可能由肠道微生物及其酶的差异所解释。此外,乙醛酸和二羧酸代谢此前与动脉粥样硬化和肥胖有关。乙醛酸循环可通过依赖谷氨酸的方式代谢脂肪酸。总之,肠道微生物通过其代谢产物(涉及氨基酸、脂肪酸和烟酸代谢等途径)对宿主产生影响,这些变化通过调节胆汁酸的结合和水解、发挥抗炎作用,以及影响胆固醇的合成、运输或代谢,进而影响胆结石的形成。
考虑到主要的差异细菌物种、LEfSe分析结果及其对临床结局指标的贡献,在排除了难以获得和培养的物种后,我们最终选择了三种菌株。研究中鉴定的三种细菌中,R. gnavus是一种研究较为充分的细菌,与炎症性肠病、克罗恩病和代谢紊乱等多种疾病呈正相关。然而,我们的研究结果不足以证明R. gnavus在小鼠中具有显著的促结石作用。C. glycyrrhizinilyticum是从人类粪便中分离出的水解甘草酸的菌株,因其对人体的多重作用而被视为一种有益的梭菌菌株。Wang 等人报告称,C. glycyrrhizinilyticum的存在可能增加血清脂质水平,并在高脂饮食诱导的非酒精性脂肪性肝病(NAFLD)大鼠中促进炎症反应。此外,我们的研究发现灌胃C. glycyrrhizinilyticum后小鼠肝脏脂质积累加重,与LD组相比,血清TC水平显著降低。因此,C. glycyrrhizinilyticum可能通过促进肝组织损伤和影响肝脂代谢,最终促进CGS的形成。F. prausnitzii是一种潜在的益生菌,可调节肠道健康。尽管在F. prausnitzii干预后小鼠的AST、ALT、TC和TBA得到了改善,但仍未显著抑制胆结石的形成。F. prausnitzii通常通过产生丁酸作用于宿主,我们推测丁酸的水平及实验持续时间可能不足以显著影响胆结石的表型。
本研究发现SCFAs代谢紊乱与CGS相关,这与先前的研究结果一致。我们的实验表明,NaA干预显著降低了小鼠模型诱导胆结石的严重程度,而NaP和NaB干预的效果差异不显著。Ye等人报道NaB可通过调节FXR-FGF15/SHP信号通路的胆汁酸代谢,缓解胆固醇结石。在他们的研究中,连续8周每日注射12 mg NaB将胆结石发生率从100%降至25%。我们研究结果的与其不一致可能与注射方法、体内有效剂量以及饲料生产厂家有关,仍需进一步研究。已有研究表明,肠道菌群衍生代谢物,特别是SCFAs,会影响肝脏功能,并对包括NAFLD和肝硬化在内的肝病具有重要作用。越来越多的研究探索了益生元在调节代谢性疾病中SCFAs的作用。最近的一项研究显示,抗性淀粉通过改变肠道微生物群,降低NAFLD患者的肝内甘油三酯水平。在所有益生元中,FOS可以显著提高F. prausnitzii的水平。我们的研究也发现FOS在小鼠中的效果显著,血清TC、ALT和TBA水平显著降低。因此,我们推测FOS可能通过增加SCFAs生成菌群来缓解胆结石的形成。Hu等人报道,制备的果胶低聚糖(POS)具有降胆固醇作用,这种作用由特定菌群及其代谢物共同调控。此外,Huang等人最近报道 FOS通过调节脂质代谢可缓解NAFLD。基于这些研究,我们推测FOS可能通过调节肠道菌群结构增加SCFAs水平,SCFAs通过调控胆固醇代谢并抑制肝脏脂质积累,对预防胆结石具有积极作用。
尽管目前公认益生元是安全的天然食品成分,但也存在一些副作用的担忧,例如胀气、黄疸和胆汁淤积。Singh等人报道,喂养可溶性纤维6个月会导致小鼠肠道菌群失衡并引发胆汁淤积性肝癌。值得注意的是,我们的研究中小鼠未观察到FOS的明显副作用。由于本实验仅进行了8周,还需更长的实验周期以验证结果。
本研究的创新之处在于利用多组学数据进行发现与表型验证。这些数据帮助我们扩展了促结石物种的范围。此外,我们首次在小鼠模型中证明,膳食补充FOS可有效预防胆结石的形成。尽管这些发现意义重大,但作为一项横断面研究,肠道菌群组成和代谢物的某些变化可能由混杂因素(如饮食、用药史)引起,这需要通过机制性实验进一步明确。尽管本研究未深入探讨其作用机制,当前的结果仍为后续研究提供了基础,旨在激发更多关于微生物靶向干预(包括益生菌和益生元)的研究,并为胆结石患者寻找有效的预防和非侵入性治疗方法。
本研究也存在一些局限性。首先,我们主要探讨了FOS对CGS的预防效果,而非治疗效果,并研究了其在小鼠中对结石的保护作用。未来需要进一步研究膳食纤维低聚果糖对临床患者的预防和治疗效果。其次,SCFAs干预未能完全抑制胆结石,其是否与干预时间和剂量相关需进一步研究。此外,本研究选用了雄性小鼠,未评估性别对结果的潜在影响。C. glycyrrhizinilyticum的作用机制需要在无菌小鼠中深入探讨。最后,FOS干扰胆固醇代谢的分子机制仍需要后续实验进一步阐明。
结 论
本研究系统评估了胆结石患者的微生物组及代谢组特征。我们发现,CGS与丁酸盐和丙酸盐代谢、牛磺酸和亚牛磺酸代谢、脂肪酸合成与降解途径以及乙醛酸和二羧酸代谢等通路相关。C. glycyrrhizinilyticum可促进胆结石的形成。FOS是一种新型、相对简单且廉价的微生物靶向治疗选项,可用于CGS的预防。总之,我们的研究发现有助于进一步理解CGS的发病机制,并为开发创新的基于微生物的治疗方法提供了重要依据。
方 法
研究对象与设计
本研究获得了北京医院伦理委员会的批准(批准号:2021BJYYEC-243-01)。所有研究对象均签署了知情同意书。于2020年4月1日至2021年6月1日共从北京医院普外科招募66名胆固醇胆结石患者。来自这66名患者的47例胆汁样本以及26例胆结石样本在胆囊切除术后获得。收集的临床指标包括年龄、性别、体重指数(BMI)、血糖、血常规和生化指标。53名健康对照通过广告招募,并通过超声检查确保其未患胆结石。患者的纳入标准如下:a)已进行过超声检查;b)被诊断为胆结石;c)理解研究内容并签署知情同意书。排除标准包括:a)患有严重消化系统疾病(如炎症性肠病、癌症和/或晚期腺瘤);b)在30天内使用过免疫抑制剂或抗生素,或在14天内使用过益生菌产品;c)患有代谢性疾病,如肥胖、高脂血症、糖尿病、慢性肠病、慢性腹泻和/或便秘;d)长期使用避孕药物;e)怀孕女性;f)现吸烟者和曾吸烟者。所有研究对象使用无菌粪便采集器收集粪便。所有生物样本进行液氮速冻并储存于−80°C冰箱,供后续分析使用。
微生物组分析
DNA提取和测序方法详见在线补充材料。Alpha多样性反映样本内部微生物群落的多样性,包括Chao 1,Observed species,Shannon和Simpson指数。Beta多样性反映不同样本间微生物群落组成的差异,体现微生物群落在样本间的差异程度。使用主坐标分析(Principal Coordinates Analysis, PCoA),基于Bray-Curtis距离反映群落差异。选择平均相对丰度 ≥ 0.001% 且检出样本比例 ≥ 10% 的细菌物种进行差异分析。
小鼠实验
雄性C57BL/6J小鼠购买自斯贝福生物技术有限公司(北京,中国),用于诱导小鼠胆结石模型(体重20–22克,SPF级)。8周龄雄性小鼠在喂养含有1.25%胆固醇和0.5%胆酸的致石饮食(由江苏协同药业生物工程有限公司合成)8周后解剖。小鼠在12小时光照/12小时黑暗周期下饲养,环境温度为22.5 ± 2.5°C,相对湿度为50 ± 5%。所有实验程序均获得北京大学医学部动物伦理委员会(IACUC)的批准(PUIRB-LA2023004,BCJG0185)。
在单菌移植实验中,Ruminococcus gnavus(Rg,BNCC319000)、C. glycyrrhizinilyticum(Cg,JCM-13368)和Faecalibacterium prausnitzii(Fp,DSM-107838)由贝纳创联生物技术有限公司(北京,中国)购买,并在严格的厌氧条件下培养传代。C57BL/6J小鼠通过抗生素(Abx)鸡尾酒法(含0.5 g/L万古霉素、1 g/L新霉素硫酸盐、1 g/L甲硝唑、1 g/L氨苄青霉素)在饮用水中喂养1周,且每天灌胃一次。随后,小鼠分别以200 μL的无菌生理盐水或活性Rg、Cg或Fp(每毫升109个菌落形成单位)无菌PBS溶液进行灌胃,每周4次,共持续3周。在开始灌胃后,小鼠继续喂养致石饮食(LD)8周(每组n = 8只)。
在SCFAs干预研究中,小鼠通过腹腔注射(IP)乙酸钠(NaA,S818278,Macklin)、丙酸钠(NaP,S817368,Macklin)和丁酸钠(NaB,S817488,Macklin)溶液。为确定SCFA的效果,喂养致石饮食(LD)的鼠分别接受200 μL的NaA溶液(300 mg/kg)、NaP(300 mg/kg)和NaB(300 mg/kg),共8周,每日1次。LD组则接受等体积的生理盐水作为对照(每组n = 12只)。
在FOS干预研究中,实验组给予标准饲料并添加10%的FOS,饲喂1周后,再给予10% FOS的致石饮食(Quantum Hi-Tech生物科技有限公司,广东,中国)持续8周。对照组给予相同的饮食但不含FOS(每组n = 12只)。
所有小鼠在解剖前禁食8小时。胆结石的分级标准参考Akiyoshi等人根据胆固醇含量制定的标准进行评估。通过心脏穿刺采集血样,并在4°C,900 ×g离心10分钟,进行后续的生化分析。血清生化指标通过日立快速自动生化分析仪(LABOSPECT 008 AS)进行测定。收集并储存肝脏和盲肠内容物于−80°C以备分析。
组织学分析
新鲜的肝脏标本在室温下用4%中性多聚甲醛固定24小时。石蜡包埋的切片(4 μm)用苏木精-伊红(H&E)染色。使用油红O染色法测定肝脏脂质积累。冷冻肝脏切片(6 μm)用油红O脂质染色,脂质含量的相对值通过ImageJ量化。
统计分析
统计分析使用R 4.1.2软件进行。连续变量对于正态分布数据表示为均值±标准差(SD),对于非正态分布数据表示为中位数和四分位距(IQR)。使用Shapiro-Wilk检验评估数据的正态性。组间差异通过独立样本t检验(正态分布)和Wilcoxon秩和检验(非正态分布)进行分析。多组比较使用单因素方差分析(ANOVA)进行,符合正态分布数据后进行Dunnett事后检验,而非正态分布数据则应用Kruskal-Wallis检验,并使用Dunn检验进行组间比较。分类数据使用卡方检验或Fisher精确检验进行分析。数据处理和可视化使用R软件包,包括dplyr、readr、stringr、ggplot2、ggsci、aPCoA、pheatmap、ggraph、corrplot、psych、DESeq2、vegan和ggsignif。通过Wilcoxon秩和检验测试任何两组之间的门、属、种和功能模块的差异丰度,p值通过Benjamini-Hochberg方法进行假发现率(FDR)校正。通过单变量线性回归计算肠道细菌物种和代谢物对肝功能相关生化特征的解释度。使用Spearman相关分析分析临床指标或代谢物与细菌物种之间的相关性。Spearman相关分析的阈值为rs > 0.7,p ≤ 0.05,并通过热图可视化。使用单变量和多变量逻辑回归模型评估诊断性能,并计算受试者工作特征(ROC)曲线下面积(AUC)。p < 0.05 或 q < 0.1 被认为差异具有统计学意义。
代码和数据可用性
本研究所使用的原始测序数据已存储在人类遗传资源组学原始数据归档库(GSA-Human)(https://bigd.big.ac.cn/gsa-human/browse/HRA004238)中。主要数据和代码已上传至Github网站,网址为:https://github.com/rhyer0418/CGS-project。更详细的数据信息可联系通讯作者获取。补充材料(文本、图、表、中文翻译版本或视频)也可从线上(http://www.imeta.science/)获取。
引文格式:
Ye Liu, Hexin Li, Tianhan Sun, et al. 2025. “Gut microbiome and metabolome characteristics of patients with cholesterol gallstones suggest the preventive potential of prebiotics.” iMeta 4: e70000. https://doi.org/10.1002/imt2.70000.
作者简介

刘晔(第一作者)
● 北京医院(北京大学第五临床医学院)在读博士研究生。
● 研究方向为多组学技术在人类消化道疾病中的生物标志物识别以及队列研究,以第一作者(含共同)在iMeta、Journal of Affective Disorders、Leukemia & Lymphoma、Frontiers in Cellular and Infection Microbiology、BMC Gastroenterology期刊发表SCI论文5篇。

崔红元(通讯作者)
● 北京医院普外科副主任,肝胆胰外科副主任,主任医师,北京大学副教授,研究生导师。
● 主要研究方向为肝胆胰腺疾病发生发展机制研究,消化疾病消化内镜及腹腔镜下微创治疗,临床营养治疗学。中华医学会肠外肠内营养分会委员,中华医学会消化内镜学会外科学组委员,中华医学会肠外肠内营养分会肠道微生态学组委员,北京抗癌协会理事,海峡两岸医药卫生交流协会肝胆胰外科专业委员会委员,北京医学会肠外肠内营养分会青年委员,北京中西医结合学会临床营养治疗委员会委员兼学会秘书长,中华临床营养杂志编委。在iMeta、NPJ Genomic Medicine、Clinical Chemistry、International Journal of Surgery、Gene、Nutrients、European Journal of Surgical Oncology、等高影响力学术期刊发表SCI论文近30篇。

赵方庆(通讯作者)
● 中国科学院北京生命科学研究院,动物研究所,研究员,博士生导师。
● 研究方向为致力于建立高效的算法模型和实验技术,探索人体微生物与非编码RNA的结构组成与变化规律。基金委优青(2017)、北京杰青(2018)、国家杰青(2020)和中科院特聘研究员(2022)。现承担国家重点研发计划首席科学家、基金委杰青和重点项目、军委科技委基础加强计划首席科学家等项目。以第一/通讯作者在Cell、Gut、Nature Biotechnology、Nature Methods、Nature Genetics、Nature Cell Biology、Nature Computational Science和Nature Communications 等刊物上发表通讯作者论文100余篇,总引用次数超过1.5万次。现任中国生物信息学会基因组信息学分会主任。在Briefings in Bioinformatics、Science Bulletin、Science China Life Sciences、Genomics, Proteomics & Bioinformatics等国际学术刊物担任副主编或编委。

肖飞(通讯作者)
● 北京医院临床生物样本中心主任,研究员,博士生导师。
● 研究方向为临床检验诊断学的方法学研究,包括测序技术、信号放大技术、个体化诊断和治疗技术的研发。主持国家自然科学基金面上项目,国家重点研发计划等国家级课题,取得多项国内和国际专利授权。荣获全国归侨先进个人,北京科技新星等荣誉称号。在iMeta、European Urology、Advanced Science、Theronostics、PNAS、Immunity、Angew Chem Int.、Nuclei Acids Research、Clinical Chemistry、Cancer letter等高影响力期刊上发表研究论文30多篇。
更多推荐
(▼ 点击跳转)
iMeta | 引用16000+,海普洛斯陈实富发布新版fastp,更快更好地处理FASTQ数据
iMeta | 兰大张东组:使用PhyloSuite进行分子系统发育及系统发育树的统计分析
iMeta | 唐海宝/张兴坦-用于比较基因组学分析的多功能分析套件JCVI
1卷1期
1卷2期
1卷3期
1卷4期
2卷1期
2卷2期
2卷3期
2卷4期
3卷1期
3卷2期
3卷3期
3卷4期
3卷5期
3卷6期
1卷1期
1卷2期
期刊简介
“iMeta” 是由威立、宏科学和本领域数千名华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表所有领域高影响力的研究、方法和综述,重点关注微生物组、生物信息、大数据和多组学等前沿交叉学科。目标是发表前10%(IF > 20)的高影响力论文。期刊特色包括中英双语图文、双语视频、可重复分析、图片打磨、60万用户的社交媒体宣传等。2022年2月正式创刊!相继被Google Scholar、PubMed、SCIE、ESI、DOAJ、Scopus等数据库收录!2024年6月获得首个影响因子23.8,位列全球SCI期刊前千分之五(107/21848),微生物学科2/161,仅低于Nature Reviews,学科研究类期刊全球第一,中国大陆11/514!
“iMetaOmics” 是“iMeta” 子刊,主编由中国科学院北京生命科学研究院赵方庆研究员和香港中文大学于君教授担任,是定位IF>10的高水平综合期刊,欢迎投稿!
iMeta主页:
http://
www.imeta.science
姊妹刊iMetaOmics主页:
http://www.imeta.science/imetaomics/
出版社iMeta主页:
https://onlinelibrary.wiley.com/journal/2770596x
出版社iMetaOmics主页:
https://onlinelibrary.wiley.com/journal/29969514
iMeta投稿:
https://wiley.atyponrex.com/journal/IMT2
iMetaOmics投稿:
https://wiley.atyponrex.com/journal/IMO2
邮箱:
office@imeta.science











































 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








