一、原子结构
1.四个量子数
二、原子核外电子排布
1.基态原子核外电子的排布规则
1.1.保里不相容原则
1.2.能量最低原则
2.原子轨道的近似能级图
2.1.多电子原子轨道能量与n和l有关
2.2.单电子原子(H)原子轨道能级只与n有关
2.3原子轨道近似能级组
3.核外电子排布的表示方式
3.1.电子排布分布式(无法直接表示简并轨道)
3.2.Hand规则特例
3.3.轨道表达式
3.4.价电子排布勾型或外围电子构型
三、周期表与原子电子层结构
1.周期与电子层结构的关系
2.族与电子层的结构关系
四、原子在周期表的位置与原子层结构的相互推断
1.位置——结构
2.结构——位置
五、周期表元素性质周期性变化规律
1原子半径(radius)
1.1表示形式
1.2 主要影响因素
1.3变化规律
一、原子结构

例1:主量子数n = 3的原子轨道最多可以容纳的电子总数为多少
答:轨道数为n^2,总电子数为2n^2|
例2:量子数n = 4,l = 2,m = 0的原子轨道数目为1
提示:原子轨道数目取决于m的取值个数
二、原子核外电子的排布
1、基态原子核外电子排布原则
1.1保里不相容原则(同一个原子不可能有四个量子数完全相同的的电子)
结论:
每一轨道最多容纳两个自旋方向相反的电子
原子中有多少个电子就有多少中运动状态
1.2、能量最低原理
电子总是尽先后有能量较低的轨道,只有能量较低的轨道占满才能依次进入能量较高的轨道
1.3、洪特规则
简并轨道上,电子排布尽可能占据不同的轨道、并且自旋方向相同(自旋平行)

2、原子轨道的近似能级图
2.1、多电子原子轨道能量与n和l有关
2.2、单电子原子(H)原子轨道能级只与n有关
2.3、原子轨道近似能级图(pauling图)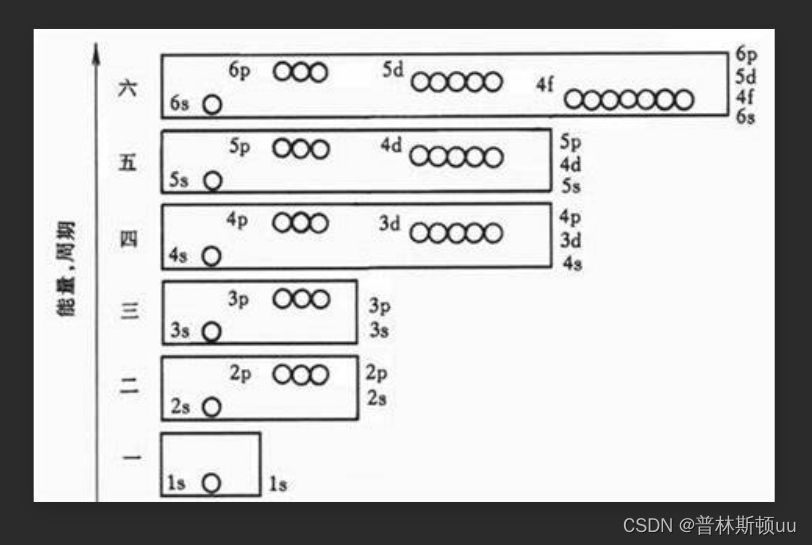
满足nsnp(n-1)d(n-2)f
3、核外电子排布的表示方法
3.1、
3.2、hand规则特例
3.3、轨道表达式
![]()

3.4、价电子构型或外围电子构型
其中黑色为电子排布式,紫色为价电子结构
三、周期表与原子电子层结构
3.1、周期与电子层结构的关系
共7个,对应能级图中的七个能级图,各周期最外层电子排布重复ns^1——ns^2np^6变化,以填充s轨道元素开始,填充p轨道元素告终
周期数 = 电子层数 = 最高能级组序号
各周期原子数 = 能级组AO可容纳的电子数(atom orbit)
3.2、族与原子层之间的关系
相对位置和旋序数的确定
四、元素在周期表的位置与电子层结构的相互推断

五、周期表元素性质周期性变化规律








 本文详细介绍了原子结构,包括量子数、电子排布规则(如保里不相容和能量最低原则)、原子轨道的能级图、核外电子排布表示方法,以及周期表与电子层结构的关系,探讨了元素性质的周期性变化规律。
本文详细介绍了原子结构,包括量子数、电子排布规则(如保里不相容和能量最低原则)、原子轨道的能级图、核外电子排布表示方法,以及周期表与电子层结构的关系,探讨了元素性质的周期性变化规律。
















 7164
7164

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








