
来自苏州大学第一附属医院骨科研究所骨科外科的Liang Zhou ,Feng Cai, Hongyi Zhu 等多名研究人员发表了题为《Immune-defensive microspheres promote regeneration of the nucleus pulposus by targeted entrapment of the inflammatory cascade during intervertebral disc degeneration》的研究成果。
在该文章中,研究人员使用了购自AbMole的LPS(目录号M9524)、DiR(目录号M5122)。
研究团队通过创新的免疫防御微球系统,针对腰椎间盘退变(IVDD)中的炎症级联反应进行了有效调控,显著促进了髓核组织的再生。
研究团队成功构建了一种由中性粒细胞膜包覆的聚乳酸-乙醇酸共聚物(PLGA)纳米颗粒(T-NNPs),并通过酰胺键将其锚定在甲基丙烯酸酐化明胶(GelMA)微球表面,形成GM@T-NNPs复合微球。这种设计使得T-NNPs能够长期稳定地锚定在GelMA微球上,并通过表面化学修饰显著提高了复合微球的稳定性和长效释放能力。
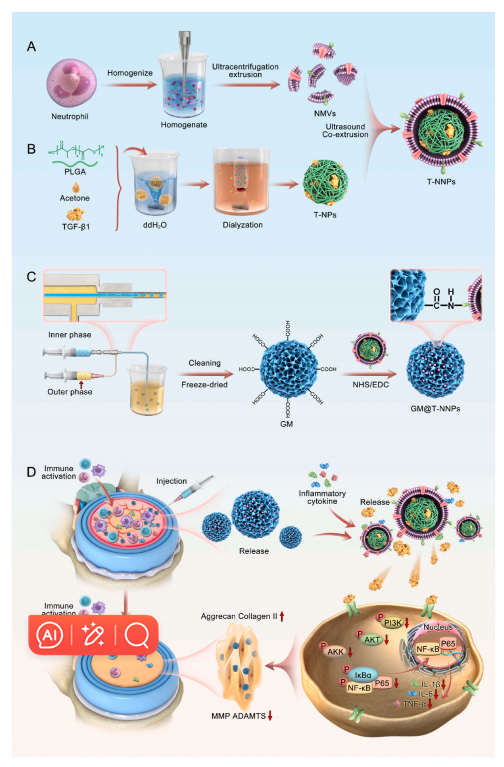
图1:设计免疫防御微球,阻断炎症级联反应,促进髓核的再生A)和B)NMVs、T-NPs和T-NNPs的制备。C)GelMA和T-NNPs纳米颗粒的制备和接枝。D)原位注射GM@T-NNPs进入大鼠IVDD模型,进行局部炎症调节和ECM再生。
通过透射电子显微镜(TEM)、动态光散射(DLS)和Zeta电位分析等方法,研究证实了T-NNPs和GM@T-NNPs的成功制备及其良好的物理和化学性质。纳米颗粒表面成功包覆了中性粒细胞膜,保持了细胞膜的完整性和活性,并有效保留了重要的膜蛋白受体。
体外实验表明,GM@T-NNPs复合微球不仅具有良好的生物相容性,还能显著抑制由脂多糖(LPS)诱导的髓核细胞炎症。通过免疫荧光和Western blot分析,研究团队发现GM@T-NNPs能够下调促炎细胞因子(如TNF-α、IL-1β)和基质金属蛋白酶(MMPs)的表达,同时上调抗炎细胞因子和细胞外基质(ECM)成分(如II型胶原和蛋白聚糖)的表达。
通过细胞增殖实验(CCK-8)和Ki-67流式细胞术分析,GM@T-NNPs显著促进了髓核细胞的增殖,显示了其作为细胞支架的潜力。此外,复合微球还表现出优异的靶向能力,能够响应炎症信号并主动迁移至炎症部位。
在大鼠IVDD模型中,GM@T-NNPs通过局部注射显著改善了椎间盘的高度和结构完整性。通过X射线、磁共振成像(MRI)和组织学染色分析,研究团队发现GM@T-NNPs治疗组的椎间盘高度恢复明显,MRI信号增强,且髓核组织再生显著。相比之下,单纯注射PBS或未修饰的纳米颗粒和微球的治疗效果有限。
GM@T-NNPs不仅抑制了局部炎症反应,还减少了免疫细胞(如中性粒细胞和巨噬细胞)的浸润。通过免疫荧光染色和Western blot分析,研究团队进一步证实了GM@T-NNPs在体内同样下调了促炎因子的表达,并抑制了PI3K-AKT信号通路的激活,从而阻断了炎症级联反应。
通过RNA测序和生物信息学分析,研究团队揭示了GM@T-NNPs促进髓核再生的潜在分子机制。GM@T-NNPs能够显著下调与炎症反应和免疫应答相关的基因表达,同时上调与ECM结构和组成相关的基因表达。此外,GM@T-NNPs还通过抑制PI3K-AKT信号通路,阻断了下游的NF-κB激活,从而抑制了促炎因子的表达和免疫细胞的招募。
综上所述,本研究通过创新的GM@T-NNPs免疫防御微球系统,实现了对腰椎间盘退变中炎症级联反应的有效调控和髓核组织的再生。该系统不仅具有良好的生物相容性和长效释放能力,还能在体内外显著抑制炎症反应,促进ECM的重建和细胞增殖。这些发现为开发针对慢性炎性疾病的新型生物材料提供了重要参考,也为腰椎间盘退变的个体化精准治疗开辟了新的途径。





















 1235
1235

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








