老板说经典的文章要反复读,读三遍,读五遍 ...

背景
骨髓是一个复杂的器官,包含了来自造血、间充质、内皮、血管平滑肌和神经谱系的多种细胞。相对稀有的非造血细胞被认为在造血过程中起着关键作用。包括内皮细胞(ECs)、间充质基质细胞(MSCs)和成骨细胞在内的多种非造血细胞类型被认为是骨髓微环境的重要组成部分。近年来,单细胞 RNA 测序(scRNA-seq)的技术进步揭示了小鼠中这些非造血骨髓成分的多个亚群的存在。尽管对人类造血细胞的研究已相当广泛,但关于定义构成人类骨髓微环境的非造血细胞的类似研究仍相对匮乏。定义骨髓微环境中单细胞的组成一直受到分离足够数量的可存活非造血细胞的挑战的限制,这些细胞在骨髓细胞总量中占比不到 0.5%。此外,特定的细胞分离方法可能极大地影响所捕获的细胞类型的多样性,如在小鼠中所示。骨髓抽吸类似于冲洗小鼠骨头,无法捕获紧密粘附在骨表面的细胞,可能会使骨髓 MSC 成分偏向脂肪细胞而非成骨细胞。许多人类 MSC 的分析都是在这种抽吸样本上进行的,确实得到了主要是脂肪生成的 MSCs。其他人类 MSC 的分析是在体外扩增一段时间后进行的,这可能会改变 MSC 的转录谱,使其与在体内的稳态状态不同。此外,大多数上述分析缺乏这些微环境细胞的空间信息,尚不清楚是否存在具有不同空间组织的人类 MSC 亚型。
结果
人类骨髓的综合单细胞 RNA 测序图谱
为了揭示人类骨髓的细胞组成,作者开发了一条从股骨头组织中酶释放细胞的实验流程。通过进行微计算机断层扫描分析,确认了感兴趣区域具有正常的小梁结构(小梁骨体积(BV)分数:0.261 ± 0.098 [平均值±标准差], n = 6)。接下来,设计了一种富集策略,可以捕获造血细胞、稀有的造血干细胞和祖细胞(HSPCs)以及非造血微环境细胞。这三类细胞按比例混合,以便更好地代表稀有的 HSPCs 和非造血细胞,然后进行 scRNA-seq。

图 1 人类骨髓中造血和非造血细胞的单细胞转录组图谱
(A) scRNA-seq 工作流程的示意图。通过磁激活细胞分选(MACS)将造血、干/祖细胞和间充质部分分离,然后每位患者将这些部分混合到一个 scRNA-seq 反应中。
(B) 12 名个体骨髓中 82,742 个单细胞转录组的统一流形近似与投影(UMAP)表示。AEC,动脉内皮细胞;SEC,窦状内皮细胞;VSMC,血管平滑肌细胞;Ba,嗜碱性粒细胞;Eo,嗜酸性粒细胞;Ma,肥大细胞;RBC,红细胞;pDC,浆细胞样树突状细胞;CLP,普通淋巴祖细胞;MEP,巨核红系祖细胞;GMP,粒单系祖细胞;MPP,多能祖细胞;HSPC,造血干细胞和祖细胞;HSC,造血干细胞;Meg/E,巨核/红系;MSC,间充质基质细胞。
(C) 柱状图显示捕获的每个谱系的细胞计数(左)和每个样本的细胞谱系比例(右)。
(D) 热图显示按行(基因)缩放的标准化基因表达,列出最显著差异表达的和关键细胞谱系标志基因。EC,内皮细胞;M,血管平滑肌。基因按颜色编码以匹配它们差异表达的细胞类型的谱系
非造血细胞亚群分析展示了 MSC 和 EC 的转录多样性
作者在间充质细胞中辨别出了显著的异质性,鉴定出了成骨谱系(NCAM1、SPP1 和 BGLAP)、脂肪谱系(APOE、LPL、PPARG 和 CEBPA)和成纤维细胞(PDPN、CSPG4、DCN 和 DPT)(图 2A、2B、S3A 和 S3B)。成骨谱系细胞被分为 IBSP/BGLAP 高表达的成骨细胞和 IBSP/BGLAP 低表达的成骨间充质干细胞(Osteo-MSCs)(图 2B)。尽管可能由于样本处理损失未捕获脂肪细胞,我们发现了一个具有最高 CXCL12 水平并高表达脂肪谱系基因如 CEBPA、PPARG、APOE 和 LPL 的细胞簇,我们将其标记为脂肪间充质干细胞(Adipo-MSCs)(图 2B 和 S3B)。这些细胞类似于小鼠中已报道的骨髓脂肪生成谱系前体细胞(MALPs)和脂肪 Cxcl12 丰富的网状细胞(Adipo-CAR)。我们还发现了一群 THY1+ MSCs,这些细胞强烈表达脂肪基因,但也有一个独特的表达谱,包括 THY1 和 LBP,但 LPL 表达低于 Adipo-MSCs,因此我们将其称为 THY1+ MSCs(图 2B 和 S3B)。THY1+ MSCs 没有明确的小鼠对应物。表达 CXCL12、高度表达 DPT 和 NT5E,并非常特异地表达 PDPN 和 HAS1 的成纤维细胞样细胞也被观察到,我们将其称为成纤维间充质干细胞(Fibro-MSCs)(图 2B)。我们还鉴定出一个 APOD+ GSN 高表达的细胞群,我们无法将其与人类或小鼠中已知的细胞类型相关联,因此我们将其命名为 APOD+ MSCs,因为这个基因高度且特异地表达(图 2A 和 2B)。

图 2 定义人类骨髓的非造血细胞组成
(A) 12 名个体中 19,257 个间充质细胞的 UMAP 图,显示了不同的间充质细胞亚群,其中 RNA 低表达的 MSC 因其质量控制(QC)特征被排除。
(B) 点图显示了 MSC 亚群中关键间充质标志基因的标准化表达。
(C) 点图显示了从文献中得出的标志基因在人体 MSC 中的标准化表达,包括 NT5E(CD73)、THY1(CD90)和 ENG(CD105)。NGFR(CD271)和 MCAM(CD146)也被描述为经典的 MSC 标志。
(D) CytoTRACE 分析投影到 MSC 的 UMAP 上,显示预测的分化得分。
(E) 箱线图显示了分选的 MSC 亚型的相对成纤维细胞集落形成潜力。每个数据点代表一个样本。p 值使用 Welch 双样本双侧检验计算。
(F) 线图显示了细胞培养过程中经过八次传代的群体倍增情况,其中所有细胞每 7 天传代一次。p 值通过双向 ANOVA 计算为 Fibro-MSC 与其他 MSC 的比较。∗p < 0.05;∗∗p < 0.01;∗∗∗p < 0.001。
(G) 12 名个体中 3,874 个内皮细胞的 UMAP 图。SEC,窦状内皮细胞;AEC,动脉内皮细胞。
(H) 点图显示了在内皮细胞亚群中经调整 p 值筛选出的选择性全内皮和差异表达基因的标准化表达。
(I) 参考图谱映射显示了本研究与已发表研究中人类骨髓 MSC 亚群之间的关系。左图显示了每个数据集中映射的 MSC 计数;右图显示了每个数据集中映射的 MSC 百分比。数据集根据实验方案用颜色编码。
MSC、EC 和成骨谱系细胞协同产生多种造血支持因子
接下来,我们询问 MSC 的异质性是否转化为支持造血因子的差异性转录水平。从造血因子开始,这些因子在非造血细胞亚群中已被广泛研究,我们发现不同的 MSC 类型专门生产特定的支持因子;例如,CXCL12 在 Adipo- 和 THY1+ MSCs 中最高,而 IGF1 主要由 Fibro-MSCs 表达(图 3A)。
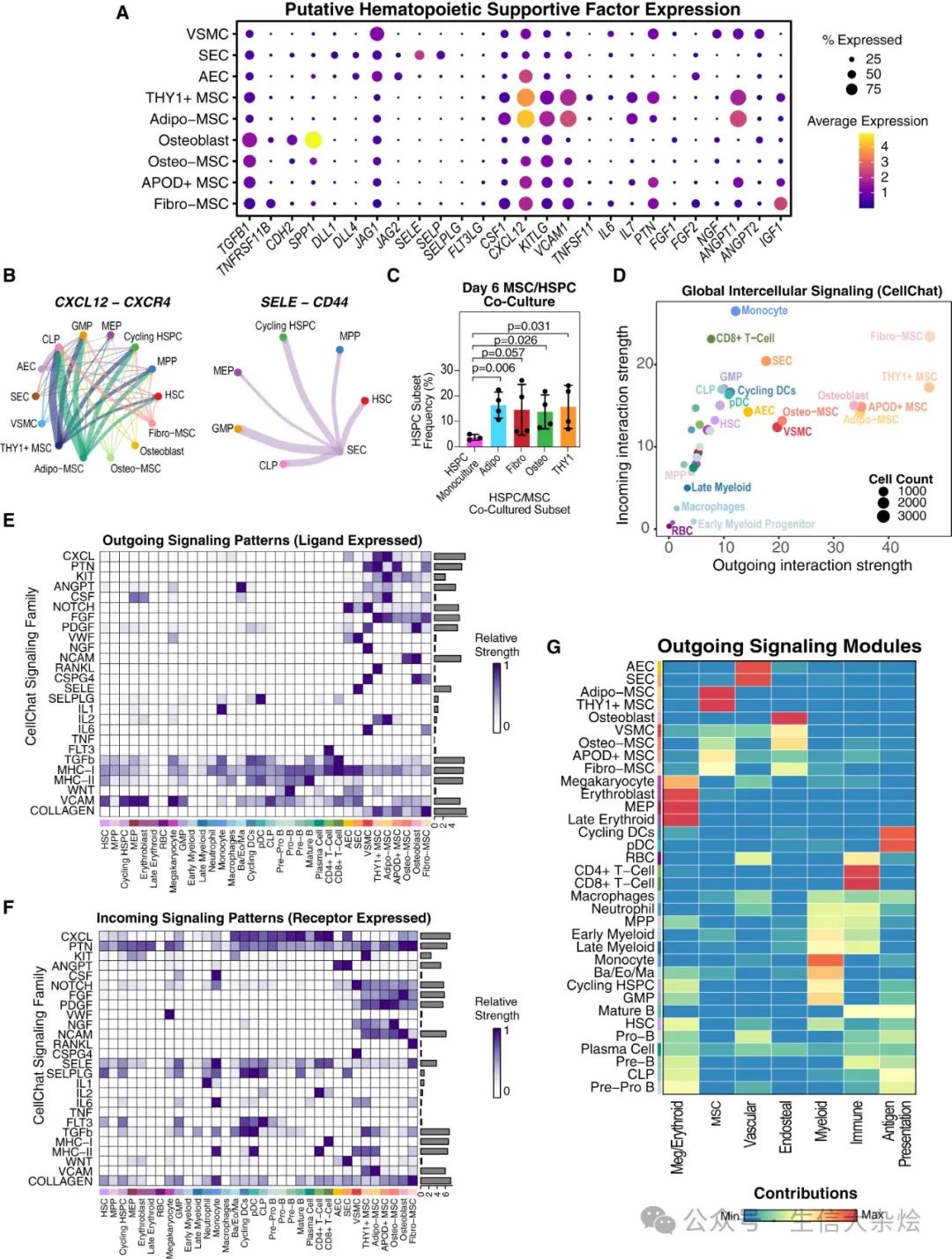
图 3 细胞 - 细胞通信分析揭示了造血和非造血细胞类型之间多样的信号模式
(A) 点图显示了在间充质和内皮群体中手动筛选的支持造血的因子的标准化表达。
(B) 弦图显示了 CellChat 预测的来源于间充质/内皮细胞类型和目标 HSPC 细胞类型之间的显著相互作用。线的厚度对应于预测相互作用的强度。
(C) 新鲜分离的 CD34+ HSPCs 与分选和培养的 MSC 亚群的共培养实验。误差棒表示 3(单培养)或 4(共培养)次独立实验的均值±标准差。p 值使用 Welch 双样本单侧检验计算。
(D) CellChat 网络分析,对细胞类型基于它们对网络的传出和传入贡献进行评分,强度由显著的传出相互作用的数量定义,计数指每组中的细胞数量。
(E 和 F) 每个注释信号家族的传出(配体富集,E)和传入(受体富集,F)显著信号预测分别评分,并且每个细胞类型的信号强度(CellChat 交互概率)按路径进行行缩放并绘制。每个panel右侧的柱状图显示了所有细胞组中的总信号强度。
(G) 非负矩阵分解(NMF)用于识别传出信号的模块及每个细胞类型对该模式的贡献。
CODEX 多重成像揭示了人体骨髓微环境的原位解剖
接下来,我们试图定义我们在 scRNA-seq 图谱中定义的骨髓细胞类型的单细胞解剖。我们使用 12 个标本的全切片 CODEX 多重成像,其中 8 个包括在我们的转录组图谱中(图 4A)。在 scRNA-seq 数据的指导下,我们设计并验证了一个 54 重的抗体panel(53 种抗体 +DAPI)(图 4A、4B 和图 S5;表 S4、S5 和 S6;数据 S1)。例如,除了 CD34 和 CD38 等经典 HSPC 标志物外,我们还包括了 scRNA-seq 数据中衍生的标志物如 SPINK2,该基因在原始 HSCs 中表达最高。这提高了识别原始 HSPCs 的分辨率,因为 CODEX 检测的动态范围低于流式细胞术,CD34 和 CD38 是流式细胞术的金标准。全切片 CODEX 图像被获取并使用 Mesmer 进行分割以识别单细胞。然后,通过无监督聚类对细胞进行注释,在少数情况下通过手动分选进行细化。每轮聚类后,细胞标签会叠加在荧光图像上,并进行迭代视觉检查和必要时的校正。我们计算注释了 803,132 个细胞(91.6% 的分割对象),涵盖 12 个样本中的 32 种细胞类型,包括罕见细胞如免疫表型 HSCs(Lin− CD34+ CD38− CD45RA− CD90+)和施旺细胞(PLP1+ CD271+)。整体细胞类型分布在个体之间相似。蛋白质水平的表型也揭示了一些有趣的模式,如所有观察到的巨噬细胞的 CD163 阳性和 GATA1+/−巨核细胞的不同簇。
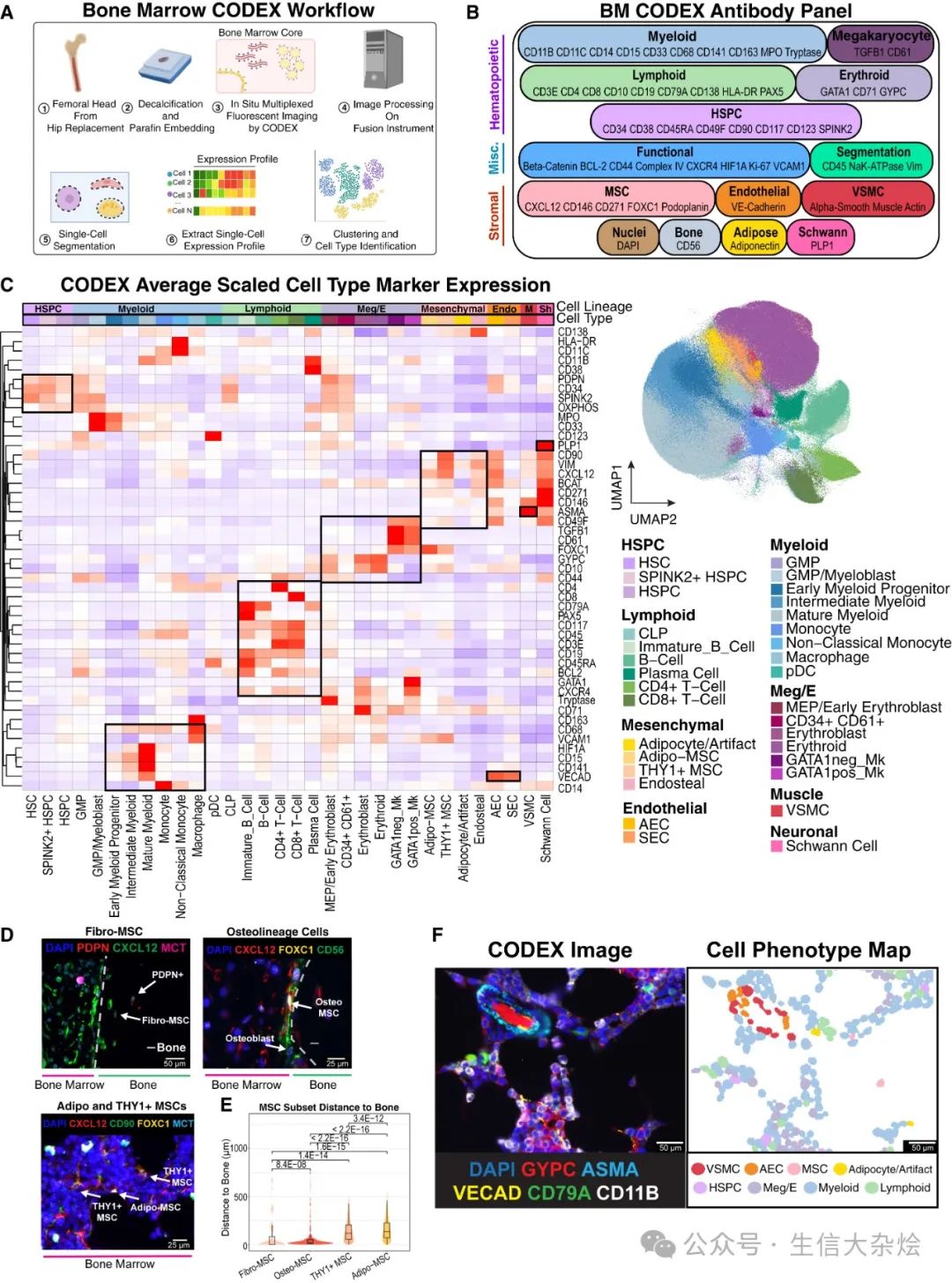
图 4 54 重 CODEX 成像揭示了人类骨髓的空间细胞拓扑
(A) 展示了 CODEX 实验和计算流程的示意图,最终识别细胞类型。
(B) 53 种抗体的 CODEX panel,按目标细胞群体分组。
(C) 热图显示每种细胞类型按蛋白质标志物标准化的平均集中对数比(CLR)表达,并按蛋白质表达进行层次聚类(左)。方框突出显示了协调的标志物表达。UMAP 显示来自 12 个个体的 803,131 个单细胞在 CODEX 图谱中的细胞类型着色(右)。Sh 表示施旺细胞。
(D) CODEX 图像显示手动识别的 Fibro-MSC、成骨谱系细胞(Osteo-MSC [CXCL12+ CD56+]、成骨细胞 [CXCL12 低表达 CD56+])、Adipo-MSC(FOXC1+ CXCL12+)和 THY1+ MSC(CD90+ CXCL12+ FOXC1+)的示例。
(E) 小提琴图显示不同 MSC 亚型(n = 64 Fibro-MSC,n = 422 Osteo-MSC,n = 5,110 Adipo-MSC,和 n = 4,108 THY1+ MSC)的注释细胞与手动注释骨轮廓的最近距离。为了改进可视化,距离被裁剪到每种细胞类型的第 99 百分位数。p 值使用双侧 Wilcoxon 秩和检验计算。
(F) CODEX 图像(左)与细胞表型图(CPM,右)配对,显示分割的细胞按细胞注释着色。
EMPs 和 GMPs 定位于相对高氧的动脉 - 内骨膜微环境
我们按照之前描述的方法进行无监督的邻域分析,识别出 15 个细胞邻域(CNs),并基于细胞类型的富集使用超几何测试手动注释它们(图 5A)。考虑到在 CODEX 协议中骨脱离的挑战,我们首先确认了富含内骨膜细胞的邻域确实接近手动注释的骨位置(STAR 方法;图 S7B)。我们发现了预期的邻域,例如与红细胞岛一致的“红系”邻域(CN13 和 CN15),以及新的邻域,例如围动脉淋巴细胞邻域(图 5A 和图 S7C)。我们还发现了多个混合谱系的邻域(CN7 和 CN8),包括所有三种造血谱系(红系/髓系/淋巴系)。HSPCs,包括更原始的 SPINK2+ HSPCs,主要出现在混合谱系的邻域(CN7 和 CN8),其次是在髓系/淋巴系(CN5)和早期髓系/动脉(CN4)邻域中。淋巴祖细胞如 CLPs 和未成熟 B 细胞主要出现在混合谱系(CN7 和 CN8)、浆细胞/动脉(CN3)和围动脉淋巴(CN2)邻域中。两个邻域(CN4 和 CN6),富含 GMP/髓母细胞和早期髓系祖细胞(EMPs),主要位于内骨膜表面和动脉周围(图 5A–5C)。这与我们使用 CellChat 识别的内骨膜信号模块一致,该模块由 AECs 和 VSMCs 贡献(图 3G)。因此,我们分别根据 AECs 和内骨膜细胞的富集情况将它们命名为早期髓系/动脉(CN4)和早期髓系/内骨膜(CN6)。值得注意的是,围动脉淋巴邻域不像早期髓系、血管/内骨膜/MSC 或浆细胞/动脉邻域那样富含内骨膜细胞(图 5A、图 S7B 和图 S7C)。最后,富含血管/内骨膜/MSC 的邻域高度富集施旺细胞,表明该邻域具有神经支配。所有动脉和混合谱系邻域(CN1-4 和 CN7-8)均富含 Adipo-MSCs 和 THY1+ MSCs(图 5A)。这些邻域没有明显偏向某个样本或年龄(图 S7D)。重要的是,这一分析还表明围动脉和内骨膜微环境的概念在空间关联的无偏统计测量中得到了验证,并且与最近使用小鼠模型的研究一致,成年人的 HSPCs 并不优先占据内骨膜或围动脉微环境。

图 5 邻域分析揭示 GMP/早期髓系祖细胞的富氧动脉/内骨膜微环境
(A) 热图显示了各邻域中存在的细胞类型的富集情况。根据富集的细胞类型命名邻域。富集的 p 值使用超几何检验计算,并使用 Benjamini-Hochberg 方法进行多重假设检验校正。∗p < 0.05。
(B) 按邻域成员着色的细胞表型掩模,与 ASMA 荧光信号一起绘制(仅左侧)。
(C) 各邻域中的 HIF1A 染色模式。上图显示 CODEX 图像中 MPO+ 早期髓系祖细胞不表达 HIF1A,与成熟髓系细胞形成对比。下图显示了邻域掩模,图例与(B)共享。
(D) 箱线图显示按邻域成员划分的早期髓系祖细胞的标准化 HIF1A 表达水平。为了改进可视化,数据裁剪在 0.1 到 0.95 之间。p 值使用 Welch 单侧双样本检验计算,比较每个邻域的细胞与所有其他邻域的细胞,并使用 Benjamini-Hochberg 方法进行校正。∗p < 0.05;∗∗∗p < 0.001。
(E) 小提琴图显示使用 AUCell 和我们的 scRNA-seq 数据计算的缺氧特征评分。p 值比较了每种细胞类型的 AUCell 缺氧评分与所有其他细胞类型,如(D)。
(F) 气泡图显示了 CellChat 交互预测强度与两个细胞类型的最大 CODEX 空间邻域共定位强度之间的相关性和 CODEX-CellChat 效应大小(CCES)。
使用健康骨髓 CODEX 图谱进行无监督参考映射揭示 AML 基质扩展和新型 AML-MSC 富集的邻域
了解骨髓微环境的空间组织对健康造血和疾病状态都有重要意义。例如,AML 先前已被描述与内骨膜微环境相互作用以实现化疗耐药。我们应用我们的骨髓 CODEX panel,使用我们的健康图谱作为参考,探索肿瘤进化和微环境变化。我们分析了来自髂嵴活检的三名诊断(Dx)和两名治疗后(PostTx)的 AML 患者样本,这些患者接受了维奈克拉克斯加去甲基化剂(Ven/HMA)治疗(表 S1)。作为对照,我们还包括了来自 38 至 62 岁患者髂嵴的三例阴性淋巴瘤分期骨髓活检(NSM)。我们选择了检测到 NPM1 突变(NPM1c W288∗fs)的 AML 患者,因为有特异性抗体可以识别假定的白血病暴发细胞。我们使用对照主成分分析(RPCA)参考映射,将 AML 和 NSM 样本中的细胞分类到我们的健康图谱中最接近的对应物(图 7A;STAR 方法)。如预期的那样,我们发现 Dx AML 中的髓系细胞比例显著增加,不包括成熟髓系细胞,与 NSM 相比(47.6% 对 23.1%;p < 2.2E−16,通过比例检验)(图 7B)。这证明了我们的图谱在快速注释健康和疾病情况下数十万个细胞方面的实用性。将这些细胞标签投射到分割掩模上,显示了 Dx 和 PostTx AML 样本与 NSM 样本相比的显著结构变化,例如在白血病环境中脂肪细胞几乎完全丧失,以及治疗后 30 天在残留爆发细胞存在下的不完全造血恢复(图 7C)。对 AML 细胞景观的更详细观察还揭示了显著的基质扩展,AML 样本中 Adipo-MSCs 和 THY1+ MSCs 的相对频率是 NSM 样本的 2 到 3 倍(图 7D)。接下来,我们旨在使用基于突变 NPM1 和 CD141 染色的分类器识别白血病暴发细胞(图 S10A 和 S10B;STAR 方法)。我们的分类爆发细胞百分比与 NPM1c 变异等位基因频率相关(R = 0.62;图 S10C)。使用这种方法,我们识别出包括 AML3 的 PostTx 样本中双阳性 GATA1+ NPM1c+ 群体在内的白血病群体,以及个别 NPM1 突变的 PostTx 细胞(图 7E)。我们观察到两个 PostTx 样本中 NPM1 突变爆发细胞中的 GATA1 表达增加了约 2 倍,这表明这些残留细胞表现出谱系可塑性(图 7F)。
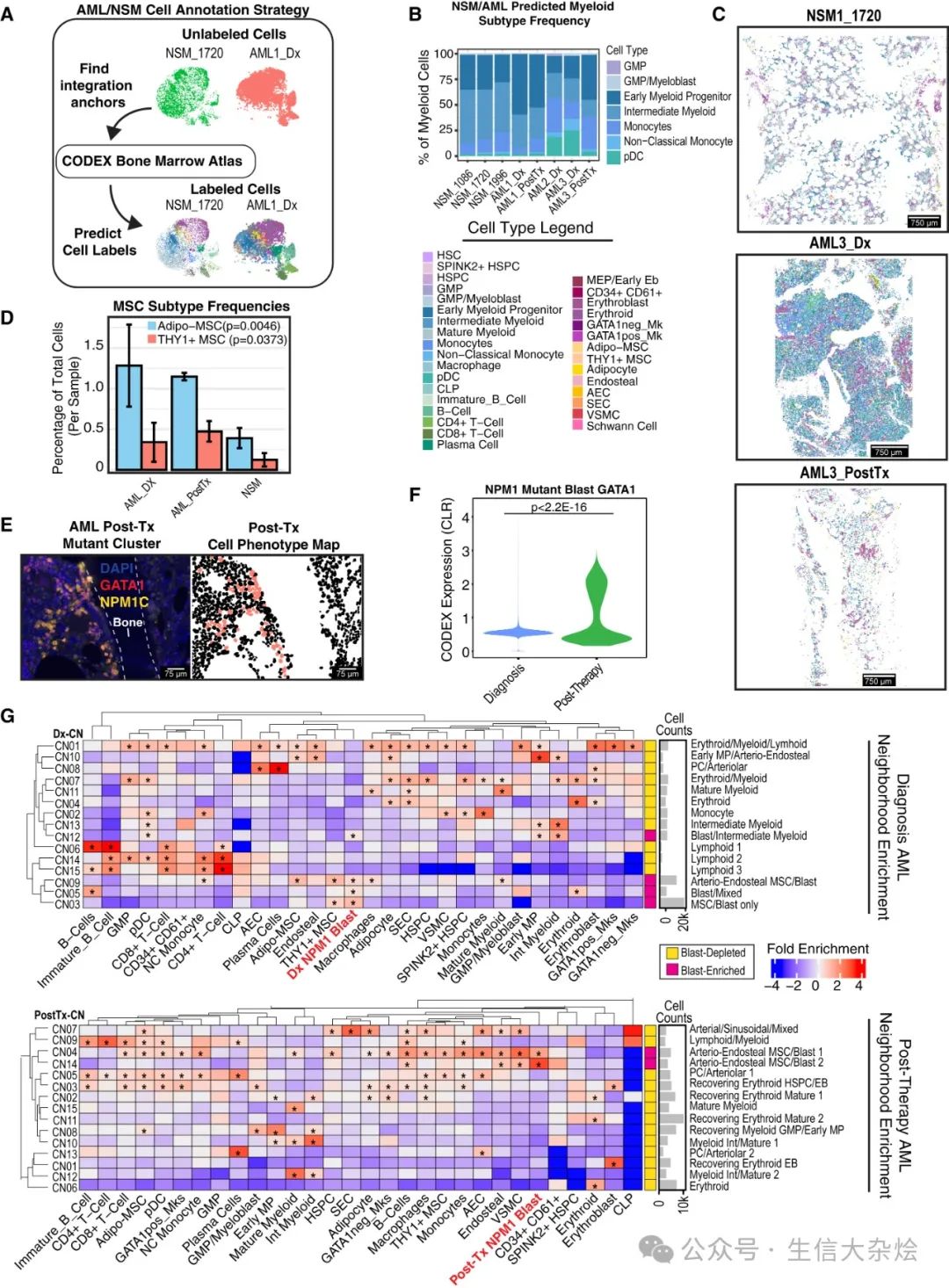
图 7 无监督单细胞映射 AML 揭示基质扩展和 MSC 富集的 AML 特异性邻域
(A) 展示了我们无监督标签转移计算方法的示意图。
(B) 柱状图显示每个样本中的髓系细胞类型频率,不包括成熟髓系细胞。
(C) 代表性样本图像的细胞表型图(CPMs)。掩模按细胞类型着色,与 (B) 共享图例。Dx,诊断;PostTx,治疗后。
(D) 柱状图显示 AML 与 NSM 中每个样本的 MSC 频率。MSC 频率计算为每个样本中注释为 Adipo-MSC 或 THY1+ MSC 的细胞比例。使用 Welch 双样本双侧检验比较 AML 样本(AML_Dx 和 PostTx 合并)与 NSM 样本中 MSC 亚型频率的分布。
(E) CODEX 图像显示罕见残留 NPM1 突变爆发细胞的聚集,这些细胞也对 GATA1 染色阳性,与突出显示分割爆发细胞的 CPM 并列。
(F) 小提琴图显示诊断和治疗后样本中 NPM1 突变爆发细胞中的 GATA1 蛋白水平。p 值使用 Welch 双样本双侧检验计算。
(G) 热图显示邻域细胞富集情况(AML:n = 175,365 个细胞,NSM:n = 152,198 个细胞)。富集的 p 值使用超几何检验计算,并使用 Benjamini-Hochberg 方法进行多重假设检验校正。∗p < 0.05。
























 2177
2177

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








