大脑完成功能需要大量代谢,并且依赖于脑血流量(CBF)和神经活动之间的耦合,然而,这种耦合在发育过程中如何变化的,仍未得到探索。在这里,我们使用来自Philadelphia Neurodevelopmental Cohort数据集中831名儿童的数据(478名女性,年龄8-22岁),分析基于动脉自旋标记测量的CBF与静息态功能磁共振成像计算的低频振荡振幅(ALFF)之间的耦合关系。首先,使用局部加权回归在大脑皮层表面来量化CBF-ALFF耦合。接着使用广义加性模型将CBF-ALFF耦合与年龄、性别和执行功能联系起来,并通过基于旋转的空间置换检验评估网络富集程度。结果表明了随年龄变化的局部区域耦合变化,且与性别和执行功能有关。我们的结果强调了CBF-ALFF耦合在整个发育过程中的重要性;并讨论了它作为未来神经精神疾病研究目标的潜力。本文发表在Cell Reports杂志。
引言
人脑功能的新陈代谢是需要大量能量:尽管大脑平均重量只有1.5公斤,但其大脑不成比例地占身体能量需求的五分之一(Attwell and Laughlin, 2001; Kety, 1957; Sokoloff, 1996)。为了满足如此大的新陈代谢需求,大脑接受20%的心排血量(Williams and Leggett, 1989; Xing et al. 2017)。在健康人中,大脑活动和脑血流(CBF)之间的关系,或神经血管耦合,存在紧密联系(Armstead, 2016; Kim and Filosa, 2012; Phillips et al., 2016)。在正常情况下,神经元活动时产生的代谢物会导致微血管扩张,从而局部血流量增加,葡萄糖和氧气对活性细胞的输送(Armstead, 2016; Girouard and Iadecola, 2006a; Kim and Filosa, 2012; Phillips et al., 2016)增加。通过代谢需求(神经活动)和供应(血流)的耦合,神经血管单位维持适当的能量平衡(Girouard and Iadecola, 2006a)。
为了测量体内的神经血管耦合,需要局部血流和局部大脑活动的替代指标。因此,神经血管耦合经常被描述为两种指标:CBF和基于血氧水平依赖(BOLD)的静息态功能磁共振成像中的低频振荡振幅(ALFF;10-12)。通过动脉自旋标记成像(ASL)能够可靠且无辐射的得到大脑平均CBF (Detre and Alsop, 1999; Li et al., 2012; Zheng et al., 2019),并与局部新陈代谢需求和稳态神经活动有关。由BOLD信号测量的ALFF代表大脑活动波动,是大脑内在功能连接的基础(Cordes et al., 2001)。因此,尽管BOLD信号变化包括来自CBF的贡献,但ALFF被认为提供了神经元动态活动的非侵入性替代指标(Biswal et al., 1995; Zou et al., 2008)。
CBF-ALFF测量的神经血管耦合在衰老过程中演变,年轻人比健康的老年人表现出更高耦合(Garrett et al., 2017; Girouard and Iadecola, 2006a)。众所周知,年轻人的BOLD信号变化更大,被认为可以支持灵活、高效的活动,并可能有助于更高的耦合(Garrett et al., 2017; Nomi et al., 2017)。这种高效对应于在大规模脑髓鞘形成结束时白质微结构的成熟(Giedd et al., 1999; Miller et al., 2012; Sydnor et al., 2021)。随着正常衰老的进展,尽管内稳态仍大体保持平衡(Girouard and Iadecola, 2006b; Hu et al., 2019; Jin et al., 2020),但血管硬化且对神经活动的反应减弱,导致次优耦合和轻度认知下降(Garrett et al., 2017; Lourenc¸ oet al., 2018; Nomi et al., 2017; Raz et al., 2007; Sorond et al., 2008)。值得注意的是,这些疾病与严重的认知障碍有关,进一步突出了耦合完整的重要性。
尽管探究耦合性的文献越来越多,但仍然存在差距。首先,之前的研究只关注健康群体和病人的神经血管耦合(Girouard and Iadecola, 2006b; Hu et al., 2019; Jin et al., 2020; Liang et al., 2013; Presa et al., 2020)。据我们所知,以前没有研究探索血流和大脑功能之间的关系是如何在童年、青春期和青年时期演变的。因此,目前尚不清楚随着神经发育,代谢需求和血流供应之间的平衡是如何变化的。其次,以前的研究主要在全脑水平上探究CBF和ALFF之间的关系,得出全脑耦合的衡量标准(Gur et al., 2021)。虽然提供全脑信息,但这种方法掩盖了CBF-ALFF耦合的潜在重要区域差异。
在这里,我们试图在区域基础上定义CBF和ALFF之间的局部关系,并确定神经血管耦合在发育过程中如何演变。为此,我们利用Philadelphia Neurodevelopmental Cohort数据集:一项大规模脑发育研究,其中包括ASL MRI和fMRI(Satterthwaite et al., 2014a, 2016)。我们使用最近开发的探究区域间耦合情况的工具来表征CBF-ALFF关系,这个工具使我们能够描述这两种成像模式之间的局部关系(Vandekar et al., 2015, 2016)。如下所述,我们证明了CBF-AlFF耦合在青年时期经历实质性的进化,存在性别差异,并与个体的执行功能差异有关。
数据分析过程:
我们调查了基于非侵入性指标的神经血管耦合在发育过程中是如何变化的,以及与性别和执行功能有关。为此,我们研究了PNC数据集中831名受试者的影像数据,他们同时完成ASL和静息状态fMRI扫描(Figure 1)。对于每个受试者,在每个位置(顶点)使用局部加权回归来评估局部CBF-ALFF关系,并在所有顶点重复此过程,为每个受试者生成基于皮质顶点的CBF-ALFF耦合(Figure 2)。为了最大限度地减少由信噪比(SNR)较差区域引起的差异结果,我们删除了SNR<50的顶点。使用基于随机旋转的置换检验(Alexander-Bloch et al., 2018),我们证实CBF-ALFF耦合平均图与SNR之间没有相关性(r=0.17,置换检验,p > 0.1)。对年龄、性别和执行功能的统计分析使用了受试者的CBF-ALFF耦合图。为了在严格的统计中灵活地考虑线性和非线性效应,我们使用广义加性模型(GAM)将年龄建模为样条函数(Wood et al., 2015)。多重校正采用FDR校正(false discovery rate, Q<0.05)。

Figure 1 样本结构。
作为PNC研究的一部分,共有1,601名受试者接受神经影像扫描,排除了因T1质量差(n=61)、静息状态fMRI质量差(n=450)、ASL质量差(n=54)以及内科和精神并存(n=205)而未能通过严格质量评估的人后,剩余831人纳入该研究。
方法
关键资源表

实验方法和实验对象
数据来自于PNC数据库。如上所述,共有9498名8-22岁的受试者接受了认知评估和临床表型分析,其中1601名年轻人完成了神经成像(Calkins et al., 2015; Satterthwaite et al., 2014a)。在这份研究中,我们排除了数据缺失的受试者,目前正在接受精神活性药物治疗的受试者,患有可能影响大脑功能疾病的受试者,以及图像质量较差的受试者(见下文)。831名受试者符合标准并纳入研究(Figure 1)。受试者的平均年龄为15.6岁(标准差(SD)=3.4)。男性占42%(n=353),女性占58%(n=478)。宾夕法尼亚大学和费城儿童医院的机构审查委员会批准了所有研究程序。
研究方法详细信息
认知评估
使用the University of Pennsylvania Computerized Neurocognitive Battery (CNB)进行认知评估(Gur et al., 2012)。神经认知表现的准确性是通过CNB中包括的所有测试来衡量的,在整个PNC中对原始测量数据进行标准化。使用先前发表的CNB研究总结受试者的执行功能(EF) (Moore et al., 2015)。每个受试者的执行功能和CBF-ALFF耦合之间的关联用z分数来评估。
图像采集
PNC数据集使用3T西门子TIM Trio扫描仪和32通道磁头线圈(Erlangen,德国)在单一地点采集的,如前所述(Satterthwaite et al., 2014a)。为了最大限度地减少头动,在数据采集之前,受试者的头部被稳定在头部线圈中,在耳朵两侧及头顶上使用泡沫垫固定。
获取高分辨率的结构图像,以便于将受试者图像对齐到标准空间。结构图像采用3D MPRAGE-T1加权序列(TR=1810ms;TE=3.51ms;FoV=180 x 3240 mm;matrix size = 192 x 256,层数=160,层厚/间隙=1 mm/0;分辨率0.9375 x 0.9375 x 1 mm)。
使用与BOLD加权的2D EPI序列(TR=3000ms;TE=32ms;FoV=192 x 192 mm;matrix size = 64 x 64;层数=46;层厚/间隙=3 mm/0;分辨率3 mm;124 volumes),每个受试者获取大约6分钟的静息态功能数据。图像采集时显示固定十字。受试者采集时保持清醒,睁大眼睛,盯着十字准线,保持不动。脑灌注成像采用3D-PCASL序列(TR=4000ms;TE=15ms;FOV=220 x 220 mm;matrix size = 96 x 96;层数=20;层厚/间隙=5/1 mm;分辨率2.3 x 2.3 x 6 mm;80 volumes)。
质量控制
对每种图像进行质量控制。低质量和/或FreeSurfer重建后低质量的T1加权图像被排除之外(Fischl, 2012)。如果平均帧向位移大于0.2 mm,或者如果有超过20帧的头动超过0.25 mm,则排除该BOLD图像(Satterthwaite et al., 2014a)。如果ASL图像有过度头动(平均帧向位移>0.5 mm)、低信噪比(SNR<30)、或过多体素达到最大强度值,则排除ASL图像(Kaczkurkin et al., 2016; Satterthwaite et al., 2014b)。
数据预处理
使用Freesurfer 5.3对结构图像进行处理,使得能够将ALFF和CBF投影到皮质表面(Fischl, 2012)。使用可扩展连接管道(eXtensible Connectivity Pipelines, XCP)实现预处理管道来进行静息状态fMRI数据(Ciric et al., 2018),其中包括来自FSL (Jenkinson et al., 2012; Smith et al., 2004)和AFNI (Cox, 1996)。预处理过程包括:
(1)利用FSL的Fugue工具校正磁场不均匀引起的失真;
(2)去除静息态fMRI的前4张图像;
(3)使用FSL的MCFLIRT将所有体积重新对准到选定的参考体积;
(4)使用AFNI的3dDespike工具插值每个体素的时间序列中的强度异常值;
(5)降低和消除任何线性或二次趋势;
(6)使用基于边界的配准将功能数据与高分辨率结构图像进行联合配准。
使用36参数的混合回归模型对图像进行去噪。该模型包括运动的六帧估计、从脑白质和脑脊液室中提取的平均信号、从整个大脑提取的平均信号、这九个参数中每个参数的导数以及九个参数及其导数中每个参数的二次项。这种方法先前已被证明可以适当地识别BOLD时间序列中受运动影响的体积,并减少进一步分析的影响(Ciric et al., 2017)。然后使用在0.01-0.08Hz之间的一阶巴特沃斯滤波器对BOLD加权时间序列和人工模型时间序列进行滤波,以避免时间域中的失配(Hallquist et al., 2013)。使用傅里叶变换,计算ALFF,即功率谱低频(0.01-0.08Hz)频段的总和(Cordes et al., 2001)。
CBF根据以下等式中的对照-标记对进行量化:

其中f为CBF,△M是对照像和标记像获取之间的差异信号,R1a是血液的纵向弛豫速率,τ是标记时间,ω是标记后延迟时间,α是标记效率,λ是血/组织水分配系数,M0是平衡磁化强度(Wang et al., 2008)。本研究设置:α = 0.85,λ = 0.9g/mL,τ = 1.6s,ω = 1.2s。使用基于边界的六个自由度配准被试级别的CBF配准到与之相应的T1加权图像(Greve and Fischl, 2009)。鉴于T1弛豫时间随年龄和性别的不同而不同(Biagi et al., 2007; Hales et al., 2014; Taki et al., 2011),T1弛豫参数以年龄和性别为基础进行建模(Wu et al., 2010)。这已被证明提高了发育样本结果的准确性和可靠性(Jain et al., 2012; Satterthwaite et al., 2014b)。
每个个体的CBF和ALFF图被投影到解剖皮质表面,并用6 mm FWHM核进行平滑。平滑后的数据被归一化到fsaverage5模板,该模板在每个半球上有10,242个顶点(移除内侧壁后总共有18,715个顶点)。
CBF-ALFF耦合
使用先前详细描述的方法在皮质表面生成耦合图(Vandekar et al., 2016)。对于每个顶点,定义15 mm的FWHM,并用CBF预测ALFF的局部加权回归模型是合适的。这在每个受试者的所有顶点上重复,生成一个CBF-ALFF耦合图,其中每个顶点由耦合回归斜率表示(Figure 2)。组平均耦合图是通过平均每个个体在给定顶点处的CBF-ALFF斜率的T统计量。
为了最大限度地减少我们的结果是由信噪比较低区域影响的可能性,耦合分析删除了信噪比<50的顶点。此外,我们使用基于随机旋转的置换检验来确认CBF-ALFF耦合的均值与仍存在区域的SNR之间没有关系(Alexander-Bloch et al., 2018)。
量化和统计分析
我们试图评估神经血管耦联是如何发育变化的,以及与性别和执行功能的关系。每个受试者的CBF-ALFF耦合图用于统计分析。使用广义加性模型(GAM)计算每个顶点的线性和非线性的年龄和性别效应,模型如下:
Couplingvertex= spline(age) + sex + CBF motion + ALFF motion + error
这种方法允许对线性和非线性效应进行灵活的建模。在显著性检验中,光滑核被定义为固定自由度回归样条函数(k=4)。我们还用年龄与性别的交互作用来拟合模型;然而,它并不显著,因此从模型中删除了。为了评估耦合和执行功能之间的关系,我们建立了第二个模型,除了上述模型的协变量(年龄、性别、CBF和ALFF运动、误差)外,该模型还包括一个线性执行精度项。使用CRAN中R包“mgcv”的估计GAM (Wood, 2021)。所有的分析都控制了错误。
使用FDR-Q<0.05估计GAM中每个回归变量所解释的方差,并计算了偏相关系数(R2)
除了对顶点的分析外,我们还非线性地评估了全脑耦合与年龄的关系。首先,计算每个受试者的T统计量平均值,通过对满足FDR校正的每个顶点处斜率的T统计量进行平均,然后使用GAM(广义加性模型(GAM))估计每个受试者的平均耦合与年龄之间的关系。为了测试存在显著变化的年龄范围,我们使用有限差分计算来自GAM模型的年龄平滑函数的一阶导数,然后用R包的‘Gratra’,生成导数的95%可信区间(Larsen et al., 2020; Simpson and Singmann, 2021; Wood, 2021)。导数的同时置信区间且不包括零的区域被确定为显著变化的区域。
实验方法和实验对象
鉴于不同功能网络的神经活动模式不同(Raut et al., 2020),我们试图表征感兴趣的变量的影响是否倾向于位于特定的功能大脑网络中(Buckner and Krienen, 2013; Thomas Yeo et al., 2011)。为此,我们进行了网络富集分析。具体地说,我们评估了平均耦合和与感兴趣的变量(年龄、性别、执行功能)的显著关联区域是否优先位于Yeo等人定义的七个大规模功能网络中的一个或多个(Thomas Yeo et al., 2011)。为了说明每个网络的不同规模和脑图的空间自相关性,统计测试使用了一种基于随机旋转的空间置换模型(Alexander-Bloch et al., 2018)。简而言之,相关分析的结果图投影到一个球体表面,该球体每个半球通过旋转1000次,以产生零分布。对于耦合性的富集分析,使用的检验统计量是Yeo等人的七个网络中每一个网络的平均T值。对于回归分析,使用的检验统计量是在FDR校正后存活顶点的比例。如果观测数据中的测试量位于从置换检验得出的零分布的前5%,则认为该网络具有显著的富集。
结果:
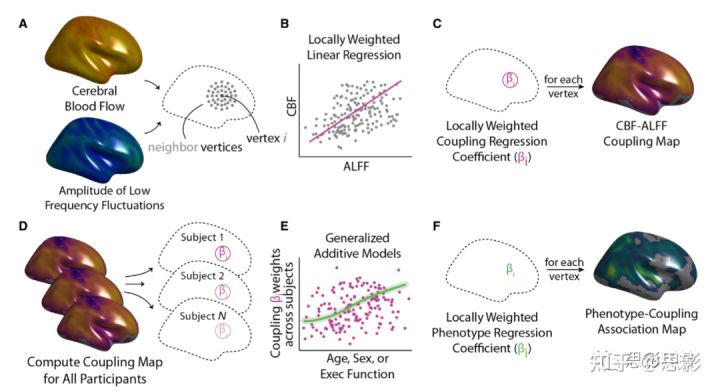
Figure 2 CBF-ALFF耦合分析。
CBF-ALFF耦合分析包括计算受试者内部耦合和跨受试者比较以评估个体差异。(A)对于每个受试者,确定每个顶点的邻域。(B)计算ALFF对CBF的局部加权回归。(C)在每个顶点重复局部加权回归,得到每个受试者的耦合图。(D、E)计算每位受试者的耦合图后,使用广义加性模型(GAM)计算了感兴趣的协变量(例如,年龄、性别和执行功能)与受试者的耦合图进行统计分析。(F)在每个顶点设置GAM,生成描述个体差异的组级别的统计图。
CBF和ALFF显著耦合
我们评估了大脑皮质的平均CBF-ALFF耦合。首先在成人中重复了先前研究的发现,我们观察到跨皮质的CBF-ALFF耦合(Figure 3A)。联合皮质的耦合最强,包括额叶、顶叶和颞叶皮质(pfdr<0.05)。为了测试耦合模式是否在先前定义的功能网络富集(Thomas Yeo et al., 2011),我们使用了基于随机旋转的置换检验(Alexander-Bloch et al., 2018)。基于随机旋转的置换检验将真实数据中大脑网络中重要顶点的比例与符合零分布的数据空间协方差结构进行比较。网络的富集分析显示,CBF-ALFF耦合富集在额顶网络(p=0.005;Figure 3B)。

Figure 3 平均CBF-ALFF耦合。
(A )CBF-ALFF耦合在整个大脑中都很强,最大的耦合位于内侧和外侧前额叶皮质、顶叶、后扣带回,楔前叶。(B) 我们使用基于随机旋转的置换检验来评估正则函数网络中CBF-ALFF耦合的富集程度,结果揭示了额顶网络的富集(p=0.005)。星号代表统计学意义(p<0.05)。黑条表示观测值,而小提琴曲线图则反映的零分布。
青少年发育过程中CBF-ALFF耦合下降
年轻人中发现紧密的CBF-ALFF耦合后,我们接下来评估CBF-ALFF耦合是如何在发育过程中进化的。结果表明,发育过程中大脑皮质的平均耦合程度有所下降 (F3,828=60.0,p<0.0001;Figure 4A)。然而,下降速度并不是恒定的。对样条函数导数的分析表明,在11.6岁到20.5岁之间,耦合度显著降低,在青春期中期16岁时出现高峰。部分大脑皮质的CBF-ALFF耦合普遍下降,峰值出现在后颞叶皮质 (pfdr<0.05,R2范围=0.01-0.1;Figure 4B)。富集分析显示,与年龄相关的耦合性在背侧注意网络中下降最为显著 (p=0.027;Figure 4C)。
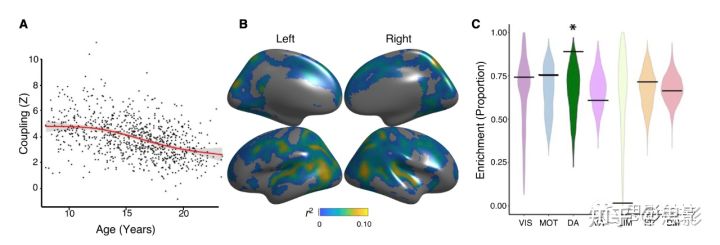
Figure 4 CBF-ALFF耦合随年龄变化。
在每个顶端使用广义加法模型模拟CBF-ALFF的线性和非线性的年龄效应,同时控制性别和头动;使用FDR进行校正(Q<0.05)。
(A)大脑皮质平均CBF-ALFF耦合随年龄增长呈非线性下降(F3,828=60.0,p<0.0001)。数据点代表每个受试者(n=831)在符合统计校正(pfdr<0.05)的所有顶点上的平均CBF-ALFF耦合。
(B)CBF-ALFF在后侧颞叶皮质、顶叶皮质和背外侧前额叶皮质下降显著。偏相关系数(R2)用来表示影响强度。
(C) 基于随机旋转的置换检验表明,年龄效应在背侧注意网络中富集(p=0.027)。星号代表统计意义。黑条代表观测值,而小提琴曲线图反映的是零分布。
女性在额顶网络的CBF-ALFF耦合较高
在单模态成像研究中青少年大脑功能的性别差异得到了一致的证明(Chung et al., 2019; Reding et al., 2021; Satterthwaite et al., 2014b)。在建立CBF-ALFF耦合随年龄显著下降之后,我们评估CBF-ALFF耦合的性别差异。研究发现,女性在双侧背外侧前额叶皮质、内侧额叶皮质、前扣带回和楔前叶的耦合强于男性。相比之下,女性在楔叶和外侧颞叶皮质的耦合程度较低(pfdr<0.05,R2范围=0.02-0.04;Figure 5A)。置换检验显示,性别差异主要富集在额顶网络(p=0.032;Figure 5B)。年龄与性别的交互作用不显著。

Figure 5 CBF-ALFF耦合的性别差异。
(A)在双侧背外侧前额叶皮质、内侧额叶皮质、前扣带回皮质和楔前叶,CBF-ALFF耦合在女性高于男性。使用广义加性模型构建女性和男性之间的CBF-ALFF耦合差异,同时调整线性和非线性的年龄效应以及头动;FDR校正(q<0.05)。偏相关系数(R2)用来表示影响的强度。女性耦合度较高的区域为正,红色显示。男性耦合度较高的区域为负,以蓝色显示。(B)置换检验显示额顶网络内的性别差异显著增加(p=0.032)。星号代表统计意义。黑条表示观测值,而小提琴曲线图反映的是零分布。
CBF-ALFF耦合与执行功能相关
执行功能是一个广泛的认知领域,包括工作记忆、认知控制、任务转换和反应抑制(Miyake et al., 2000)。执行功能在青春期和成年期长期发育;执行功能障碍与学习成绩差和各种神经精神疾病有关(Satterthwaite et al., 2013; Shanmugan et al., 2016; Wade et al., 2020)。本研究评估CBF-ALFF耦合与执行功能的关系。研究发现,执行功能与默认模式网络具有更高耦合性,包括后扣带回、内侧前额叶皮质和左侧颞顶交界处。此外,包括颞横回在内的双侧运动皮质和初级听觉皮质的耦合增加与较低执行功能有关(pfdr<0.05,R2范围=0.02-0.03;Figure 6A)。置换检验显示躯体运动网络与执行功能显著相关(p=0.040;Figure 6B)。

Figure 6 CBF-ALFF耦合与执行功能相关。
(A) CBF-ALFF耦合与执行功能的关系存在局部差异,既有正相关,也有负相关。使用广义加性模型来计算CBF-ALFF耦合与执行功能之间的关系,同时控制线性和非线性的年龄效应、性别效应和头动;FDR校正(q<0.05)。部分默认模式网络的高耦合与更好的执行功能相关,而部分躯体运动网络的高耦合与执行功能降低相关。偏相关系数(R2)用来表示影响的强度。正相关的区域红色显示。负相关的区域蓝色显示。
(B)置换检验显示执行功能和耦合之间的联系在运动网络中显著富集(p=0.040)。星号代表统计学意义(p<0.05)。黑条代表观测值,而小提琴曲线图反映的是零分布。
讨论
使用最近开发的评估区域耦合的工具和大量年轻人样本,我们探究了跨皮质的显著的CBF-ALFF耦合。
此外,我们确定了广泛分布于大脑皮层的与年龄相关的CBF-ALFF耦合下降,并在背侧注意网络中富集。我们还发现,CBF-ALFF耦合的性别差异主要富集在额顶网络内。最后,CBF-ALFF耦合与执行功能之间显著关联,强调CBF-ALFF耦合与认知的相关性。综上所述,这些结果扩展先前在成人研究中的结果,并表明CBF-ALFF耦合经历了一个与认知相关的发展过程。
神经血管耦合被认为能够反映需求和供应之间的相互关系,从而神经元活动影响局部血流量的变化(Armstead, 2016; Kim and Filosa, 2012; Presa et al., 2020; Silverman and Petersen, 2022)。在细胞水平上,研究人员已经证明血流和神经功能之间的密切关系,这种关系通常通过星形胶质细胞之间的交互来促进,在星形胶质细胞中,激活神经元的离子梯度和代谢双产物导致大脑小动脉的局部血管扩张(Blanco et al., 2008; Takano et al., 2006)。因此,高耦合可以被概念化为一个优化的、高保真的系统,其中神经功能影响血管单位的局部活动(Mulligan and MacVicar, 2004)。之前研究表明,CBF-ALFF耦合可以被理解为神经血管耦合的替代指标(Girouard and Iadecola, 2006b; Hu et al., 2019; Jin et al., 2020)。
高度代谢活跃的区域,特别是在协调跨分布大脑区域活动的联合网络中,往往会增加CBF和ALFF (Passow et al., 2015; Zou et al., 2008)。本研究发现CBF-ALF耦合富集在额顶神经网络(FPN)。与大脑其他部分表达的锥体神经元相比,服务于FPN的跨模式联合皮质具有更大的锥体神经元,具有更高的脊椎和突触密度(Beul and Hilgetag, 2019; Elston et al., 2009; Jacobs et al., 2001)。同样,这些联合网络在空间上分布最广,具有更多的长距离皮质连接(Bassett et al., 2008; Bazinet et al., 2020; Jung et al., 2017; Sepulcre et al., 2010)。这些神经解剖特征会产生更大的代谢活动,因此可能需要在神经活动和血液流动之间建立更紧密的联系(Liang et al., 2013; Shokri-Kojori et al., 2019)。
尽管在发育过程和进入青春期后,CBF-ALFF耦合仍然很紧密,但大部分皮质的CBF-ALFF耦合减弱,其中以青春期中期的变化最大。这些发现与之前许多微尺度结构性脑发育变化相吻合(Ball et al., 2019; Baum et al., 2020; Giedd et al., 1999; Tamnes et al., 2017; Va´ zquez-Rodrı´guez et al., 2019)。在生命的第二个十年中,突触和树突被修剪,以促进神经元之间更有效的交流(Arain et al., 2013; Bercury and Macklin, 2015; Paquola et al., 2019; YurgelunTodd, 2007)。为了支持这些结构变化,神经周围细胞包围着细胞体和树突,并控制离子流动和传导(Fawcett et al., 2019)。有可能是因为,这些结构和离子适应减少了神经元的新陈代谢需求,这在以前的灌注研究中已经得到证明(Liu et al., 2018; Satterthwaite et al., 2014b)。这些局部神经回路可能允许神经活动的波动得到较低代谢底物的支持,这些代谢底物由血流输送。
除了细胞结构的改变,大脑白质在大尺度上的发育也可能影响局部神经血管耦合关系。在发育过程中发生的神经血管耦合的变化与大脑白质的发育平行,反映了少突胶质细胞促进髓鞘形成(Baum et al., 2020; Giedd et al., 1999; Miller et al., 2012; Paquola et al., 2019)。少突胶质细胞还向神经元递送代谢底物,沿着轴突提供更多的代谢支持,而不仅仅是在细胞体(Stadelmann et al., 2019; Suminaite et al., 2019)。重要的是,在发育后期有髓鞘的联合皮层中形成支持远程皮质连接的轴突(Miller et al., 2012; Vasa et al., 2018)。在青春期发育期髓鞘形成终止时,发出相同的神经冲动可能会对神经元细胞体产生较低的代谢需求。因此,参与相同的低频活动将需要更少的血液流量,从而导致神经血管耦合减少。
就寿命而言,成年早期可能是达到最佳神经血管动态平衡的时期,血流和神经活动之间的动态关系支持最大的代谢和认知效率(Girouard and Iadecola, 2006b)。随着年龄的增长,皮质厚度的减少是组织丢失而不是网络求精的结果(Zheng et al., 2019)。此外,大脑经历应激反应,通常表现为结构性、血管和代谢性疾病(Girouard and Iadecola, 2006b; Hu et al., 2019; Jin et al., 2020; Presa et al., 2020)。这些效应可能会破坏神经血管的动态平衡,并解释为什么衰老、痴呆、中风和代谢性疾病与神经血管耦合的急剧下降以及认知能力下降有关(Garrett et al., 2017; Girouard and Iadecola, 2006b)。
与年龄相关的变化不同,与性别相关的耦合差异遵循不同的模式。女性在FPN中表现出明显更高的耦合性,这是认知控制所必需的(Dosenbach et al., 2007)。有趣的是,以往研究表明,在同一发育时期,当女孩的循环卵巢雌激素增加时,灌注也出现了显著的性别差异(Janfaza等人,2006年;Kaczkurkin等人,2016;Satterthwaite等人,2014b)。神经活性类固醇17β-雌二醇是卵巢分泌的主要雌激素,通过促进一氧化氮的产生而发挥强大的神经血管扩张剂的作用(Krause et al., 2011)。神经生理学研究表明,女性单位血压的脑血管直径大于男性(Gundling et al., 1985; Liu et al., 2012)。众所周知,雌激素还可以选择性地增加成人大脑执行区域的血流量(Berman et al., 1997)。最新证据表明,在青少年情绪调节过程中,较高的17β-雌二醇水平与较大的背外侧前额叶皮质活动之间存在联系(Chung et al., 2019)。这可能是由于荷尔蒙介导的机制有助于观察到FPN内耦合的性别差异。
了解青春期在额顶网络出现的性别差异至关重要,因为在同一发育阶段,情绪障碍和焦虑症在女孩中的流行率是男孩的两倍(Dhamala et al., 2019; Seney and Sibille, 2014)。文献报道了成年人在抑郁和焦虑中FPN功能的改变(Kaiser et al., 2015; Sylvester et al., 2012),这些差异也在发育过程中发现。以前的功能磁共振研究已经将额顶神经网络功能的变化与青年抑郁症(Baller et al., 2020)和焦虑症(Fitzgerald et al., 2013)的表型异质性联系起来。下一步,可重点研究额顶网络耦合是否可以作为精神病理学中性别差异的生物标志物。
CBF-ALFF耦合与认知功能的相关性在本研究中支持,该结果详细描述了CBF-ALFF耦合与执行功能之间显著相关,且与年龄无关。具体地说,更好的执行功能与躯体运动网络中的低耦合和DMN内的区域(包括后扣带皮质和内侧前额叶皮质)的高耦合有关。我们的发现与之前关于青年认知的单模态神经影像研究保持一致。在这些文献中,执行功能既与低阶感觉运动网络有关,也与高阶联想网络相关(Gilbert et al., 2019; Satterthwaite et al., 2013)。以往研究也表明,执行功能如何与感觉运动和联合皮质的神经成像测量之间存在分离(Schulte et al., 2020)。我们的研究结果可能进一步表明,青年执行功能的发展依赖于低阶网络中耦合减少和高阶联想网络中暂时耦合增加的平衡。
具体地说,躯体运动皮质的负相关可能表明了一种更精细的回路,其中神经活动的局部波动可以由较低的大脑血流量来支持。这与之前的研究一致,这些研究表明,在青少年中运动功能和执行功能之间存在着强烈的联系(Livesey et al., 2006; Sto¨ ckel and Hughes, 2016; van der Fels et al., 2015),但在年轻人中不存在这种关系(Spedden et al., 2017; Stuhr et al., 2020)。DMN区域的执行功能与神经血管耦合的更高相关性可能表明,该网络正在经历发育调整,因此没有处于最高代谢效率。尽管由于样本的年龄范围,我们无法解决这个问题,但我们推测,随着大脑完全成熟,耦合和执行功能之间的关系可能会在20岁后发生变化,并在联合皮质中变为负值。
局限性
值得注意的是,本研究有几个局限性。之前研究已经将CBF-ALFF耦合理解为神经血管耦合的表示,这奠定了我们对这一指标的理解(Hu et al., 2019; Jin et al., 2020; Zheng et al., 2019)。然而,我们不能直接测量神经血管耦合,只能依靠替代测量来表征体内的神经血管耦合。通常,正电子发射断层扫描通常是测量血流的黄金标准,而我们使用ASL来量化CBF。然而,之前的研究已经证明了PET和ASL之间存在良好的相关性(Detre and Alsop, 1999)。考虑到PET对儿童存在放射暴露的潜在风险,ASL测量CBF是用于大规模青年研究的一种更安全的方法(Proisy et al., 2016; Wang et al., 2003; Ye et al., 2000)。此外,ALFF是从BOLD信号中计算得到的,BOLD信号本身就有血管成分(Tong et al., 2016)。然而,过去的许多研究表明,ALFF信号反映神经活动,BOLD和CBF功能磁共振测量捕捉到独特的差异(Biswal et al., 1995; Bu et al., 2019; Cordes et al., 2001; Qiu et al., 2017; YuFeng et al., 2007)。值得注意的是,用于测量CBF的ASL扫描的空间分辨率低于用于测量ALFF的fMRI扫描的空间分辨率。虽然所有的分析都是在模板空间的皮质表面进行的,但ASL采集的低分辨率可能限制识别耦合中细粒变化的能力。最后,研究使用横断面样本,阻止了估计个体内的变化;未来对纵向样本的研究将是重要的。
尽管存在局限性,但我们提供了青年发育过程中CBF-ALFF耦合的变化,以及与性别和执行功能的明显关联。我们的发现为未来的研究提供了许多途径。纵向评估允许探究受试者在整个生命周期内的耦合变化,这可能有助于我们在个性化层面上更好地了解正常的生理性大脑发育和衰老。将脑电或脑磁图等神经活动的直接测量与脑血流相结合的研究可能会对神经血管耦合动力学提供进一步的见解。此外,执行功能的跨诊断缺陷通常在精神疾病中观察到(Satterthwaite et al., 2013; Shanmugan et al., 2016; Wade et al., 2020)。鉴于执行功能缺陷与CBF-ALFF耦合的改变有关,未来的研究可能会对CBF-ALFF耦合的局部差异是否与精神病理学的发生和发展有关提供重要的见解。最终,表征高危青年的神经血管耦合可能有助于开发有针对性的药物和神经治疗方法。























 6968
6968

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








