9生物化学与分子生物学——酶通论
酶的研究历史
远古人类发现,吃剩的米粥数日后变成了醇香可口的饮料—酒,4千年前的夏禹时代,人们就知道了酿酒,3千年前的周代已开始制作饴糖和酱
酶学始于19世纪对发酵过程的研究
1810年,Gaylussac发现,酵母可使糖转化为酒精
1857年,Pastuer认为酒精发酵是酵母细胞活动的结果,认为活细胞是必需;同时代Liebig则认为发酵是酵母细胞液中酶引起
1876年,William Kuhne提出用“Enzyme”一词来表示未统一名称的已知的各种酵素(Enzyme一词就是“在酵母内”的意思)
1897年,Buchner兄弟用不含细胞的酵母汁成功实现了发酵。提出了发酵与活细胞无关,而与细胞液中的酶有关——这使他获得了1907年的诺奖“for his biochemical researches and his discovery of cell-free fermentation”

1833年,Payen & Perzos从麦芽中获得了粗淀粉酶制剂(diastase)
1903年,Henri提出了酶与底物作用的中间复合物学说——对阐明酶的作用的动力学有着深刻的作用
1913年,Michaelis和Menten提出了酶促动力学原理—米氏学说
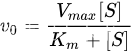

-
-
-
-
- 米氏方程(Michaelis-Menten equation)是表示一个酶促反应的起始速度与底物浓度关系的速度方程
-
-
-
1925年,Briggs和Handane对米氏方程做出了修正,提出了稳态学说
1926年,Sumner从刀豆种子中分离、纯化得到了脲酶结晶,首次证明酶是具有催化活性的蛋白质;1930-36年,Northrop得到了胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶的结晶——他们于1946年获得诺奖,“for discovery that enzymes can be crystallized”

1969年,Merrifield等人工合成了具有酶活性的胰RNase
1982年,Cech和Altman对四膜虫的研究中发现RNA具有催化作用,从而发现核酶(ribozyme),打破了以往酶是蛋白质的传统观念
1986年,Schultz和Lerner等人研制成功抗体酶(abzyme);Boyer和Walker阐明了ATP合酶合成与分解ATP的分子机制,并于1997年获得诺贝尔化学奖
酶是生物催化剂
酶的概念
酶是活细胞产生的一类具有催化功能的蛋白质或核酸,亦称为生物催化剂(biocatalysts)
酶催化的生物化学反应,称为酶促反应(enzymatic reaction)
在酶的催化下发生化学变化的物质,称为底物(substrate)
酶催化作用的特点
酶和一般催化剂的比较
-
-
-
-
- 它能改变化学反应的速度,但是不能改变化学反应平衡。酶本身在反应前后也不发生变化
-
-
-
-
-
-
-
- 酶能够稳定底物形成的过渡状态,降低反应的活化能,从而加速反应的进行
-
-
-

-
-
-
-
-
- 一定温度下,使1mol底物全部进入活化状态所需的自由能,称活化能
-
-
-
-

酶作为生物催化剂的特性
-
-
-
-
- 酶易失活
-
-
-
-
-
-
-
-
- 凡能使蛋白质变性的因素如强酸、强碱高温等条件都能使酶破坏而完全失去活性
-
-
-
-
-
-
-
-
- 高的催化效率
-
-
-
-
-
-
-
-
- 以mol为单位进行比较,酶的催化效率比化学催化剂高10的7次方到13次方倍,比非催化反应高10的8次方到20次方倍
-
-
-
-
-
-
-
-
-
- 转换数(turnover number,TN or kcat):每秒钟或每分钟,每个酶分子转换底物的分子数,或每秒钟或每分钟每摩尔酶转换底物的摩尔数。其大小可以反映酶的催化效率
-
-
-
-

-
-
-
-
- 高度专一性
-
-
-
-
-
-
-
-
- 酶的专一性(specificity)又称为特异性,是指酶在催化生化反应时对底物的选择性,即一种酶只能作用于某一类或某一种特定的物质。即酶只能催化某一类或某一种化学反应
-
-
-
-
-
-
-
-
- 酶活力可调节和控制
-
-
-
-
-
-
-
-
- 酶浓度的调节 诱导或抑制酶的合成 调节酶的降解
-
-
-
-
-
-
-
-
-
- 激素调节酶的活性
-
-
-
-
-
-
-
-
-
- 反馈抑制调节酶的活性
-
-
-
-
-
-
-
-
-
- 抑制剂和激活剂的调节
-
-
-
-
-
-
-
-
-
- 其他调节方式:共价修饰调节、别构调节、酶原激活、同工酶等
-
-
-
-
酶的化学本质
除了核酶外,几乎所有的酶都是蛋白质
水解产物是氨基酸
能被蛋白质变性剂所失活
两性电解质
不能透过半透膜
具备蛋白质所有的化学颜色反应
-
-
-
-
- 双缩脲反应
-
-
-
-
-
-
-
- 黄色反应
-
-
-
-
-
-
-
- 茚三酮反应
-
-
-
酶的化学组成
单纯蛋白质酶类(simple protein)
-
-
-
-
- 水解淀粉、蛋白质类的仅由蛋白质组成的一类酶
-
-
-
结合蛋白质酶类(conjugated protein)
-
-
-
-
- 酶蛋白(apoenzyme、apoprotein)
-
-
-
-
-
-
-
- 辅助因子(cofactor)
-
-
-
-
-
-
-
-
- 金属离子
-
-
-
-
-
-
-
-
-
- 金属有机物
-
-
-
-
-
-
-
-
-
- 小分子有机物
-
-
-
-
全酶(holoenzyme)= 酶蛋白 + 辅助因子
-
-
-
-
- 辅助因子分为辅酶和辅基
-
-
-
-
-
-
-
- 辅酶(coenzyme)如:辅酶 Ⅰ、Ⅱ
-
-
-
-
-
-
-
-
- 辅酶与酶蛋白之间通过非共价键结合
-
-
-
-
-
-
-
-
-
- 可以通过透析的方法分离酶蛋白和辅酶(辅酶是小分子能通过半透膜)
-
-
-
-
-
-
-
-
- 辅基(prosthetic group)如:FAD、FMN
-
-
-
-
-
-
-
-
- 辅基与酶蛋白之间是共价结合
-
-
-
-
酶的分子特点
单体酶(monomeric enzyme)如:溶菌酶、胰蛋白酶、木瓜 蛋白酶等
寡聚酶(oligomeric enzyme)如:乳酸脱氢酶、丙酮酸激酶等
多酶复合体(multienzyme complex)如:丙酮酸脱氢酶系、脂肪酸合成酶复合物等
酶的命名和分类
习惯名称
根据底物,如:淀粉酶、蛋白酶
根据催化反应性质,如:水解酶、氧化酶
系统名称
标明底物,催化反应性质
-
-
-
-
- eg:G-6-P → F-6-P G-6-6异构酶
-
-
-
两个底物参与反应时应同时列出,中间用冒号(:)分开。如果其中一个底物为水,水可略去
-
-
-
-
- 丙氨酸+α-酮戊二酸 → 谷氨酸+丙氨酸 丙氨酸:α-酮戊二酸氨基转移酶
-
-
-
-
-
-
-
- 脂肪+H2O → 脂酸+甘油 脂肪水解酶
-
-
-
国际系统分类法及编号(Enzyme Commission)
1.氧化还原酶类
2.转移酶类
3.水解酶类
4.裂合酶类
5.异构酶类
6.连接酶类(合成酶类)

六大类酶催化反应的性质
1.氧化还原酶类(oxido-deductases)
-
-
-
-
- 包括氧化酶类、脱氢酶类、过氧化氢酶、过氧化物酶等
-
-
-
-
-
-
-
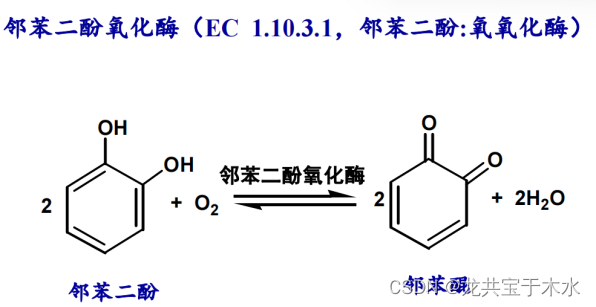
- 氧化酶类:催化底物脱氢,并氧化生成水或过氧化氢
-
-
-

-
-
-
-
- 脱氢酶类:直接催化底物脱氢
-
-
-

2.转移酶类(transferases)
-
-
-
-
- 催化基团的转移
-
-
-


3.水解酶类(hydrolases)
-
-
-
-
- 催化水解的反应,相对比较简单
-
-
-
![]()

4.裂合酶类(lyases)
-
-
-
-
- 从底物移去一个基团而形成双键或逆反应
-
-
-
![]()
5.异构酶类(isomerase)
-
-
-
-
- 催化异构反应
-
-
-


6.连接酶类(ligases,也称synthetases合成酶类)
-
-
-
-
- 将两个小分子合成一个大分子,通常需要ATP供能
-
-
-


酶的专一性
酶专一性
结构专一性
-
-
-
-
- 概念:酶对所催化的分子—底物化学结构的特殊要求和选择
-
-
-
-
-
-
-
- 类别:绝对专一性、相对专一性
-
-
-
-
-
-
-
- 绝对专一性(absolute specificity):这种酶对底物有绝对的要求,任何对底物的修饰都会导致酶的功能不起作用
-
-
-
-
-
-
-
- 相对专一性(relative specificity)
-
-
-
-
-
-
-
-
- 族专一性(基团专一性,group specificity):对底物中化学键一侧的基团有要求,而对另一侧基团无要求,或者是对化学键本身有特殊的要求
-
-
-
-


-
-
-
-
-
-
- 只要糖苷键一侧是α-D-葡萄糖,另一侧是与什么形成的糖苷无所谓,此酶就可以水解掉这个化合物
-
-
-
-
-
-
-
-
-
-
- 键专一性:只对底物的化学键有特殊的要求,对化学键两侧的基团无要求
-
-
-
-


立体异构专一性(stereospecificity
-
-
-
-
- 概念:酶除了对底物分子的化学结构有要求外,对其立体异构也有一定的要求
-
-
-
-
-
-
-
- 类别:旋光异构专一性、几何异构专一性
-
-
-
-
-
-
-
- D-,L-立体异构专一性
-
-
-
-
-
-
-
-
- 生物体内蛋白质大多是由L型氨基酸组成,而L-氨基酸氧化酶就只对L型氨基酸起作用,对D型氨基酸不起作用
-
-
-
-

-
-
-
-
- 几何异构专一性
-
-
-
-
-
-
-
-
- 琥珀酸脱氢酶催化反应生成只能生成反式的延胡索酸
-
-
-
-

关于酶作用专一性的假说
锁钥学说(lock and key theory)1894年Fischer提出

-
-
-
-
- 能一部分解释酶的专一性,但酶促反应是一个可逆的过程,酶的底物和酶催化反应的产物结构已经不一样了,此学说对酶促反应的逆反应无法解释
-
-
-
诱导契合学说(induced-fit theory)1958年Koshland提出

-
-
-
-
- 与锁钥学说不同的是,底物在一开始并不是完全匹配酶的结构,而是大致匹配,在酶与底物结合的过程中底物逐渐适配酶的结构
-
-
-
酶的活力测定和分离纯化
酶活力的测定
酶活力(enzyme activity):也称酶活性,指酶催化一定化学反应的能力。其大小可用在一定条件下,它所催化的某一化学反应的反应速率(reaction velocity)来表示
酶反应速度:用单位时间内、单位体积中底物的减少量或产物的增加量来表示。单位:浓度/单位时间
测定酶促反应速度时一定要测初速度(initial speed),因为随反应时间的延长,酶反应速度会降低

-
-
-
-
- 底物浓度的降低
-
-
-
-
-
-
-
- 酶的部分失活
-
-
-
-
-
-
-
- 产物对酶的抑制
-
-
-
酶的活力单位(U,activity unit)
酶的活力单位,即酶单位(U)
在一定条件下,一定时间内将一定量的底物转化为产物所需要的酶量。这样酶的含量就可以用每克酶制剂或每毫升酶制剂含有多少酶单位来表示(U/g或U/ml)
国际单位:“IU”、“Kat”


酶的比活力(specific activity)
代表酶的纯度,实质表示单位蛋白质的催化能力
每毫克酶蛋白所具有的酶活力单位数,用U/mg蛋白、IU/mg蛋白、Kat/mg蛋白表示
酶活力测定方法
两种思路:测定完成一定量所需的时间 测定单位时间内酶催化的化学反应量
测定酶活力就是测定产物增加量或底物减少量,主要根据产物或底物的物理或化学特性来决定测定方法
分光光度法(spectrophotometry)
-
-
-
-
- 该法要求酶的底物和产物在紫外或可见光部分光吸收不同
-
-
-
-
-
-
-
- 优点:简便、迅速、准确。一个样品可以多次测定,有利于动力学研究
-
-
-
荧光法(fluorometry)
-
-
-
-
- 主要利用底物或产物的荧光性质。灵敏度高,但易受到干扰
-
-
-
同位素测定法
-
-
-
-
- 同位素标记底物,反应后经分离,检测产物的脉冲数,即可换算成酶的活力单位,灵敏度最高
-
-
-
-
-
-
-
- 比如测定蛋白激酶,它催化ATP上的γ-磷酸基团转移到蛋白质上,这时我们就可以用放射性的ATP标记,测定转移到蛋白质的放射性的强弱,来监测酶的活力
-
-
-
电化学方法
-
-
-
-
- pH计
-
-
-
-
-
-
-
- 氧电极法
-
-
-
关于酶的分离与纯化
具体操作与前面蛋白质的分离纯化基本一致,但有两点需要注意
总活力:损失
-
-
-
-
- 酶你要想要越纯,酶的绝对量就会损失的越多
-
-
-
比活力:纯度
-
-
-
-
- 随着不断地纯化,比活力会不断增加—杂蛋白都被去掉
-
-
-
核酶
发现历程
Cech T.R 于1982年提出。1981年,Cech发现四膜虫(Tetrahymena thermophila) 的26S rRNA前体在成熟过程中,其居间序列(相当于现在我们说的内含子)通过剪接反应被除去(并发现此过程没有任何蛋白质参与)。并证明四膜虫rRNA前体的居间序列核糖核酸(L-19RNA)具有多种催化功能,将这种具有催化活性的RNA 称为核 酶(Ribozyme)
rRNA基因的转录产物即rRNA前体(大约6400个核苷酸残基)很不稳定,在鸟苷和Mg2+存在下切除自身的内含子(intron或intervening sequence,IVS-居间序列或间插序列),使两个外显子(exon)拼接起来,形成成熟的rRNA,此过程没有任何蛋白酶参与,称为自我剪接(self-splicing),并证明RNA具有催化活性

1992年,Piccirilli发现L19RNA具有,氨酰酯酶的活性。此外,在兔子肌肉中发现有一种蛋白-RNA复合物中的RNA(31 nt)单独具有1,4-α葡聚糖分支酶的活性
Ribozyme具有经典的酶促催化标志
高度专一性
符合米氏方程
对竞争性抑制剂敏感
Ribozyme发现的意义
RNA具有酶的催化活性,向酶的化学本质是蛋白质这一传统概念提出了挑战
在理论上,对于生物起源和生命进化的研究具有重要启示
在实践上,由于Ribozyme的内切酶活性,可定点切割mRNA,破坏mRNA,抑制基因表达,为基因、病毒和肿瘤治疗提供了可行途径
抗体酶
定义
抗体酶(abzyme):指具有催化活性的免疫球蛋白,即在其高可变区赋予了酶的属性。是抗体的高度选择性于酶的高效催化性相结合的产物

抗体酶产生历史
1969年Jencks 等提出设想,能与化学反应中的过渡态结合的抗体,可能具有酶的活性,催化反应的进行
Schultz认为,对硝基苯酚磷酸胆碱(PNPPC)作为相应羧酸二酯水解反应的过渡态类似物,推测用这个类似物作为半抗原诱导产生的单克隆抗体可能对羧酸二酯水解反应有催化活性
-
-
-
-
- 半抗原是指具有免疫原反应的一种物质,但其没有免疫原性,直接注射动物体不能引起免疫反应,但其能和专门识别它的抗体进行特异的反应
-
-
-


抗体酶的意义
抗体酶的方法有利于研究生物催化反应过程中的过渡态、极性效应、一般的酸碱催化和亲核催化等机理,从而对于理解自然界酶功能的演变历程具有重要理论意义
抗体酶为科学研究和工业应用打开了一个新的平台,为酶学、免疫学、化学和医学的有机结合搭建了一个成功桥梁
-
-
-
-
- 为蛋白质结构的研究提供新手段:开发能精准定位某两种氨基酸之间肽键的水解酶
-
-
-
-
-
-
-
- 设计新型生物药物:针对药物和吸烟成瘾开发能解毒和戒毒的药物
-
-
-
-
-
-
-
- 应用于工业制药(立体专一性抗性酶)
-
-
-


























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










